1.本发明涉及一种原生质体的制备及转化方法,具体涉及一种柴胡原生质体的制备及瞬时转化方法。
背景技术:
2.柴胡(radix bupleuri)是一种中药材,《中国药典》规定正品柴胡为北柴胡及狭叶柴胡的干燥根。近年来对北柴胡的研究主要集中在采用传统育种方法培育柴胡新品种,这些方式耗时长,效率低。目前结合基因组学、分子生物学的基因编辑技术已成为新品种选育的有力工具。但是,由于柴胡转化体系技术还不成熟,制约了利用转基因技术研究柴胡基因功能,而利用原生质体可以对植物基因功能进行快速验证,因而,对柴胡原生质体制备与转化研究具有重要意义,但目前尚未有对柴胡建立外源基因转化体系的报道。
技术实现要素:
3.本发明的目的是提供一种柴胡原生质体的制备及瞬时转化方法,解决了目前柴胡转化体系技术还不成熟的问题,该方法制备的原生质体完整好,浓度可达106个/ml,可有效保证瞬时转化及原生质培养的浓度要求。
4.为了达到上述目的,本发明提供了一种柴胡原生质体的制备及瞬时转化方法,该方法包含:原生质体制备和原生质体瞬时转化;所述原生质体制备,包含:将柴胡下胚轴愈伤组织经酶解液在避光条件下酶解处理,并进行纯化,得到柴胡原生质体;所述原生质体瞬时转化,包含:将所述柴胡原生质体和crispr/cas9-t3t4质粒混合,加入聚乙二醇转化液,室温孵育,待孵育结束后加入w5溶液终止反应,离心收集经过瞬时转化的柴胡原生质体,并重悬于mmg溶液中,室温避光孵育,并通过基因编辑靶位点分析验证原生质体是否转化成功;其中,其中,所述crispr/cas9-t3t4质粒为phee401e-t3t4质粒,其构建为:以pcbc-dt1t2质粒为模板,采用核苷酸序列为seq id no.6~9的引物,进行overlapping pcr构建sgrna表达盒,将产物连接至phee401e质粒,从而构建phee401e-t3t4质粒。
5.优选地,所述柴胡下胚轴愈伤组织的制备,包含:将柴胡种子用无菌水浸泡,去除漂浮的种子,将种子转移用加2%ppm的无菌水在4℃暗光振荡消毒;将消毒后的种子转移至种子萌发培养基中培养,该种子萌发培养基包含:ms基础培养基、30g蔗糖、4g植物凝胶、0.1%ppm;取发芽的柴胡幼苗,切取柴胡下胚轴并置于愈伤诱导培养基中诱导愈伤组织,该愈伤组织诱导培养基包含:ms基础培养基、30g蔗糖、4g植物凝胶、0.5%ppm、3mg/l 6-ba、2.2mg/l 2,4-d、0.8mg/lkt。
6.优选地,所述发芽的柴胡幼苗为发芽14~16天的柴胡幼苗。
7.优选地,所述消毒时间为12h。
8.优选地,所述酶解液包含:2%cellulase r-10、1%macerozyme r-10、0.4m甘露醇、20mm ph=5.7的mes、20mm kcl、10mm cacl2、0.1%bsa和ddh2o。
9.优选地,所述酶解液包含:2%cellulase r-10、1%macerozyme r-10、0.4m甘露
醇、20mm ph=5.7的mes、20mm kcl、10mm cacl2、0.1%bsa和ddh2o。
10.优选地,所述聚乙二醇转化液包含:40%peg4000、0.2m甘露醇、100mm cacl2;所述mmg溶液包含:0.4m mannitol、15mm mgcl2、4mm ph=5.7的mes;所述w5溶液包含:8.9g/lnacl、18.4g/l cacl2、0.37g/l kcl、0.9g/l葡萄糖。
11.优选地,所述纯化,为:通过w5溶液稀释所述酶解处理的溶液,经70μm滤网过滤,离心,将沉淀重悬于mmg溶液,得到纯化的原生质体。
12.优选地,所述酶解处理的温度为27~29℃。
13.优选地,所述室温避光孵育的时间为24h以上。
14.优选地,所述基因编辑靶位点分析,为:提取经过瞬时转化的柴胡原生质体的总dna,作为模板,使用靶位点引物进行pcr反应,将pcr扩增获得的pcr片段克隆至t载体,转化大肠杆菌后,测序验证原生质体是否转化成功;其中,所述靶位点引物的核苷酸序列如seq id no.1和seq id no.2所示;所述测序验证原生质体是否转化成功,为:若核苷酸序列seq id no.4中第8位的c变t,或者第21位的g变a,则表明靶位点已被编辑,原生质体转化成功。
15.优选地,所述柴胡包含:川北柴一号、川红柴一号。
16.本发明的柴胡原生质体的制备及瞬时转化方法,解决了目前柴胡转化体系技术还不成熟的问题,具有以下优点:
17.本发明的方法能够实现柴胡下胚轴愈伤原生质体的制备,采用本发明的方法制备的原生质体完整好,浓度可达106个/ml,可有效保证瞬时转化及原生质培养的浓度要求,原生质体浓度降低将导致瞬时转化效率下降,而且导致原生体培养时再生细胞分裂频率明显下降甚至不分裂。本发明的方法建立了柴胡原生质体的瞬时转化体系,实现在柴胡原生质体中外源基因的高效表达,为柴胡的分子生物学研究和遗传转化提供技术支持。
附图说明
18.图1为本发明实施例1准备的材料图;a:已消毒的柴胡种子,用于获取无菌苗;b:切下柴胡无菌苗的下胚轴,置于ms培养基中诱导愈伤组织;c:柴胡下胚轴诱导的愈伤,用于柴胡原生质体的制备。
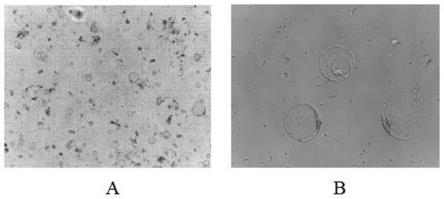
19.图2为本发明实施例1制备的柴胡下胚轴原生质体;a:血球计数板中的柴胡原生质体,浓度达1.1
×
106个/ml;b:leica显微镜40倍,可见光下的原生质体饱满且完整。
20.图3为本发明实施例1利用柴胡原生质体瞬时转化验证crispr/cas9靶位点敲除效果;a:以原生质体基因组dna为模板,对crispr/cas9敲除的靶基因进行pcr扩增,得到靶基因片段并进行凝胶电泳;b:靶位点片段测序结果显示基因序列出现c变t以及g变a,说明靶基因敲除成功,该靶位点可有效作用于该靶基因。
具体实施方式
21.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
22.实施例1
23.一种柴胡原生质体的制备及瞬时转化方法,该方法包含以下步骤:
24.(1)材料制备
25.取川北柴一号种子适量,置于烧杯中无菌水搅拌混匀后浸泡30min,倒去上层漂浮的种子,重复3次。在超净台中转移种子至50ml无菌离心管中,加2%ppm(植物组培抗菌剂)的无菌水,于培养箱中4℃暗光振荡混匀12h。
26.于超净台中将消毒后的种子用无菌水冲洗后置于滤纸上晾干,随后转移至种子萌发培养基中,该种子萌发培养基的组分为:ms基础培养基、30g蔗糖(碳源)、4g植物凝胶(固化剂)、0.1%ppm(植物组培抗菌剂);
27.取发芽15d的柴胡幼苗,用手术刀切取柴胡下胚轴并置于愈伤诱导培养基中诱导愈伤组织,愈伤组织诱导培养基的组分为:ms基础培养基、30g蔗糖(碳源)、4g植物凝胶(固化剂)、0.5%ppm(植物组培抗菌剂)、3mg/l 6-ba(6-苄氨基嘌呤)、2.2mg/l 2,4-d(2,4-二氯苯氧乙酸)、0.8mg/l kt(激动素)。
28.(2)原生质体制备
29.取1.5~3g上述柴胡下胚轴愈伤组织,用镊子轻轻夹碎后放入酶解液中,避光振荡6h,28℃;其中,酶解液的组分为:2%(w/v)cellulase r-10(纤维素酶r-10)、1%(w/v)macerozyme r-10(离析酶r-10)、0.4m mannitol(甘露醇)、20mm mes(ph=5.7,吗啉乙磺酸)、20mm kcl、10mm cacl2、0.1%(w/v)bsa(牛血清蛋白)和ddh2o,定容至10ml。
30.将10ml w5溶液加入酶解液中,轻柔混匀;经70μm滤网过滤,滤液100
×
g离心2min,吸去上清,重悬沉淀于1ml mmg溶液,得到纯化的原生质体;其中,w5溶液(200ml)的组分为:8.9g/l nacl、18.4g/l cacl2、0.37g/lkcl、0.9g/l葡萄糖;mmg溶液的组分为:0.4m mannitol、15mm mgcl2、4mm mes(ph=5.7)。
31.取10~20μl纯化后的原生质体滴加于血球计数板的计数室中,在显微镜下进行观察并计数,计数结果为1.1
×
106个/ml。
32.原生质体个数=(血球计数板5个大方格内总原生质体个数
×
104×
稀释倍数)
33.(7)原生质体转化
34.设计靶向柴胡iaa13基因的双靶点引物,以pcbc-dt1t2质粒(为本领域已知质粒,如“基于crispr/cas9系统构建拟南芥expa多基因编辑表达载体”[j].分子植物育种,2020,18(17):5748-5754,可购自addgene)为模板,进行overlapping pcr构建sgrna表达盒,产物连接至phee401e(为本领域已知质粒,如“基于crispr/cas9系统构建拟南芥expa多基因编辑表达载体”[j].分子植物育种,2020,18(17):5748-5754,可购自addgene),构建phee401e-t3t4质粒。
[0035]
上述柴胡iaa13基因的双靶点引物,序列见下表:
[0036][0037]
取10μl phee401e-t3t4质粒(浓度为1~2μg/μl)加入100μl原生质体(1
×
105~7
×
105个/ml),轻柔混匀,加入110μl聚乙二醇转化液,轻柔完全混匀后,室温孵育15min,间歇轻柔混匀,加入440μl w5溶液终止反应。100
×
g离心2min,吸去上清,重悬沉淀于1ml mmg溶液,室温避光孵育24h。
[0038]
其中,聚乙二醇转化液的组分为:40%(w/v)peg4000、0.2m mannitol、100mm cacl2,水浴55℃,直到peg粉末完全溶解,恢复至室温,用于转化。
[0039]
离心并提取原生质体总dna,并以其为模板,使用iaa-t4f、iaa-t4r为引物进行pcr,获得的pcr片段(929bp,seq id no.5)与t载体进行连接,转化大肠杆菌后,测序验证,靶位点序列为caaatgacgctatggacaa(seq id no.3),测序序列出现c变t或者g变a(序列seq id no.4中第8位的c变t,或者第21位的g变a,参见图3),说明靶位点已被编辑,原生质体转化成功。
[0040]
iaa-t4f序列(seq id no.1):
[0041]
tagtaggatggcctccgataag;
[0042]
iaa-t4r序列(seq id no.2):
[0043]
gagcgtttagatccacctttct。
[0044]
尽管本发明的内容已经通过上述优选实施例作了详细介绍,但应当认识到上述的描述不应被认为是对本发明的限制。在本领域技术人员阅读了上述内容后,对于本发明的多种修改和替代都将是显而易见的。因此,本发明的保护范围应由所附的权利要求来限定。
