与控制辣椒果实vc含量基因连锁的snp分子标记kq8-4472及应用和专用引物
技术领域
1.本发明涉及一种辣椒品种选育技术领域,特别涉及一种与控制辣椒果实vc含量基因连锁的snp分子标记kq8-4472、扩增该分子标记的专用引物、试剂盒以及他们的应用。
背景技术:
2.辣椒是世界范围内广泛栽培的一种重要蔬菜兼经济作物,也是我国许多地区的主要经济支柱作物。随着人民生活水平的不断提高,消费者对优质农产品的需求更为迫切,蔬菜品质正受到人们越来越多的关注。辣椒品质改良已成为辣椒育种工作的重要研究课题。
3.辣椒是公认的果实维生素c(vc)含量最高的蔬菜,果实vc含量是辣椒的一个重要营养品质。然而不同辣椒品种之间果实vc含量差异非常显著。选育果实高vc含量的品种是辣椒品质育种的一个重要方向。常规蔬菜育种技术对目的基因型植株的选择多依赖于植株表型,而对一些诸如果实vc含量、辣椒红素含量和辣椒碱含量等的数量性状,则无法借助植株表型对目标性状进行选择。利用分子标记辅助选择(mas)育种技术,并与单倍体育种技术和传统育种方法相结合,可以极大地提高选择效率,大大加快材料创新和品种选育的进程,也是缩小我国与发达国家之间辣椒育种差距的必由之路。然而,辣椒参与果实vc生物合成、循环、降解的代谢途径尚未明确,对辣椒果实vc的研究也仅限于遗传规律等方面,分子水平研究进展缓慢。迄今还没有可用于选育高果实vc含量辣椒品种的分子标记,因此,开发与控制辣椒辣椒果实vc含量基因紧密连锁的分子标记,建立分子标记辅助育种技术体系,对加快高果实维生素c含量辣椒品种的选育尤为重要。
技术实现要素:
4.针对现有技术的缺陷,本发明的目的之一在于提供一种与控制辣椒果实vc含量基因连锁的snp分子标记kq8-4472。该分子标记为高vc含量辣椒品种的选育提供了新得途径。
5.本发明的目的之二在于提供一种用于扩增与控制辣椒果实vc含量基因连锁的snp分子标记kq8-4472或用于确定snp分子标记kq8-4472对应的基因型的kasp特异性引物。
6.本发明的目的之三在于提供一种包含上述kasp特异性引物的试剂盒。
7.本发明的目的之四在于提供上述snp分子标记kq8-4472、kasp特异性引物以及试剂盒的应用。
8.本发明的目的之五在于提供一种鉴定辣椒果实vc含量高低的方法。
9.为了实现上述目的,本发明采用了以下技术方案:
10.第一方面,本发明提供一种与控制辣椒果实vc含量基因连锁的snp分子标记kq8-4472,所述分子标记位于1号染色体的36281092bp处,碱基为a或t;所述分子标记对应的基因型:t:t和a:t为辣椒高果实vc含量的基因型;a:a为辣椒低果实vc含量的基因型。
11.第二方面,本发明还提供一种kasp特异性引物,用于扩增与控制辣椒果实vc含量基因连锁的snp分子标记kq8-4472或用于确定snp分子标记kq8-4472对应的基因型,所述特
异性引物包括第一正向引物、第二正向引物和通用反向引物。
12.优选地,本发明所述kasp特异性引物,第一正向引物的碱基序列如序列表seq id no.1所示;第二正向引物的碱基序列如序列表seq id no.2所示;通用反向引物的碱基序列如序列表seq id no.3所示。
13.优选地,本发明所述kasp特异性引物,所述第一正向引物和第二正向引物的5’端分别连有不同的荧光接头序列。
14.优选地,本发明所述kasp特异性引物,所述荧光接头序列选择fam、hex、fitc、red、tet、joe、r110中的一种。
15.第三方面,本发明还提供一种试剂盒,包括上述kasp特异性引物和pcr反应试剂。
16.优选地,本发明所述的试剂盒,所述pcr反应试剂为touch-down pcr反应试剂。
17.第四方面,本发明还提供上述与控制辣椒果实vc含量基因连锁的snp分子标记kq8-4472、或者上述kasp特异性引物、或者上述试剂盒在以下任一方面的应用:
18.(a)辅助选育高果实vc含量的辣椒品种;
19.(b)鉴定辣椒果实vc含量高低。
20.第五方面,本发明还提供一种鉴定辣椒果实vc含量高低的方法,包括如下步骤:待测样品基因组dna的提取;
21.以待测样品基因组dna为模板,利用上述kasp特异性引物进行pcr扩增;
22.对扩增产物进行荧光检测和分析,获得待测样品的基因型,由此确定待测样品vc含量的水平;
23.当基因型为t:t和a:t时,待测样品为高果实vc含量品种;当基因型为a:a时,待测样品为低果实vc含量品种。
24.优选地,本发明所述的方法,所述pcr扩增的条件依次为:94℃预变性15分钟;在94℃下变性20s;61℃-55℃下退火60s,共10个循环,61℃为第一个循环的退火温度,之后每个循环退火温度降低0.6℃;94℃变性20s;55℃复性/延伸60s,共26个循环。
25.本发明的有益效果:本发明利用果实vc含量差异极显著的两份辣椒自交系和以这两份材料为亲本构建的包含252个株系的rils群体为试验材料,通过slaf-seq技术构建辣椒高密度遗传图谱,结合rils各株系果实vc含量三个季节的表型数据,将控制果实vc含量的主效qtl定位到1号染色体,并获得紧密连锁的snp分子标记kq8-4472,该标记位于1号染色体36281092bp。本发明的研究成果为该基因的精细定位与克隆奠定了良好基础,并为辣椒果实高vc含量分子育种提供了强有力的技术支撑。利用本发明的分子标记开发的特异性扩增引物,可以高效、准确地鉴定辣椒材料或品种是否属于高果实vc含量材料或品种,可显著提高育种效率。
附图说明
26.图1是辣椒高密度遗传图谱;
27.图2是辣椒控制果实vc含量qtl定位结果;
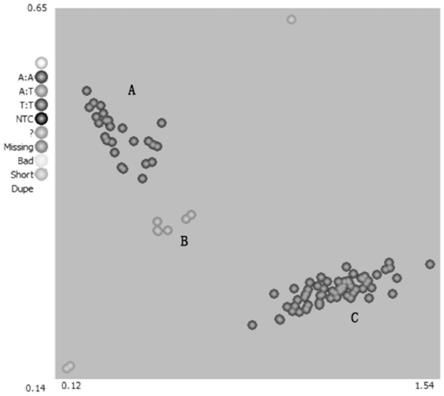
28.图3是利用本发明的分子标记kq8-4472对100份辣椒材料进行基因分型的结果或者进行kasp扩增的结果图,其中a处是与低vc含量亲本具有相同基因型的辣椒单株(a:a基因型,红色);b处是杂合型单株(a:t基因型,绿色);c处是与高vc含量亲本具有相同基因型
的辣椒单株(t:t基因型,蓝色)。
具体实施方式
29.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进或应用的基础,并不以任何方式构成对本发明的具体限制。
30.下述实施例中的实验方法中,如无特殊说明,均为常规方法,可按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从常规商业途径得到。
31.本发明提供的与控制辣椒果实vc含量基因连锁的snp分子标记kq8-4472,位于1号染色体上,物理位置为36281092,高vc亲本z5中此处的碱基为t;低vc亲本z6该位置的碱基为a。
32.分子标记对应的基因型:t:t和a:t基因型为辣椒高果实vc含量的基因型,而a:a基因型为辣椒低果实vc含量的基因型。
33.本发明中使用的两个自交系亲本:半野生种质z5果实vc含量为390mg/100g鲜重,甜椒自交系z6果实vc含量为25mg/100g鲜重。通常行业内,辣椒果实vc含量低于100mg/100g鲜重为低vc含量的品种,不低于100mg/100g鲜重为高vc含量的品种。
34.本发明还提供了一种kasp特异性引物,该特异性引物可以用于扩增与控制辣椒果实vc含量基因连锁的snp分子标记kq8-4472或用于确定snp分子标记kq8-4472对应的基因型,特异性引物包括第一正向引物、第二正向引物和通用反向引物。
35.优选地,第一正向引物的碱基序列如序列表seq id no.1所示,具体为5
’‑
gaggtcccaattgagatcttggat-3’;
36.第二正向引物的碱基序列如序列表seq id no.2所示,具体为5
’‑
gaggtcccaattgagatcttggaa-3’;
37.通用反向引物的碱基序列如序列表seq id no.3所示,具体为5
’‑
acatccttggttcgcaaccgacaaa-3’。
38.为了便于pcr产物检测,第一正向引物和第二正向引物的5’端分别连有不同的荧光接头序列。所述荧光接头序列选择fam、hex、fitc、red、tet、joe、r110中的一种。
39.在本发明实施例中第一正向引物选用了fam作为荧光接头序列,第二正向引物选用了hex作为荧光接头序列,5’端连接有接头的第一正向引物的碱基序列如序列表seq id no.4所示,5’端连接有接头的第二正向引物的碱基序列如序列表seq id no.5所示。
40.对扩增产物进行荧光检测时,如果样品pcr产物只检测到连接了荧光接头序列的第一正向引物对应的荧光信号,则说明对应的基因型为t:t,判定该辣椒果实具有高果实vc含量;如果样品pcr产物只检测到连接了荧光接头序列的第二正向引物对应的荧光信号,则说明对应的基因型为a:a,判定该辣椒果实具有低果实vc含量;如果同时检测到第一正向引物对应的荧光信号和第二正向引物对应的荧光信号则说明对应基因型为a:t(或称为t:a),判定该辣椒果实具有高vc含量。
41.本发明提供的试剂盒,包括上述kasp特异性引物和pcr反应试剂,pcr反应试剂为touch-down pcr反应试剂,比如2x kasp master mix。
42.上述与控制辣椒果实vc含量基因连锁的分子标记kq8-4472、或者kasp特异性引物、或者上述试剂盒可以用于:
43.(a)辅助选育高果实vc含量的辣椒品种;
44.(b)鉴定辣椒果实vc含量高低。
45.本发明还提供了一种鉴定辣椒果实vc含量高低的方法,包括如下步骤:
46.待测样品基因组dna的提取;
47.以待测样品基因组dna为模板,利用上述kasp特异性引物进行pcr扩增;
48.对扩增产物进行荧光检测和分析,获得待测样品的基因型由此确定待测样品vc含量的水平;
49.当基因型为t:t和a:t时,待测样品vc含量高;当基因型为a:a时,待测样品vc含量低。
50.所述pcr扩增的条件依次为:94℃预变性15分钟;在94℃下变性20s;61℃-55℃下退火60s,共10个循环,61℃为第一个循环的退火温度,之后每个循环退火温度降低0.6℃;94℃变性20s;55℃复性/延伸60s,共26个循环。
51.下面结合实施例对本发明做进一步详细说明。
52.实施例1 与控制辣椒果实vc含量基因连锁的分子标记kq8-4472的获得
53.1、群体的构建
54.利用自交系z5和自交系z6为双亲构建的包含252个株系的f10代重组自交系为试验材料。半野生种质z5果实vc含量为390mg/100g鲜重,甜椒自交系z6果实vc含量为25mg/100g鲜重。
55.2、vc含量测量:
56.待辣椒果实进入红熟期,将每个株系红熟期的果实混合取样,每个株系至少15g辣椒果实,应用色谱仪检测各株系中辣椒果实的vc含量。
57.3、dna提取及slaf数据分析:
58.采用天根植物基因组dna提取试剂盒提取双亲、重组自交系群体各株系基因组dna。
59.slaf-seq文库的原始测序读长为pe125bp。为保证信息分析质量,在分析前会对原始测序的数据进行过滤,对原始数据过滤标准为需要过滤掉含有接头序列的reads;当read中含有的n的含量超过该条read长度比例的10%时,需要去除此对reads。
60.将测序产生的reads通过bwa软件进行序列比对,得到bam文件后,使用gatk软件进行snpcalling。根据每个snp标签的亲本情况,首先进行亲本分型的编码,而后根据子代的测序序列与亲本的一致性确定子代的基因型。对已经成功编码的snp标记进行过滤,为了得到高质量的snp标记进行后续的图谱构建和分析,要求标记过滤的标准为:
61.1)过滤父母本测序深度10x以下。
62.2)子代分型矫正。如果子代的snp深度不足2x,则深度过低,矫正为缺失。
63.3)完整度过滤。筛选基因型至少覆盖所有子代90%以上个体的标记。
64.4)偏分离标记(卡方检验p<0.05)过滤。
65.4、遗传图谱构建:
66.遗传图谱构建采用百迈客自主开发的highmap构图软件完成,首先计算标记与标
记之间的重组率和mlod值,而后根据mlod值将分子标记分为不同的连锁群,每个连锁群即为一条染色体。以染色体为单位,通过最大似然法进行遗传图谱构建,获得标记的初版顺序,由于分子标记本身存在一定的分型错误,根据图谱顺序进行分型的矫正,经历排图,矫正,再排图,在矫正的循环,最终获得一个高质量的遗传图谱。其中作图函数采用kosambi函数完成。qtl定位选择icimapping软件的met算法进行多环境数据扫描定位,icimapping使用完备区间作图法,手动阈值2.5进行定位。
67.利用以z5和z6为双亲构建的包含252个株系的高代rils群体为材料,通过slaf-seq技术对亲本平均测序深度为109.43x、子代平均测序深度为16.26x的简化基因组测序,共获得1,377,197,015数据,2,098,184个snp标签,通过筛选最终得到可用于作图的snp标签8,061个。通过两两标签之间计算mlod值,设置最小群与最大群标签数,预设mlod值区间,按标签的mlod值从小到大排列,标签之间mlod值最高的分在同一个连锁群,过滤掉与其他snp标签的mlod值均低于5的标签,定为上图标记(marker)。最终共上图标记6,345个,构建12个连锁群。
68.以连锁群为单位,采用highmap软件分析获得连锁群内marker的线性排列,并估算相邻marker间的遗传距离,最终得到总图距为1,552.20cm、平均图距为0.25cm的高密度完全连锁辣椒遗传图谱(参见图1)。
69.5、果实vc含量qtl定位
70.结合测序得到的遗传图谱标记信息和rils群体3个季节的果实vc含量表型数据,应用icimapping软件,设置手动阈值2.5进行定位,共获得12个qtl区间,分布在1、2、5、8、9、11这6条染色体上(如图2、表1),其中贡献率最高的主效qtl区间位于1号染色体上的marker4486和marker3918之间,贡献率为15.1%,区间大小为2.30mb。
71.表1 辣椒控制果实vc含量qtl定位结果
72.[0073][0074]
6、开发辣椒中与控制果实vc含量基因连锁的分子标记
[0075]
将主效qtl定位区间内marker4486和marker3918之间的marker4472前后70bp的序列进行测序,结果显示高vc亲本z5中此处的等位基因碱基均为t,低vc亲本z6该位置的等位基因碱基均为a。基于测序结果开发此snp为kasp特异性引物kq8-4472,引物序列参见表2。
[0076]
表2 针对分子标记kq8-4472设计的引物序列
[0077][0078]
表2中划线部分为相应正向引物5’端连接的荧光接头序列,第一正向引物5’的接头为fam,第二正向引物的接头为hex。
[0079]
实施例2 辣椒中与控制果实vc含量基因连锁的分子标记的可靠性验证
[0080]
对实施例1开发的分子标记,进行进一步的群体验证。以发明人所在课题组选育的100份辣椒自交系为验证材料,应用实施例1的特异性引物进行pcr扩增,对与控制果实vc含量基因紧密连锁的分子标记kq8-4472应用于分子标记辅助育种的准确性进行验证。
[0081]
pcr反应在hydrocycler水浴pcr仪上进行,荧光检测是在bmg labtech gmbh平台上进行的。
[0082]
pcr扩增的体系为:基因组dna(20ng/μl)2.5ul,2xkasp master mix(购自基因公司)2.5μl;kbd assay mix(即引物的混合物,各引物浓度为10μmol/μl,按照摩尔比2:2:5混合第一正向引物、第二正向引物和通用反向引物)0.07μl;
[0083]
扩增条件依次为:94℃预变性15分钟;在94℃下变性20s;61℃-55℃下退火60s,共
10个循环,61℃为第一个循环的退火温度,之后每个循环退火温度降低0.6℃;94℃变性20s;55℃复性/延伸60s,共26个循环。
[0084]
对扩增产物进行荧光检测时,如果样品pcr产物只检测到连接了荧光接头序列的第一正向引物对应的荧光信号(蓝色荧光),则说明对应的基因型为t:t,判定该辣椒果实为高vc含量;如果样品pcr产物只检测到连接了荧光接头序列的第二正向引物对应的荧光信号(红色荧光),则说明对应的基因型为a:a,判定该辣椒果实为低vc含量;如果同时检测到第一正向引物对应的荧光信号和第二正向引物对应的荧光信号(即绿色)则说明对应基因型为a:t,判定该辣椒果实具有高vc含量。
[0085]
按照实施例1第2部分的vc含量测量方法测定该实施例选定的100份辣椒材料的果实vc含量,具体含量如表3。
[0086]
根据现有辣椒果实vc含量遗传规律研究结果,辣椒红熟果果实vc含量由一对加性-显性主基因+加性-显性-上位性多基因控制(d-0)(张晓芬等,辣椒果实vc含量的变化规律与遗传分析,核农学报,2015,12期),针对分子标记kq8-3918,将100份辣椒材料分为两组,即基因型与低vc亲本kasp分型(a:a)相同的组和基因型与高vc亲本kasp分型(t:t或a:t)相同的组。t-test检验两组株系的kasp分型和果实vc含量,得到p值为5.32e-15,表明两组存在极显著差异(表3)。
[0087]
按照通常行业内对辣椒果实vc含量高低的界定,“辣椒果实vc含量低于100mg/100g鲜重为低果实vc含量品种,不低于100mg/100g鲜重为高果实vc含量品种”来判断利用分子标记kq8-4472分子检测所得结果的准确性,即将得到的各辣椒材料的基因分型结果与实测的辣椒果实vc含量进行对比,如果该材料的基因分型为t:t或a:t,实测的该材料的辣椒果实vc含量不低于100mg/100g鲜重,则认定该鉴定结果准确,否则认为鉴定结果不准确;如果该株系的基因分型为a:a,实测的该株系的辣椒果实vc含量低于100mg/100g鲜重,则认定该鉴定结果准确,否则认为鉴定结果不准确。由表3数据可得,分子标记kq8-4472分子检测的准确率为90%,可以应用于辣椒分子标记辅助选择育种。
[0088]
表3 利用100份材料对标记kq8-4472进行准确性验证
[0089]
[0090]
