:
1.本发明涉及生物技术领域,具体涉及一种耐热碱性果胶酶及其制备与应用。
背景技术:
2.果胶酶(pectinases)包括聚半乳糖醛酸酶(pg)、果胶酯酶(pe)、果胶裂解酶(pl)等主要组分,是最早得到应用的酶类之一。到了五十年代,果胶酶制剂开始规模化生产。它在食品工业、麻料脱胶、木材防腐方面有着重要的价值。果胶酶源自各种生物,微生物因生长速度快,生长条件简单和分布广泛等优势成为果胶酶的重要来源。
3.果胶酶按其作用的最适ph值,分为酸性果胶酶和碱性果胶酶。碱性果胶酶酶来源较广,普遍存在于细菌、酵母菌、霉菌、植物和某些寄生线虫体内。来源于不同微生物的碱性果胶酶生物、理化性质也不同,微生物来源的原果胶酶、果胶醋酶、聚半乳糖醛酸酶和果胶裂解酶的最适ph有偏酸的、也有偏碱的,而果胶酸裂解酶则全部属于碱性果胶酶。真菌来源的果胶酶较细菌来源的偏酸。自1972年日本学者koki horikoshi首次用嗜碱细菌制得碱性果胶酶以来,至今已分离鉴定出几十种碱性果胶酶,但其中能应用于工业化生产的为数不多。碱性果胶酶广泛应用于食品、纺织、造纸、环境、生物技术等各个领域,在茶和咖啡发酵、纺织和植物纤维加工、油提取、含果胶工业废水处理等发挥巨大作用。
4.碱性果胶酶可以作为新型生物防预农药,因其可降解寄主组织的果胶质产生寡聚糖片段;在纺织工业中,用碱性果胶酶代替碱,对棉、麻等织物进行煮练加工和整理工艺;在造纸行业中,真叶木原料中释放的溶解性胶体物质会严重影响过滤,果胶酶可以降解果胶或聚半乳糖酸,提高纸的质量;利用果胶酶还可以处理柑橘加工和蔬菜加工过程中产生的大量含果胶的废水,传统方法成本高、处理时间长,碱性果胶酶克服了以上缺点,成本低、效果好且不产生二次污染。
5.目前,碱性果胶酶工业化生产中主要存在以下问题:生产的碱性果胶酶本身活力不高;碱性果胶酶的工业化生产工艺技术不成熟。以上问题导致碱性果胶酶的生产成本过高。为了使碱性果胶酶在工业上有更加广泛的应用,筛选新型碱性果胶酶并构建高产菌株是本发明所解决的重点问题。
技术实现要素:
6.为了解决上述技术问题,本发明首先提供一种耐热性提高的果胶酶突变体,所述果胶酶突变体具有seq id no.4所示的氨基酸序列;
7.所述果胶酶突变体来自一株经紫外诱变获得的枯草芽孢杆菌(bs-5),经诱变后,野生型枯草芽孢杆菌中的果胶酶发生phe166leu和gly195ala突变;
8.进一步地,所述果胶酶突变体具有如下酶学性质:
9.(1)碱性果胶酶的作用温度范围40-60℃,最适作用温度为55℃,在温度40℃、60℃下较55℃有70%以上作用效果;
10.(2)ph为9.0为酶的最适作用ph,在ph8.0、10.0下较ph9.0仍有70%以上酶作用效
果;
11.(3)碱性果胶酶突变体在70℃条件下保温2h仍能维持80%的酶活性,在80℃条件下保温2h仍能维持70%的酶活性,而野生型剩余酶活低于50%,表明果胶酶突变体具有相当高的热稳定性。
12.进一步地,所述果胶酶突变体的编码基因a-2,具有seq id no.3所示的核苷酸序列;
13.本发明还提供包含上述编码基因a-2的重组质粒或重组菌株;
14.进一步地,所述重组质粒所采用的表达载体为ppic9质粒;
15.进一步地,所述重组菌株所采用的宿主细胞为毕赤酵母gs115。
16.本发明还提供上述重组质粒或重组菌株在制备果胶酶中的应用。
17.有益效果:
18.1、本发明提供了一种全新的碱性果胶酶突变体,该突变体具有酶活高,热稳定性好的特点。该突变体摇瓶发酵液酶活可达359u/ml,较原始碱性果胶酶提高200%;
19.2、本发明获得的碱性果胶酶热稳定性好,在70℃条件下保温2h仍能维持80%的酶活性,在80℃时,仍保留70%以上的活性。
附图说明:
20.图1菌落pcr鉴定电泳图;
21.图2碱性果胶酶最适作用温度图;
22.图3碱性果胶酶最适作用ph图;
23.图4碱性果胶酶温度稳定性曲线。
具体实施方式:
24.通过具体实施例对本发明作出更详尽的说明,仅作为举例说明,而不作为对本发明实施范围的限定。对于本领域技术人员,在本发明原理基础上还可做出的改进,这些改进也应视为本发明保护的范围。本实施例中未作具体说明的分子生物学实验方法,可参照《分子克隆实验指南》。
25.本发明采用的碱性果胶酶活力测定方法如下:
26.将发酵液在4℃,12000rpm的高速冷冻离心机上离心5min,取上清液制成酶液测定酶活力。方法:取1ml酶液和2ml的1%(w/v)果胶(ph9.0缓冲液配制)溶液分别置于两个试管中,于45℃水浴预热5min,再使它们充分混合,准确反应10min,取上述混合物1ml加入9ml 0.01mol/l hcl终止反应,在235nm处测定吸光值,以灭过酶活的酶液作为空白对照。
27.1个标准酶活力单位定义为:在一定条件下(如未特别说明,所述条件为45℃,ph9.0),每分钟裂解果胶产生1μmol不饱和半乳糖酸的酶量。不饱和半乳糖酸在235nm处的摩尔吸光系数为4600mol/(l
·
cm)。
28.酶活力:u=a
×n×
30/46
29.式中:u—酶液的酶活力,单位为u/ml;a—od
235
;n—酶液稀释倍数。
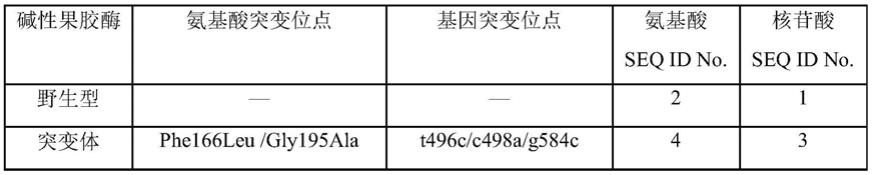
30.本发明所采用的果胶酶突变体的标识:
31.采用“原始氨基酸位置替换的氨基酸”来表示突变体中突变的氨基酸。如
phe166leu,表示位置166的氨基酸由野生型的phe替换成leu,位置的编号对应于seq id no.2中野生型碱性果胶酶的氨基酸序列编号;同样采用“原始碱基位置替换的碱基”来表示突变体中突变的碱基,位置的编号对应于seq id no.1中野生型碱性果胶酶的核苷酸序列编号。
32.在本发明中,a-1表示野生型碱性果胶酶的编码基因,a-2表示碱性果胶酶突变体的编码基因,信息如下表。
[0033][0034]
本发明涉及菌株的诱变筛选过程如下:
[0035]
菌悬液制备:将处在生长旺盛阶段的原始菌株枯草芽孢杆菌(bs)采用0.9%的生理盐水,35℃振荡30min,配成均匀的菌悬液。
[0036]
紫外诱变:菌悬液置于紫外灯下25cm照射处理100s。照射后的菌株悬液依次稀释至10-4
、10-5
、10-6
,从每个稀释倍数培养液中吸取0.1ml涂布于平板培养基(每个做三个平行),35℃倒置培养48h,未经紫外照射的菌株作为对照,观察比较透明圈大小。
[0037]
复筛验证:将诱变得到的透明圈较大的5个正突变株进行活化培养,将菌株在种子培养基中培养48h后以6%接种量接到发酵培养基中,摇床200rpm,35℃振荡培养48h,将发酵液在冷冻离心机4000rpm离心l0min,取其上清测定酶活,进行复筛验证。由表1可以看出,菌株bs-5酶活力最高,可达到215u/ml,较出发菌株(65u/ml)提高2.3倍。获得一株酶活提高的菌株并命名为枯草芽孢杆菌(bs-5)。
[0038]
表1紫外诱变下正突变菌株筛选结果
[0039][0040]
菌株的诱变筛选培养基及发酵产酶培养基如下:
[0041]
试管斜面培养基(g/l):牛肉膏6-8,胰蛋白胨8-11,氯化钠8-10,琼脂18-22,ph7.5,其余为水。
[0042]
种子培养基(g/l):蛋白胨8-12,酵母粉4-8,氯化钠8-10,ph7.0,其余为水。
[0043]
发酵产酶培养基(g/l):酵母粉1-2,豆饼粉2-5,麦芽糊精5-10,氯化钙0.1-0.5%,硫酸镁0.1-0.5,磷酸氢二钾0.5-2,其余为水。
[0044]
平板培养基(g/l):果胶8-12,蛋白胨8-12,酵母粉4-8,硫酸镁0.5-1.5,琼脂20,其余为水。
[0045]
以下通过具体实施方式对本发明作进一步地解释说明。
[0046]
实施例1碱性果胶酶基因a-2的获得
[0047]
将紫外诱变筛选得到的菌株bs-5,根据果胶酶基因核苷酸序列设计pcr引物,5'端加入酶切位点xhoⅰ,3'端加入酶切位点notⅰ,通过pcr得到突变基因a-2,经过测序其核苷酸序列为seq id no.3所示。引物序列如下:
[0048]
a-2-f 5'-ccgctcgagatgaaaaaagtgatgttagc-3';
[0049]
a-2-r 5'-ttgcggccgcttaatttaatttacccgcac-3'。
[0050]
实施例2重组载体ppic9-a-2的构建
[0051]
分别对a-2基因和质粒ppic9进行xhoⅰ和notⅰ酶切,回收产物,将回收后的a-2基因和ppic9按比例混合,用t4连接酶在16℃条件下连接过夜,连接产物转化大肠杆菌dh5α感受态细胞,转化产物涂布在lb(含氨苄霉素)固体平板上,37℃倒置培养过夜,挑取单菌落至lb液体培养基,37℃培养,菌液进行菌落pcr,电泳鉴定结果如图1,测序结果显示序列正确,序列大小1.26kb。抽提重组质粒ppic9-a-2待用。
[0052]
实施例3重组质粒转化毕赤酵母
[0053]
1.毕赤酵母gs115感受态细胞的制备
[0054]
1)挑取毕赤酵母平板单菌落,接种于5ml的ypd培养基,30℃,220rpm振荡过夜;
[0055]
2)取0.5ml的过夜培养的菌液,接种于50ml新鲜配制的ypd培养基,30℃,220rpm振荡培养,使od600值达到1.3-1.5;
[0056]
3)取上述培养液于4℃,3000rpm,离心5min;
[0057]
4)弃去上清液,加入50ml冰上预冷的无菌水,振荡重悬菌体;
[0058]
5)4℃,3000rpm,离心5min,弃去上清液,吸干管壁残余液体,加入25ml冰上预冷的无菌水,振荡重悬菌体;
[0059]
6)4℃,3000rpm,离心5min,弃去上清液,吸干管壁残余液体,加入10ml冰上预冷的1mol/l的无菌山梨醇溶液,重悬菌体;
[0060]
7)4℃,3000rpm,离心5min,弃去上清液,吸干管壁残余液体,加入1ml冰上预冷的1mol/l的无菌山梨醇溶液(预先加入甘油至终浓度15%),振荡混匀。
[0061]
8)分装100μl/管至无菌ep罐,-70℃冰箱冰冻保藏(新鲜制备的感受态细胞效果更佳)。
[0062]
2.线性化质粒的转化
[0063]
抽提得到的重组质粒ppic9-a-2用salⅰ进行单酶切,得到线性化质粒。取新鲜制备的(或-70℃冻存的)感受态细胞置于冰浴中,使其完全解冻。
[0064]
1)将100μl感受态细胞移出至一新的无菌ep管中,加入10μl线性化质粒,轻吹混匀,吸出转移到0.2cm型的电穿孔转化杯中;
[0065]
2)转化杯置于冰浴中5-10分钟,保持低温。
[0066]
3)电穿孔转化电击条件:1500v,200ω,25μf,放电时间5ms左右,一次电击。
[0067]
4)电击后,马上在电击转化杯中加入1ml 4℃预冷的1mol/l的山梨醇溶液,用移液枪吹打均匀,置于冰浴中;
[0068]
5)在超净工作台上无菌操作涂布md培养基(1.34%ynb;4
×
10-5
%生物素;2%葡萄糖平板),100-200μl/板,涂好的平板30℃倒置培养3-4天;
[0069]
6)在md平板上筛选得到两株重组菌,经菌落pcr得到目的序列,测序比对显示为目
的基因a-2的核苷酸序列,即所得菌株为含有ppic9-a-2的重组菌,分别命名为诱变1,诱变2。
[0070]
实施例4含有重组质粒ppic9-a-2的酵母菌的诱导表达
[0071]
bmgy培养基配方:1%酵母浸出物,2%蛋白胨,10%0.1mol/l ph6.0磷酸盐缓冲液,1.34%ynb,4
×
10-5
%生物素,1%甘油,其余为水。
[0072]
bmmy培养基配方:1%酵母浸出物,2%蛋白胨,10%0.1mol/l ph6.0磷酸盐缓冲液,1.34%ynb,4
×
10-5
%生物素,0.5%甲醇,其余为水。
[0073]
将重组菌诱变1,诱变2以及用实施例2、3同样方法以原始基因a-1构建的重组菌株gs115/ppic9-a-1分别接种于装有30ml bmgy培养基的三角瓶中,30℃,220rpm培养至od600为10左右,离心收集菌体,用35ml的bmmy诱导培养基重悬菌体,并在30℃,220rpm条件下继续培养48h,发酵液离心后测定上清中的碱性果胶酶酶活,结果如下表,可见突变后的果胶酶phe166leu/gly195ala突变体酶活较野生型提高2倍左右。
[0074][0075][0076]
实施例5碱性果胶酶的酶学性质
[0077]
a.碱性果胶酶的最适作用温度范围
[0078]
在ph9.0条件下测定在不同温度下碱性果胶酶活的作用效果,碱性果胶酶在温度范围35-70℃下进行实验,实验结果表明温度为55℃为本发明碱性果胶酶突变体的最适温度,以55℃下的作用酶活为标准参照(相对作用酶活100%)作图,结果如图2所示。实验结果表明碱性果胶酶在温度为55℃效果显著,温度高于或者低于55℃作用效果降低。在温度40℃、60℃相对酶活仍然有70%,这表明该酶作用的温度范围较广,可以适应不同的温度。
[0079]
b.碱性果胶酶最适作用ph范围
[0080]
将酶液放置在45℃条件下测定在不同ph下碱性果胶酶活的作用效果,设置不同ph值(7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0),实验结果表明ph为9.0为酶的最适作用ph,以ph9.0下作用酶活为标准参照(相对作用酶活100%)作图,结果如图3所示。实验结果表明碱性果胶酶在ph9.0作用效果显著,该酶在ph为8.0、10.0时,酶活力均可保持在70%以上,说明该菌产生的碱性果胶酶可以在较宽的ph范围内保持其酶的作用效果。
[0081]
实施例6碱性果胶酶的热稳定性
[0082]
取野生型和诱变型菌株产生的碱性果胶酶进行实验,取相同酶活的作用量(相对酶活100%),在ph9.0的条件下,以10℃为间隔,分别在30℃-80℃下保温2h后测定酶的剩余酶活力,绘制热稳定性曲线。结果如图4所示,突变体较野生型酶活热稳定性高。果胶酶突变体在70℃条件下保温2h仍能维持80%的酶活性,在80℃时,仍保留70%以上的活性,而野生型剩余酶活低于50%。本发明提供的碱性果胶酶突变体具有相当高的热稳定性。
