一种抑制pcsk9靶基因表达的核酸序列及其应用
技术领域
1.本发明涉及分子生物学领域,特别是涉及一种抑制pcsk9靶基因表达的核酸序列及其应用。
背景技术:
2.前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/kexin type 9,pcsk9)是属于ca
2+
依赖的丝氨酸内切酶,pcsk9可以通过细胞外及细胞内途径与低密度脂蛋白受体(low density lipoprotein receptor,ldlr)结合,促进ldlr的降解;细胞外途径也是发挥作用的主要方式,分泌至细胞外的pcsk9通过与细胞膜上的ldlr结合,使得ldlr被内吞形成内体,最终进入溶酶体而被降解;在细胞内途径中从高尔基体分泌出的pcsk9进入细胞质,直接与ldlr结合,使ldlr在细胞内直接进入溶酶体降解途径。由于ldlr是组织尤其是肝脏摄取循环中胆固醇的重要方式,因此pcsk9的含量增加引起的ldlr降解会导致循环中胆固醇含量的升高,这使得pcsk9成为降低血胆固醇的重要靶点。
3.并且,低密度脂蛋白胆固醇(ldl-c)升高是心血管疾病主要的危险因素,pcsk9抑制剂具有强大的降低ldl-c作用,是极具前景的新型降脂药物。靶向pcsk9的sirna药物从mrna层面上阻断pcsk9蛋白功能,降低血液中的ldl-c水平,比传统药物具有特异性好、易于设计、低毒性、不产生耐药性等特点。
4.sirna作为一种新的治疗方法具有巨大的发展潜力,sirna作用于细胞内的mrna,相对于传统的小分子药物,它能够直接沉默靶基因,因此可以从根本上更高效地组织疾病的发生和发展,但由于sirna稳定性较差,在体内容易被核酸酶降解,不易被组织吸收,难以被细胞摄取,易产生脱靶效应等缺陷,使得其在临床应用上受到局限。对sirna进行恰当的修饰能够增加sirna的稳定性,同时有效抑制目的基因的表达。
技术实现要素:
5.基于此,本发明的目的之一在于提供一种抑制或降低pcsk9靶基因表达的sirna。
6.包括如下技术方案:
7.一种抑制或降低pcsk9靶基因表达的sirna,其由互补的正义链和反义链组成;所述正义链的碱基组成序列选自seq id no.1-seq id no.2,并且,所述正义链从5
′
末端起第1个碱基和从3
′
末端起第1-2个连续碱基均进行2
′‑
o-甲基修饰;所述反义链的碱基组成序列选自seq id no.3-seq id no.9。
8.本发明的目的之一还在于提供一种药物组合物。
9.包括如下技术方案:
10.一种药物组合物,其有效成分包括上述抑制或降低pcsk9靶基因表达的sirna。
11.本发明的目的之一还在于提供上述药物组合物在预防或缓解或治疗由pcsk9靶基因表达引起的疾病中的应用。
12.本发明的目的之一还在于提供一种抑制或降低pcsk9靶基因表达的方法。
13.包括如下技术方案:
14.一种抑制或降低pcsk9靶基因表达的方法,其为引入上述抑制或降低pcsk9靶基因表达的sirna、和/或上述药物组合物。
15.本发明的发明人基于对pcsk9和sirna技术的深入研究,在正义链碱基组成序列为seq id no.1,反义链碱基组成序列为seq id no.3,或正、反义链核苷酸序列分别经取代、缺失和/或添加多个碱基并经修饰而形成的sirna中,找到了一种sirna,其正义链碱基组成序列为seq id no.1,反义链碱基组成序列为seq id no.8,同时,发现对sirna的核糖环进行2
′‑
o-甲基、2
′‑
氟代修饰,还能在保持抑制目的基因表达能力的前提下,能够减少其被血液和组织中核酸酶降解,增加体内的稳定性,提高其做为临床药物的适用性。特别是对上述碱基序列中的部分碱基进行特定的化学组合修饰(即正义链从5
′
末端到3
′
末端的方向,第1、2、6位碱基为2
′‑
o-甲基修饰,第4、8、10位碱基为2
′‑
氟代修饰,倒数第1、2、5、6、8位碱基为2
′‑
o-甲基修饰,倒数第3、4、7位碱基为2
′‑
氟代修饰;反义链仅采用2
′‑
氟代修饰,特别是从5
′
末端到3
′
末端的方向,第1、4、5、7、8、10、12、13、14、16、17、20、21、22、24位碱基为2
′‑
氟代修饰),形成的sirna:rb-51在使用浓度低至6nm时就能够有效降低pcsk9靶基因表达。
16.对sirna:rb-51进一步进行配体修饰,在形成的缀合物(galnac-sirna):rb59-rb71中,经内吞实验和亲和力实验发现,rb-61、rb-70可以在有效降低pcsk9靶基因表达的同时,还具有良好的促进细胞内吞的能力,并且还具有优异的亲和力,预示其在临床使用中,可降低对其他组织或器官的影响以及减少sirna分子的使用量,从而达到减轻毒性和降低成本的目的;还可以更有效地进入细胞或组织发挥作用,有望开发为降脂药物并为靶向治疗提供了可能。
附图说明
17.图1为实施例1中不同sirna对pcsk9 mrna表达水平影响的统计结果。
18.图2为实施例2中半乳糖修饰单体l的合成反应流程图。
19.图3为实施例3中采用hela细胞进行内吞实验,不同sirna对pcsk9mrna表达水平影响的统计结果。
20.图4为实施例3中采用原代小鼠肝细胞进行内吞实验,不同缀合物对pcsk9mrna表达水平影响的统计结果。
21.图5为实施例3中采用原代小鼠肝细胞进行内吞实验,不同缀合物下活细胞群cy5荧光的平均荧光强度mfi统计结果。
具体实施方式
22.为了便于理解本发明,下面将参照实施例对本发明进行更全面的描述,以下给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。应理解,下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用试剂,均为市售产品。
23.除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。在本发明的说明书中所使用的术语只是为了描述具体的
实施例的目的,不是旨在于限制本发明。本发明所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。
24.以下结合具体实施例对本发明作进一步详细的说明。
25.本发明的一些实施例提供了一种抑制或降低pcsk9靶基因表达的sirna,其由互补的正义链和反义链组成;所述正义链的碱基组成序列选自seq id no.1-seq id no.2,并且,所述正义链从5
′
末端起第1个碱基和从3
′
末端起第1-2个连续碱基均进行2
′‑
o-甲基修饰;所述反义链的碱基组成序列选自seq id no.3-seq id no.9。
26.在其中的一些实施例中,上述抑制或降低pcsk9靶基因表达的sirna中,在核糖的2
′
位置引入取代基修饰羟基后,可使sirna具有更强的抵抗核酸酶水解的性能。并且发现2
′‑
o-甲基修饰的sirna可有效避免sirna中任一条链因全部甲基化,从而避免sirna失去基因沉默的活性;2
′‑
氟修饰的sirna使rna酶不易识别sirna,从而增加了sirna的稳定性。
27.在其中的一些实施例中,上述抑制或降低pcsk9靶基因表达的sirna中,正义链从5
′
末端到3
′
末端的方向,第1-7位碱基为2
′‑
o-甲基修饰,倒数第1-7位碱基位2
′‑
o-甲基修饰;或,第1、6位碱基为2
′‑
o-甲基修饰,倒数第1、2、5、6位碱基为2
′‑
o-甲基修饰,第4、8位碱基为2
′‑
氟代修饰。
28.在其中的一些实施例中,上述抑制或降低pcsk9靶基因表达的sirna中,反义链从5
′
末端到3
′
末端的方向,第2位碱基为2
′‑
o-甲基修饰;或,第3、4、7、8位碱基为脱氧核糖核苷酸修饰;或,第9、11、13、14、15、17、18位碱基为2
′‑
氟代修饰。
29.在其中的一些实施例中,上述正义链和反义链形成的sirna包括rb1-rb57。
30.在其中的一些实施例中,上述抑制或降低pcsk9靶基因表达的sirna,其正义链的碱基组成序列为seq id no.1,并且所述正义链从5
′
末端到3
′
末端的方向,第1、2、6位碱基为2
′‑
o-甲基修饰,第4、8、10位碱基为2
′‑
氟代修饰,倒数第1、2、5、6、8位碱基为2
′‑
o-甲基修饰,倒数第3、4、7位碱基为2
′‑
氟代修饰;所述反义链的碱基组成序列为seq id no.8,并且所述反义链从5
′
末端到3
′
末端的方向,第1、4、5、7、8、10、12、13、14、16、17、20、21、22、24位碱基为2
′‑
氟代修饰。
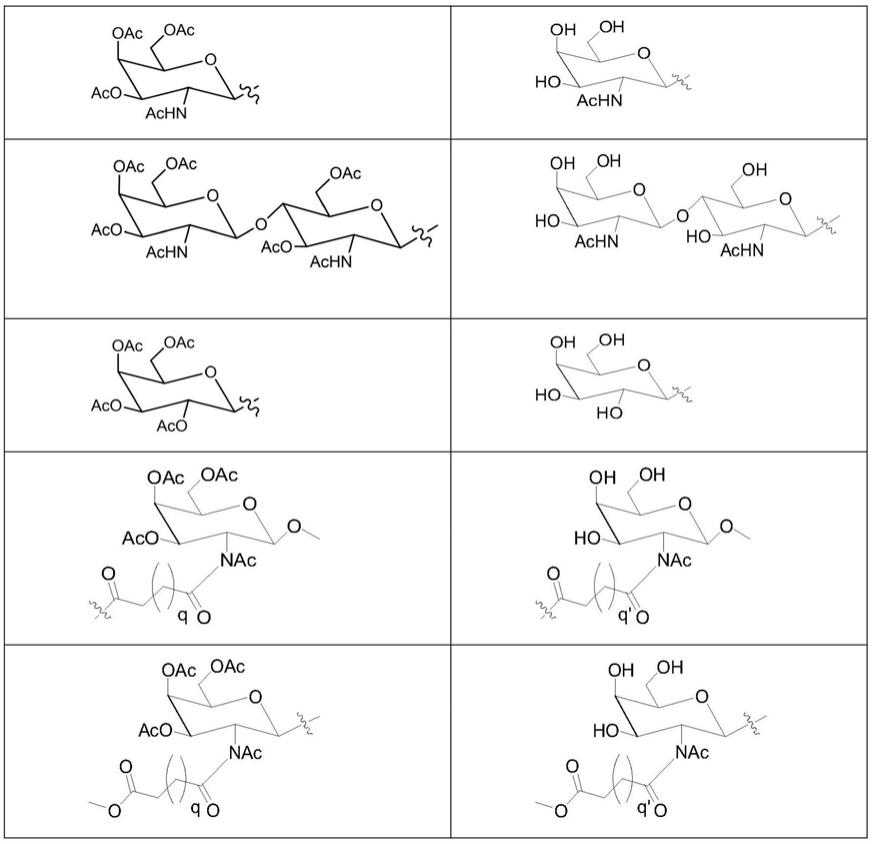
31.在其中的一些实施例中,上述抑制或降低pcsk9靶基因表达的sirna,其正义链为mcmadgfcdamadgfudgfudgmafcmamgfufcmamu,反义链为afugafcfugfufcafcafcfufugfcfuggfcfcfugfu。其中,n:未修饰的核糖核苷酸的统称,包括有a:腺嘌呤核糖核苷酸,g:鸟嘌呤核糖核苷酸,c:胞嘧啶核糖核苷酸,u:尿嘧啶核糖核苷酸。dn:未修饰的脱氧核糖核苷酸的统称,包括有da:腺嘌呤脱氧核糖核苷酸,dg:鸟嘌呤脱氧核糖核苷酸,dc:胞嘧啶脱氧核糖核苷酸,dt:胸腺嘧啶脱氧核糖核苷酸。fn:2'-氟代修饰的核糖核苷酸。mn:2
’‑
o-甲基修饰的核糖核苷酸。
32.在其中的一些实施例中,上述抑制或降低pcsk9靶基因表达的sirna具有配体修饰,配体修饰可改善sirna分子的细胞摄取、细胞内靶向、半衰期、或药物代谢或动力学性等性能。在一些实施方案中,与不经配体修饰的sirna相比,配体修饰的sirna针对选定靶标(如特定的组织类型、细胞类型、细胞器等)、优选肝细胞具有增强的亲和力或细胞摄取力,且不会干扰sirna的活性。
33.在其中一些实施例中,上述配体修饰的位置为sirna的正义链末端或反义链3
′
末端。
34.在其中一些实施例中,上述抑制或降低pcsk9靶基因表达的sirna经配体修饰可形成缀合物。
35.在其中一些实施例中,上述配体修饰为上述抑制或降低pcsk9靶基因表达的sirna与配体化合物连接而成,所述配体化合物的结构为ax-linker-r。
36.在其中一些实施例中,上述配体修饰的配体化合物结构中,所述ax选自如下表中的结构:
[0037][0038][0039]
在其中一些实施例中,上述配体修饰的配体化合物结构中,所述linker选自任一如下结构:
[0040][0041]
其中,n选自1-10的整数,进一步优选为,n为1;
[0042]
[0043]
其中,n1和n2各自独立地选自1-10的整数,进一步优选为,n1为1,n2为1;
[0044][0045]
其中,n1、n2、n3各自独立地选自1-10的整数,进一步优选为,n1为1,n2为1,n3为1;
[0046][0047]
其中,n选自1-10的整数,进一步优选为,n为1。
[0048]
在其中一些实施例中,上述配体修饰的配体化合物结构中,所述r选自任一如下结构:
[0049]
r1为
[0050]
r2为r2中,m1和m2各自独立地选自1-10的整数,
[0051]
r3为
[0052]
r1、r2、r3中,z为羟基的保护基,优选地,z各自独立地为4,4-二甲氧基三苯甲烷基或4-甲氧基三苯基氯甲烷基。
[0053]
在其中的一些实施例中,上述配体化合物结构为:
[0054]
其中,n选自1-10之间的整数。
[0055]
在其中一些实施例中,上述配体化合物结构中的n为1,该配体化合物为半乳糖修饰单体l,简称配合物l。
[0056]
在其中的一些实施例中,上述配体化合物与sirna配合修饰成为如下任一结构:
[0057]
[0058][0059]
其中nu为上述抑制或降低pcsk9靶基因表达的sirna中的核苷酸序列。
[0060]
在其中的一些实施例中,上述配合修饰形成的缀合物中,核苷酸序列可选自seq id no.1-seq id no.2所示sirna的正义链和/或seq id no.3-seq id no.9所示反义链序列,或rb1-rb57中经修饰的sirna正义链和反义链序列。
[0061]
在其中的一些实施例中,上述配合修饰形成的缀合物中,所缀合的序列为sirna的正义链mcmadgfcdamadgfudgfudgmafcmamgfufcmamu,或为反义链afugafcfugfufcafcafcfufugfcfuggfcfcfugfu。
[0062]
在其中的一些实施例中,上述sirna的3’端或5’端能够和与配体化合物形成缀合物,sirna和l形成的缀合物结构可参考zw1001,sirna和ll形成的缀合物结构可参考zw1002,sirna和lll形成的缀合物结构可参考zw1003。
[0063]
在其中一些实施例中,上述配体化合物与sirna配合修饰成为zw1003或zw1004,其中配体化合物中n为1。
[0064]
在其中一些实施例中,上述配合修饰形成的缀合物还包括荧光标记和/或生物素标记;所述荧光标记的荧光基团包括但不限于fam、tet、joe、hex、cy3、tamra、rox、texas、red、lc red640、cy5、lc red705、alexa fluor488和alexa fluor 750,优选为cy5;所述生物素标记可以减少位阻效应,增加检测的灵敏度和特异性。其使用的生物素包括但不限于n-羟基丁二酰亚胺酯(bnhs)、对硝基酚酯(pbnp)、生物有生物素酰肼(bhz)及肼化生物素(bchz)。
[0065]
在其中一些实施例中,上述配体修饰的位置为sirna的正义链末端或反义链3
′
末端。
[0066]
在其中的一些实施例中,上述配合修饰形成的缀合物如rb58-rb71所示。
[0067]
在其中一些实施例中,上述缀合物为rb-61,其正义链为mcmadgfcdamadgfudgfudgmafcmamgfufcmamu-lll,反义链为/cy5/-afugafcfugfufcafcafcfufugfcfuggfcfcfugfu;或为rb-66,其正义链为lll-mcmadgfcdamadgfudgfudgmafcmamgfufcmamu,反义链为/cy5/-afugafcfugfufcafcafcfufugfcfuggfcfcfugfu;或为rb-66,其正义链为mcmadgfcdamadgfudgfudgmafcmamgfufcmamu-llll,反义链为/cy5/-afugafcfugfufcafcafcfufugfcfuggfcfcfugfu。其中,/cy5/为cy5荧光染料标记;l为上述l型配体化合物配合修饰。
[0068]
本发明的一些实施例提供了一种药物组合物,其有效成分包括上述抑制或降低pcsk9靶基因表达的sirna。
[0069]
在其中的一些实施例中,上述药物组合物可应用于由pcsk9基因介导的疾病中,包括但不限于高脂血症、高胆固醇血症、黑色素瘤、肝癌。
[0070]
本发明的一些实施例还提供了一种抑制或降低细胞pcsk9靶基因表达的方法,包括向细胞引入本发明的sirna和/或药物组合物。如本文所使用,术语“引入”是指便于摄取或吸收入细胞,其可通过非辅助性扩散或主动的细胞过程发生,或通过辅助试剂或设备发生。可以为直接引入或间接引入,除使用转染试剂外,其他已知的各种将sirna分子递送如细胞的方式都可采用,如注射、载体转染(载体可以是质粒或病毒)、电穿孔,脂质体转染等。
[0071]
在其中的一些实施例中,上述方法包括抑制或降低pcsk9靶基因表达,步骤如下:
[0072]
(1)获取待转染细胞和上述抑制或降低pcsk9靶基因表达的sirna;
[0073]
(2)将上述sirna与待转染细胞混合并转染至该细胞中;
[0074]
(3)细胞培养,得到。
[0075]
在其中的一些实施例中,上述方法中sirna转染的浓度为4nm-0.1μm;进一步优选为6nm-60nm。
[0076]
在其中的一些实施例中,上述方法中细胞为表达pcsk9的哺乳动物细胞,优选靶细胞中pcsk9基因高水平表达,例如灵长类动物细胞,诸如人细胞;优选细胞来源于脑、唾液腺、心脏、脾脏、肺脏、肝脏、肾脏、肠道或肿瘤。进一步优选为肝癌细胞或宫颈癌细胞,更进一步优选为hela细胞。
[0077]
实施例1pcsk9-sirna的制备及检测
[0078]
一、sirna设计
[0079]
根据人pcsk9 mrna序列,选择不同位点设计多对pcsk9-sirna,设计的所有单个sirna均能靶向靶基因(如表1)的所有转录本,这些多对sirna经序列相似性软件比对与其他所有非靶标基因序列有最低同源性。序列设计方法参考elbashir et al.2002;paddison et al.2002;reynoldset al.2004;ui-tei et al.2004等人的方法。
[0080]
表1-1
[0081]
靶基因物种geneidnm_idpcsk9homosapiens(人)255738nm_174936.3
[0082]
二、sirna合成
[0083]
本发明涉及的sirna基本碱基序列(未修饰)如下表1-2所示:
[0084]
表1-2
[0085][0086]
上述表中的正义链、反义链分别经独立修饰后,组合形成的sirna序列如下表1-3所示,具体制备步骤参考中国发明专利cn109957567a:
[0087]
表1-3 sirna序列表
[0088]
[0089]
[0090]
[0091][0092]
其中,序列中各缩写含义如下:
[0093]
n:未修饰的核糖核苷酸的统称,包括有a:腺嘌呤核糖核苷酸,g:鸟嘌呤核糖核苷酸,c:胞嘧啶核糖核苷酸,u:尿嘧啶核糖核苷酸。
[0094]
dn:未修饰的脱氧核糖核苷酸的统称,包括有da:腺嘌呤脱氧核糖核苷酸,dg:鸟嘌呤脱氧核糖核苷酸,dc:胞嘧啶脱氧核糖核苷酸,dt:胸腺嘧啶脱氧核糖核苷酸。
[0095]
fn:2'-氟代修饰的核糖核苷酸。
[0096]
mn:2
’‑
o-甲基修饰的核糖核苷酸。
[0097]
三、sirna抑制pcsk9基因表达水平
[0098]
实验材料:hela细胞(crm-ccl-2
tm
),ribofect
tm cp transfection kit(ribobio,c10511-1),nc1(ribobio),nc2(ribobio),减血清培养基opti-mem(gibco,31985-070)、dmem(gibco,c11995500bt),fbs(gibco,10270-106),magzol reagent(magen,r4801),2x sybr green mix(ribobio,c10712f-1ml),riboscript
tm reverse transcription kit(ribobio,c11027-2),24孔板(corning,3524),co2培养箱(memmert,inc246),荧光定量pcr仪(bio-rad,cfx96)等。
[0099]
实验步骤:
[0100]
1、细胞铺板
[0101]
用1ml pbs润洗24孔板,取细胞状态良好的hela正常消化计数,dmem完全培养基稀释后,每孔加入50,000个细胞,每孔体积700ul。37℃,5%co2培养箱培养过夜。
[0102]
2、细胞转染
[0103]
转染前确定细胞密度(约为50%左右,相对均匀)。转染前将所有sirna样品配置成20um储液,除了试验组,设置正常细胞对照组(untreated)、转染试剂对照组(mock)、阴性对照组1(nc1,不相关sirna)、阴性对照组2(nc2,不相关sirna)。对于每一条sirna,3个复孔的转染体系均按如下步骤配制:
[0104]
(1)取12ul的20um sirna样品加入138ul的opti-mem之中,混匀。
[0105]
(2)取15ul的ribofect
tm cp transfection reagent加入135ul ribofect
tm cp buffer之中,混匀。
[0106]
(3)将稀释好的sirna与稀释好的转染试剂混合,轻轻混匀,瞬时离心后静置5-15min,制备转染复合物。
[0107]
(4)将混合转染体系加入3个重复孔中,100ul/孔,混合均匀,sirna终浓度100nm。
[0108]
(5)将细胞放于37℃,5%co2培养箱培养48h。
[0109]
3、提取rna
[0110]
按照magzol reagent(magen,r4801)说明书,提取总rna。
[0111]
4.荧光定量pcr及数据分析
[0112]
(1)反转录pcr
[0113]
在pcr管中分别加入以下组分,配制反转录反应体系:
[0114][0115]
瞬时离心后在pcr仪中进行反应。
[0116]
(2)42℃反应60min。
[0117]
(3)72℃10min灭活逆转录酶。
[0118]
(4)稀释5倍,充分混匀,-20℃冰箱保存。
[0119]
(2)荧光定量pcr
[0120]
以人的看家基因actin作为内参基因,actin基因上游引物序列:5
’‑
tcaagatcattgctcctcctgag-3’(seq id no.10),下游引物序列:5
’‑
acatctgctggaaggtggaca-3’(seq id no.11);人的pcsk9基因上游引物序列:5
’‑
aagccaagcctcttcttacttca-3’(seq id no.12),下游引物序列:5
’‑
cctgggtgataacggaaaaag-3’(seq id no.13)。利用2x sybr green mix进行实时荧光定量pcr反应,具体步骤如下:
[0121]
96孔板中加入下列组分配制pcr体系,每个样品3次重复:
[0122][0123]
使用美国bio-rad公司cfx96荧光定量pcr仪进行pcr反应,pcr反应程序如下:
[0124][0125]
pcr反应后温度从70℃上升到95℃绘制熔解曲线,以判断扩增产物的正确性。
[0126][0127]
(3)数据分析
[0128]
pcr反应结束后,一个样品的9个重复(每个单独的样品在转染时有3个重复,在qpcr时每个重复做3个复孔)的ct误差应在
±
0.5。然后用cfx 2.1软件进行相对定量分析。分析结果如图1和下表1-4所示:
[0129]
表1-4sirna的mrna表达水平
[0130][0131][0132]
通过上述对实时定量pcr检测结果的统计分析可知,在hela细胞中,sirna分子:
rb1-rb57都能有效抑制细胞内的pcsk9基因表达,其中转染rb1-rb6、rb8、rb10-rb14、rb17-rb22、rb24-rb27、rb47-rb48、rb51的细胞中,pcsk9基因表达水平都低于0.1,表明对应sirna抑制pcsk9基因表达的活性较高。
[0133]
其中,在rb1-rb3、rb5-rb7、rb10-rb12中,rb1、rb5、rb10抑制pcsk9活性最高,表明反义链的长度对其抗pcsk9活性有影响,在正义链两端为7个甲氧基修饰或在第16位核苷酸加入甲氧基修饰的情况下,反义链长度为25个核苷酸的活性较22和19个核酸长度的sirna高;rb19-rb21、rb23-rb25中rb19活性不如rb20、21,rb25活性优于rb23、24,表明在正义链两端为7个甲氧基修饰或在第10、14位核苷酸加入氟化修饰,第12位加入甲氧基修饰的情况下,反义链长度为19个核苷酸的活性较25个核酸长度的sirna高;rb4、相对于rb1、rb13相对于rb10、rb22相对于rb19的抗pcsk9活性相近或轻微降低,表明对反义链第2位核苷酸进行甲氧基修饰对其活性影响不大;rb5、rb-6相对于rb1,rb14相对于rb10,rb23相对于rb19,其抗pcsk9活性相当,表明前8个核苷酸修饰后进行可保持其抑制pcsk9活性;rb-8活性优于rb9,rb17优于rb18,表明在正义链两端为7个甲氧基修饰情况下,反义链的第1、3、4位核苷酸的核糖环加入脱氧修饰,第5位核苷酸的核糖环使用氟化修饰替代脱氧修饰,第6、8位核苷酸使用dt替代fu降低sirna抗pcsk9活性,rb27活性优于rb26表明在正义链两端为7个甲氧基修饰,第10、14位核苷酸加入氟化修饰,第12位加入甲氧基修饰情况下,反义链的第1、3、4位核苷酸的核糖环加入脱氧修饰,第5位核苷酸的核糖环使用氟化修饰替代脱氧修饰,第6、8位核苷酸使用dt替代fu提高其抗pcsk9活性;rb47活性优于rb48,表明在正义链两端为8个甲氧基修饰,第9、11、13、15、17位核苷酸的核糖环进行脱氧化修饰,第10、14位进行氟化修饰,第12、16位进行甲氧化修饰的情况下,反义链25个核苷酸长度的sirna活性优于19个核苷酸,rb-51的活性较好,表明正义链长度为19个核苷酸,两端进行2个甲氧基修饰,第3、5、7、9、11进行脱氧修饰,第4、8、10、13、16、17进行氟化修饰,第6、12、14、15进行甲基化修饰,反义链长度为25个核苷酸,第2、5、6、8、9、11、13、14、15、17、18、21、22、23、25进行氟化修饰时其抗pcsk9活性较好。
[0134]
实施例2缀合物的制备
[0135]
1、配体化合物的制备:半乳糖修饰单体l的合成反应流程图如图2所示,具体制备步骤参考中国发明专利cn109957567a。
[0136]
2、配体化合物修饰sirna
[0137]
将rb51通过上述配合物l修饰形成缀合物,并参考中国发明专利cn109957567a对其中部分进行生物素、荧光标记,形成rb-58~rb-71,具体结构如表2-1所示。以rb-59为例,制备步骤如下:
[0138]
表2-1
[0139]
[0140][0141]
其中,/bio/:生物素标记;/cy5/:cy5荧光染料标记;l:l型配体化合物。
[0142]
实施例3内吞实验
[0143]
一、hela细胞
[0144]
实验材料:hela细胞,ribofect
tm cp transfection kit(ribobio,c10511-1),nc1(ribobio,sib0943083707),nc2(ribobio,sib0818164933),biotin labeled mimic nc(ribobio),减血清培养基opti-mem(gibco,31985-070)、dmem(gibco,c11995500bt)、fbs(gibco,10270-106),magzol reagent(magen,r4801),2x sybr green mix(ribobio,c10712f-1ml),riboscript
tm reverse transcription kit(ribobio,c11027-2),24孔板(corning,3524),co2培养箱(memmert,inc246),荧光定量pcr仪(bio-rad,cfx96)等。
[0145]
实验步骤:
[0146]
1、细胞铺板:参考实施例1中相应的步骤
[0147]
2、细胞转染
[0148]
转染前确定细胞密度要约为40-50%左右,相对均匀。转染前将所有sirna样品配置成20um储液,除了试验组(如无配体修饰的rb-51、具有半乳糖修饰单体l修饰的rb-62、具有半乳糖修饰单体l和生物素修饰的rb-59),设置正常细胞对照组(untreated)、转染试剂对照组(mock)、阴性对照组1(nc1)、阴性对照组2(nc2)、内吞阴性对照组(biotin labeled mimic nc,nt)。转染后样品浓度为100nm,未转染样品浓度为500nm。对于每一条sirna,3个复孔的转染体系均参考实施例1中相应步骤配制:
[0149]
3、细胞孵育
[0150]
细胞密度约为40-50%左右,相对均匀。对于每一条sirna(3个复孔)按照以下步骤稀释:
[0151]
(1)取60ul的20um sirna样品加入到240ul opti-mem之中,混匀。
[0152]
(2)将稀释好的sirna加入3个重复孔中,100ul/孔,终浓度500nm,混合均匀。将细胞放于37℃,5%co2培养箱培养48h。
[0153]
4、提取rna
[0154]
按照magzol reagent(magen,r4801)说明书,提取总rna。
[0155]
5.荧光定量pcr及数据分析:
[0156]
参见实施例1中相应步骤检测,检测结果如图3及下表2-1所示:
[0157]
表3-1缀合物的mrna表达水平
[0158][0159]
结合上表2-1和图3的信息可知,无配体修饰的rb-51、具有半乳糖修饰单体l修饰的rb-62、具有半乳糖修饰单体l和生物素修饰的rb-59在有细胞转染的情况下,都能显著有效地抑制细胞内的pcsk9基因表达,在没有细胞转染的帮助下,相比内吞阴性对照组,也都存在抑制细胞内的pcsk9基因表达的活性,充分说明本发明设计得到的galnac-sirna能有效降低pcsk9靶基因表达。
[0160]
二、原代小鼠肝细胞内吞galnac-sirna
[0161]
实验材料:小鼠原代肝细胞,propidium iodide(sigma,p4170),tdl5m台式低速冷冻离心机,u型底96孔板,流式细胞仪(bdaccuri c6),多通道移液器,缀合物(galnac-sirna):rb-60、rb-61、rb-64、rb-65、rb-66、rb-67、rb-68、rb-69、rb-70、rb-71,均由广州市锐博生物科技有限公司合成。
[0162]
实验步骤:
[0163]
1.细胞准备及鉴定
66的内吞活性相比较高。
[0175]
实施例4亲和力测定
[0176]
实验材料:小鼠原代肝细胞,propidium iodide(sigma,p4170),tdl5m台式低速冷冻离心机,u型底96孔板,流式细胞仪(bdaccuri c6),多通道移液器,缀合物:rb-61、rb-66、rb-70均由广州市锐博生物科技有限公司合成。
[0177]
实验步骤:
[0178]
1、稀释galnac-sirna
[0179]
galnac-sirna(1um)按下表4-1梯度稀释:
[0180]
表4-1
[0181][0182][0183]
rb-61、rb-66、rb-70均按上述步骤制备sirna溶液。
[0184]
2、细胞准备
[0185]
用含2%fbs的dmem培养基稀释细胞浓度4*105个/ml。
[0186]
3、混合加样及孵育
[0187]
每个样品200ul细胞与200ulsirna混合均匀,空白对照组200ul细胞与200ul培养基混合均匀。加入u型底96孔板的3个孔中,100ul每孔。所有sirna的各浓度样品加好样后置于冰盒中,放在脱色摇床上,避光孵育2h。
[0188]
4、检测
[0189]
将u型底96孔板4℃,50g离心2min。用排枪小心的吸弃80ul的上清,用含有2%fbs的pbs配制10ug/ml的propidium iodide,每孔加入100ul的pi试剂,染色15min。染色完成后,将u型底96孔板4℃,50g离心2min。含有2%fbs的pbs洗涤2次后,加入100ul含有2%fbs的pbs重悬,流式细胞仪检测,统计活细胞群cy5荧光平均荧光强度,绘制结合饱和曲线,如图5所示。
[0190]
5、数据分析
[0191]
将各实验组cy5荧光平均荧光强度减去空白组平均荧光强度,数据使用graphpadprism软件拟合,求得解离平衡常数kd值,具体如下表4-2所示。
[0192]
表4-2亲和力kd值
[0193]
[0194][0195]
结合上表数据可知,连接了半乳糖修饰单体l的sirna序列rb-61和rb-70与小鼠原代肝细胞的亲和力高于rb-66,说明l单体连接的位置对缀合物的亲和力可能也存在一定影响,优选为将半乳糖修饰单体l连接于正义链的3’端进行修饰,从而得到的缀合物。
[0196]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
