1.本发明属于药物化学技术领域,具体涉及吡唑醇-哒嗪酮类耦联化合物、其药物组合物及其在药物中的应用。
背景技术:
2.脑卒中又称脑梗死,主要是由于血栓栓塞导致大脑组织血液供给发生障碍,继而伴随着脑细胞缺血缺氧死亡。具有高发病率、高致残率、高死亡率等特点,成为危害人类健康的难治性疾病之一。随着社会老龄化的增加以及生活节奏的加快,我国脑卒中的发病率不断增长并趋于年轻化,据推测到2030年我国的脑血管疾病发生率将比2010年增加约50%。2016年全球疾病负担(gbd)数据显示,脑卒中是造成我国寿命年损失的第一位病因,每年用于脑卒中治疗的花费达200亿,脑卒中给患者及家庭带来了沉重的负担。因此脑卒中的防治成为了亟待解决的科学问题。
3.公开号为cn102947295a的专利公开了作为11β-hsd1抑制剂的3,3-二取代的-(8-氮杂双环[3.2.1]辛烷-8-基)-[5-(1h-吡唑-4基)-噻吩-3-基]-甲酮,具体公开了3,3-二取代的-(8-氮杂双环[3.2.1]辛烷-8-基)-[5-(1h-吡唑-4-基)-噻吩-3-基]-甲酮、3,3-二取代的-(6-氮杂双环[3.1.1]庚烷-6-基)-[5-(1h-吡唑-4-基)-噻吩-3-基]-甲酮、和4,4-二取代的哌啶-1-基)-[5-(1h-吡唑-4基)-噻吩-3-基]-甲酮化合物、和此类化合物和组合物在体外和体内抑制11β-羟基类固醇脱氢酶1型;治疗通过抑制11β-羟基类固醇脱氢酶1型而改善的疾病;治疗代谢综合症,其包括疾病如2型糖尿病和肥胖症,和相关性疾病,包括胰岛素抵抗、高血压、脂质疾病和心血管疾病如缺血性(冠脉)心脏疾病;治疗cns疾病如轻度认知功能障碍和早期痴呆症,包括阿尔茨海默氏症等等的应用有关。
[0004]
公开号为cn1415617a的专利公开了具有预防和治疗动脉粥样硬化功能的化合物及其在生物医药学中的应用,具体公开了2-(3,5-二甲氧基-4-羟基苯基)-2-[4-(2-吡啶基)哌嗪基]甲基膦酸二乙酯、2-(4-羟基-3-甲氧基苯基)-2-[4-(2-吡啶基)哌嗪基]甲基膦酸二乙酯、2-(4-羟基-3-甲氧基苯基)-2-(4-甲基哌嗪基)甲基膦酸二乙酯在制备用于预防或治疗动脉粥样硬化、高血脂、冠心病、脑卒中等心脑血管疾病的药物中的用途,或作为工具药用于研究动脉粥样硬化等心脑血管疾病的用途。
[0005]
由现有技术可知,临床针对缺血性脑卒中临床主要采用的治疗手段为改善脑血循环和神经保护联合用药。改善脑血循环除了机械取栓以外,主要还是使用抗血栓药物进行治疗,包括溶栓药、抗凝药和抗血小板聚集药物。抗血小板聚集药物疗效高,副作用相对较少,同时血小板聚集由于是血栓形成的始动因素,因此是抗血栓药物中的研究热点。另外由于其聚集机制错综复杂,同时其也参与生理性止血,所以导致目前的抗血小板聚集药物或多或少都会存在延迟性出血的副作用。此外,最常用的阿司匹林、氯吡格雷会出现药物抵抗等问题,因此,寻找新型的抗血小板聚集药物具有重要的临床意义。
[0006]
对于缺血缺氧后或血管再通后的再灌注阶段所导致的神经损伤,常使用神经保护
剂进行治疗,常用的包括依达拉奉、丁苯酞和一些传统中药提取物如川芎嗪等。依达拉奉(3-甲基-1-苯基-2-吡唑啉-5-酮)是一种新型自由基清除剂,通过清除自由基,抑制脂质过氧化和脑细胞,内皮细胞和神经细胞的氧化性衰老,减少脑缺血和水肿,从而减少组织损伤,发挥神经保护作用。此外,依达拉奉还能有效改善急性脑梗死引起的神经功能缺损。但依达拉奉由于不良反应发生率高等原因,未获得美国fda批准用于治疗缺血性脑卒中。6-苯基哒嗪酮类化合物具有优异的抗血小板聚集聚集活性。其通过多重的作用机制发挥抗血小板聚集作用,包括抑制磷酸二酯酶ⅲ(pdeⅲ),减少camp的降解,提高细胞内camp含量,从而减少降低adp的浓度,达到抑制血小板聚集的作用;影响细胞内钙动员等等。联合用药会导致病人用药负担增加,此外,药物之间的相互作用同样是不可忽视的问题。因此,急需设计一种低成本、具有优异的抗血小板聚集作用和神经保护作用的化合物,以期能够实现在治疗脑卒中、脑细胞缺血缺氧死亡、缺血缺氧后或血管再通后的再灌注所致神经损伤的药物制备中的良好应用。
[0007]
本发明结合临床实际需求和弥补现有药物的不足,设计、合成了依达拉奉-哒嗪酮类化合物。该类化合物不仅仅拥有优异的抗血小板聚集作用,同时还有着很好的神经保护作用。
技术实现要素:
[0008]
本发明针对现有技术的不足,提出了吡唑醇-哒嗪酮类耦联化合物、其药物组合物及其在药物中的应用。
[0009]
具体是通过以下技术方案来实现的:
[0010]
本发明的第一方面提供了吡唑醇-哒嗪酮类耦联化合物,其涉及式(ⅰ)所示的化合物、其衍生物、其异构体、消旋体或光学异构体、其药用盐、其水合物、或其溶剂化物、及药用载体或赋形剂;所述式(ⅰ)为:
[0011][0012]
其中,r为氢原子、烷基、环烷基、杂环基、杂环基烷基、烷氧基、r1c(=o)o-、氨基、芳基或杂芳基;所述烷基、环烷基、杂环基、杂环基烷基、烷氧基、r1c(=o)o-、氨基、芳基和杂芳基各自独立地任选地被一个或多个选自h、氟、氯、溴、碘、羟基、氨基、硝基、氧代(=o)、氰基、c1-4烷基、c1-4卤代烷基、c1-4烷氨基、c1-4二烷氨基、c1-4羟烷基、c1-4烷氧基、c1-4卤代烷氧基、c1-4卤代烷硫基、c1-4羟基烷氧基、或c1-4烷氧基c1-4烷基的取代基所取代;所述r1为h、烷基、芳基、芳基烷基、杂芳基或杂芳基烷基。
[0013]
本发明的第二方面提供了吡唑醇-哒嗪酮类耦联化合物,其涉及式(ⅱ)所示的化合物、其衍生物、其异构体、消旋体或光学异构体、其药用盐、其水合物、或其溶剂化物、及药用载体或赋形剂;所述式(ⅱ)为:
[0014][0015]
其中,x和y为氮原子、碳原子任意取代,z为的烷氧基、卤素、羟基所取代;r为氢原子、烷基、环烷基、杂环基、杂环基烷基、烷氧基、r1c(=o)o-、氨基、芳基、或杂芳基,其中所述烷基、环烷基、杂环基、杂环基烷基、烷氧基、r1c(=o)o-、氨基、芳基和杂芳基各自独立地可任选地被一个或多个选自h、氟、氯、溴、碘、羟基、氨基、硝基、氧代(=o)、氰基、c1-4烷基、c1-4卤代烷基、c1-4烷氨基、c1-4二烷氨基、c1-4羟烷基、c1-4烷氧基、c1-4卤代烷氧基、c1-4卤代烷硫基、c1-4羟基烷氧基、或c1-4烷氧基c1-4烷基的取代基所取代;r1为h、烷基、芳基、芳基烷基、杂芳基或杂芳基烷基。
[0016]
本发明的第三方面提供了吡唑醇-哒嗪酮类耦联化合物,其含有至少一种式(ⅰ)和式(ⅱ)所示的化合物、其衍生物、其异构体、消旋体或光学异构体、其药用盐、其水合物、或其溶剂化物、及药用载体或赋形剂。
[0017]
所述吡唑醇-哒嗪酮类耦联化合物选自6-(4-(5-羟基-1-苯基-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(5-羟基-1-(吡啶-2-基)-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(5-羟基-1-(间甲苯基)-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(1-(3,5-二甲基苯基)-5-羟基-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(5-羟基-1-(4-甲氧基苯基)-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(1-(4-氯苯基)-5-羟基-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(1-(4-氟苯基)-5-羟基-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(5-羟基-3-甲基-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(5-羟基-3-苯基-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(5-羟基-3-(4-甲氧基苯基)-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(3-(4-氟苯基)-5-羟基-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(3-(4-氯苯基)-5-羟基-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(3-(4-氰基苯基)-5-羟基-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(3-(2,4-二氯苯基)-5-羟基-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(5-羟基-3-(萘-2-基)-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、6-(4-(5-羟基-3-(噻吩-2-基)-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮、3-(4-(6-甲氧基哒嗪-3-基)苯基)-1-苯基-1h-吡唑-5(4h)-酮、3-(4-(6-羟基哒嗪-3-基)苯基)-1-苯基-1h-吡唑-5(4h)-酮、3-(4-(6-甲氧基吡啶-3-基)苯基)-1-苯基-1h-吡唑-5(4h)-酮、3-(4-(6-羟基吡啶-3-基)苯基)-1-苯基-1h-吡唑-5(4h)-酮、3-(4-(6-溴哒嗪-3-基)苯基)-1-苯基-1h-吡唑-5(4h)-酮。
[0018]
进一步优选为6-(4-(1-(4-氟苯基)-5-羟基-1h-吡唑-3-基)苯基)-4,5-二氢哒
嗪-3(2h)-酮。
[0019]
本发明的第四方面提供了吡唑醇-哒嗪酮类耦联化合物在制备用于预防或治疗由血栓和自由基过量引起的脑卒中、心脑血管疾病、老年痴呆症及其并发症的药物中的用途。
[0020]
进一步的,提供了含有至少一种式(ⅰ)和式(ⅱ)所示的化合物、其衍生物、其异构体、消旋体或光学异构体、其药用盐、其水合物、或其溶剂化物、及药用载体或赋形剂的吡唑醇-哒嗪酮类耦联化合物在制备用于预防或治疗由血栓和自由基过量引起的脑卒中、心脑血管疾病、老年痴呆症及其并发症的药物中的用途。
[0021]
本发明的第五方面提供了吡唑醇-哒嗪酮类耦联化合物与其他药物联合在制备用于治疗由血栓和自由基过量引起的脑卒中、心脑血管疾病、老年痴呆症及其并发症的药物中的用途。
[0022]
有益效果:
[0023]
本发明设计、合成了吡唑醇-哒嗪酮类化合物,其兼具优异的抗血小板聚集作用和神经保护作用,该类化合物能够满足临床实际需求和弥补现有药物的不足,降低用药负担、无毒性和副作用、药物抗性小。
附图说明
[0024]
图1为化合物1-化合物7的合成路线图;
[0025]
图2为化合物8-化合物16的合成路线图;
[0026]
图3为化合物17-化合物19的合成路线图;
[0027]
图4为化合物1-化合物21抗h2o2诱导的pc12细胞氧化损伤活性图;
[0028]
图5为化合物7抗maco损伤活性图;
[0029]
图6为化合物1-21的结构式。
具体实施方式
[0030]
下面对本发明的具体实施方式作进一步详细的说明,但本发明并不局限于这些实施方式,任何在本实施例基本精神上的改进或代替,仍属于本发明权利要求所要求保护的范围。
[0031]
实施例1
[0032]
本实施例提供了化合物1-化合物7的具体化学结构式和通式如表1:
[0033]
表1
[0034][0035]
化合物1为6-(4-(5-羟基-1-苯基-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.257-261℃.1h nmr(400mhz,dmso-d6)δ11.88(s,1h),10.95(s,1h),7.88(d,j=8.5hz,2h),7.81(dd,j=10.4,8.4hz,4h),7.49(dd,j=10.8,5.1hz,2h),7.30(t,j=7.4hz,1h),6.08(s,1h),2.98(t,j=8.2hz,2h),2.47(t,j=8.2hz,2h).
13
c nmr(100mhz,dmso-d6)δ167.49,154.33,149.56,149.39,139.26,135.65,134.58,129.40,126.34,126.28,125.52,121.68,85.77,26.47,22.26.hrms(esi)calcd for c
19h17
n4o2[m+h]
+
:333.1352,found 333.1341.
[0036]
化合物2为6-(4-(5-羟基-1-(吡啶-2-基)-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3
(2h)-酮;m.p.253-256℃.1h nmr(600mhz,dmso-d6)δ12.60(s,1h),10.99(s,1h),8.49(dd,j=4.9,0.9hz,1h),8.10(t,j=7.4hz,1h),7.93(t,j=8.6hz,3h),7.83(d,j=8.2hz,2h),7.43
–
7.32(m,1h),6.24(s,1h),2.99(t,j=8.3hz,2h),2.48(t,j=8.3hz,2h).
13
c nmr(150mhz,dmso-d6)δ167.50,156.55,153.34,151.00,149.45,147.02,141.00,136.29,133.80,126.39,125.89,121.69,113.47,86.25,26.45,22.25.hrms(esi)calcd for c
18h16
n5o2[m+h]
+
:334.1304,found 334.1306.
[0037]
化合物3为6-(4-(5-羟基-1-(间甲苯基)-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.258-262℃.1h nmr(600mhz,dmso-d6)δ11.86(s,1h),10.97(s,1h),7.88(d,j=8.4hz,2h),7.80(d,j=8.4hz,2h),7.65(s,1h),7.62(d,j=8.1hz,1h),7.36(t,j=7.8hz,1h),7.11(d,j=7.5hz,1h),6.06(s,1h),2.98(t,j=8.2hz,2h),2.47(t,j=8.3hz,2h),2.38(s,3h).
13
c nmr(150mhz,dmso-d6)δ167.50,154.36,149.57,149.26,139.23,138.80,135.61,134.62,129.18,126.93,126.33,125.51,122.19,118.85,85.71,26.47,22.25,21.60.
[0038]
hrms(esi)calcd for c
20h18
n4o2[m+h]
+
:347.1508,found 347.1504.
[0039]
化合物4为6-(4-(1-(3,5-二甲基苯基)-5-羟基-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.239-242℃.1h nmr(600mhz,dmso-d6)δ11.81(s,1h),10.98(s,1h),7.88(d,j=7.8hz,2h),7.80(d,j=7.7hz,2h),7.44(s,2h),6.94(s,1h),6.06(s,1h),2.98(t,j=7.9hz,2h),2.47(t,j=8.0hz,2h),2.34(s,6h).
13
c nmr(150mhz,dmso-d6)δ167.52,154.25,149.59,149.10,139.18,138.51,135.55,134.63,127.76,126.32,125.49,119.45,85.66,26.46,22.23,21.52.hrms(esi)calcd for c
21h20
n4o2[m+h]
+
:361.1665,found 361.1656.
[0040]
化合物5为6-(4-(5-羟基-1-(4-甲氧基苯基)-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.236-239℃.1h nmr(600mhz,dmso-d6)δ11.71(s,1h),10.96(s,1h),7.86(d,j=7.5hz,2h),7.79(d,j=7.4hz,2h),7.68(d,j=8.2hz,2h),7.04(d,j=8.2hz,2h),6.04(s,1h),3.80(s,3h),2.97(t,j=7.6hz,2h),2.46(t,j=7.7hz,2h).
13
c nmr(150mhz,dmso-d6)δ167.50,157.76,153.85,149.59,148.83,135.46,134.75,132.46,126.32,125.39,123.53,114.49,85.40,55.81,26.47,22.24.hrms(esi)calcd for c
20h18
n4o3[m+h]
+
:363.1457,found 363.1463.
[0041]
化合物6为6-(4-(1-(4-氯苯基)-5-羟基-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.261-263℃.1h nmr(600mhz,dmso-d6)δ12.13(s,1h),10.97(s,1h),7.92
–
7.86(m,4h),7.80(d,j=8.5hz,2h),7.57
–
7.52(m,2h),6.09(s,1h),2.98(t,j=8.2hz,2h),2.47(t,j=8.3hz,2h).
13
c nmr(150mhz,dmso-d6))δ167.51,154.57,149.80,149.54,138.13,135.83,134.30,130.21,129.41,126.36,125.61,122.87,85.94,26.46,22.25.hrms(esi)calcd for c
19h15
n4o2cl[m+h]
+
:367.0962,found 367.0958.
[0042]
化合物7为6-(4-(1-(4-氟苯基)-5-羟基-1h-吡唑-3-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.245-247℃.1h nmr(600mhz,dmso-d6)δ=11.98(s,1h),10.97(s,1h),7.88(d,j=8.5,2h),7.85
–
7.82(m,2h),7.80(d,j=8.4,2h),7.39
–
7.24(m,2h),6.08(s,1h),2.98(t,j=8.3,2h),2.47(t,j=8.2,2h).
13
c nmr(150mhz,dmso-d6)δ167.49,160.34(d,j=243.0hz),154.21,149.50(d,j=16.5hz),135.69,134.50,126.34,125.52,123.70(d,j=
8.4hz),116.22,116.07,85.68,26.47,22.26.hrms(esi)calcd for c
19h15
n4o2f[m+h]
+
:351.1257,found 351.1254.
[0043]
化合物1-化合物7的合成路线如图1所示;
[0044]
化合物1-化合物7的合成方法,包括如下步骤:
[0045]
第一步2-(2-(4-氰基苯基)-2-氧乙基)丙二酸二乙酯的合成:取4-(2-溴乙酰基)苄腈(5.00g,0.02mol)于100ml圆底反应瓶中,溶解于40ml丙酮中,室温下缓慢加入无水k2co3(6.20g,0.04mol),最后,缓慢滴加丙二酸二乙酯(10.77g,0.07mol),室温下搅拌反应2h;反应完成后,将反应液抽滤,将滤饼用乙酸乙酯洗涤;蒸除溶剂,硅胶柱纯化,得3.01g无色透明的油状物,产率44%;1h nmr(600mhz,dmso-d6)δ8.15(d,j=8.4hz,2h),8.03(d,j=8.2hz,2h),4.22
–
4.06(m,4h),3.94(t,j=7.1hz,1h),3.67(d,j=7.1hz,2h),1.19(t,j=7.1hz,6h).
[0046]
第二步4-(6-氧代-1,4,5,6-四氢哒嗪-3-基)苄腈的合成:称取原料2-(2-(4-氰基苯基)-2-氧乙基)丙二酸二乙酯(3.01g,0.01mol)于100ml圆底反应瓶,溶解于40ml无水乙醇中,向反应瓶中加入无水k2co3(2.06g,0.01mol),加入85%的水合肼(0.88g,0.01mol),90℃下反应过夜;反应完成后,放冷至室温,将反应液蒸干,得黄色固体;然后向其中加入适量蒸馏水使其充分溶解,抽滤,滤饼干燥后柱层析分离纯化,旋蒸浓缩得1.19g白色固体,产率60%;1h nmr(600mhz,dmso-d6)δ11.16(s,1h),7.94
–
7.86(m,4h),2.99(t,j=8.3hz,2h),2.50
–
2.47(m,2h).
[0047]
第三步3-氧代-3-(4-(6-氧代-1,4,5,6-四氢哒嗪-3-基)苯基)丙酸乙酯的合成:
[0048]
(1)称取naoh(2.39g,0.05mol)于100ml圆底反应瓶中,向其加入10ml蒸馏水使其充分溶解,再加入25ml无水乙醇,加入原料4-(6-氧代-1,4,5,6-四氢哒嗪-3-基)苄腈(1.19g,0.01mol),于90℃油浴下反应8h。反应毕,放至室温;用3n hcl调节ph至2~3,然后抽滤,滤饼干燥得黄色固体粗品,1.11g,即为4-(6-氧代-1,4,5,6-四氢哒嗪-3-基)苯甲酸粗品,不经纯化备用;
[0049]
(2)取4-(6-氧代-1,4,5,6-四氢哒嗪-3-基)苯甲酸粗品(1.11g,0.01mol)于25ml圆底反应瓶中,加入10ml干燥dmf使其溶解,再在搅拌下分批加入cdi(1.24g,0.01mol),室温反应完全后,加入3-乙氧基-3-氧代丙酸钾(1.73g,0.01mol),mgcl2(0.73g,0.01mol),然后升至100℃反应12h,反应完成;放置室温,二氯甲烷萃取将有机相合并,用饱和食盐水洗涤,最无水硫酸钠干燥;减压浓缩,柱层析纯化,tlc检测,旋蒸浓缩得淡黄色固体产物549.50mg,产率35%;1h nmr(600mhz,dmso-d6)δ11.13(s,1h),8.00(d,j=8.5hz,2h),7.90(d,j=8.6hz,2h),4.21(s,2h),4.12(q,j=7.1hz,2h),3.00(t,j=8.3hz,2h),2.50
–
2.47(m,2h),1.18(t,j=7.1hz,3h).
[0050]
第四步
[0051]
化合物1的合成:称取原料3-氧代-3-(4-(6-氧代-1,4,5,6-四氢哒嗪-3-基)苯基)丙酸乙酯(100.00mg,0.35mmol),苯肼(38.00mg,0.35mmol)于10ml原底烧瓶中,再加入无水乙醇(4ml)和乙酸(4滴),90℃反应4h后,tcl检测,反应完全后。将反应液放置至室温,抽滤,抽滤完成后,将抽出的产物用乙醇打浆纯化,然后再次抽滤,滤饼蒸干,得65mg化合物1;
[0052]
化合物2的合成:按照化合物1的合成方法,将苯肼替换为2-肼吡啶,得到化合物2;
[0053]
化合物3的合成:按照化合物1的合成方法,将苯肼替换为3-甲基苯肼,得到化合物
3;
[0054]
化合物4的合成:按照化合物1的合成方法,将苯肼替换为3,5-二甲基苯肼,得到化合物4;
[0055]
化合物5的合成:按照化合物1的合成方法,将苯肼替换为4-甲氧基苯肼,得到化合物5;
[0056]
化合物6的合成:按照化合物1的合成方法,将苯肼替换为4-氯苯肼,得到化合物6;
[0057]
化合物7的合成:按照化合物1的合成方法,将苯肼替换为4-氟苯肼,得到化合物7;
[0058]
化合物1-7的得率以及表观物理性状如表2所示:
[0059]
表2
[0060][0061]
实施例2
[0062]
本实施例提供了化合物8-16,其通式如下:
[0063][0064]
化合物8-16的具体化学结构式如表3:
[0065]
表3
[0066]
[0067][0068]
化合物8为6-(4-(5-羟基-3-甲基-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.258-261℃.1h nmr(600mhz,dmso-d6)δ11.69(s,1h),10.94(s,1h),7.81(s,4h),5.41(s,1h),2.96(t,j=8.2hz,2h),2.46(t,j=8.2hz,2h),2.12(d,j=5.7hz,3h).
13
c nmr(150mhz,dmso-d6)δ167.46,153.92,149.31,140.13,132.63,126.74,120.20,117.79,88.35,26.45,22.21,14.78.hrms(esi)calcd for c
14h15
n4o2[m+h]
+
:271.1195,found 271.1200.
[0069]
化合物9为6-(4-(5-羟基-3-苯基-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.254-257℃.1h nmr(600mhz,dmso-d6)δ12.06(s,1h),10.98(s,1h),7.93(d,j=8.7hz,2h),7.86(dd,j=11.6,8.5hz,4h),7.43(t,j=7.5hz,2h),7.34(t,j=7.2hz,1h),6.05(s,1h),2.99(t,j=8.2hz,2h),2.48(t,j=8.2hz,2h).
13
c nmr(150mhz,dmso-d6)δ167.47,154.59,150.40,149.25,139.94,133.67,133.29,129.05,128.46,126.82,125.63,120.80,85.81,26.44,22.25.hrms(esi)calcd for c
19h16
n4o2[m+h]
+
:333.1352,found 333.1353.
[0070]
化合物10为6-(4-(5-羟基-3-(4-甲氧基苯基)-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.256-260℃.1h nmr(600mhz,dmso-d6)δ11.96(s,1h),10.96(s,1h),7.92(d,j=8.7hz,2h),7.85(d,j=8.8hz,2h),7.77(d,j=8.6hz,2h),6.98(d,j=8.1hz,2h),5.97(s,2h),3.79(s,3h),2.98(t,j=8.2hz,2h),2.47(t,j=8.2hz,2h).
13
c nmr(150mhz,dmso-d6)δ167.46,159.66,154.53,150.33,149.27,140.05,133.07,126.97,126.79,126.35,120.61,114.42,85.44,55.60,26.46,22.26.hrms(esi)calcd for c
20h18
n4o3[m+h]
+
:363.1457,found 363.1453.
[0071]
化合物11为6-(4-(3-(4-氟苯基)-5-羟基-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.263-265℃.1h nmr(600mhz,dmso-d6)δ12.07(s,1h),10.97(s,1h),7.89(m,6h),7.25(t,j=8.7hz,2h),6.05(s,1h),2.98(t,j=8.2hz,2h),2.48(t,j=8.2hz,2h).
13
cnmr
(150mhz,dmso-d6)δ167.46,162.47(d,j=244.7hz),154.66,149.54,149.23,139.89,133.34,130.28,127.65(d,j=7.8hz),126.81,120.82,115.91(d,j=21.5hz),85.80,26.44,22.26.hrms(esi)calcd for c
19h15
fn4o2[m+h]
+
:351.1257,found 351.1257.
[0072]
化合物12为6-(4-(3-(4-氯苯基)-5-羟基-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.262-264℃.1h nmr(600mhz,dmso-d6)δ12.11(s,1h),10.97(s,1h),7.92(d,j=8.9hz,2h),7.89
–
7.84(m,4h),7.48(d,j=8.4hz,2h),6.08(s,1h),2.98(t,j=8.3hz,2h),2.48(t,j=8.2hz,2h).
13
c nmr(150mhz,dmso-d6)δ167.45,154.71,149.28,149.21,139.82,133.46,132.89,132.59,129.08,127.34,126.82,120.90,85.93,26.44,22.26.hrms(esi)calcd for c
19h15
cln4o2[m+h]
+
:367.0962,found 367.0952.
[0073]
化合物13为6-(4-(3-(4-氰基苯基)-5-羟基-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.268-271℃.1h nmr(600mhz,dmso-d6)δ12.28(s,1h),10.98(s,1h),8.04(d,j=8.3hz,2h),7.93(d,j=8.8hz,2h),7.87(dd,j=8.4,5.2hz,4h),6.18(s,1h),2.98(t,j=8.3hz,2h),2.47(t,j=8.3hz,2h).
13
c nmr(150mhz,dmso-d6)δ167.48,154.99,149.20,148.70,139.64,138.10,133.77,133.12,126.85,126.23,121.14,119.46,110.56,86.54,26.4222.26.hrms(esi)calcd for c
20h15
n5o2[m+h]
+
:358.1304,found 358.1299.
[0074]
化合物14为6-(4-(3-(2,4-二氯苯基)-5-羟基-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.252-256℃.1h nmr(600mhz,dmso-d6)δ12.14(s,1h),10.97(s,1h),7.93
–
7.84(m,5h),7.71(d,j=2.1hz,1h),7.50(dd,j=8.5,2.1hz,1h),6.10(s,1h),2.98(t,j=8.3hz,2h),2.47(t,j=8.3hz,2h).
13
c nmr(150mhz,dmso-d6)δ167.46,153.79,149.18,147.31,139.56,133.77,133.58,132.39,131.87,131.48,130.19,128.03,126.86,121.14,89.43,26.43,22.26.hrms(esi)calcd for c
19h15
cln4o2[m+h]
+
:401.0572,found 401.0575
[0075]
化合物15为6-(4-(5-羟基-3-(萘-2-基)-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.257-259℃.1h nmr(600mhz,dmso-d6)δ12.17(s,1h),11.00(s,1h),8.37(s,1h),8.08(d,j=8.4hz,1h),8.04
–
7.95(m,4h),7.93(d,j=7.8hz,1h),7.89(d,j=8.7hz,2h),7.57
–
7.48(m,2h),6.22(s,1h),3.00(t,j=8.2hz,2h),2.49(t,j=8.5hz,2h).
13
c nmr(150mhz,dmso-d6)δ167.48,154.75,150.34,149.26,139.95,133.61,133.35,133.21,131.17,128.56,128.52,128.10,126.84,126.52,124.26,123.90,120.86,86.05,26.45,22.26.hrms(esi)calcd for c
23h18
n4o2[m+h]
+
:383.1508,found 383.1501.
[0076]
化合物16为6-(4-(5-羟基-3-(噻吩-2-基)-1h-吡唑-1-基)苯基)-4,5-二氢哒嗪-3(2h)-酮;m.p.247-249℃.1h nmr(600mhz,dmso-d6)δ12.13(s,1h),10.97(s,1h),7.86(s,4h),7.56
–
7.42(m,2h),7.13
–
7.02(m,1h),5.97(s,1h),2.98(t,j=8.2hz,2h),2.47(t,j=8.2hz,2h).
13
c nmr(150mhz,dmso-d6)δ167.45,154.49,149.21,146.42,139.65,137.08,133.35,128.09,126.83,125.87,125.26,120.80,85.76,26.44,22.26.hrms(esi)calcd for c
17h14
n4o2s[m+h]
+
:339.0916,found 339.0911.
[0077]
化合物8-化合物16的合成路线如图2所示;
[0078]
化合物8-化合物16的合成方法,包括如下步骤:
[0079]
第一步4-(4-乙酰氨基苯基)-4-氧代丁酸的合成:取无水氯化铝(27.37g,205.26mmol)置反应瓶,室温搅拌条件下缓慢滴加n,n-二甲基甲酰胺(dmf)4.40ml,冷至室温后,移入70℃油浴中,缓慢加入研至粉末状的乙酰苯胺(2.70g,19.98mmol)与丁二酸酐
(2.03g,20.29mmol)的混合物,加入完毕后,回流反应4h;反应完毕后,趁热转入180ml冰水中,抽滤,滤液缓慢滴加12ml浓盐酸,有大量固体析出,低温静置一段时间后,抽滤,滤饼用乙醇重结晶并干燥后得到固体2.57g;收率为54.70%;1h nmr(600mhz,dmso-d6)δ:12.11(s,1h),10.27(s,1h),7.94(d,j=8.8hz,2h),7.72(d,j=8.7hz,2h),3.21
–
3.16(m,2h),2.58
–
2.54(m,2h),2.09(s,3h);
[0080]
第二步4-(4-氨基苯基)-4-氧代丁酸的合成:取4-(4-乙酰氨基苯基)-4-氧代丁酸(1.00g,4.25mmol)于反应瓶,加入6n盐酸10ml,110℃的油浴中反应;反应完毕后,移入冰浴中,缓慢加入无水碳酸钠调节ph至4左右,有大量固体析出,抽滤,滤饼用蒸馏水洗涤2-3次,干燥得到固体0.70g;收率为85.4%;1h nmr(600mhz,dmso-d6)δ:12.03(s,1h),7.69(d,j=8.7hz,2h),6.57(d,j=8.7hz,2h),6.03(s,2h),3.06(t,j=6.4hz,2h),2.51(t,j=4.3hz,2h);
[0081]
第三步6-(4-氨基苯基)-4,5-二氢哒嗪-3(2h)-酮的合成:取4-(4-氨基苯基)-4-氧代丁酸(1.90g,9.84mmol)于反应瓶,加入约20倍量的无水乙醇,滴加(0.75g,11.81mmol)水合肼(所用水合肼含量为80%),移入90℃油浴中回流反应;反应完毕后,移入冰浴中至大量固体析出,抽滤,滤饼用乙醇重结晶并干燥后得到固体1.72g,收率为92.5%;1h nmr(600mhz,dmso-d6)δ10.62(s,1h),7.45(d,j=8.6hz,2h),6.56(d,j=8.0hz,2h),5.47(s,2h),2.82(t,j=8.1hz,2h),2.36(t,j=8.1hz,2h).
[0082]
第四步6-(4-肼基苯基)-4,5-二氢哒嗪-3(2h)-酮的合成:取6-(4-氨基苯基)-4,5-二氢哒嗪-3(2h)-酮(0.10g,0.53mmol)于反应瓶,加入2.1ml 1n盐酸,降温至0℃左右,缓慢滴加(0.04g,0.58mmol)nano2的0.5ml水溶液(期间保持温度低于5℃),滴加完毕,保持温度低于5℃条件下反应30min。反应结束后,将所配置的(0.29g,1.27mmol)sncl2·
2h2o的2.5ml 1n盐酸溶液置于冰浴中降温至0℃左右后,将反应液缓慢滴加至该溶液中,保持温度低于5℃条件下继续反应1h;反应完毕后,反应液用正丁醇萃取,无水硫酸钠干燥后减压蒸干,固体中加入二氯甲烷,抽滤,取滤饼加入适量水中,超声使其充分溶解,抽滤,将滤液置于冰浴中,用10%的氢氧化钠溶液调节ph至9-10,有固体析出,低温静置一段时间后,抽滤,,滤饼干燥得到固体35.60mg,不用经纯化可直接用于下一步反应。
[0083]
第五步化合物8的合成:取6-(4-肼基苯基)-4,5-二氢哒嗪-3(2h)-酮(0.20g,0.98mmol)于反应瓶,加入5ml乙醇后,加入乙酰乙酸乙酯(153.6mg,1.18mmol),移入90℃油浴中,滴加2滴乙酸,继续回流反应2h。待反应完毕后,放冷,有固体析出,抽滤;将得到的固体以v(二氯甲烷):v(甲醇)=10:1的比例进行硅胶柱层析快速分离,蒸干得到固体,将固体用乙醇打浆后抽滤干燥得目标产物30mg,即化合物8。
[0084]
化合物9的合成:按照化合物8的合成方法,将乙酰乙酸乙酯替换为3-氧代-3-苯基丙酸乙酯,得到化合物9;
[0085]
化合物10的合成:按照化合物8的合成方法,将乙酰乙酸乙酯替换为3-(4-甲氧基苯基)-3-氧代丙酸乙酯,得到化合物10;
[0086]
化合物11的合成:按照化合物8的合成方法,将乙酰乙酸乙酯替换为3-(4-氟苯基)-3-氧代丙酸乙酯,得到化合物11;
[0087]
化合物12的合成:按照化合物8的合成方法,将乙酰乙酸乙酯替换为3-(4-氯苯基)-3-氧代丙酸乙酯,得到化合物12;
[0088]
化合物13的合成:按照化合物8的合成方法,将乙酰乙酸乙酯替换为3-(4-氰基苯基)-3-氧代丙酸乙酯,得到化合物13;
[0089]
化合物14的合成:按照化合物8的合成方法,将乙酰乙酸乙酯替换为3-(2,4-二氯苯基)-3-氧代丙酸乙酯,得到化合物14;
[0090]
化合物15的合成:按照化合物8的合成方法,将乙酰乙酸乙酯替换为3-(萘-2-基)-3-氧代丙酸乙酯,得到化合物15;
[0091]
化合物16的合成:按照化合物8的合成方法,将乙酰乙酸乙酯替换为3-氧代-3-(噻吩-2-基)丙酸乙酯,得到化合物16;
[0092]
化合物8-16的得率以及表观物理性状如表4所示:
[0093]
表4
[0094]
项目产率(%)表观物理性状项目产率(%)表观物理性状化合物811.42淡黄色固体化合物1311.42淡黄色固体化合物913.11淡黄色固体化合物148.55淡黄色固体化合物1017.10淡黄色固体化合物1519.38淡黄色固体化合物1110.83淡黄色固体化合物1614.54淡黄色固体化合物128.55淡黄色固体
ꢀꢀꢀ
[0095]
实施例3
[0096]
本实施例提供了化合物17-19,其通式如下:
[0097][0098]
化合物17-19的具体化学结构式如表5:
[0099]
表5
[0100]
[0101]
化合物17为3-(4-(6-甲氧基哒嗪-3-基)苯基)-1-苯基-1h-吡唑-5(4h)-酮;m.p.198-201℃.1h nmr(600mhz,dmso-d6)δ11.92(s,1h),8.22(d,j=9.3hz,1h),8.14(d,j=8.3hz,2h),7.99(d,j=8.4hz,2h),7.85(d,j=8.0hz,2h),7.50(t,j=7.9hz,2h),7.32(dd,j=17.3,8.3hz,2h),6.13(s,1h),4.09(s,3h).
13
c nmr(150mhz,dmso-d6)δ164.58,154.87,154.35,149.40,139.29,135.59,134.83,129.41,128.15,126.97,126.29,125.98,121.70,118.06,85.83,54.97.hrms(esi)calcd for c
20h17
n4o2[m+h]
+
:345.1352,found 345.1351.
[0102]
化合物18为3-(4-(6-溴哒嗪-3-基)苯基)-1-苯基-1h-吡唑-5(4h)-酮;m.p.243-246℃.1h nmr(400mhz,dmso-d6)δ11.91(s,1h),8.27(d,j=9.1hz,1h),8.21(d,j=8.3hz,2h),8.12(d,j=9.0hz,1h),8.03(d,j=8.3hz,2h),7.85(d,j=7.8hz,2),7.51(t,j=7.9hz,2h),7.32(t,j=7.4hz,1h),6.15(s,1h).
13
c nmr(100mhz,dmso)δ158.40,154.48,149.20,147.48,139.23,135.87,134.41,132.85,129.42,127.66,127.50,126.36,126.12,121.75,86.05.hrms(esi)calcd for c
19h14
brn4o[m+h]
+
:393.0351,found 393.0352.
[0103]
化合物19为3-(4-(6-甲氧基吡啶-3-基)苯基)-1-苯基-1h-吡唑-5(4h)-酮;m.p.175-178℃.1h nmr(400mhz,dmso-d6)δ11.86(s,1h),8.55(d,j=2.3hz,1h),8.06(dd,j=8.6,2.5hz,1h),7.92(d,j=8.3hz,2h),7.85(d,j=7.8hz,2h),7.72(d,j=8.2hz,2h),7.49(t,j=7.9hz,2h),7.30(t,j=7.3hz,1h),6.93(d,j=8.6hz,1h),3.91(s,3h).
13
c nmr(100mhz,dmso-d6)δ163.55,154.31,149.59,145.03,139.34,137.85,136.72,132.95,129.39,126.87,126.17,121.62,111.09,85.66,53.75.hrms(esi)calcd for c
21h17
n3o2[m+h]
+
:344.1399,found 344.1402.
[0104]
化合物17-化合物19的合成路线如图3所示;
[0105]
化合物17-化合物19的合成方法,包括如下步骤:
[0106]
第一步4-(6-甲氧基哒嗪-3-基)苯甲酸的合成:取反应瓶50ml加入原料4-羧基苯硼酸(522.8mg,3.15mmol),3-溴-6-甲氧基哒嗪(651mg,3.46mmol),加入蒸馏水8ml、1.4-二氧六环溶解,加入碳酸钾(1.30g,9.45mmol)后,最后快速加入四(三苯基膦)钯(109.15mg,0.09mmol),置换n2,90℃反应5h。待反应完成后,将反应夜冷却至室温,减压蒸除1,4-二氧六环,加入适量蒸馏水,抽滤,滤液置于冰浴下,用6n hcl调节ph=2,有白色固体析出,抽滤,乙醇重结晶,得到528.1mg白色固体,产率72.87%;1h nmr(400mhz,dmso-d6)δ13.10(s,1h),8.22(dd,j=17.1,8.8hz,3h),8.07(d,j=8.4hz,2h),7.35(d,j=9.3hz,1h),4.10(s,3h).
[0107]
第二步4-(6-甲氧基吡啶-3-基)苯甲酸的合成:依照4-(6-甲氧基哒嗪-3-基)苯甲酸同样的合成方法,将3-溴-6-甲氧基哒嗪代替成5-溴-2-甲氧基吡啶,得到410mg白色固体,产率85%;1h nmr(600mhz,dmso-d6)δ8.57(d,j=2.5hz,1h),8.09(dd,j=8.6,2.6hz,1h),8.01(d,j=8.3hz,2h),7.77(d,j=8.4hz,2h),6.95(d,j=8.6hz,1h),3.91(s,3h).
[0108]
第三步4-(6-溴哒嗪-3-基)苯甲酸的合成:依照4-(6-甲氧基哒嗪-3-基)苯甲酸同样的合成方法,将3-溴-6-甲氧基哒嗪代替成3,6-二溴达嗪,得到265mg白色固体,产率75.07%;1h nmr(400mhz,dmso-d6)δ13.22(s,1h),8.31(d,j=9.1hz,1h),8.27(d,j=8.5hz,2h),8.18(d,j=9.0hz,1h),8.10(d,j=8.5hz,2h).
[0109]
第四步3-(4-(6-甲氧基哒嗪-3-基)苯基)-3-氧代丙酸乙酯的合成:取50ml反应
瓶,加入原料4-(6-甲氧基哒嗪-3-基)苯甲酸(499mg,2.17mmol),加入干燥的n,n-二甲基甲酰胺(dmf)5ml,cdi(527.54mg,3.25mmol),室温反应,完毕后加入丙二酸单乙酯钾盐(738.3mg,4.34mmol),mgcl2(310mg,3.25mmol),升温至100℃反应,反应过夜。待反应完毕后,将反应液冷却至室温,加入适量蒸馏水,用乙酸乙酯萃取,反复3次,饱和食盐水洗涤,乙酸乙酯相合并用无水硫酸钠除水,减压旋干,得到淡黄色固体325mg,产率49.9%;1h nmr(400mhz,dmso-d6)δ8.27(m,3h),8.10(d,j=8.5hz,2h),7.37(d,j=9.3hz,1h),4.26(s,2h),4.14(m,2h),4.11(s,3h),1.20(t,j=7.1hz,3h).
[0110]
第五步3-(4-(6-甲氧基吡啶-3-基)苯基)-3-氧代丙酸乙酯的合成:依照3-(4-(6-甲氧基哒嗪-3-基)苯基)-3-氧代丙酸乙酯同样的合成方法,将4-(6-甲氧基哒嗪-3-基)苯甲酸代替成4-(6-甲氧基吡啶-3-基)苯甲酸,得到白色粉末288mg,产率53.79%;1h nmr(600mhz,dmso-d6)δ8.60
–
8.52(m,1h),8.10(dd,j=8.6,2.6hz,1h),7.96(d,j=8.6hz,2h),7.79(d,j=8.6hz,2h),6.94(d,j=8.6hz,2h),4.25(dd,j=14.5,7.4hz,2h),3.92(s,2h),3.91(s,3h),1.28(t,j=7.1hz,3h).
[0111]
第六步3-(4-(6-溴哒嗪-3-基)苯基)-3-氧代丙酸乙酯的合成:依照3-(4-(6-甲氧基哒嗪-3-基)苯基)-3-氧代丙酸乙酯同样的合成方法,将4-(6-甲氧基哒嗪-3-基)苯甲酸代替成4-(6-溴哒嗪-3-基)苯甲酸,得到白色固体163.2mg,产率39.05%;1h nmr(400mhz,dmso-d6)δ8.33(m,3h),8.17(m,2h),4.28(s,2h),4.14(q,j=7.1hz,2h),1.20(t,j=7.1hz,3h).
[0112]
第七步 化合物17的合成:取25ml反应瓶加入3-(4-(6-甲氧基哒嗪-3-基)苯基)-3-氧代丙酸乙酯(354mg,1.23mmol),苯肼(133mg,1.23mmol),5ml无水乙醇,5滴冰醋酸,90℃回流反应;tcl检测反应完毕后,将反应液冷却至室温,放入冰浴中,抽滤,乙醇重结晶,得到目标产物272.8mg,即为化合物17。
[0113]
化合物18的合成:按照化合物17的合成方法,将3-(4-(6-甲氧基哒嗪-3-基)苯基)-3-氧代丙酸乙酯替换为3-(4-(6-溴哒嗪-3-基)苯基)-3-氧代丙酸乙酯,得到化合物18。
[0114]
化合物19的合成:按照化合物17的合成方法,将3-(4-(6-甲氧基哒嗪-3-基)苯基)-3-氧代丙酸乙酯替换为3-(4-(6-甲氧基吡啶-3-基)苯基)-3-氧代丙酸乙酯的合成,得到化合物19。
[0115]
化合物17-19的得率以及表观物理性状如表6所示:
[0116]
表6
[0117]
项目化合物17化合物18化合物19产率(%)46.7823.1544.77%表观物理性状黄色固体灰色固体淡黄色固体
[0118]
实施例4
[0119]
化合物20-21的具体结构式如表7:
[0120]
表7
[0121][0122]
化合物20为6-(4-(5-羟基-1-苯基-1h-吡唑-3-基)苯基)哒嗪-3(2h)-酮;m.p.264-267℃.1h nmr(600mhz,dmso-d6)δ13.24(s,1h),11.91(s,1h),8.10(d,j=9.9hz,1h),7.94(q,j=8.7hz,4h),7.84(d,j=8.0hz,2h),7.55
–
7.43(m,2h),7.31(t,j=7.4hz,1h),7.02(d,j=9.9hz,1h),6.11(s,1h).
13
c nmr(150mhz,dmso-d6)δ160.70,154.36,149.34,143.96,139.25,134.54,134.29,131.85,130.59,129.40,126.29,125.96,121.68,118.87,85.83.hrms(esi)calcd for c
19h15
n4o2[m+h]
+
:331.1195,found 331.1190.
[0123]
化合物21为5-(4-(5-羟基-1-苯基-1h-吡唑-3-基)苯基)吡啶-2(1h)-酮;m.p.235-237℃.1h nmr(600mhz,dmso-d6)δ11.88(d,j=18.5,1h),7.89(dd,j=9.5,2.8hz,1h),7.87
–
7.82(m,4h),7.77(d,j=2.6hz,1h),7.61(d,j=8.4hz,2h),7.52
–
7.45(m,2h),7.29(t,j=7.4hz,1h),6.46(d,j=9.5hz,1h),6.05(s,1h).
13
c nmr(150mhz,dmso-d6))δ161.76,153.80,149.17,139.84,138.89,135.47,132.67,131.80,128.92,125.69,125.60,125.26,121.14,120.11,117.49,85.11.hrms(esi)calcd for c
20h16
n3o2[m+h]
+
:330.1243,found330.1240.
[0124]
化合物20-化合物21的合成方法,包括如下步骤:
[0125]
化合物20的合成:取10ml反应瓶加入原料3-(4-(6-甲氧基哒嗪-3-基)苯基)-1-苯基-1h-吡唑-5(4h)-酮(化合物17)(150mg,0.44mmol),48%氢溴酸4ml,升至100℃反应2h。tcl检测反应完毕后,冷却至室温,加入适量的蒸馏水,抽滤,乙醇重结晶得到灰色固体125.6mg。
[0126]
化合物21的合成:按照化合物20的合成方法,将3-(4-(6-甲氧基哒嗪-3-基)苯基)-1-苯基-1h-吡唑-5(4h)-酮替换为3-(4-(6-甲氧基吡啶-3-基)苯基)-1-苯基-1h-吡唑-5(4h)-酮,得到化合物21
[0127]
化合物20-21的得率以及表观物理性状如表8所示:
[0128]
表8
[0129]
项目化合物20化合物21产率(%)86.595表观物理性状灰色固体灰色固体
[0130]
试验例1生物活性试验
[0131]
1.本发明化合物抗血小板聚集抑制活性评价
[0132]
采用born氏比浊法对本发明化合物对二磷酸腺苷(adp)诱导的家兔血小板聚集的
抑制活性进行测试。家兔心脏取血,用体积分数3.8%枸橼酸钠1:9抗凝,以800r/min离心10min,得富血小板血浆(prp),剩余部分以3000r/min离心10min,得贫血小板血浆(ppp)。测试杯中加入prp 238μl和不同浓度的受试化合物2μl,温孵5min,加入诱导剂adp(终浓度10μmol/l)10μl,观察记录5min内最大血小板聚集率,根据公式(血小板聚集抑制率=(空白组最大聚集率—给药组最大聚集率)/空白组最大聚集率))计算各受试化合物的血小板聚集的ic
50
。用生理盐水作空白对照组,其结果如表5所示。由表5可知,本发明的化合物相比先导化合物,在adp作为血小板聚集诱导剂下,其中化合物7和化合物20活性较好,ic
50
分别为56.82μm和53.79μm。
[0133]
表9化合物1-21抗adp诱导的血小板聚集活性(n=6)
[0134][0135][0136]
2.本发明化合物对pc12细胞氧化损伤保护作用评价
[0137]
采用h2o2诱导pc12细胞损伤进行化合物的抗氧化损伤活性评价,取对数生长期,将pc12细胞均匀接种到96孔板中,培养箱中培养24h,实验进行分组,更换为含待测化合物的新鲜培养基继续培养24h,加入h2o2进行损伤,继续培养4h,更换含mts的培养基,2h后于490nm处测试吸光度,通过公式计算细胞存活率,以此反映化合物的细胞保护作用。其结果如图4所示,本发明所有化合物均有显著的抗h2o2氧化损伤活性(与模型组比较p<0.05,n=3),与阳性药依达拉奉相当。
[0138]
3.化合物7抗大鼠中脑动脉栓塞(mcao)活性评价
[0139]
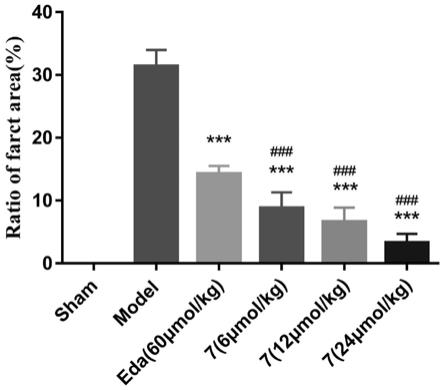
选择抗血小板聚集聚集和抗pc12氧化损伤活性表现较好的化合物7进行maco活性评价,采用sd大鼠进行建模,用10%的水合氯醛(0.35ml/100g)腹腔注射麻醉后。颈部正中切开皮肤,分离各层组织,暴露右侧颈颈外动脉。分离至颈内动脉颈内动脉、颈外动脉分叉后一段。于颈内动脉、颈外动脉处用动脉夹夹闭,颈外动脉近心端及远心端手术线结扎,中间剪断。颈外动脉近结扎端斜向下剪一小口,将尼龙由颈外动脉插入至颈内动脉,继续插入颅内,插入至微感阻力,使线栓头端通过大脑中动脉起始处,此时即实现大脑中动脉的血流阻塞。在闭塞1小时后,将线取出,恢复大脑中动脉区血供,使之再灌注24h,用10%水合氯醛麻醉大鼠。取出大脑,将大脑分为5个2mm左右厚的冠状切片:在含2%ttc磷酸盐缓冲液中孵育10min,正常的脑组织呈现出红色,梗死的脑组织为白色。采用pro+6.0图像系统计算脑梗死面积。其结果如图5所示,化合物7相较模型组,能显著减少maco模型中大脑的梗死面积(p
<0.001),同时,显著优于先导化合物依达拉奉(p<0.001)。其他化合物(即化合物1-6、化合物8-21)也进行了相同实验,结果显示:均能减少maco模型中大脑的梗死面积(p<0.001)且优于先导化合物依达拉奉(p<0.001)。
[0140]
结论:本发明的化合物根据药物化学中经典的拼合原理和生物电子等排原理,将具有较好抗血小板聚集的6-苯基哒嗪酮进行拼合,设计合成了一系列衍生物,成功发现了一系列兼具抗血小板聚集和神经保护活性的化合物,其中化合物7药效最佳,适用于由血栓疾病及其并发症的预防和治疗,从根本上解决了临床上联合用药带来的不便。
