methylorubrum extorquens am1ft07,保藏单位为中国典型培养物保藏中心,保藏时间为2021 年11月11日,保藏号为cctcc m 20211396,保藏单位地址为湖北省武汉市武昌区八一路 299号。
7.上述扭脱甲基杆菌进化菌的培养方法,其特征在于,包括如下步骤:
8.将权利要求1所述的扭脱甲基杆菌进化菌接种在甲醇和甲酸作为混合碳源的hypho培养 基上,29-31℃摇瓶培养,即可获得高效利用甲酸的扭脱甲基杆菌进化菌的发酵液。
9.进一步的,上述步骤1)中所述的甲醇和甲酸作为混合碳源的hypho培养基的制备方法, 包括如下步骤:
10.s1配制大量元素a溶液:在水中添加k2hpo4和nah2po4,k2hpo4的终浓度为5-5.2g/l, nah2po4的终浓度为2.4-2.6g/l;
11.s2配制大量元素b溶液:在水中添加mgso4·
7h2o和(nh4)2so4,mgso4·
7h2o的终浓 度为0.3-0.5g/l,(nh4)2so4的终浓度为0.8-1g/l;
12.s3配制微量元素a溶液:在水中添加na2edta和feso4·
7h2o,na2edta的终浓度为 8-10g/l,feso4·
7h2o终浓度为0.8-1g/l,用1m naoh调ph至3-4;
13.s4配制微量元素b溶液:在水中添加cacl2·
2h2o、mncl2·
4h2o、na2moo4·
2h2o、 cuso4·
5h2o、cocl2·
6h2o、znso4·
7h2o,cacl2·
2h2o的终浓度为1.2-1.6g/l,mncl2·
4h2o 终浓度为0.5-1g/l,na2moo4·
2h2o的终浓度为0.2-0.5g/l,cuso4·
5h2o的终浓度为0.2-0.5g/l, cocl2·
6h2o的终浓度为1.2-1.8g/l,znso4·
7h2o的终浓度为4-4.5g/l,用hcl调ph到1-2;
14.s5将步骤s1配制的大量元素a溶液和步骤s2配制的大量元素b溶液按照质量比1:1 的比例混合,获得混合溶液;
15.s6将步骤s3配制微量元素a溶液和步骤s4配制的微量元素b溶液与步骤s5制备的混 合溶液按照质量比1:1:1000的比例进行混合,再按照比例添加甲醇和甲酸作为碳源,获得甲 醇和甲酸作为混合碳源的hypho培养基。
16.进一步的,上述步骤s6中所述的所述的甲醇和甲酸的摩尔比为0.33:1,总摩尔浓度为 120mm。
17.进一步的,上述高效利用甲酸的扭脱甲基杆菌进化菌在作为底盘宿主催化转化甲醇合成 相应有机酸产品中的应用。
18.进一步的,上述高效利用甲酸的扭脱甲基杆菌进化菌在作为底盘宿主转化甲醇和甲酸合 成3-羟基丙酸中的应用。
19.进一步的,上述应用的方法,包括如下步骤:
20.ss1 3-羟基丙酸异源合成途径质粒电转入上述高效利用甲酸的扭脱甲基杆菌进化菌中, 获得3-羟基丙酸生产菌;
21.ss2将步骤ss1中获得的3-羟基丙酸生产菌通过两阶段培养工艺转化甲醇和甲酸合成3
‑ꢀ
羟基丙酸。
22.有益效果:
23.本发明提供了一种利用动态梯度控制一碳含能化合物甲酸和甲醇供给比例作为实验室适 应性进化的选择压力,驱动扭脱甲基杆菌基因组发生超突变,获得一株兼顾高耐
受甲酸和高 利用甲酸的进化菌。进化菌在甲醇和甲酸作为混合碳源,或在甲醇、甲酸、乙醇、乙酸、草 酸、丙二醇、丙酮酸和琥珀酸作为唯一碳源,或添加不同浓度的甲醛、3-羟基丙酸、乳酸的 培养条件下,生长速率和生物量得率都显著优于适应性进化前的祖先菌wt
△
cel。所述获得 的进化菌应用于有机酸合成(本案例是3-羟基丙酸),利用甲酸作为辅助碳源,为进化菌生长 和生产3-羟基丙酸提供所需的额外还原力,优化甲醇和甲酸的摩尔浓度比例能显著提高两种 碳源协同合成3-羟基丙酸的产量和转化率。本发明获得的进化菌,为甲醇和甲酸有效协同转 化成有机酸提供了有价值的底盘细胞工厂,为二氧化碳减排和碳资源可持续利用提供了创新 的底盘细胞工厂。
附图说明
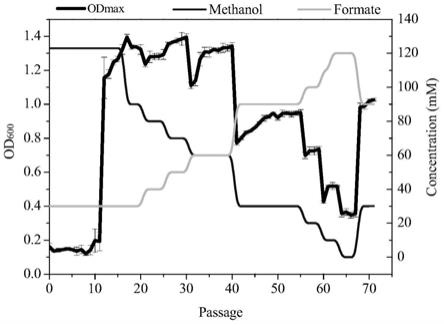
24.图1扭脱甲基杆菌实验室适应性进化传代培养过程的示意图。
25.图2一株进化菌am1ft07和适应性进化前祖先菌wt
△
cel的透射电镜比较图。
26.图3获得的一株进化菌am1ft07和适应性进化前祖先菌wt
△
cel在甲醇和甲酸作为混 合碳源和甲酸作为唯一碳源下的生长曲线。
27.图4一株进化菌am1ft07和适应性进化前祖先菌wt
△
cel在不同浓度甲醇下的生长曲 线。
28.图5一株进化菌am1ft07和适应性进化前祖先菌wt
△
cel在乙醇、乙酸、草酸、丙二 醇、丙酮酸和琥珀酸作为唯一碳源下的生长曲线。
29.图6一株进化菌am1ft07和适应性进化前祖先菌wt
△
cel在添加不同浓度的甲醛培养 条件下的生长曲线。
30.图7一株进化菌am1ft07和适应性进化前祖先菌wt
△
cel在添加不同浓度的3-羟基丙 酸培养条件下的生长曲线。
31.图8一株进化菌am1ft07和适应性进化前祖先菌wt
△
cel在添加不同浓度的l-型乳酸 培养条件下的生长曲线。
32.图9 13
c分析一株进化菌am1ft07在甲醇和甲酸作为混合碳源(摩尔比例0.33:1,总 浓度120mm)下,细胞内合成的氨基酸分别来源于甲酸和甲醇的百分比例。
33.图10一株进化菌am1ft07和适应性进化前祖先菌wt
△
cel的胞内甲酸脱氢酶fdh和 nadh转氢酶(pntab)酶活比较。
34.图11以进化菌am1ft07作为底盘细胞构建的3-羟基丙酸生产菌am1ft07-3hp在添加 不同摩尔浓度比例的甲醇和甲酸下的生长曲线和3-羟基丙酸产量。
35.图12一株3-羟基丙酸生产菌am1ft07-3hp在优化发酵罐两阶段培养工艺下的生长曲 线、甲醇和甲酸消耗曲线以及3-羟基丙酸合成曲线。
具体实施方式
36.为了使本技术领域人员更好地理解本技术中的技术方案,下面结合实施例对本发明作进 一步说明,所描述的实施例仅是本技术一部分实施例,而不是全部,本发明不受下述实施例 的限制。
37.本技术中涉及到的培养方法
38.本发明对所述扭脱甲基杆菌的进化菌am1ft07和适应性进化前祖先菌wt
△
cel的
实验 室培养条件,采用30℃的条件下进行培养;所述培养的方式优选为摇瓶培养,转速为200 rpm,在本发明中,所述hypho培养基的配制方法优选如下:大量元素(2x):大量元素 a:5.06g/l k2hpo4,2.585g/l nah2po4;大量元素b:0.4095g/l mgso4·
7h2o,1 g/l(nh4)2so4;若配制固体培养基,则在大量元素b中,加入琼脂30g/l。单独灭菌,使 用时按照1:1比例混匀。微量元素:微量元素a和微量元素b分开储存,配置100ml1000x微量元素。微量元素a:1g na2edta,0.1g feso4·
7h2o,用1m naoh调ph 至4;微量元素b:0.14g cacl2·
2h2o,0.1g mncl2·
4h2o,0.02g na2moo4·
2h2o,0.03gcuso4·
5h2o,0.16g cocl2·
6h2o,0.44g znso4·
7h2o,用hcl调ph到1-2。微量元素配 制完成后用0.22μm无菌过滤器过滤除菌,不可高压灭菌,配好之后放在4℃冷藏保存,使 用时按稀释1000倍比例添加。使用时按比例添加适量碳源。
39.所述在甲醇和甲酸作为混合碳源(总摩尔浓度分别是120mm或150mm),或甲酸作为 唯一碳源(120mm)的培养条件下有明显生长优势的一株进化菌,即为am1ft07。所述不 同浓度甲醇包括浓度为120mm、240mm、480mm;多碳化合物作为碳源包括二碳化合物 乙醇(34mm)、乙酸(5mm)、草酸(20mm),三碳化合物包括1,2-丙二醇(68mm)、 丙酮酸(36mm),四碳化合物包括琥珀酸(15mm);添加不同浓度的甲醛为0mm,2.5 mm,5mm,7.5mm,10mm,12.5mm,添加不同浓度3-羟基丙酸为0mg/l,100mg/l, 200mg/l,500mg/l,1000mg/l,添加不同浓度的l-型乳酸为0g/l、0.5g/l、1g/l、1.5 g/l、2g/l、2.5g/l、3g/l。
40.实施例1实验室适应性进化筛选获得一株高耐受甲酸且高利用甲酸的扭脱甲基杆菌进化 菌am1ft07
41.本实施例提供了一株通过实验室适应性进化筛选获得的高耐受甲酸和高利用甲酸的扭脱 甲基杆菌进化菌am1ft07,具体过程如下:
42.为避免纤维素合成基因celabcd表达干扰后续进化实验,我们以敲除了celabcd基因 的扭脱甲基杆菌(wt
△
cel)为适应性进化前的祖先菌,在甲醇和甲酸作为混合碳源(摩尔 比为4:1,即120mm甲醇和30mm甲酸)的hypho培养基上进行传代培养,每48小时转接 一次(转接初始od
600
为0.02),在经过10次转接后,菌株在该培养条件下的最高od
600
值 由0.2增长到1.2,且最高od600值维持稳定,按照该进化方式,随后梯度降低甲醇浓度同 时升高甲酸浓度(甲醇浓度由120mm降至90mm、80mm、70mm、60mm等直至30mm, 甲酸浓度由30mm升高至40mm、50mm、60mm等直至90mm)提高适应性进化的选择 压力,最终经过约300代的传代培养后,得到一株高耐受甲酸和高利用甲酸的扭脱甲基杆菌 的进化菌am1ft07,在高浓度甲酸培养条件下(甲醇和甲酸摩尔比为0.33:1,总摩尔浓度 为120mm)最高od
600
值可达到1.0(图1)。
43.经过甲酸适应性进化后,筛选到的进化菌am1ft07在细胞形态上与进化前的祖先菌 wt
△
cel存在明显差异,透射电镜照片显示进化菌am1ft07的细胞壁和细胞膜存在不同程 度的加厚(图2),这与进化菌am1ft07高甲酸耐受相关。基因组重测序发现,am1ft07 基因组共发生snp单碱基突变7604个,其中基因内发生碱基错义突变2042个,同义突变 3493个,无义突变16个,基因间发生碱基突变2053个,这些突变的发生导致了进化菌 am1ft07与进化前祖先菌wt
△
cel在甲酸耐受和细胞代谢甲酸能力上存在明显差异,相关 功能需要进一步挖掘。
44.实施例2一株进化菌am1ft07和适应性进化前祖先菌wt
△
cel在甲醇和甲酸作为混
合 碳源或甲酸作为唯一碳源下的生长曲线测定
45.我们比较了进化菌株am1ft07与其适应性进化前的祖先菌wt
△
cel的生长表型差异, 进化菌am1ft07能够在以甲醇和甲酸作为混合碳源(摩尔比例0.33:1,总摩尔浓度为120 mm)的hypho培养基中稳定生长,最高od值能够达到1.10
±
0.02,比生长速率为0.114
±ꢀ
0.019h-1
,适应性进化前的祖先菌wt
△
cel在相同培养条件下,最高od值只有0.21
±
0.05 (图3中的a)。进化菌am1ft07在以甲酸(120mm)作为唯一碳源的hypho培养基中最 终od
600
可达到0.35
±
0.01,而进化前祖先菌wt
△
cel在该培养条件下无法生长,表明进化 菌与祖先菌相比对甲酸耐受和利用能力大幅提高(图3中的b)。
46.实施例3一株进化菌am1ft07和适应性进化前祖先菌wt
△
cel在甲醇、乙醇、乙酸、 草酸、丙二醇、丙酮酸和琥珀酸作为唯一碳源下的生长曲线测定
47.为了验证上述进化菌am1ft07在其他不同碳源培养条件下是否也具有一定生长优势, 选取添加不同碳源的hypho培养基进行培养,其中一碳化合物包括不同浓度甲醇(120mm、 240mm、480mm)(图4),二碳化合物包括乙醇(34mm)(图5中的a)、乙酸(5mm)(图 5中的b)、草酸(20mm)(图5中的c),三碳化合物包括1,2-丙二醇(68mm)(图5中的 d)、丙酮酸(36mm)(图5中的e),四碳化合物包括琥珀酸(15mm)(图5中的f)。
48.在以120mm甲醇为唯一碳源培养时,进化菌am1ft07的比生长速率比适应性进化前祖 先菌wt
△
cel提高12%,达到了0.175
±
0.006h-1
,但最终生物量没有明显差异(图4),表明 基因组突变提高了进化菌am1ft07的甲醇利用速率,但未提高甲醇合成生物量的转化率。 在以34mm乙醇为唯一碳源培养时,进化菌am1ft07的比生长速率为0.111
±
0.010h-1
,与 适应性进化前祖先菌wt
△
cel相比生长速率提高了1.98倍,进化菌am1ft07的最高od值 为0.59,而适应性进化前的祖先菌wt
△
cel的最高od值为0.42(图5中的a)。在以5mm 乙酸为唯一碳源培养时,进化菌am1ft07的比生长速率为0.104
±
0.002h-1
,而适应性进化 前的祖先菌wt
△
cel比生长速率为0.102
±
0.005h-1
,两者比生长速率差异并不明显,但进化 菌am1ft07的最高od值为0.40,而适应性进化前的祖先菌wt
△
cel的最高od值为0.30 (图5中的b)。在以20mm草酸为唯一碳源培养时,进化菌am1ft07的比生长速率为0.102
ꢀ±
0.001h-1
,而适应性进化前的祖先菌wt
△
cel比生长速率为0.055
±
0.008h-1
,进化菌 am1ft07的最高od值为0.22,而适应性进化前的祖先菌wt
△
cel的最高od值为0.12(图 5中的c)。在以68mm 1,2-丙二醇为唯一碳源的培养时,进化菌am1ft07的比生长速率为 0.072
±
0.003h-1
,而适应性进化前的祖先菌wt
△
cel比生长速率为0.048
±
0.001h-1
,进化菌 am1ft07的最高od值为2.39,而适应性进化前的祖先菌wt
△
cel的最高od值为1.67(图 5中的d)。在以36mm丙酮酸为唯一碳源培养时,进化菌am1ft07的比生长速率为0.175
ꢀ±
0.004h-1
,而适应性进化前的祖先菌wt
△
cel比生长速率为0.060
±
0.004h-1
,进化菌 am1ft07的最高od值为1.71,而适应性进化前的祖先菌wt
△
cel的最高od值为1.62(图 5中的e)。在以15mm琥珀酸为唯一碳源培养时,进化菌am1ft07的比生长速率为0.177
ꢀ±
0.009h-1
,而适应性进化前的祖先菌wt
△
cel比生长速率为0.163
±
0.004h-1
(图5中的f)。 上述结果显示本发明提供的进化菌am1ft07同时能够显著提高对多种碳源的利用率,与祖 先菌wt
△
cel相比具有明显生长优势。
49.实施例4一株进化菌am1ft07和适应性进化前祖先菌wt
△
cel在添加不同浓度的甲 醛、3-羟基丙酸、l-型乳酸的培养条件下的生长曲线测定
50.进化菌am1ft07和适应性进化前的祖先菌wt
△
cel在以120mm甲醇为唯一碳源的 hypho培养基培养至od值0.8后,同时添加不同浓度(0mm、2.5mm、5mm、7.5mm、 10mm、12.5mm)甲醛溶液,祖先菌在添加10mm甲醛后停止生长,而进化菌am1ft07 在添加10mm甲醛后仍能持续生长,最高od可达1.655(图6)。进化菌am1ft07和适应 性进化前的祖先菌wt
△
cel在以120mm甲醇为碳源的hypho培养基基础上,添加不同终浓 度(0mg/l、100mg/l、200mg/l、500mg/l、1000mg/l)的3-羟基丙酸,在添加1000mg/l 3-羟基丙酸后,进化菌am1ft07的比生长速率为0.120
±
0.001h-1
,而适应性进化前的祖先 菌wt
△
cel比生长速率为0.081
±
0.006h-1
(图7)。进化菌am1ft07和适应性进化前的祖先 菌wt
△
cel在以120mm甲醇为碳源的hypho培养基基础上,添加不同浓度(0g/l、0.5g/l、 1g/l、1.5g/l、2g/l、2.5g/l、3g/l)l-型乳酸,在添加小于1.5g/l l-型乳酸时,进化菌 am1ft07比生长速率和未添加l-型乳酸的比生长速率无显著差异,而出发菌进化前祖先菌 wt
△
cel在添加1.5g/l l-型乳酸时比生长速率显著降低到0.091
±
0.029h-1
(图8);。结果显 示,本发明提供的进化菌am1ft07对甲醛和个别有机酸(如:3-羟基丙酸,l-型乳酸)具有 较高耐受性,未来可作为底盘宿主应用于高效催化转化甲醇合成相应有机酸产品。
51.实施例5进化菌am1ft07在甲醇和甲酸作为混合碳源下细胞内氨基酸的
13
c标记分析
52.进化菌am1ft07在甲醇和甲酸作为混合碳源(90mm
13
c标记甲酸,30mm
12
c标记甲 醇,即摩尔比例0.33:1)下培养,利用
13
c标记方法分析细胞内合成的氨基酸来源于甲酸和 甲醇的百分比例。
53.衍生化的氨基酸样品运用安捷伦5975b/6890n气相色谱质谱仪检测,色谱柱为 hp-5ms(30m
×
0.25mm
×
0.25um film;restek,bellefonte,pa,usa)。使用超高压纯氮作为 载气,流速为1ml/min,上样体积为1μl,安捷伦7890自动进样器无分流模式进样。进样 口和传输管的温度设为280℃。温度梯度为:60℃保持0.25分钟,以5℃/min速度增加到 280℃,保持10min;离子源的温度设为230℃。色谱质谱图用安捷伦数据分析软件进行分 析。
54.根据氨基酸标准品保留时间和质谱谱图,获得样品的氨基酸保留时间及其特征碎片峰m/z 值,峰面积积分计算出未被
13
c标记氨基酸的特征碎片峰峰面积。由于
13
c标记甲酸的同化 代谢转化为
13
c标记的氨基酸,在相同保留时间下氨基酸特征碎片峰m/z出现加1漂移,分 别对这些加1的特征离子峰进行峰面积积分,计算出
13
c标记氨基酸占未标记氨基酸的百分 比例,从而计算出细胞内合成的氨基酸分别来源于甲酸和甲醇的百分比例。结果显示本发明 提供的进化菌am1ft07在甲醇和甲酸作为混合碳源(摩尔比例0.33:1)培养条件下,氨基 酸合成来源于甲醇和甲酸的百分比例约为0.33:1(图9),这表明进化菌am1ft07有效充 分同化利用甲酸。
55.实施例6进化菌am1ft07和适应性进化前祖先菌wt
△
cel在甲醇作为唯一碳源培养时 甲酸脱氢酶(fdh)酶活的比较分析
56.进化菌am1ft07和适应性进化前祖先菌wt
△
cel在甲醇作为唯一碳源(120mm)的 hypho液体培养基中培养至od=0.8时收获细胞,50ml细胞最终溶解于7ml buffer缓冲液 (ph=7.0,50mm tricine-koh)中,用超高压破碎仪(constant systems ltd.,uk,3.8*10
7 psi)破壁,离心后取上清获得粗酶液。粗酶液蛋白浓度用上海生工的改良型bca蛋白检测 试剂盒检测。
57.表1fdh酶活测定体系
[0058][0059]
将分光光度计和微量比色皿在30℃下预热,在微量比色皿中依次添加buffer缓冲液、 nad
+
、fdh粗酶,最后加入底物甲酸钠,混匀后立即放入比色皿中反应5min,设置每10s 读一次数。用纯buffer在340nm下调零,在340nm吸光度下根据标准曲线检测nadh的生 成速率,表征酶活活性。三次生物学重复。
[0060]
酶活反应开始后,nadh的含量会逐渐上升直到平稳,以时间为横坐标,生成的nadh 含量为纵坐标得到酶反应动力学曲线,根据指数上升区的数据点计算酶活。酶活定义为:每 分钟催化生成1μmol nadh所需的酶量定义为1个酶活单位。
[0061]
甲酸脱氢酶fdh酶活结果显示进化菌am1ft07的fdh酶活与进化前祖先菌wt
△
cel 相比,显著提高4.75倍(图10中的a),该结果表明进化菌am1ft07中甲酸脱氢酶突变提 高其催化活性,增强了氧化甲酸能力。
[0062]
实施例7进化菌am1ft07和适应性进化前祖先菌wt
△
cel以甲醇作为唯一碳源培养时 nadh转氢酶酶活的比较分析
[0063]
进化菌am1ft07和适应性进化前祖先菌wt
△
cel在甲醇作为唯一碳源(120mm)的 hypho液体培养基中培养至od=0.8时收获细胞,50ml细胞用超高压破碎仪破壁(constantsystems ltd.,uk,3.8*107psi),最终溶解于7ml buffer缓冲液(ph=7.5,50mm tris)中, 获得粗酶液。粗酶液蛋白浓度用上海生工的改良型bca蛋白检测试剂盒检测。
[0064]
表2nadh转氢酶酶活测定体系
[0065][0066]
将分光光度计和微量比色皿在30℃下预热,在微量比色皿中依次添加buffer缓冲液、 mgcl2、apad
+
(3-乙酰吡啶腺嘌呤二核苷酸)、nadph、nadh转氢酶(pntab),混匀 后立即放入比色皿中反应5min,设置每10s读一次数。在375nm吸光度下根据标准曲线检 测下检测
apadh(3-乙酰吡啶腺嘌呤二核苷酸还原态)的生成速率,表征酶活活性。三次生 物学重复。
[0067]
酶活反应开始后,会逐渐上升直到平稳,以时间为横坐标,生成的apadh含量为纵坐 标得到酶反应动力学曲线。根据指数上升区的数据点计算酶活。酶活定义为:每分钟催化生 成1μmol apadh所需的酶量定义为1个酶活单位。
[0068]
nadh转氢酶(pntab)粗酶酶活测定结果显示进化菌am1ft07中的nadh转氢酶比 进化前祖先菌wt
△
cel提高2.02倍(图10中的b),表明进化菌am1ft07中nadh转氢 酶突变提高其催化活性,增强nadh转化为nadph。
[0069]
实施例8一株3-羟基丙酸生产菌在三角摇瓶培养下,优化甲醇和甲酸的摩尔浓度比例显 著提高3-羟基丙酸的产量
[0070]
进化菌am1ft07作为底盘宿主,将3-羟基丙酸异源合成途径质粒电转入进化菌 am1ft07,构建3-羟基丙酸生产菌am1ft07-3hp,该菌株能够在以甲醇和甲酸作为混合碳 源(摩尔浓度比例分别为5.67:1、4:1、3:1、2.33:1、1.86:1、1.5:1、0.33:1)的hypho培养基 中稳定生长(图9a),其中甲醇和甲酸混合总摩尔浓度为150mm。随着甲酸比例的增加, am1ft07菌的比生长速率逐渐降低(图11中的a),但对于3-羟基丙酸的合成,增加甲酸 作为辅助碳源有利于提高3-羟基丙酸的产量,当甲醇和甲酸摩尔浓度比为2.33:1时,3-羟 基丙酸产量最高可达到175mg/l(图11中的b和c)。因此,合理添加甲酸有利于生产菌 am1ft07-3hp合成3-羟基丙酸,进化菌株am1ft07作为优良的甲酸耐受和同化利用菌株, 适用于甲酸甲醇混合碳源下3-羟基丙酸的高效生产。
[0071]
实施例9一株3-羟基丙酸生产菌在优化发酵罐的两阶段培养工艺下,有效协同转化甲醇 和甲酸合成3-羟基丙酸
[0072]
3-羟基丙酸生产菌am1ft07-3hp在以120mm甲醇为唯一碳源的hypho培养基培养至 od值0.8后,按照10%的接种量转接种于含1.7l choi3培养基(120mm甲醇)的发酵罐中 连续培养,初始培养条件为发酵温度30℃,转速500rpm,通气量1l/min,用30%氨水控制 ph值维持在7.0,溶解氧通过转速(500-800rpm)和通气量(1-4l/min)调节维持在20%以 上,用甲醇电极准确控制甲醇补料,甲醇浓度不低于72mm(0.3%),在发酵60h之后开始 第二阶段发酵,在发酵罐中流加甲醇与甲酸钠的混合溶液(摩尔比为2.33:1),控制甲醇浓 度不低于72mm(0.3%),用1m的盐酸溶液控制其培养体系ph维持在7.0,用半定量氨氮 试纸检测发酵液中氨氮浓度,用10%的硫酸铵溶液控制发酵液中硫酸铵含量维持在0.25-0.75 g/l范围,其余参数保持不变,经过100h的发酵,am1ft07-3hp菌的生物量达到约26 g/l,3-羟基丙酸产量达到约6.5g/l(图12)。结果显示,发明提供的am1ft07-3hp菌通过 甲醇甲酸双碳源两阶段发酵培养,可以大幅度提高单位发酵时间内菌体的生物量和3-羟基丙 酸的产量,具有明显的有机酸产品的生长及合成优势。
[0073]
choi3培养基:
[0074]
a液:na2hpo4·
12h2o 5.37g/l、kh2po
4 1.305g/l;
[0075]
b液:mgso4·
7h2o 0.45g/l,(nh4)2so
4 1g/l。
[0076]
微量:(100x 100ml):na2moo4·
2h2o 8mg,cacl2·
2h2o 200g,cuso4·
5h2o 8mg, cocl2·
6h2o 32mg,mncl2·
4h2o 63.36mg,znso4·
7h2o 26mg,feso4·
7h2o 0.2mg, h3bo
3 6mg。
[0077]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人
员来说, 在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发 明的保护范围。
