osparp3基因在调控植物耐旱性中的应用
技术领域
1.本发明属于植物抗性育种技术领域,具体涉及osparp3基因在调控植物耐旱性中的应用。
背景技术:
2.干旱胁迫可以显著影响植物的生长发育,也对植物分布格局起着至关重要的作用。干旱胁迫响应包括渗透调节基因、抗氧化代谢基因、逆境诱导蛋白基因。植物激素脱落酸(aba)在植物对非生物胁迫的适应性反应中起着重要的作用,是胁迫适应信号转导通路中调控基因表达的关键调控因子。当环境正常时,植物体内脱落酸含量极低。当遭受干旱时,脱落酸含量增加,调节保护细胞离子通量,介导气孔闭合,减少水分流失。介导蛋白激酶snrk2.6/ost1和其他信号机制的激活如ros和ca
2+
。干旱胁迫时加入外源aba,可以显著提高植物体内脯氨酸和可溶性蛋白含量,有效缓解干旱胁迫对叶片的损伤,从而改善叶片生理状态,维持植株的正常生长。众所周知,水稻是一种干旱易感作物,生长过程中需水量大。它的根系小,气孔关闭迅速,在轻度水分胁迫下角质层蜡质产量减少。因此,培育具有抗旱能力的水稻新品种,能促进水稻健康生长的同时降低人工劳动量。在水稻中引入胁迫激活的应答基因以增强抗旱性是在日益严重的环境胁迫下提高水稻产量和品质的有效途径;农业产量更高,同时还对环境友好,实现可持续发展农业的目标。
3.多聚adp-核糖聚合酶参与dna损伤应答、胁迫修复、转录及转录后调控和细胞程序性死亡等一系列生物学事件。parp是损伤修复途径的一个重要的信号通路,募集其他必要的修复蛋白来维持基因组的完整性。此外,有一系列关于parp是植物免疫反应的正调控子的报道。水稻基因组中共包含3个parp家族成员,osparp3基因在水稻的种子成熟脱水阶段高表达。然而,有关该基因调控水稻耐旱方面的研究和应用则未见报道。
技术实现要素:
4.本发明的目的是提供水稻osparp3基因在抗旱调控中的应用。本发明从水稻模式材料日本晴中克隆到osparp3基因,转入水稻中提高osparp3基因的表达水平,显著提高了水稻的干旱胁迫耐性。因此,在水稻中过量表达osparp3基因对于提高水稻抗旱性具有重要意义。
5.本发明基于一个耐旱性降低的水稻t-dna插入突变体,通过特异性引物进行pcr扩增验证该插入突变体的插入位置,插入的具体基因为一个基因编号os02g0530600、编码parp 蛋白的osparp3基因。水稻osparp3基因序列全长2496bp,编码831个氨基酸。于是以日本晴植株为材料,提取其总rna,再将rna反转录成cdna。以该逆转录产物为模板设计引物进行pcr扩增,回收目的片段并克隆出整条基因片段。通过农杆菌eha105介导的遗传转化方法,将融合osparp3基因的过量表达载体导入日本晴。转基因植株经pcr及定量pcr 鉴定,证明目标基因已经转化到水稻中,并且实现目标基因osparp3的表达量提高。过表达转基因阳性植株进行自交繁殖,得到纯合阳性转基因株系。osparp3由干旱胁迫和aba诱导,与这个表
达模式相对应,过表达的水稻植株抗旱性显著高于野生型。这些结果表明, osparp3是水稻aba信号转导和干旱胁迫耐受性的正调控因子。osparp3在水稻抗旱性遗传改良中具有很高的应用潜力。
6.因此,本发明的第一个目的是提供一种多聚adp-核糖聚合酶,其氨基酸序列如 seqidno.2所示。
7.本发明的第二个目的是提供一种多聚adp-核糖聚合酶基因,其编码所述的多聚adp-核糖聚合酶。
8.优选,所述的多聚adp-核糖聚合酶基因,为osparp3基因,其核苷酸序列如seqidno.1 所示。
9.本发明的第三个目的是提供一种含有所述的多聚adp-核糖聚合酶基因(osparp3基因) 的重组载体。
10.优选,所述的重组载体为过表达多聚adp-核糖聚合酶基因(osparp3基因)的载体。
11.本发明的第四个目的是提供一种含有所述的多聚adp-核糖聚合酶基因(osparp3基因) 的重组菌株或重组细胞。
12.本发明的第五个目的是提供所述的多聚adp-核糖聚合酶基因(osparp3基因)在调控植物耐旱性中的应用。
13.优选,所述的应用,为过表达多聚adp-核糖聚合酶基因(osparp3基因)在增强植物耐旱性中的应用。
14.优选,所述的植物为禾本科植物。
15.优选,所述的植物为水稻。
16.本发明还包括与osparp3基因同源的dna片段,只要它们编码的蛋白与所示的蛋白在生物学功能和生理生化特征等方面相同或相近,可以响应aba诱导并通过上调osparp3所示的表达量和/或活性增加抗旱性。这些与osparp3基因同源的dna片段包括本发明核苷酸序列对应的等位基因、同源基因、突变基因和衍生基因;它们编码的蛋白类似于本发明的蛋白,或存在一个、数个或数十个氨基酸的替换、删除或插入现象,都属于本发明内容。
17.本发明创造的优点:
18.1.提供了一种提高水稻干旱胁迫耐性的基因osparp3,并首次在水稻中过量表达了 osparp3基因。过量表达osparp3基因阳性植株干旱胁迫耐性显著提高。基于本发明新发现的osparp3基因,通过分子标记辅助育种和遗传转化等技术,可用于改良现有水稻等禾本科植物的耐旱性,培育和创制耐旱性高的中间材料和生产品种。
19.2.本发明的osparp3基因与水稻抗性有关,响应激素aba诱导,为研究控制激素和逆境的互作调控提供了材料,也有助于揭示水稻osparp3基因提高水稻干旱胁迫耐性的分子机制,对水稻安全生产和降低劳动力具有广阔的应用前景。
附图说明
20.图1为t-dna插入突变体的鉴定分离;其中:图a:突变体水稻t-dna插入位置示意图,方框标示为编码区,直线表示为内含子,三角形示意t-dna插入位置;图b:测序峰图;图c: pcr检测osparp3突变体水稻株系分离鉴定示意图;从左往右第一个泳道为野生型oryza satival.ssp.japonica cv.donjin植株对照,第二个泳道为杂合突变体,第三个泳道为纯
合突变体,上部dna条带为osparp3基因组特异性引物扩增,下部dna条带为基因组和插入t-dna特异性引物组合扩增;图d:western-blot检测显示突变体中的parp3蛋白表达缺失。
21.图2为过量表达载体pxu1301的图谱。
22.图3为oryza sativa l.ssp.japonica cv.nipponbare和该遗传背景下过表达转基因植株中 osparp3的表达水平。
23.图4为干旱和aba处理后osparp3的表达水平;图a为干旱处理(peg6000);图b为aba 处理。
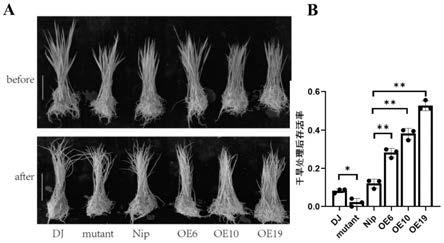
24.图5为过量表达osparp3使水稻抗旱性增加,图a中为干旱处理后水稻表型,其中标尺:5 cm;dj表示oryza sativa l.ssp.japonica cv.donjin,mutant表示dj背景下的纯合突变体osparp3 株系,nip表示oryza sativa l.ssp.japonica cv.nipponbare,oe6、oe10、oe19为nip背景下的 osparp3纯合过表达水稻株系;图b为对应的干旱处理后水稻存活率,一颗星表示突变体与对照dj相比存在显著差异,两颗星表示与对照nip相比存在极显著差异。
具体实施方式
25.以下实施例是对本发明的进一步说明,而不是对本发明的限制。
26.以下将结合具体的实施例详细说明本技术的技术方案。本发明实施例中所用的试验试剂和耗材均为本领域常规的试验材料,可通过商业渠道购买得到。
27.实施例1:t-dna插入突变体鉴定
28.本发明基于一个耐旱性降低的水稻(oryza sativa l.ssp.japonica cv.donjin)t-dna插入突变体,通过特异性引物进行pcr扩增验证该插入突变体的插入位置以及插入的具体基因为一个基因编号os02g0530600、编码parp蛋白的osparp3基因。本发明通过鉴定并分离得到纯合的t-dna插入突变体水稻,并进一步利用western-blot验证了突变体中osparp3的表达缺失。
29.种植获得的t-dna突变体水稻,分单株取样叶片并提取突变体叶片基因组dna,通过 t-dna载体的边界序列引物搭配osparp3基因侧翼序列引物扩增并测序。利用引物lp和rp可以扩增基因组序列,引物rb1和lp可以检测t-dna插入基因组序列。只有rb1+lp引物配合的单一扩增条带的株系才是纯合株系(图1)。其中涉及的引物序列如下:rb1: ccacagttttcgcgatccagactg;lp:tatcgcctcctaaatcgcac;rp: ggtcagctcgagtgtaaggg。通过鉴定获得的纯合突变体osparp3可进一步繁殖后代。利用osparp3基因序列片段制备多克隆兔抗体,经总蛋白的提取、蛋白质的sds-page电泳、转膜和抗体孵育,再次验证了突变体中osparp3的表达缺失。
30.实施例2:osparp3基因的克隆及过表达植株的构建
31.1.取模式水稻材料日本晴(oryza sativa l.ssp.japonica cv.nipponbare)种子,rna提取参照百泰克多糖多酚rna植物提取试剂盒(含dna酶)说明书进行;采用琼脂糖凝胶电泳和 nanodrop微量分光光度计检测总rna的纯度及浓度,取1μg的总rna做起始逆转录反应,所采用的逆转录酶为primescript,逆转录反应的步骤参考该逆转录酶的使用说明。以逆转录产物为模板,采用引物f:atggtacacgagacaagatcacg;r:tcactcgtccggcaccac,进行pcr扩增,pcr所用的聚合酶为kod fx(toyobo)。反应体系为50ul,按照kod fx 的说明书
配制pcr反应体系。反应条件为:94℃5min;94℃30sec,58℃30sec,68℃150 sec,30个循环;68℃10min。pcr扩增获得约2500bp的片段。采用pcr产物直接纯化的方法回收该片段后连接t载体转入大肠杆菌dh5α。挑取克隆测序。测得osparp3基因cds序列全长2496bp,其核苷酸序列如seqidno.1所示;编码831个氨基酸,其氨基酸序列如seqidno.2 所示。
32.2.用同源重组的方法将上述pcr扩增的osparp3基因cds连接到用hindiii和bamh i 双酶切掉gus exon2后的过量表达载体pxu1301(载体图如图2所示)上。转化后挑5个单克隆进行提取质粒,酶切鉴定,选择两个阳性克隆进行测序确定质粒构建正确。将正确质粒用农杆菌eha105转化野生型日本晴愈伤,经过预培养、侵染、共培养,筛选具有抗性的愈伤组织,分化、生根、炼苗移栽,得到转基因植株。经筛选的阳性植株移至种植盆中,待成熟后收集种子即得t1代植株。每个株系选择5株经pcr检测为阳性的植株自交繁种,得到 t2代植株,t2代株系再进行pcr检测获得osparp3纯合过表达株系。
33.3.取3个株系的孕穗期的穗子进行荧光定量pcr,以野生型日本晴为对照检测目标基因 osparp3的表达量。用trizol reagent提取总rna,反转录cdna第一链的合成计算所需的 1μg rna模板体积,将其与试剂盒的溶液混合轻微震荡混匀,37℃短暂离心5min去除掉 rna基因组残留的dna;上述反应后,进行第一链cdna合成,在上述去基因组dna反应液中加入试剂盒中的试剂短暂离心,42℃保持15min,85℃加热5min至star scriptiirt mix 失活,得到cdna溶液。反应完成后,将所得到的cdna稀释10倍;用上下游引物分别为: f:cgttcaactttagatgacccactg,r:ccttgacaggctcgtaggttttc,以水稻的内参基因actin(f:cggtgtcatggtcggaat,r:gctcgttgtagaaggtgt)作为对照。结果如图3所示,3个过量表达的转基因株系osparp3的表达量都显著提高35-60倍。
34.实施例3:osparp3基因的功能鉴定
35.1、水稻在aba和干旱处理后osparp3在mrna水平的表达
36.取日本晴3叶期小苗的根分别浸入到含有5μm aba和含有20%peg6000的水稻培养液中进行处理,取0、1、3、6、12、24h不同处理时间长度的材料。用trizol reagent提取茎叶和根总rna,检测方法参见实施例2的步骤3。结果如图4所示,在aba和干旱处理(peg6000 处理)条件下,茎叶和根中的osparp3基因都受到了诱导上调,说明osparp3基因响应aba 和干旱。
37.2、osparp3过表达转基因株系和突变体干旱处理
38.分别将收获的osparp3纯合过表达株系、纯合突变体osparp3株系和野生型dj、野生型日本晴种子在28℃光照培养箱发芽。2天后将萌发的幼苗移至水稻培养液中,约2周后将生长状况基本一致的各个株系小苗用20%peg6000于28℃光照培养箱中处理7天,每个株系至少45株,之后复水恢复3天。实验重复三次统计各个株系的存活率。结果如图5所示,与野生型dj植株相比,纯合突变体osparp3植株干旱胁迫耐性降低,植株存活率为0。 osparp3纯合过表达植株(oe6、oe10、oe19)的存活率显著高于野生型日本晴,表现为抗旱。
