1.本技术要求基于2019年7月2日提交的韩国申请号10-2019-0079490的优先权,并且在相应申请的说明书和附图中公开的所有内容通过引用并入本文。
2.本公开内容涉及用于从植物原料包括具有坚硬果肉或果皮的植物分离外排体的方法。更具体地,本公开内容涉及用于从植物原料大规模产生高纯度植物外排体以便有用地用于相关行业例如药物和商业化产品等的方法。
背景技术:
3.据报道,外排体是由多种细胞分泌的纳米大小的微泡,并且含有蛋白质、脂质、mrna和mirna,并且通过作用于内分泌系统而充当细胞间通讯的重要介质。这种作用作为可克服常规干细胞治疗剂的问题,例如移植率和免疫原性的新治疗剂而引起人们的注意。
4.根据最近的研究,从可食用植物分离的外排体与从哺乳动物细胞分泌的外排体相比没有毒性或免疫原性,并且已知具有非常高的体内稳定性和生物相容性。此外,据报道从哺乳动物细胞分离的外排体含有约20%的胆固醇,但可食用植物外排体不含胆固醇。特别地,与动物组织或细胞培养溶液相比,植物原料具有可大量获得的优点。
5.根据来源的植物,外排体中包含多种植物,但是直到现在,关于与植物外排体相关的蛋白质知之甚少,并且与哺乳动物细胞的外排体相比,在确定特征方面存在限制。在大多数研究中,植物外排体的特征通过外排体的大小或形状来确定,并且为了分离植物外排体,需要用于选择适当大小并仅分离外排体的方法。
6.在现有技术的情况下,已经尝试通过使用蔗糖梯度的密度梯度超速离心法来分离植物外排体,但是该方法难以用于外排体商业化的生产过程中。此外,有一种方法是通过过滤分离的胞外囊泡来获得尺寸小于过滤过滤器孔的物质,即当从大量植物汁液中分离外排体时,由于杂质或外排体被吸附并积聚在过滤器孔中,过滤效率迅速降低,这对于长期外排体分离非常不利。
7.在整个说明书中引用了许多文献,并指出了其引用。所引用的文献的公开内容通过引用整体并入本文以更清楚地说明本公开内容和本公开内容所属领域的水平。
8.技术问题
9.在本公开内容中,建议使用离心和tff的大规模产生方法作为用于分离高纯度植物外排体的方法。通过本公开内容,高纯度植物外排体的纯化和生产率得到有效提高。
10.因此,本公开内容的一个目的是提供能够大规模有效分离高纯度植物外排体的方法,补充了常规分离方法。
11.本公开内容的另一个目的是提供用于从植物原料中大规模分离具有均匀粒径和分布的高纯度外排体的方法。
12.本公开内容的另一个目的是提供用于分离植物外排体的方法,所述方法不限于植物原料包括海洋植物群例如硬皮、茎、种子和海芥菜、紫菜等,不同于现有技术中限于软肉或汁液的方法。
13.本公开内容的另一个目的是提供用于分离植物来源外排体的方法,其适合于医疗和商业产品的gmp生产并且有助于过程放大(scale-up)。
14.本公开内容的其他目的和益处将通过以下本发明详细描述、所附权利要求书和附图而变得更加明显。
15.技术方案
16.本公开内容的一个方面是提供用于分离植物外排体的方法,其包括进行离心;以及进行切向流过滤(tangential-flow filtration,tff)作为超滤。
17.本文中使用的术语“植物外排体”是指从植物分离的大小为约50至200nm的外排体或外排体样胞外囊泡。
18.已知植物来源外排体与从哺乳动物细胞分泌的外排体相比具有低毒性和免疫原性,并且具有非常低的胆固醇含量,因此它们的稳定性和生物相容性非常高。此外,已知植物来源外排体由于植物来源抗氧化剂组分或蛋白质组分而在伤口愈合和皮肤再生方面有效。
19.同时,作为用于从活生物体分离外排体的多种方法,已经开发了离心、超速离心、密度梯度离心、色谱法、过滤、超滤、切向流过滤、基于聚合物的沉淀、总外排体提取试剂盒和免疫亲和分离方法等。然而,在该现有技术的情况下,外排体分离方法限于从动物,有限地,哺乳动物来源的细胞或生物溶液(例如牛奶)中分离外排体的方法。由于在与动物来源细胞不同的植物来源细胞中发现了与外排体相似的液泡,因此已经引入了用于去除它们的方法,但是大多数限于实验室水平的剂量。
20.在本公开内容中,通过将常规已知的外排体分离方法中的超速离心和作为超滤的切向流过滤特别地组合,提供了用于分离植物来源外排体的方法,其可以防止杂质例如液泡的污染和纯度的劣化并且大规模地获得高纯度植物外排体。除了所述组合之外,通过先前已知的外排体分离方法中任何其他两种方法的组合都难以获得从中去除了液泡的植物外排体,并且特别是不可能大规模均一地获得高纯度植物外排体。
21.植物来源外排体可具有30至500nm的均匀尺寸分布,优选地,其可具有50至200nm的均匀尺寸分布。
22.在另一方面,为了替代限于小量产生植物外排体的常规密度梯度离心方法,提供了使用离心和tff方法的大规模产生植物外排体的方法。
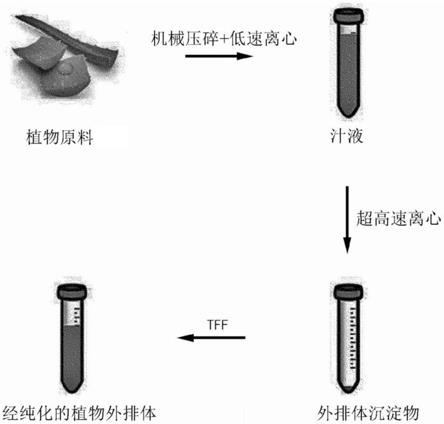
23.本公开内容中使用的离心是使用固体与固体周围的液体之间的密度差的分离方法,并且是指使用离心力加速固体沉降的方法。离心具有能够连续重复该过程、在短时间内处理大量以及允许在无菌状态下容易操作的优点。本公开内容的离心可以是差速离心、密度梯度离心或其组合,但不限于此。
24.本公开内容中使用的离心方法可选自低速离心、高速离心、超速离心及其组合,并且优选地,其可包括超速离心。低速离心可达到6,000rpm(6,000xg)或更低的速度,并且主要用于容易沉淀的样品例如细胞或细胞核的离心,并且高速离心具有约20,000至25,000rpm(60,000xg)的最大速度,并且超速离心是指具有约40,000至80,000rpm(600,000xg)的最大速度的离心方法。
25.先前,已知超速离心在分离过程中具有低产率并且破坏外排体,因此它不能用于外排体的大量分离,并且仅可以是实验室级别的分离。然而,本发明人出人意料地发现,与
动物外排体不同,植物外排体可通过超速离心有效地提高生产力而不损伤外排体,并且可应用于外排体大量产生过程。在一个实施方案中,本公开内容的离心可以通过包括以下来进行:(a)在以1,000至3,000xg的速度的离心条件下离心10至30分钟之后获得上清液的过程,(b)在以10,000至50,000xg的速度的超速离心条件下通过超速离心60分钟至2小时去除液泡的过程,和(c)在以100,000至150,000xg的速度的超速离心条件下通过超速离心60分钟至2小时获得包含外排体的沉淀物的过程。
26.此外,本公开内容的方法的特征在于其包括进行切向流过滤(tff)。本公开内容中使用的切向流过滤(tff)是这样的过滤方法,其中溶液沿与过滤膜垂直的方向流动,滤出溶液中存在的小尺寸杂质,并分离大尺寸外排体。与常规过滤方法相比,可以使外排体对过滤过滤器的孔的吸附或膜孔的堵塞最小化,并因此易于过程放大和gmp过程应用。
27.在tff中,进料溶液的快速流动起到降低浓差极化(孔表面上的产物浓度)同时“清扫”膜或中空纤维表面的作用。此外,tff方法防止可堵塞孔的污染物的增加。这种快速的交叉流动降低了压力,这可以迫使比膜或中空纤维的孔小的一些进料溶液和溶解的分子通过过滤器。已经通过孔的溶液被称为滤液或渗透液,并且大于孔的分子或颗粒保留在进料溶液中并被有效地浓缩。在一个优选实施方案中,本公开内容的tff是超滤系统,并且作为进行如上所述的tff方法的结果,离心的提取物可以有效地浓缩至1/10至1/100的体积。超滤位于微滤和反渗透的中间,是通过膜孔与溶质之间的尺寸差异来分离特定物质的方法。超滤膜可以表现出其作为截止分子量(molecular weight cutoff,mwco)的分离性能,该截止分子量定义为表现出90%或更多被膜排斥的溶质的最小分子量。
28.本公开内容中使用的切向流过滤可以是选自能够进行超滤的中空纤维tff和膜tff的一种或更多种,并且优选地,其可使用具有100,000da至500,000da的截止分子量(mwco)的tff过滤器。
29.此外,本公开内容的方法还可包括在离心和tff之前将植物原料压碎。在这种情况下,其优点在于,通过机械和物理压碎可以将限于软果肉的植物原料的范围扩大到硬植物包括果皮等。因此,本公开内容的方法中使用的植物原料可以包含选自以下的一种或更多种:果肉、皮、种子、茎、叶、根和花。
30.将植物原料压碎可包括机械压碎其中植物原料和缓冲液以1∶1至1∶10的重量比混合的混合物的过程,并且作为缓冲液,可以使用包含磷酸缓冲盐水(pbs)、tris-缓冲盐水(tbs)、4-(2-羟乙基)-1-哌嗪乙磺酸(hepes)缓冲盐水(hbs)、生理盐水溶液、蒸馏水、培养基、注射用水等中的一种或更多种的缓冲液,但不限于此。
31.将植物原料压碎的过程可以通过用以10至1,000rpm的速度旋转的刀的刀片机械压碎植物混合物来进行。
32.通过本公开内容的该方法获得的提取物可以包含浓度为107至10
12
的颗粒数目/1ml单位体积的植物外排体。
33.如上所述的本公开内容的方法的优点在于其适合于大规模产生植物外排体,并且可以是每次1ml或更多、10ml或更多、100ml或更多、1l或更多、10l或更多或者100l或更多的植物原料的大规模加工。
34.效果
35.本公开内容的方法提供了用于均一地获得从中去除了液泡的高纯度外排体的方
法。特别地,使用可同时处理大量植物原材料的离心和tff,可以从大量的植物原料中分离高纯度的植物外排体。这改进了停留在实验室水平的常规植物外排体分离方法,并由此提出了大规模产生的简单方法。
附图说明
36.图1是根据本公开内容一个实施方案的分离植物来源外排体的方法的过程的示意图。
37.图2是根据实施例1的芦荟皮来源外排体的形态分析(tem)结果。
38.图3是根据实施例1的芦荟皮来源外排体的特征分析(nta)的结果。
39.图4是将省略uc过程而仅进行tff时获得的结果与组合uc和tff时获得的结果进行比较的tem照片。
40.图5是根据实施例1的芦荟皮来源外排体的特征分析(dls)的结果。
41.图6是根据实施例2的大蒜来源外排体的形态分析(tem)的结果。
42.图7是根据实施例2的大蒜来源外排体的特征分析(nta)的结果。
43.图8是根据实施例3的海芥菜皮来源外排体的形态分析(tem)的结果。
44.图9是根据实施例3的海芥菜皮来源外排体的形态分析(nta)的结果。
具体实施方式
45.在下文中,将通过实施例更详细地描述本公开内容。这些实施例仅用于更具体地举例说明本公开内容,并且对于本公开内容所属领域的技术人员显而易见的是,本公开内容的范围不受这些实施例的限制。
46.实施例
47.1.芦荟皮来源外排体
48.(1)分离方法
[0049]-实施例1(uc+tff)
[0050]
使用uc和tff分离芦荟皮来源外排体。具体地,将芦荟皮与磷酸缓冲盐水(pbs)设定为1∶2(w/w)放入混合器中之后进行充分研磨。然后,将以1,000xg离心10分钟之后产生的上清液以2000xg离心20分钟,然后再次收集上清液。将上清液以3,000xg离心30分钟,然后以10,000xg离心60分钟。将10,000xg之后的上清液在4℃下使用uc以100,000xg超速离心70分钟。
[0051]
将uc之后剩余的沉淀物悬浮,并通过切向流过滤(tff)系统从悬浮液中分离外排体。具体地,从截止值为100至500kda的多过滤器表面去除小于过滤器孔的其他杂质颗粒,并将含有芦荟皮来源外排体的溶液浓缩。将以这种方式分离的外排体在-70℃或更低的温度下冷冻储存直至用于实验。
[0052]-比较例1(mf+tff)
[0053]
使用微滤和tff分离芦荟皮来源外排体。具体地,将芦荟皮与磷酸缓冲盐水(pbs)设定为1∶2(w/w)放入混合器中之后进行充分研磨。然后,为了获得粒径分布均匀的高纯度外排体,添加2%重量的海藻糖。添加海藻糖之后,用0.22μm过滤器过滤,并去除杂质例如细胞碎片、废物和大颗粒。
[0054]
在通过过滤过程之后,通过切向流过滤(tff)系统作为超滤,分离外排体。具体地,从截止值为100至500kda的多过滤器表面去除小于过滤器孔的其他杂质颗粒,并将含有芦荟皮来源外排体的溶液浓缩。将以这种方式分离的外排体在-70℃或更低的温度下冷冻储存直至用于实验。
[0055]
(2)外排体特征的评价
[0056]
对于芦荟皮来源外排体,进行外排体特征的评价。为了确定外排体的形状,使用扫描电子显微镜(tem),并且为了确定精确的微粒尺寸,使用动态光散射光度计(dls)。通过纳米粒子追踪分析(nta)确定每单位体积分离的外排体的颗粒数目。
[0057]
在实施例1中,作为实验的结果,在10,000xg离心后通过上清液的微滤(孔径0.1至1.0μm)过滤具有相对大粒径的固体之后,获得了其中外排体和液泡一起存在的混合物,并且证实了在10,000xg离心后上清液中混合有外排体和液泡。在实施例1中,证实了在进行100,000xg超速离心后收集的沉淀物中混合了大量杂质例如蛋白质和核酸以及外排体。在实施例1中,作为通过进行超滤tff来分离外排体的结果,每1ml的单位体积分离出1
×
10
9~11
个高纯度外排体。确定了分离的芦荟皮来源外排体具有200nm或更小的微观结构(图2),并且通过纳米粒子追踪分析(nta)确定了1
×
10
9~11
个外排体/1ml单位体积的浓度(图3)。
[0058]
另一方面,观察到通过比较例1的方法分离的芦荟皮来源提取物中混合有与外排体相似的液泡,并由此证实通过mf和tff方法难以去除包含在植物提取物中的液泡。换句话说,当在从芦荟皮分离外排体的过程中仅进行tff而不进行超速离心(uc)过程时,清楚地证实了除了外排体之外还包括包含液泡(红色箭头)的杂质,并且这些杂质导致植物外排体的效力降低(参见图4)。
[0059]
2.大蒜来源外排体的分离
[0060]
(1)分离方法
[0061]-实施例2(uc+tff):
[0062]
使用uc和tff分离大蒜来源外排体。具体地,将去除了皮的大蒜与磷酸缓冲盐水(pbs)设定为1:2(w/w)放入混合器中之后进行充分研磨。然后,将以1,000xg离心10分钟之后产生的上清液以2,000xg离心20分钟,然后再次收集上清液。将上清液以3,000xg离心30分钟,然后以10,000xg离心60分钟。将10,000xg之后的上清液在4℃下使用uc以100,000xg超速离心70分钟。通过将uc之后剩余的沉淀物悬浮,通过切向流过滤(tff)系统作为超滤来分离外排体。具体地,从截止值为100至500kda的多过滤器表面去除小于过滤器孔的其他杂质颗粒,并将含有大蒜来源外排体的溶液浓缩。将以这种方式分离的外排体在-70℃或更低的温度下冷冻储存直至用于实验。
[0063]-比较例2(uc+s-dguc)
[0064]
使用uc和蔗糖密度梯度超速离心来分离大蒜来源外排体。具体地,将去除了皮的大蒜与磷酸缓冲盐水(pbs)设定为1∶2(w/w)放入混合器中之后进行充分研磨。然后,将以1,000xg离心10分钟之后产生的上清液以2,000xg离心20分钟,然后再次收集上清液。将上清液以3,000xg离心30分钟,然后以10,000xg离心60分钟。将10,000xg之后的上清液在4℃下使用uc以100,000xg超速离心70分钟。
[0065]
通过将uc之后剩余的沉淀物悬浮,另外进行蔗糖密度梯度超速离心。具体地,将具有密度梯度的蔗糖溶液添加到离心管中用于超速离心。将这些蔗糖溶液分别制成90%、
80%、70%、60%、50%、40%和30%的溶液,并且在124℃下灭菌15分钟之后,小心放置用于超速离心的管使其具有90%~30%的层。在将含有外排体的悬浮液小心地添加至如上制备的用于超速离心的蔗糖梯度管的顶部之后,使用用于超速离心的离心机,在4℃,200,000xg下进行4小时的超速离心。然后,从管的顶部获得1ml的级分,并测量密度以获得对应于外排体的级分并洗涤以分离蔗糖。
[0066]
(2)外排体特征的评价
[0067]
作为实验结果,通过扫描电子显微镜(tem)确定了实施例2中分离的大蒜来源外排体具有200nm或更小的圆形微观结构(图6),并且作为通过纳米粒子追踪分析(nta)确定每单位体积分离的外排体的颗粒数目的结果,确定了1
×
10
10~12
个外排体/1ml单位体积的浓度(图7)。
[0068]
通过扫描电子显微镜(tem)观察到通过比较例2的方法分离的大蒜来源外排体也具有200nm或更小的圆形微观结构。然而,为了分离高纯度的外排体,需要另外的用于分离蔗糖的洗涤过程,并且每小时的外排体产量小于实施例2产量的1/100。因此,证实了比较例2的方法难以用于外排体商业化的大规模产生过程。
[0069]
3.海芥菜来源外排体的分离
[0070]
(1)分离方法
[0071]-实施例3(uc+tff):
[0072]
使用uc和tff分离海芥菜来源外排体。具体地,将去除水分的海芥菜与磷酸缓冲盐水(pbs)设定为1∶2(w/w)放入混合器中之后进行充分研磨。然后,将以1,000xg离心10分钟之后产生的上清液以2,000xg离心20分钟,然后再次收集上清液。将上清液以3,000xg离心30分钟,然后以10,000xg离心60分钟。将10,000xg之后的上清液在4℃下使用uc以100,000xg超速离心70分钟。
[0073]
通过将uc之后剩余的沉淀物悬浮,通过切向流过滤(tff)系统作为超滤来分离外排体。具体地,在tff系统中从截止值为100至500kda的多过滤器的表面去除小于过滤器孔的其他杂质颗粒,并将含有海芥菜来源外排体的溶液浓缩。将以这种方式分离的外排体在-70℃或更低的温度下冷冻储存直至用于实验。
[0074]-比较例3(sec+tff):
[0075]
已知尺寸排阻色谱是能够分离外排体而没有外排体损伤或特征改变的有用方法。因此,使用sec和tff来分离海芥菜来源外排体。具体地,通过boing et al(single-step isolation of extracellular vesicles by size-exclusion chromatography,j extracell vesicles,2014∶1-11)中公开的方法进行通过sec分离外排体。将12ml的sepharose cl-2b(sigma aldrich,st.louis,mo,usa)堆积在20ml注射器(bd plasticpakctm,san jose,ca)中,用pbs洗涤并平衡。将2ml样品加载到柱上,并使用pbs作为洗脱缓冲液收集级分。
[0076]
通过切向流过滤(tff)系统从收集的级分中分离外排体。具体地,在tff系统中从截止值为100至500kda的多过滤器的表面去除小于过滤器孔的其他杂质颗粒,并将含有海芥菜来源外排体的溶液浓缩。将以这种方式分离的外排体在-70℃或更低的温度下冷冻储存直至用于实验。
[0077]
(2)外排体特征的评价
[0078]
通过扫描电子显微镜(tem)确定了实施例3中分离的海芥菜来源外排体具有200nm或更小的圆形微观结构(图8),并且作为通过纳米粒子追踪分析(nta)证实每单位体积分离的外排体的颗粒数目的结果,确定了1
×
10
9~11
个外排体/1ml单位体积的浓度(图9)。
[0079]
另一方面,观察到通过比较例3的方法分离的海芥菜来源提取物中混合有与外排体相似的液泡,并因此证实通过sec和tff方法难以去除包含在植物提取物中的液泡。
