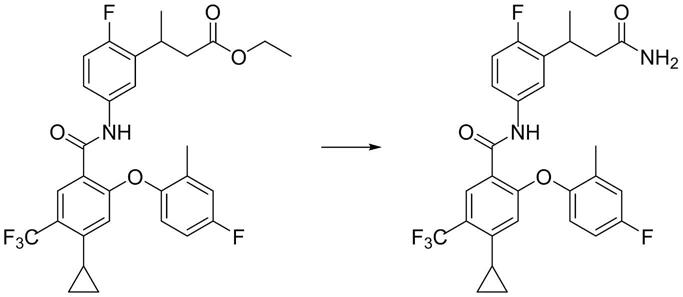
1.本发明涉及医药技术领域,特别是涉及一种用作电压门控钠离子通道亚型 nav1.8专一性抑制剂的化合物及其用途。
背景技术:
2.随着全球老龄化社会的到来,慢性疼痛疾病影响的范围已逐渐扩大,全球有三 分之一以上的人患有慢性疼痛,我国关节炎患者数量高达1.2亿;同时,我国至少 还有八九千万神经病理性慢疼痛患者,而且呈增长态势;另外,癌症最终也将成为 一种慢性病,癌痛将长期伴随着患者,据报道,中国半数以上的癌症患者并未接受 过癌痛治疗。疼痛本是动物或人体自我保护的一种机制,然而许多持续疼痛却超出 了其有用性,给患者身体或身心健康带来的极大的痛苦,疼痛治疗是改善症患者生 活质量的重要因素,市场前景也十分巨大。
3.2005年,全球止痛剂市场总量达800亿美元以上,处方药品销售额约为200亿 美元。根据美国国立卫生研究院(national institutes of health,nih)的统计估算, 美国有多达2500万人每天在于疼痛作斗争,其中有2300万的成年人患有严重的疼 痛。国内方面,随着我国制造业大国地位的不断提升,产业工人数量急剧膨胀,长 期的劳作容易导致各种机体劳损和关节疼痛,该群体已成为疼痛药物消费的另一个 大群体。资料显示:我国非处方药市场上止痛药增长迅速,其销售额仅次于感冒药, 约占20%的比例。
4.但是,阿片类止痛药物的滥用给社会造成了惊人的影响,据who估计,全球 每年有6.9万人死于阿片类药物过量,1500万人依赖阿片类药物(即阿片类药物成 瘾),开发新的安全有效的止痛药物的重要性不言而喻。
5.电压门控性钠离子通道(nav)的内向电流是中枢和外周神经元动作电位产生 和传导的重要环节,而神经元兴奋性增高或对刺激的反应性增加是各种疼痛产生发 展的重要机制。因此,电压门控性钠离子通道在疼痛传导通路特别是在外周感觉神 经元中的作用一直是疼痛研究的热点。
6.人类钠离子通道有9种,分别为nav1.1~nav1.9,nav1.5、nav1.8和nav1.9 是河豚毒素(tetrodotoxin,ttx)不敏感性钠通道,其中,nav1.8是参与慢性疼痛、 心房纤维性颤动、布加综合征的重要离子通道,是疼痛治疗的高选择性作用靶点。 nav1.8主要表达在小直径痛觉感受神经元,参与感觉神经元的动作电位和节律放 电。nav1.8受炎症性介质的调控,同时在坐骨神经损伤模型中上调表达,nav1.8 的基因敲除和沉默研究表明,其参与神经性和炎症性疼痛的调节。由于nav1.8主 要局限于感受疼痛的神经元,故选择性nav1.8阻断剂不大可能诱导非选择性nav 阻断剂所常见的不良反应。因此,针对nav1.8疼痛靶点进行专一性抑制剂筛选的 研究已成为疼痛领域的热点,但是,已知的nav抑制剂主要存在治疗窗带较差等缺 点,这可能是由于其缺乏亚型选择性而导致。
7.目前已知的nav1.8抑制剂有pf-01247324,a803467,pf-06305591以及vx150 等。其中,前三个化合物都因为选择性不够好,药代数据差,生物利用的低等问题 终止于临床
对映异构体、非对映异构体或其混合物形式、药学上可接受的水合物、溶剂化物或 盐:
[0020][0021]
本发明还提供了具有式iii或iii’所示结构或其异构体、互变异构体、内消旋体、 外消旋体、对映异构体、非对映异构体或其混合物形式、药学上可接受的水合物、 溶剂化物或盐:
[0022][0023]
a1选自cr1或n;a2选自nr
10r11
或or
12
;
[0024]
r1选自氢、卤素、羟基、氰基、氨基、取代或非取代的烷基、取代或非取代的 环烷基、取代或非取代的杂烷基、取代或非取代的杂环烷基、酯基、酰基、羧基、 酰胺基、磺酰基、磺酰胺基、硼酸基、硼酸酯基、磷酰基;
[0025]
r6、r7、r8、r9分别独立选自氢、卤素、羟基、氰基、氨基、取代或非取代的 烷基、取代或非取代的环烷基、取代或非取代的杂烷基、取代或非取代的杂环烷基、 取代或非取代的芳基、取代或非取代的杂芳基、酯基、酰基、羧基、酰胺基、磺酰 基、磺酰胺基、硼酸基、硼酸酯基、磷酰基、取代或非取代的烯基、取代或非取代 的炔基;其中,取代基选自氘、卤素、羟基、氨基、烷基、杂烷基、环烷基、杂环 烷基、氰基、酯基、酰基、羧基、酰胺基、芳基、杂芳基、磺酰基、磺酰胺基。
[0026]
进一步地,n选自0、1、2。
[0027]
进一步地,m选自0、1、2。
[0028]
进一步地,z选自0、1、2、3。
[0029]
其中,n、m、z三者的数值可以随意组合。
[0030]
r1选自氢、卤素、羟基、氰基、氨基、取代或非取代的烷基、取代或非取代的 环烷基、取代或非取代的杂烷基、取代或非取代的杂环烷基、取代或非取代的酰胺 基、酯基、酰基、羧基、磺酰基、磺酰胺基、硼酸基、硼酸酯基、磷酰基;其中, 取代基选自卤素、羟基、氨基、c1~c6烷基、3~6元环烷基、2~7元杂烷基、3~6 元杂环烷基、氰基、酯基、酰基、羧基、酰胺基、芳基、杂芳基、磺酰基、磺酰胺 基;
[0031]
其中,r1选自氢、卤素、羟基、氰基、氨基、取代或非取代的c1~c6烷基、取 代或非取代的3~6元环烷基、取代或非取代的2~7元杂烷基、取代或非取代的3~6 元杂环烷基、取代或非取代的酰胺基、酯基、酰基;其中,取代基选自卤素、羟基、 氨基、c1~c6烷基、3~6元环烷基、2~7元杂烷基、3~6元杂环烷基、氰基、酯基、 酰基、羧基、酰胺基、磺酰基、磺酰
胺基;
[0032]
进一步地,r1选自氢、卤素、取代或非取代的c1~c3烷基、取代或非取代的 2~4元杂烷基;其中,取代基选自卤素、羟基、氨基、c1~c3烷基、2~4元杂烷基、 酰基。
[0033]
进一步地,r1选自氢、卤素。
[0034]
更进一步地,r1选h,f。
[0035]
一方面,n为1或2,每一个r2独立选自氢、卤素、取代或非取代的c1~c3烷 基、取代或非取代的环丙基。
[0036]
进一步地,每一个r2独立选自氢、卤素、三氟甲基、取代或非取代的环丙基; 当n为1时,r2不为h;n为2时,两个r2不同时为h。
[0037]
一发明,m为2或3,每一个r3分别独立选自卤素、取代或非取代的烷基、取 代或非取代的环烷基、取代或非取代的杂烷基、取代或非取代的杂环烷基,其中, 取代基选自氘、c1~c6烷基、2~7元杂烷基、3~6元环烷基、3~6元杂环烷基、卤素、 羟基、酰胺基;每个r3不同。
[0038]
进一步地,每一个r3分别独立选自氢、卤素、取代或非取代c1~c6烷基、取 代或非取代c1~c6烷氧基,其中,取代基选自氘、卤素、c1~c6烷基、2~7元杂烷 基、3~6元环烷基、3~6元杂环烷基、羟基、酰胺基。
[0039]
更进一步地,每一个r3分别独立选自卤素、取代或非取代的c1~c3烷基、取 代或非取代c1~c3烷氧基。
[0040]
进一步地,r4与r5及其相连的原子组成环烷基或杂环烷基时,可以是相邻两个 取代位点的r4与r5及其相连的原子组成环烷基或杂环烷基(如组成), 或不相邻两个取代位点的r4与r5及其相连的原子组成环烷基或杂环烷基(如组成),或同一取代位点的r4与r5及其相连的原子组成环烷基或杂环烷基 (如组成)。
[0041]
r4与r5及其相连的原子组成=o,即同一取代位点的r4与r5及其相连的原子 组成羰基(组成)。
[0042]
一方面本发明还提供了具有式iv、iv’或iv”所示结构或其异构体、互变异构体、 内消旋体、外消旋体、对映异构体、非对映异构体或其混合物形式、药学上可接受 的水合物、溶剂化物或盐:
[0043][0044]
其中,
[0045]
a1选自n或-cr1;r
15
、r
16
分别独立选自氢、c1-c3烷基,进一步选自氢、甲 基;
[0046]r17
选自c1-c5的酰胺基、含有内酰胺的四元或五元杂环,至少含有羟基或氨 基取
代的c1-c5烷基,或者r
15
、r
16
其中之一与r
17
及其相连的原子组成 z3选自0、1或2;r
17
进一步选自c1-c3的酰胺基、含有内酰胺的四元或五元杂环, 至少含有羟基或氨基取代的c1-c3烷基,或者r
15
、r
16
其中之一与r
17
及其相连的 原子组成z3选自0、1或2;
[0047]r19
选自r
13
、r
14
分别独立选自氢、酰基、取代或非取代 的烷基、取代或非取代的环烷基、取代或非取代的杂环烷基、取代或非取代的杂芳 基,z1、z2分别独立为1-5。
[0048]
进一步地,r
13
、r
14
分别独立选自氢、酰基、c1-c5烷基或环烷基、 噻唑。
[0049]
另一方面,本发明还提供了具有式v或v’所示结构或其异构体、互变异构体、 内消旋体、外消旋体、对映异构体、非对映异构体或其混合物形式、药学上可接受 的水合物、溶剂化物或盐:
[0050][0051]
其中,a1、a3选自cr1;或者,a1选自n,a3选自n或cr1;
[0052]r20
分别独立选自氢、酰基、c1-c5烷基或环烷基、噻唑。
[0053]
本发明还提供一种药用组合物,该药用组合物活性成份选自权利要求1~21任一 权利要求所述的化合物或其立体异构体、溶剂化物、水合物、药学上可接受的盐或 共晶中的一种或两种以上的组合。
[0054]
本发明还提供了本发明化合物或其立体异构体、溶剂化物、水合物、药学上可 接受的盐或共晶在制备钠离子通道调节剂中的用途。
[0055]
进一步地,所述钠离子通道调节剂为nav1.8抑制剂。
[0056]
本发明还提供了本发明化合物或其立体异构体、溶剂化物、水合物、药学上可 接受的盐或共晶在制备治疗致使nav1.8过度表达的疾病的药物中的用途。
[0057]
本发明还提供了本发明化合物或其立体异构体、溶剂化物、水合物、药学上可 接受的盐或共晶在制备治疗nav1.8过度表达所致疾病的药物中的用途。
[0058]
本发明还提供了本发明化合物或其立体异构体、溶剂化物、水合物、药学上可 接受的盐或共晶在制备用于治疗慢性疼痛、肠痛、神经性疼痛、肌肉骨骼痛、急性 疼痛、炎性疼痛、癌症疼痛、原发性疼痛、多发性硬化症、夏-马-图三氏综合症、 失禁和心律失常中的任意一种或多种疾病的药物中的用途。
[0059]
进一步地,所述神经性疼痛选自疱疹后神经痛、糖尿病性神经痛、痛性hiv相 关性
感觉神经病、三叉神经痛、口灼伤综合症、截肢术后疼痛、幻痛、痛性神经瘤、 创伤性神经瘤、morton神经瘤、神经挤压损伤、脊管狭窄、腕管综合症、神经根痛、 坐骨神经痛、神经撕脱伤、臂丛撕脱伤、复杂性区域疼痛综合症、药物疗法引起的 神经痛、癌症化学疗法引起的神经痛、抗逆转录病毒疗法引起的神经痛、脊髓损伤 后疼痛、原发性小纤维神经病、原发性感觉神经病、三叉自主神经性头痛中的一种 或几种;
[0060]
所述肌肉骨骼痛选自骨关节炎疼痛、背痛、冷痛、烧伤疼痛、牙痛中的一种或 几种;
[0061]
所述炎性疼痛痛选自类风湿性关节炎疼痛和/或外阴痛;
[0062]
所述原发性疼痛选自纤维肌痛。
[0063]
含有本发明化合物或其立体异构体、溶剂化物、水合物、药学上可接受的盐或 共晶的药物组合物中,可以含有药学上可接受的辅料。
[0064]
本发明中所述“药学上可接受的”是指包括任意不干扰活性成分的生物活性的有 效性且对它被给予的宿主无毒性的物质。
[0065]
本发明所述药学上可接受的辅料,是药物中除主药以外的一切附加材料的总称, 辅料应当具备如下性质:(1)对人体无毒害作用,几无副作用;(2)化学性质稳 定,不易受温度、ph、保存时间等的影响;(3)与主药无配伍禁忌,不影响主药 的疗效和质量检查;(4)不与包装材料相互发生作用。本发明中辅料包括但不仅限 于填充剂(稀释剂)、润滑剂(助流剂或抗粘着剂)、分散剂、湿润剂、粘合剂、 调节剂、增溶剂、抗氧剂、抑菌剂、乳化剂、崩解剂等。粘合剂包含糖浆、阿拉伯 胶、明胶、山梨醇、黄芪胶、纤维素及其衍生物(如微晶纤维素、羧甲基纤维素钠、 乙基纤维素或羟丙甲基纤维素等)、明胶浆、糖浆、淀粉浆或聚乙烯吡咯烷酮等; 填充剂包含乳糖、糖粉、糊精、淀粉及其衍生物、纤维素及其衍生物、无机钙盐(如 硫酸钙、磷酸钙、磷酸氢钙、沉降碳酸钙等)、山梨醇或甘氨酸等;润滑剂包含微 粉硅胶、硬脂酸镁、滑石粉、氢氧化铝、硼酸、氢化植物油、聚乙二醇等;崩解剂 包含淀粉及其衍生物(如羧甲基淀粉钠、淀粉乙醇酸钠、预胶化淀粉、改良淀粉、 羟丙基淀粉、玉米淀粉等)、聚乙烯吡咯烷酮或微晶纤维素等;湿润剂包含十二烷 基硫酸钠、水或醇等;抗氧剂包含亚硫酸钠、亚硫酸氢钠、焦亚硫酸钠、二丁基苯 酸等;抑菌剂包含0.5%苯酚、0.3%甲酚、0.5%三氯叔丁醇等;调节剂包含盐酸、枸 橼酸、氢氧化钾(钠)、枸橼酸钠及缓冲剂(包括磷酸二氢钠和磷酸氢二钠)等; 乳化剂包含聚山梨酯-80、没酸山梨坦、普流罗尼克f-68,卵磷酯、豆磷脂等;增溶 剂包含吐温-80、胆汁、甘油等。
[0066]
术语“药学上可接受的盐”指本发明化合物与酸或碱所形成的适合用作药物的 盐。上述酸碱为广义的路易斯酸碱。适合形成盐的酸包括但并不限于:盐酸、氢溴 酸、氢氟酸、硫酸、硝酸、磷酸等无机酸,甲酸、乙酸、丙酸、草酸、丙二酸、琥 珀酸、富马酸、马来酸、乳酸、苹果酸、酒石酸、柠檬酸、苦味酸、甲磺酸、苯甲 磺酸,苯磺酸等有机酸;以及天冬氨酸、谷氨酸等酸性氨基酸。
[0067]
本发明化合物或药物组合物的施用方式没有特别限制,代表性的施用方式包括 (但并不限于):口服、肠胃外(静脉内、肌肉内或皮下)、和局部给药。
[0068]
用于口服给药的固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂。在这些固 体剂型中,活性化合物与至少一种常规惰性赋形剂(或载体)混合,如柠檬酸钠或磷 酸二钙,或与下述成分混合:(a)填料或增容剂,例如,淀粉、乳糖、蔗糖、葡萄糖、 甘露醇和硅酸;(b)粘
对映体),对映异构体都有旋光性,其中一个是左旋的,一个是右旋的,所以对映异 构体又称为旋光异构体。
[0081]
非对映异构体(diastereoisomers)是指分子具有两个或多个手性中心,并且分子 间为非镜像的关系的立体异构体。
[0082]“取代”是指分子中的氢原子被其它不同的原子或分子所替换。
[0083]“元”是表示构成环或杂烷基的骨架原子的个数。
[0084]
本发明中所述“一键”,指该处仅为一个连接键,亦可理解为“无”。
[0085]“烷基”,是指脂肪族烃基团,指饱和烃基。烷基部分可以是直链烷基,亦可 以是支链烷基。典型的烷基包括但不限于甲基、乙基、丙基、异丙基、丁基、异丁 基、叔丁基、戊基、己基等等。
[0086]
本发明中使用的c1~cn包括c1~c2、c1~c3
……
c1~cn,n为大于一的整数; 作为取代基的前缀表示取代基中碳原子个数的最小值和最大值,例如,“c1~c6烷 基”是指含有一个至6个碳原子的直链或支链的烷基。
[0087]“杂烷基”是指含有杂原子的烷基,包括烷氧基。
[0088]“烯基”,是指具有至少一个碳-碳双键的脂肪族碳氢基团。所的烯基可以是直 链或支链的。
[0089]“炔基”,是指具有至少一个碳-碳三键的脂肪族碳氢基团。所述炔基可以 是直链或支链的。
[0090]“酰胺基”是具有式-c(o)nhr或-nhc(o)r的化学结构,其中r可选自烷基、 杂烷基、环烷基、杂环烷基、芳基、杂芳基等。
[0091]“磺酰基”是具有式-s(=o)2r的化学结构,包括磺酰胺基,其中r可选自烷基、 杂烷基、环烷基、杂环烷基、芳基、杂芳基、氨基等;
[0092]“磷酰基”是具有式-p(=o)rr’的化学结构,其中r、r’可别独立选自烷基、杂 烷基、环烷基、杂环烷基、芳基、杂芳基、羟基、氨基等;
[0093]“酯基”是指具有式-coor的化学结构,其中r选自烷基、杂烷基、环烷基、 杂环烷基、芳基、杂芳基等。
[0094]“酰基”是指具有式-c(o)r的化学结构,其中r选自烷基、杂烷基、环烷基、 杂环烷基、芳基、杂芳基等。
[0095]“环烷基”指饱和或不饱和的环状烃取代基。
[0096]“杂环烷基”指环骨架上含有至少一个杂原子的环烷基。
[0097]
杂原子包括但不限于o、s、n、p、si等。
[0098]“环”是指任意的共价封闭结构,包括例如碳环(例如芳基或环烷基)、 杂环(例如杂芳基或杂环烷基)、芳香基(如芳基或杂芳基)、非芳香基(如 环烷基或杂环烷基)。本发明中所述“环”可以是单环也可以是多环,可以是 并环、螺环或桥环。
[0099]
典型的环烷基包括但不限于:环丙基、环丁基、环戊基、环己基、等 等。
[0100]
典型的杂环烷基包括但不限于:
[0101][0102]“芳基”,是指平面环具有离域的π电子系统并且含有4n+2个π电子,其中n是 整数。芳基环可以由五、六、七、八、九或多于九个原子构成。芳基包括但不限于 苯基、萘基、菲基、蒽基、芴基和茚基等。
[0103]
典型的杂芳基包括但不限于:
[0104][0105]“卤素”或“卤”是指氟、氯、溴或碘。
[0106]“氘”是指氢(h)的同位素,也被称为重氢,元素符号一般为d或2h,可以 使用氘替代本发明h的位置。
[0107]
文中所述烷基、杂烷基、环基、杂环基、氨基、酯基、羰基、酰胺基、磺酰基、 磷酰基、硼酸基、硼酸酯基、芳基、杂芳基等,可以是非取代的烷基、杂烷基、环 基、杂环基、氨基、酯基、羰基、酰胺基、磺酰基、磷酰基、硼酸基、硼酸酯基、、 芳基、杂芳基,也可以是取代的烷基、杂烷基、环基、杂环基、氨基、酯基、羰基、 酰胺基、磺酰基、磷酰基、硼酸基、硼酸酯基、芳基、杂芳基、。
[0108]
上文中,除已经指明的外,所述“取代”是指所提及的基团可以被一个或多个 额外的基团取代,所述额外的基团各自并且独立地选自烷基、环烷基、芳基、羧基、 杂芳基、杂环烷基、羟基、烷氧基、烷硫基、芳氧基、o=、胍基、氰基、硝基、酰 基、卤素、卤代烷基、氨基等等。
[0109]
抑制剂,是指导致蛋白质生物活性降低的产品,如本发明化合物可以降低nav1.8 离子通道活性,即为nav1.8抑制剂。
[0110]
本发明的有益效果是:本发明提供了一系列对nav1.8离子通道活性具有明显的 抑制作用的化合物,为以nav1.8为治疗的靶点的疾病如慢性疼痛、肠痛、神经性疼 痛、肌肉骨骼痛、急性疼痛、炎性疼痛、癌症疼痛、原发性疼痛、多发性硬化症、 夏-马-图三氏综合症、失禁或心律失常疾病等的治疗提供新的方案,可用于制备治 疗相关疾病的药物,具有广阔的应用前景。
具体实施方式
[0111]
下面对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本 发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技 术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护 的范围。
[0112]
本发明中,化合物的结构是通过质谱(ms)和/或核磁共振(1hnmr)设备来确定 的。
化学缩写简称具有以下意义:
[0113]
dmf:n,n-二甲基甲酰胺
[0114]
thf:四氢呋喃
[0115]
diad:偶氮二甲酸二异丙酯
[0116]
dipea:n,n-二异丙基乙胺
[0117]
pe:石油醚
[0118]
ea:乙酸乙酯
[0119]
dcm:二氯甲烷
[0120]
hatu:o-(7-氮杂苯并三唑-1-基)-n,n,n
′
,n
′‑
四甲基脲
[0121]
dmso:二甲基亚砜
[0122]
dast:二乙胺基三氟化硫
[0123]
tbaf:四丁基氟化铵
[0124]
nmp:n-甲基吡咯烷酮
[0125]
cdi:n,n'-羰基二咪唑
[0126]
lihmds:双三甲基硅基胺基锂
[0127]
中间体合成
[0128]
中间体1
[0129]
2-(4-氟-2-甲基苯氧基)-4-(三氟甲基)苯甲酸
[0130][0131]
步骤1:2-氟-4-(三氟甲基)苯甲酸甲酯的合成
[0132]
向反应瓶中加入2-氟-4-(三氟甲基)苯甲酸(2.08g,10mmol),碳酸钾(2.76g, 20mmol)和20ml乙腈,室温下加入碘甲烷(1.70g,12mmol),该反应混合物加热 至回流搅拌6小时,tlc显示反应完全。反应体系降温至室温后过滤,滤液旋干, 得到2.10g目标产物,收率:95%。
[0133]
步骤2:2-(4-氟-2-甲基苯氧基)-4-(三氟甲基)苯甲酸甲酯的合成
[0134]
向反应瓶中加入2-氟-4-(三氟甲基)苯甲酸甲酯(1.11g,5mmol),4-氟-2-甲基 苯酚(0.63g,5mmol),碳酸钾(1.38g,10mmol)和10mln-甲基吡咯烷酮,该反应 混合物加热至120℃搅拌20小时,tlc显示反应完全。反应体系降温至室温后倒 入50ml水中,乙酸乙酯萃取,有机相干燥并旋干后经硅胶柱层析纯化 (pe/ea=20/1),得到1.3g目标产物,收率:79%。
[0135]
步骤3:2-(4-氟-2-甲基苯氧基)-4-(三氟甲基)苯甲酸的合成
[0136]
向反应瓶中加入2-(4-氟-2-甲基苯氧基)-4-(三氟甲基)苯甲酸甲酯(656mg, 2mmol),氢氧化钠(320mg,8mmol),10ml水和10ml甲醇,该反应混合物于室 温下搅拌8小时,tlc显示反应完全。反应体系倒入50ml水中,用1m的盐酸调 节ph值至5,乙酸乙酯萃取,有机相干燥并旋干,得到620mg目标产物,收率: 99%。
[0137]
中间体2
[0138]
2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸
[0139][0140]
操作与中间体1一致。
[0141]
中间体3
[0142]
4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸
[0143][0144]
步骤1:4-溴-2-氟-5-(三氟甲基)苯胺的合成
[0145]
将2-氟-5-(三氟甲基)苯胺(3.58g,20mmol)溶于50ml dmf,室温下加入 nbs(3.56g,20mmol),该反应混合物室温搅拌过夜。反应体系倒入200ml水中, 乙酸乙酯萃取,有机相干燥并旋干后经硅胶柱层析纯化(pe/ea=2/1),得到4.80g 目标产物,收率:93%。
[0146]
步骤2:4-环丙基-2-氟-5-(三氟甲基)苯胺的合成
[0147]
向反应瓶中加入4-溴-2-氟-5-(三氟甲基)苯胺(2.58g,10mmol),环丙基硼酸 (3.44g,40mmol),碳酸钠(5.30g,50mmol)和30ml dmf,置换氮气后加入 pd(dppf)cl2(220mg,0.3mmol),该反应混合物在氮气保护下加热至90℃搅拌过夜。 反应体系降温至室温后倒入200ml水中,乙酸乙酯萃取,有机相干燥并旋干后经 硅胶柱层析纯化(pe/ea=2/1),得到1.62g目标产物,收率:74%。
[0148]
步骤3:1-碘-4-环丙基-2-氟-5-(三氟甲基)苯的合成
[0149]
将4-环丙基-2-氟-5-(三氟甲基)苯胺(1.10g,5mmol)溶于15ml乙腈,0℃ 下滴加亚硝酸异戊酯(0.70g,6mmol),加毕后体系室温搅拌1小时。加入碘化钾(1.66 g,10mmol)的5ml水溶液,该反应混合物室温搅拌6小时。反应体系倒入50ml 水中,乙酸乙酯萃取,有机相依次用1m的稀盐酸,1m的碳酸钠水溶液及饱和食盐 水反洗,干燥并旋干后得到1.05g目标产物,收率:61%。
[0150]
步骤4:4-环丙基-2-氟-5-(三氟甲基)苯甲酸的合成
[0151]
将1-碘-4-环丙基-2-氟-5-(三氟甲基)苯(660mg,2mmol)及三乙胺(404mg,4 mmol)溶于dmf/h2o(10ml/1ml),加入pd(dppf)cl2(73mg,0.1mmol),用一氧 化碳置换体系中的空气后,该反应混合物在1m pa压力的一氧化碳下加热至90℃ 搅拌过夜。反应体系降温至室温后倒入50ml水中,乙酸乙酯萃取,有机相干燥并 旋干后经硅胶柱层析纯化(dcm/
meoh=10/1),得到190mg目标产物,收率:38%。
[0152]
步骤5:4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸的合成
[0153]
以上步产物为底物,通过与中间体1一致的方法得到中间体3化合物
[0154]
中间体4
[0155]
5-氯-2-(4-氟-2-甲基苯氧基)-4-(三氟甲基)苯甲酸
[0156][0157]
步骤1:4-溴-2-氟-5-(三氟甲基)苯胺的合成
[0158]
将1-氯-4-氟-2-(三氟甲基)苯(2.0g,10.1mmol)溶于20ml干燥的thf,体系于 氮气保护下降温至-70℃,滴加2,2,6,6-四甲基哌啶锂(11.1ml,1.0m正己烷溶液, 11.1mmol),反应液继续于-70℃搅拌0.5小时后,加入过量干冰。自然升至室温, 加入100ml水,盐酸调节体系至酸性,乙酸乙酯萃取,有机相干燥并旋干后经硅 胶柱层析纯化(dcm/meoh=20/1),得到1.8g目标产物,收率:75%。
[0159]
步骤2:5-氯-2-(4-氟-2-甲基苯氧基)-4-(三氟甲基)苯甲酸的合成
[0160]
以上步产物为底物,通过与中间体1一致的方法得到中间体3化合物
[0161]
实施例1
[0162]
n-(3-(1,3-二氨基-3-氧代丙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三 氟甲基)苯甲酰胺
[0163][0164]
步骤1:3-氨基-3-(2-氟-5-硝基苯基)丙酸的合成
[0165]
向反应瓶中加入2-氟-5-硝基苯甲醛(2000mg,11.8mmol),丙二酸(1477mg,14.2 mmol),乙酸铵(1823mg,10mmol)和20ml乙醇,该反应混合物加热至80℃搅拌 过夜,tlc显示反应完全。反应体系降温至室温后过滤,滤饼用乙醇洗涤三次,所 得固体旋干,得到约3000mg黄色固体,粗品直接用于下一步反应。
[0166]
步骤2:3-((叔丁氧羰基)氨基)-3-(2-氟-5-硝基苯基)丙酸的合成
[0167]
向反应瓶中加入3-氨基-3-(2-氟-5-硝基苯基)丙酸(3000mg,粗品),(boc)2o(4716 mg,21.6mmol)和30ml水,加入氢氧化钠(1154mg,28.9mmol),反应混合物室温 搅拌过夜,反应体系直接旋干,经硅胶柱层析纯化(dcm/meoh=20/1),得到780 mg淡黄色固体,两步收率:20%。
[0168]
步骤3:(3-氨基-1-(2-氟-5-硝基苯基)-3-氧代丙基)氨基甲酸叔丁酯的合成
[0169]
向反应瓶中加入3-((叔丁氧羰基)氨基)-3-(2-氟-5-硝基苯基)丙酸(100mg, 0.35mmol),氯化铵(185mg,3.5mmol),dipea(89mg,0.69mmol)和2ml四氢呋 喃,加入hbtu(261mg,0.69mmol),反应混合物室温搅拌过夜。反应体系倒入10 ml水中,乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化(dcm/meoh=20/1), 得到75mg淡黄色固体,收率:75%。
[0170]
步骤4:(3-氨基-1-(5-氨基-2-氟苯基)-3-氧代丙基)氨基甲酸叔丁酯的合成
[0171]
向反应瓶中加入(3-氨基-1-(2-氟-5-硝基苯基)-3-氧代丙基)氨基甲酸叔丁酯 (75mg,0.23mmol)和2ml乙醇,加入10%的pd/c(50mg),反应体系于氢气氛围 下室温搅拌过夜。抽滤,乙醇洗涤滤饼,滤液旋干后得到70mg白色固体,收率: 103%。
[0172]
步骤5:叔丁基(3-氨基-1-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺基)苯基)-3-氧代丙基)氨基甲酸酯的合成
[0173]
向反应瓶中加入2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(89mg,0.28 mmol),(3-氨基-1-(5-氨基-2-氟苯基)-3-氧代丙基)氨基甲酸叔丁酯(70mg,0.23 mmol),dipea(61mg,0.47mmol)和2ml四氢呋喃,加入hbtu(179mg,0.47 mmol),反应混合物室温搅拌过夜。反应体系倒入10ml水中,乙酸乙酯萃取,有 机相干燥并旋干,经prep-tlc纯化(dcm/meoh=50/1),得到50mg淡黄色固体, 收率:36%。
[0174]
步骤6:n-(3-(1,3-二氨基-3-氧代丙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰的合成
[0175]
将叔丁基(3-氨基-1-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲 酰胺基)苯基)-3-氧代丙基)氨基甲酸酯(50mg,0.084mmol)溶于2ml二氯甲烷, 室温下加入三氟乙酸(2ml)后搅拌过夜。反应体系倒入10ml水中,碳酸钠调节 ph值至碱性,乙酸乙酯萃取,有机相干燥并旋干后经prep-tlc纯化 (dcm/meoh=20/1),得到8mg白色固体,收率:20%。
[0176]
lc/ms:m/z=494.2[m+h]
+
.
[0177]
1h nmr(400mhz,d
6-dmso)δ2.16(3h,s),2.53-2.55(2h,m),4.46(1h,brs), 6.77(1h,d,j=8.4hz),7.10-7.24(4h,m),7.17-7.19(1h,m),7.27(1h,d,j=8.8hz), 7.80-7.85(1h,m),7.95(1h,s),10.61(1h,s).
[0178]
实施例2
[0179]
3-氨基-3-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)苯 基)丙酸
[0180][0181]
步骤1:3-(5-氨基-2-氟苯基)-3-((叔丁氧基羰基)氨基)丙酸的合成
[0182]
向反应瓶中加入3-((叔丁氧羰基)氨基)-3-(2-氟-5-硝基苯基)丙酸(100mg, 0.34mmol)和5ml乙醇,加入10%的pd/c(70mg),反应体系于氢气氛围下室温搅 拌过夜。抽滤,乙醇洗涤滤饼,滤液旋干后得到95mg白色固体,收率:100%。
[0183]
步骤2:3-((叔丁氧基羰基)氨基)-3-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺基)苯基)丙酸的合成
[0184]
向反应瓶中加入2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(110mg,0.0.35 mmol)和2ml氯化亚砜,80℃搅拌2小时后旋干,所得固体溶于2ml四氢呋喃后 室温滴加到含有3-(5-氨基-2-氟苯基)-3-((叔丁氧基羰基)氨基)丙酸(95mg, 0.31mmol)和dipea(82mg,0.64mmol)的1ml四氢呋喃溶液中,反应混合物室温 搅拌2小时。倒入10ml水中,乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc 纯化(dcm/meoh=20/1),得到100mg淡黄色固体,收率:53%。
[0185]
步骤3:(3-氨基-3-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲 酰胺基)苯基)丙酸的合成
[0186]
将3-((叔丁氧基羰基)氨基)-3-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三 氟甲基)苯甲酰胺基)苯基)丙酸(100mg,0.17mmol)溶于1ml二氯甲烷,室温 下加入三氟乙酸(1ml)后搅拌过夜。反应体系倒入10ml水中,碳酸钠调节ph值 至碱性,乙酸乙酯萃取,有机相干燥并旋干后经prep-tlc纯化(dcm/meoh=20/1), 得到9mg白色固体,收率:11%。
[0187]
lc/ms:m/z=495.1[m+h]
+
.
[0188]
1h nmr(400mhz,d
6-dmso)δ2.16(3h,s),2.47-2.49(2h,m),4.45(1h,brs), 6.78(1h,d,j=8.4hz),7.10-7.24(5h,m),7.17-7.19(1h,m),7.25(1h,d,j=8.4hz), 7.82-7.85(1h,m),7.95(1h,s),10.55(1h,s),13.08(1h,brs).
[0189]
实施例3
[0190]
n-(3-(1-氨基-3-羟丙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺
[0191][0192]
步骤1:(1-(2-氟-5-硝基苯基)-3-羟丙基)氨基甲酸叔丁酯的合成
[0193]
将3-((叔丁氧羰基)氨基)-3-(2-氟-5-硝基苯基)丙酸(50mg,0.15mmol) 溶于1ml四氢呋喃,0℃下加入硼烷四氢呋喃溶液(1m,1ml),该反应混合物室 温搅拌过夜。反应体系倒入10ml水中,乙酸乙酯萃取,有机相干燥并旋干后经 prep-tlc纯化(dcm/meoh=30/1),得到30mg白色固体,收率:63%。
[0194]
步骤2:(1-(5-氨基-2-氟苯基)-3-羟丙基)氨基甲酸叔丁酯的合成
[0195]
向反应瓶中加入(1-(2-氟-5-硝基苯基)-3-羟丙基)氨基甲酸叔丁酯(30mg, 0.096mmol)和2ml乙醇,加入10%的pd/c(20mg),反应体系于氢气氛围下室温搅 拌过夜。抽滤,乙醇洗涤滤饼,滤液旋干后得到25mg白色固体,收率:93%。
[0196]
步骤3:(1-(5-(4-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲 酰胺基)-2-氟苯基)-3-羟丙基)氨基甲酸叔丁酯的合成
[0197]
向反应瓶中加入4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(30 mg,0.085mmol),1-(5-氨基-2-氟苯基)-3-羟丙基)氨基甲酸叔丁酯(25mg,0.088 mmol),dipea(23mg,0.18mmol)和2ml四氢呋喃,加入hatu(67mg,0.18mmol), 反应混合物室温搅拌过夜。反应体系倒入10ml水中,乙酸乙酯萃取,有机相干燥 并旋干,经prep-tlc纯化(dcm/
meoh=50/1),得到35mg白色固体,收率:66%。
[0198]
步骤4:n-(3-(1-氨基-3-羟丙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺的合成
[0199]
将(1-(5-(4-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺 基)-2-氟苯基)-3-羟丙基)氨基甲酸叔丁酯(35mg,0.056mmol)溶于1ml二氯甲 烷,室温下加入三氟乙酸(1ml)后搅拌过夜。反应体系倒入10ml水中,碳酸钠 调节ph值至碱性,乙酸乙酯萃取,有机相干燥并旋干后经prep-tlc纯化 (dcm/meoh=20/1),得到18mg白色固体,收率:62%。
[0200]
lc/ms:m/z=521.2[m+h]
+
.
[0201]
1h nmr(400mhz,d
6-dmso)δ0.55-0.57(2h,m),1.01-1.04(2h,m),1.79-1.82 (2h,m),2.12-2.14(1h,m),2.16(3h,s),3.37-3.40(2h,m),4.14-4.17(1h,m),6.35(1h, s),7.02-7.12(3h,m),7.20(1h,d,j=8.4hz),7.49-7.52(1h,m),7.74-7.76(1h,m), 7.90(1h,s),10.43(1h,s).
[0202]
实施例4
[0203]
n-(3-(1,3-二氨基-2-甲基-3-氧代丙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰胺
[0204][0205]
步骤1:(3-氨基-3-(2-氟-5-硝基苯基)-2-甲基丙酸的合成
[0206]
向反应瓶中加入2-氟-5-硝基苯甲醛(2000mg,11.8mmol),2-甲基丙二酸(1676 mg,14.2mmol),乙酸铵(1823mg,10mmol)和20ml乙醇,该反应混合物加热至 80℃搅拌过夜,tlc显示反应完全。反应体系降温至室温后过滤,滤饼用乙醇洗 涤三次,所得固体用prep-hplc纯化,得到620mg白色固体,收率:23%。
[0207]
步骤2:n-(3-(1,3-二氨基-2-甲基-3-氧代丙基)-4-氟苯基)-2-(4-氟-2-甲基 苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0208]
以上一步产物及其它试剂为原料,用与实施例1相同的方法可制备得到实施例 4化合物。
[0209]
lc/ms:m/z=508.2[m+h]
+
.
[0210]
1h nmr(400mhz,d
6-dmso)δ1.04(3h,d,j=7.2hz),2.16(3h,s),2.48-2.53 (1h,m),4.25(1h,d,j=6.0hz),6.70(1h,s),6.81(1h,d,j=8.4hz),7.07-7.30(5h, m),7.60-7.64(1h,m),7.76-7.79(2h,m),7.96(1h,d,j=2.4hz),10.51(1h,s).
[0211]
实施例5
[0212]
n-(3-(1-氨基-3-甲氧基丙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰胺
[0213][0214]
步骤1:(叔丁基(1-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺基)-2-氟苯基)-3-甲氧基丙基)氨基甲酸酯的合成
[0215]
向反应瓶中加入1-(5-(4-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺基)-2-氟苯基)-3-羟丙基)氨基甲酸叔丁酯(100mg,0.16mmol), dipea(41mg,0.32mmol)和5ml二氯甲烷,室温滴加甲基黄酰氯(22mg,0.19 mmol),反应混合物室温搅拌1小时。反应体系旋干,加入5ml甲醇钠的甲醇溶液 (7m),体系升温至70℃搅拌过夜。反应液倒入10ml水中,乙酸乙酯萃取,有 机相干燥并旋干得到80mg黄色油状物,直接用于下一步反应。
[0216]
步骤2:(n-(3-(1-氨基-3-甲氧基丙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲 基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0217]
将(叔丁基(1-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲 酰胺基)-2-氟苯基)-3-甲氧基丙基)氨基甲酸酯(70mg,上步粗品)的2ml氯化氢 /二氧六环溶液(2m)室温搅拌2小时,体系旋干加入10ml水中,碳酸钠调节ph 值至碱性,乙酸乙酯萃取,有机相干燥并旋干后经prep-hplc纯化,得到3mg白 色固体,两步收率:4%。
[0218]
lc/ms:m/z=535.2[m+h]
+
.
[0219]
1h nmr(400mhz,d
6-dmso)δ0.56-0.57(2h,m),1.02-1.04(2h,m),1.74-1.76 (2h,m),2.13-2.15(1h,m),2.16(3h,s),3.19(3h,s),3.20-3.30(2h,m),4.14-4.16(1h, m),6.35(1h,s),7.05-7.10(3h,m),7.20(1h,d,j=8.8hz),7.49-7.52(1h,m), 7.74-7.76(1h,m),7.90(1h,s),10.37(1h,s).
[0220]
实施例6
[0221]
n-(3-(1-乙酰氨基-3-羟丙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰胺
[0222][0223]
向n-(3-(1-氨基-3-羟丙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ-5-(三氟甲基)苯甲酰胺
[0240]
实施例10
[0241]
n-(3-(2-氨基-1-(甲基氨基)-2-氧代乙基)-4-氟苯基)-4-环丙基-2-(4-氟-2
‑ꢀ
甲基苯氧基)-5-(三氟甲基)苯甲酰胺
[0242][0243]
步骤1:n-(3-乙酰基-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟 甲基)苯甲酰胺的合成
[0244]
向4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(81mg,0.23mmol), 5-氨基-2-氟苯乙酮(70mg,0.46mmol)和dipea(89mg,0.69mmol)的3mldmf溶 液中加入hatu(175mg,0.46mmol),反应混合物室温搅拌过夜。反应体系倒入10 ml水中,乙酸乙酯萃取,有机相干燥并旋干,经tlc纯化(pe/ea=10/1),得到 125mg白色固体。
[0245]
步骤2:2-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)
ꢀ‑
2-氟苯基)-2-氧代乙酸的合成
[0246]
向n-(3-乙酰基-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺(125mg,0.26mmol)的3ml吡啶溶液中加入二氧化硒(57mg,0.51 mmol),反应混合物于100℃搅拌过夜。反应体系旋干后加入10ml水,用1m稀 盐酸调节ph值至酸性,乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化 (dcm/meoh=10/1),得到100mg白色固体,收率:75%。
[0247]
步骤3:n-(3-(2-氨基-2-氧代乙酰基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基 苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0248]
向4-环丙基-2-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰 胺基)-2-氟苯基)-2-氧代乙酸(100mg,0.19mmol),氯化铵(102mg,1.9mmol) 和dipea(50mg,0.38mmol)的3ml dmf溶液中加入hatu(144mg,0.38mmol), 反应混合物室温搅拌过夜。反应体系倒入10ml水中,乙酸乙酯萃取,有机相干燥 并旋干,经prep-tlc纯化(pe/ea=10/1),得到50mg白色固体,收率:50%。
[0249]
步骤4:4-环丙基-n-(3-(1,2-二氨基-2-氧代乙基)-4-氟苯基)-2-(4-氟-2-甲 基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0250]
将n-(3-(2-氨基-2-氧代乙酰基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺(50mg,0.096mmol)和盐酸羟胺(27mg,0.38mmol) 的3ml甲醇溶
液于60℃搅拌20分钟。加入乙酸钠(32mg,0.38mmol),反应混 合物自然冷却至室温后加入2ml甲酸以及100mg锌粉,室温搅拌2小时。反应体 系倒入10ml水中,乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化 (dcm/meoh=10/1),得到12mg白色固体,收率:25%。
[0251]
lc/ms:m/z=520.2[m+h]
+
.
[0252]
1h nmr(400mhz,d
6-dmso)δ0.55-0.57(2h,m),1.01-1.04(2h,m),2.10-2.12 (1h,m),2.14(3h,s),4.48(1h,s),6.33(1h,s),7.07-7.13(3h,m),7.18-7.22(2h,m), 7.46(1h,s),7.55-7.58(1h,m),7.68-7.71(1h,m),7.89(1h,s),10.44(1h,s).
[0253]
步骤5:n-(3-(2-氨基-1-(甲基氨基)-2-氧代乙基)-4-氟苯基)-4-环丙基-2
‑ꢀ
(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0254]
向4-环丙基-n-(3-(1,2-二氨基-2-氧代乙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺(10mg,0.019mmol)及碳酸钾(6mg,0.043mmol)的2 ml乙腈溶液中加入碘甲烷(2.6mg,0.018mmol),室温搅拌6小时后体系加入10ml 水中,乙酸乙酯萃取,有机相干燥并旋干后经prep-hplc纯化得到4mg白色固体, 收率:33%。。
[0255]
lc/ms:m/z=534.2[m+h]
+
.
[0256]
1h nmr(400mhz,d
6-dmso)δ0.55-0.57(2h,m),1.02-1.04(2h,m),2.10-2.12 (1h,m),2.14(3h,s),2.22(3h,s),4.20(1h,s),6.33(1h,s),7.07-7.27(5h,m),7.47 (1h,s),7.55-7.58(1h,m),7.68-7.71(1h,m),7.90(1h,s),10.42(1h,s).
[0257]
实施例11
[0258]
n-(3-(1-氨基-2-羟乙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺
[0259][0260]
步骤1:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-羟基乙酰基)苯基)
ꢀ‑
5-(三氟甲基)苯甲酰胺的合成
[0261]
将2-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)-2
‑ꢀ
氟苯基)-2-氧代乙酸(52mg,0.1mmol)溶于1ml四氢呋喃,0℃下加入硼烷四氢 呋喃溶液(1m,1ml),该反应混合物室温搅拌2小时。反应体系倒入10ml水中, 乙酸乙酯萃取,有机相干燥并旋干后经prep-tlc纯化(dcm/meoh=30/1),得到 23mg白色固体,收率:45%。
[0262]
步骤2:n-(3-(1-氨基-2-羟乙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺的合成
[0263]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-羟基乙酰基)苯基)-5
‑ꢀ
(三氟甲基)苯甲酰胺(25mg,0.05mmol)和盐酸羟胺(14mg,0.2mmol)的2ml甲 醇溶液于60℃搅拌20分钟。加入乙酸钠(16mg,0.2mmol),反应混合物自然冷 却至室温后加入2ml甲酸以及100mg锌粉,室温搅拌2小时。反应体系倒入10ml 水中,乙酸乙酯萃取,有机相干燥并旋干,
经prep-tlc纯化(dcm/meoh=10/1), 得到7mg白色固体,收率:28%。
[0264]
lc/ms:m/z=507.2[m+h]
+
.
[0265]
1h nmr(400mhz,d
6-dmso)δ0.53-0.56(2h,m),1.01-1.05(2h,m),2.12-2.14 (1h,m),2.15(3h,s),3.44-3.47(2h,m),4.19-4.21(1h,m),6.37(1h,s),7.03-7.12(3h, m),7.21(1h,d,j=8.4hz),7.50-7.52(1h,m),7.74-7.76(1h,m),7.90(1h,s),10.40 (1h,s).
[0266]
实施例12
[0267]
n-(3-(氨基甲基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲 酰胺
[0268]
实施例13
[0269]
n-(3-((((2-氨基-2-氧代乙基)氨基)甲基)-4-氟苯基)-2-(4-氟-2-甲基 苯氧基)-5-(三氟甲基)苯甲酰胺
[0270][0271]
步骤1:n-(3-氰基-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲 酰胺的合成
[0272]
向反应瓶中加入2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(94mg,0.3 mmol),5-氨基-2-氟苄腈(41mg,0.3mmol),dipea(77mg,0.6mmol)和2ml四氢 呋喃,加入hatu(190mg,0.5mmol),反应混合物室温搅拌过夜。反应体系倒入 10ml水中,乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化(pe/ea=3/1), 得到110mg白色固体,收率:85%。
[0273]
步骤2:n-(3-(氨基甲基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲 基)苯甲酰胺的合成
[0274]
向反应瓶中加入n-(3-氰基-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲 基)苯甲酰胺(110mg,0.25mmol)和2ml甲醇,加入10%的pd/c(30mg),反应体 系于氢气氛围(1mpa)下50℃搅拌过夜。抽滤,甲醇洗涤滤饼,滤液旋干后得到 100mg白色固体,收率:91%。
[0275]
lc/ms:m/z=437.1[m+h]
+
.
[0276]
1hnmr(400mhz,d
6-dmso)δ2.15(3h,s),3.73(2h,s),6.81(1h,d,j=8.4hz), 7.09-7.26(4h,m),7.57-7.59(1h,m),7.76-7.79(2h,m),7.97(1h,d,j=1.6hz),10.55 (1h,s).
[0277]
步骤3:n-(3-((((2-氨基-2-氧代乙基)氨基)甲基)-4-氟苯基)-2-(4
‑ꢀ
氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0278]
向n-(3-(氨基甲基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺(44mg,0.1mmol)及碳酸钾(28mg,0.2mmol)的2ml乙腈溶液中加入溴 乙酰胺(14mg,0.1mmol),室温搅拌过夜。抽滤,滤液旋干后经prep-tlc纯化 (pe/ea=1/1),得到15mg白色固体,收率:31%。
[0279]
lc/ms:m/z=494.1[m+h]
+
.
[0280]
1h nmr(400mhz,d
6-dmso)δ2.15(3h,s),3.06(2h,s),3.70(2h,s),6.81(1h, d,j
=8.8hz),7.08-7.27(6h,m),7.61-7.63(1h,m),7.76-7.78(2h,m),7.95(1h,s), 10.55(1h,s).
[0281]
实施例14
[0282]
n-(3-(1-氨基乙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯 甲酰胺
[0283][0284]
将n-(3-乙酰基-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺(45mg,0.1mmol,通过相应的原料,以与实施例9第一步类似的方法得 到)及0.1ml氨水的2ml四氢呋喃溶液搅拌6小时,加入三乙酰氧基硼氢化钠(42 mg,0.2mmol)。该反应混合物搅拌2小时后直接旋干,粗品经prep-tlc纯化 (pe/ea=1/1),得到6mg白色固体,收率:13%。
[0285]
lc/ms:m/z=451.1[m+h]
+
.
[0286]
1h nmr(400mhz,d
6-dmso)δ1.26(3h,d,j=6.4hz),2.15(3h,s),4.28(1h,q, j=6.4hz),6.82(1h,d,j=8.8hz),7.07-7.26(4h,m),7.56-7.60(1h,m),7.77(1h,dd, j=8.4hz,1.6hz),7.88(1h,dd,j=8.0hz,2.4hz),7.96(1h,d,j=2.4hz),10.52(1h, s).
[0287]
实施例15
[0288]
2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(吡咯烷-2-基)苯基)-5-(三氟甲基)苯 甲酰胺
[0289][0290]
步骤1:n-(3-溴-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰 胺的合成
[0291]
向反应瓶中加入2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(94mg,0.3 mmol),3-溴-4-氟苯胺(57mg,0.3mmol),dipea(77mg,0.6mmol)和2ml四氢呋 喃,加入hatu(190mg,0.5mmol),反应混合物室温搅拌过夜。反应体系倒入10ml 水中,乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化(pe/ea=10/1),得 到120mg白色固体,收率:82%。
[0292]
步骤2:2-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)苯 基)叔丁基-1-h-吡咯-1-甲酸叔丁酯的合成
[0293]
向反应瓶中加入n-(3-溴-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺(97mg,0.2mmol),(1-(叔丁氧羰基)-1h-吡咯-2-基)硼酸(42mg,0.2mmol), 碳酸钾(55mg,0.4mmol)和2ml dmf,置换氮气后加入pd(dppf)cl2(7mg,0.01 mmol),该反应混合物
氮气保护下加热至90℃搅拌6小时。反应体系降温至室温后 倒入10ml水中,乙酸乙酯萃取,有机相干燥并旋干后经prep-tlc纯化 (pe/ea=4/1),得到90mg白色固体,收率:79%。
[0294]
步骤3:2-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)苯 基)吡咯烷-1-羧酸叔丁酯的合成
[0295]
向反应瓶中加入2-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰 胺基)苯基)叔丁基-1-h-吡咯-1-甲酸叔丁酯(90mg,0.16mmol)和5ml甲醇,加 入10%的pd/c(20mg),反应体系于氢气氛围(1mpa)下室温搅拌过夜。抽滤,甲 醇洗涤滤饼,滤液旋干后得到85mg白色固体,收率:94%。
[0296]
步骤4:2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(吡咯烷-2-基)苯基)-5-(三氟 甲基)苯甲酰胺的合成
[0297]
将2-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)苯基) 吡咯烷-1-羧酸叔丁酯(58mg,0.1mmol)的2ml氯化氢/二氧六环溶液(2m)室温 搅拌2小时,体系旋干后加入10ml水中,碳酸钠调节ph值至碱性,乙酸乙酯萃 取,有机相干燥并旋干后经prep-hplc纯化,得到25mg白色固体,收率:52%。
[0298]
lc/ms:m/z=477.2[m+h]
+
.
[0299]
1h nmr(400mhz,d
6-dmso)δ1.44-1.53(1h,m),1.74-1.78(2h,m),2.16(3h, s),2.17-2.20(1h,m),2.97-3.00(2h,m),4.33(1h,t,j=7.6hz),6.81(1h,d,j=8.4 hz),7.09-7.26(4h,m),7.58-7.61(1h,m),7.77(1h,dd,j=8.8hz,2.4hz),7.77(1h, dd,j=8.4hz,4.0hz),7.96(1h,d,j=2.8hz),10.51(1h,s).
[0300]
实施例16
[0301]
5-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)苯基)吡 咯烷-2-羧酰胺
[0302][0303]
步骤1:2-((叔丁氧基羰基)氨基)-5-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺基)苯基)-5-氧代戊酸甲酯的合成
[0304]-70℃下,向n-(3-溴-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯 甲酰胺(486mg,1.0mmol)的5ml无水四氢呋喃溶液中滴加正丁基锂(1.6m,3.1 ml),该温度下搅拌1小时后滴加n-叔丁氧羰基-dl-焦谷氨酸甲酯(1215mg,5.0 mmol)的2ml四氢呋喃溶液,继续搅拌1小时后倒入20ml水中。乙酸乙酯萃取, 有机相干燥并旋干后经硅胶柱层析纯化(pe/ea=4/1),得到210mg白色固体,收 率:32%。
[0305]
步骤2:5-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)苯 基)-3,4-二氢-2h-吡咯-2-羧酸甲酯的合成
[0306]
将2-((叔丁氧基羰基)氨基)-5-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三 氟甲基)苯甲酰胺基)苯基)-5-氧代戊酸甲酯(210mg,0.32mmol)溶于5ml二氯 甲烷,加入2ml三氟乙酸后室温搅拌过夜。反应体系直接旋干得~200mg粗品。
[0307]
步骤3:5-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)苯 基)-3,4-二氢-2h-吡咯-2-羧酸的合成
[0308]
将上步所得粗品溶于5ml四氢呋喃,加入2ml浓度为1m的氢氧化钠水溶液 后室温搅拌6小时。反应体系用稀盐酸调节ph值至5后直接用prep-hplc纯化, 得到90mg目标产物,两步收率:54%。
[0309]
步骤4:5-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)苯 基)-3,4-二氢-2h-吡咯-2-羧酰胺的合成
[0310]
向反应瓶中加入5-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰 胺基)苯基)-3,4-二氢-2h-吡咯-2-羧酸(52mg,0.1mmol),氯化铵(53mg,1.0mmol), dipea(39mg,0.3mmol)和2ml四氢呋喃,加入hbtu(76mg,0.2mmol),反应 混合物室温搅拌过夜。反应体系倒入10ml水中,乙酸乙酯萃取,有机相干燥并旋 干,经prep-tlc纯化(dcm/meoh=20/1),得到30mg白色固体,收率:58%。
[0311]
步骤5:2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(吡咯烷-2-基)苯基)-5-(三氟 甲基)苯甲酰胺的合成
[0312]
向5-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)苯基)
ꢀ‑
3,4-二氢-2h-吡咯-2-羧酰胺(30mg,0.058mmol)的2ml甲醇溶液中加入20mg硼 氢化钠,室温搅拌2小时后,反应体系倒入10ml水中,乙酸乙酯萃取,有机相干 燥并旋干,经prep-tlc纯化(dcm/meoh=10/1),得到6mg白色固体,收率: 20%。
[0313]
lc/ms:m/z=520.2[m+h]
+
.
[0314]
1h nmr(400mhz,d
6-dmso)δ1.55-1.74(2h,m),1.87-2.00(1h,m),2.05(3h, s),2.16-2.22(1h,m),3.45-3.46(0.6h,m),3.65-3.66(0.4h,m),4.10-4.42(1h,m), 6.57-6.64(1h,m),7.01-7.11(2h,m),7.18-7.22(2h,m),7.25-7.45(1h,m),7.50-7.69 (1h,m),7.71-7.77(3h,m),7.98(1h,s),10.63-10.74(1h,m).
[0315]
实施例17
[0316]
n-(3-(2,3-二氨基-3-氧丙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三氟 甲基)苯甲酰胺
[0317][0318]
步骤1:2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(羟甲基)苯基)-5-(三氟甲基) 苯甲
酰胺的合成
[0319]
向反应瓶中加入2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(94mg,0.3 mmol),(5-氨基-2-氟苯基)甲醇(42mg,0.3mmol),dipea(77mg,0.6mmol)和2 ml四氢呋喃,加入hatu(190mg,0.5mmol),反应混合物室温搅拌过夜。反应体 系倒入10ml水中,乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化 (pe/ea=10/1),得到95mg白色固体,收率:73%。
[0320]
步骤2:n-(3-(氯甲基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺的合成
[0321]
将2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(羟甲基)苯基)-5-(三氟甲基)苯 甲酰胺(95mg,0.22mmol)的三氯氧磷溶液60℃搅拌1小时,反应液直接旋干,用 三氯甲烷带两次残留的三氯氧磷即得到100mg黄色固体,收率:100%。
[0322]
步骤3:3-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)苯 基)-2-硝基丙酸甲酯的合成
[0323]
将n-(3-(氯甲基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯 甲酰胺(100mg,0.22mmol),硝基乙酸甲酯(52mg,0.44mmol),苄基三乙基氯化铵 (50mg,0.22mmol)及碳酸氢钾(44mg,0.44mmol)的3ml dmf溶液60℃搅拌过 夜,反应体系倒入10ml水中,乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc 纯化(pe/ea=3/1),得到25mg白色固体,收率:21%。
[0324]
步骤4:n-(3-(3-氨基-2-硝基-3-氧代丙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺的合成
[0325]
将3-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)苯基)
ꢀ‑
2-硝基丙酸甲酯(25mg,0.046mmol)及4ml氨甲醇溶液(1m)室温搅拌过夜,旋 干反应液,得到25mg白色固体,收率:100%。
[0326]
步骤5:n-(3-(2,3-二氨基-3-氧丙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺的合成
[0327]
向反应瓶中加入n-(3-(3-氨基-2-硝基-3-氧代丙基)-4-氟苯基)-2-(4-氟-2
‑ꢀ
甲基苯氧基)-5-(三氟甲基)苯甲酰胺(25mg,0.046mmol)和5ml甲醇,加入10% 的pd/c(10mg),反应体系于氢气氛围(1mpa)下室温搅拌过夜。抽滤,甲醇洗涤 滤饼,滤液旋干后经prep-hplc纯化,得到9mg白色固体,收率:38%。
[0328]
lc/ms:m/z=494.1[m+h]
+
.
[0329]
实施例18
[0330]
2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(3-氧代哌嗪-2-基)苯基)-5-(三氟甲基) 苯甲酰胺
[0331][0332]
将(2-(2-(2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基) 苯基)-2-氧代乙酰胺基)乙基)氨基甲酸叔丁酯(45mg,0.072mmol,通过相应的 原料,以与实施例9类似的方法制备得到)的3mlhcl/ea(4m)溶液室温搅拌2小时, 旋干后加入5ml甲醇及50mg氰基硼氢化钠。该反应混合物室温搅拌过夜后倒入 20ml水中,乙酸乙酯萃取,有机相干燥并旋干后经prep-hplc纯化,得到8mg 白色固体,收率:22%。
[0333]
lc/ms:m/z=506.1[m+h]
+
.
[0334]
1h nmr(400mhz,d
6-dmso)δ2.16(3h,s),2.78-2.82(1h,m),2.88-3.01(2h, m),3.15-3.19(1h,m),4.52(1h,s),6.78(1h,d,j=8.0hz),7.10-7.26(4h,m), 7.63-7.66(1h,m),7.74-7.78(2h,m),7.81(1h,s),7.93(1h,s),10.52(1h,s).
[0335]
实施例19
[0336]
n-(3-(氨基(2-氧吡咯烷-3-基)甲基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基 苯氧基)-5-(三氟甲基)苯甲酰胺
[0337][0338]
步骤1:n-(2-氟-5-硝基亚苄基)-2-甲基丙烷-2-亚磺酰胺的合成
[0339]
将2-氟-5-硝基苯甲醛(333mg,2.0mmol),叔丁基亚磺酰胺(268mg,2.2mmol) 及碳酸铯(987mg,3.0mmol)的10ml二氯甲烷溶液室温搅拌过夜。反应体系倒入 10ml水中,乙酸乙酯萃取,有机相干燥并旋干得到573mg黄色固体。
[0340]
步骤2:3-((((叔丁基亚磺酰基)氨基)(2-氟-5-硝基苯基)甲基)-2-氧 代吡咯烷-1-羧酸叔丁酯的合成
[0341]-70℃及氮气保护下,向n-boc-2-吡咯烷酮(545mg,2.94mmol)的5ml无水 四氢呋喃溶液中滴加正丁基锂(2.5m,0.9ml),加毕后继续搅拌0.5小时,再将 n-(2-氟-5-硝基亚苄基)-2-甲基丙烷-2-亚磺酰胺(200mg,0.73mmol)的1ml四氢 呋喃溶液滴加到反应体系中,控制体系温度低于-60℃。继续搅拌1.5小时后反应体 系倒入20ml氯化铵水溶液中,乙酸乙酯萃取,有机相干燥并旋干,经硅胶柱纯化 (dcm/meoh=20/1),得到280mg黄色油状物,收率:83%。
[0342]
步骤3:3-((5-氨基-2-氟苯基)((叔丁基亚硫酰基)氨基)甲基)-2-氧代 吡咯烷-1-羧酸叔丁酯的合成
[0343]
向反应瓶中加入3-((((叔丁基亚磺酰基)氨基)(2-氟-5-硝基苯基)甲基)
ꢀ‑
2-氧代吡咯烷-1-羧酸叔丁酯(110mg,0.24mmol)和5ml乙醇,加入10%的pd/c(20 mg),反应体系于氢气氛围下室温搅拌过夜。抽滤,乙醇洗涤滤饼,滤液旋干后得到 100mg黄色固体,收率:97%。
[0344]
步骤4:3-(((叔丁基亚磺酰基)氨基)(5-(4-环丙基-2-(4-氟-2-甲基苯 氧基)-5-(三氟甲基)苯甲酰胺基)-2-氟苯基)甲基)-2-氧代吡咯烷-1-羧酸叔丁 酯的合成
[0345]
向反应瓶中加入4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(82 mg,0.23mmol),3-((5-氨基-2-氟苯基)((叔丁基亚硫酰基)氨基)甲基)-2
‑ꢀ
氧代吡咯烷-1-羧酸叔丁酯(98mg,0.23mmol),dipea(106mg,0.82mmol)和5ml四 氢呋喃,加入hatu(163mg,0.42mmol),反应混合物室温搅拌过夜。反应体系倒 入20ml水中,乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化 (dcm/meoh=15/1),得到25mg白色固体,收率:14%。
[0346]
步骤5:n-(3-(氨基(2-氧吡咯烷-3-基)甲基)-4-氟苯基)-4-环丙基-2-(4
‑ꢀ
氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0347]
将3-(((叔丁基亚磺酰基)氨基)(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰胺基)-2-氟苯基)甲基)-2-氧代吡咯烷-1-羧酸叔丁酯(25mg, 0.033mmol)的2ml氯化氢/乙酸乙酯溶液(2m)室温搅拌过夜,体系旋干后加入 10ml水中,碳酸钠调节ph值至碱性,乙酸乙酯萃取,有机相干燥并旋干后经 prep-hplc纯化,得到12mg白色固体,收率:67%。
[0348]
lc/ms:m/z=560.2[m+h]
+
.
[0349]
1h nmr(400mhz,d
6-dmso)δ0.54-0.60(2h,m),1.00-1.06(2h,m),1.61-1.71 (1h,m),2.13-2.12(2h,m),2.15(3h,s),2.52-2.58(1h,m),3.07-3.13(2h,m),4.60(1h, d,j=3.2hz),6.37(1h,s),7.05-7.09(3h,m),7.20(1h,dd,j=9.2hz,2.7hz), 7.51-7.57(1h,m),7.69(1h,s),7.79(1h,dd,j=6.6hz,2.4hz),7.90(1h,s),10.40(1h, s).
[0350]
实施例20
[0351]
n-(3-(1-氨基-3-羟基丁基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺
[0352]
[0353]
步骤1:叔丁基(1-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯 甲酰胺基)-2-氟苯基)-3-氧代丁基)氨基甲酸酯的合成
[0354]
0℃下,向3-((叔丁氧基羰基)氨基)-3-(5-(4-环丙基-2-(4-氟-2-甲基苯 氧基)-5-(三氟甲基)苯甲酰胺基)-2-氟苯基)丙酸(63mg,0.10mmol)的2ml无 水四氢呋喃溶液中加入甲基锂(1m,0.4ml),室温下搅拌1小时后体系倒入10ml 水中。乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化(pe/ea=2/1),得到 30mg白色固体,收率:47%。
[0355]
步骤2:叔丁基(1-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺基)-2-氟苯基)-3-羟基丁基)氨基甲酸酯的合成
[0356]
室温下,向叔丁基(1-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺基)-2-氟苯基)-3-氧代丁基)氨基甲酸酯(30mg,0.047mmol)的2ml甲 醇溶液中加入5mg硼氢化钠,室温下搅拌1小时后体系倒入10ml水中。乙酸乙 酯萃取,有机相干燥并旋干,经prep-tlc纯化(pe/ea=1/1),得到18mg白色固 体,收率:60%。
[0357]
步骤3:n-(3-(1-氨基-3-羟基丁基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯 氧基)-5-(三氟甲基)苯甲酰胺的合成
[0358]
将叔丁基(1-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰 胺基)-2-氟苯基)-3-羟基丁基)氨基甲酸酯(18mg,0.028mmol)的2ml氯化氢/ 乙酸乙酯溶液(2m)室温搅拌过夜,体系旋干后加入10ml水中,碳酸钠调节ph 值至碱性,乙酸乙酯萃取,有机相干燥并旋干后经prep-hplc纯化,得到10mg白 色固体,收率:67%。
[0359]
lc/ms:m/z=535.2[m+h]
+
.
[0360]
1h nmr(400mhz,d
6-dmso)δ0.56-0.58(2h,m),1.00-1.07(5h,m),1.55-1.57 (1h,m),2.12-2.14(1h,m),2.16(3h,s),3.68-3.76(2h,m),4.19-4.28(1h,m),6.35(1h, s),7.06-7.10(3h,m),7.22(1h,dd,j=9.2hz,2.0hz),7.49-7.55(1h,m),7.73-7.80(1h, m),7.91(1h,s),10.39(1h,s).
[0361]
实施例21
[0362]
n-(3-(1-氨基-3-氟丙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺
[0363][0364]
向n-(3-(1-氨基-3-羟丙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺(52mg,0.10mmol)的2ml二氯甲烷溶液中加入dast(24mg, 0.15mmol),反应混合物室温搅拌过夜。反应体系倒入10ml水中,乙酸乙酯萃取, 有机相干燥并旋干,经prep-tlc纯化(dcm/meoh=10/1),得到20mg白色固体, 收率:38%。
[0365]
lc/ms:m/z=521.2[m+h]
+
.
[0366]
1h nmr(400mhz,d
6-dmso)δ0.53-0.60(2h,m),1.00-1.06(2h,m),1.94-2.16 (7h,m),4.31-4.33(1h,m),4.40-4.68(1h,m),6.34(1h,s),7.03-7.10(2h,m),7.14-7.23 (2h,m),7.49-7.56(1h,m),7.84-7.92(2h,m),10.45(1h,s).
[0367]
实施例22
[0368]
n-(3-(1-氨基-2-氟-3-羟丙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰胺
[0369][0370]
步骤1:3-((叔丁基亚磺酰基)氨基)-2-氟-3-(2-氟-5-硝基苯基)丙酸乙酯 的合成
[0371]-70℃及氮气保护下,向氟乙酸乙酯(480mg,4.53mmol)的5ml无水四氢呋 喃溶液中滴加lihmds(1.3m,3.2ml),加毕后继续搅拌0.5小时,再将n-(2
‑ꢀ
氟-5-硝基亚苄基)-2-甲基丙烷-2-亚磺酰胺(230mg,0.85mmol)的1ml四氢呋喃溶 液滴加到反应体系中,控制体系温度低于-60℃。继续搅拌1.5小时后反应体系倒入 20ml氯化铵水溶液中,乙酸乙酯萃取,有机相干燥并旋干,经硅胶柱纯化 (pe/ea=2/1),得到216mg黄色固体,收率:68%。
[0372]
步骤2:3-(5-氨基-2-氟苯基)-3-((叔丁基亚磺酰基)氨基)-2-氟丙酸乙酯 的合成
[0373]
向反应瓶中加入3-((叔丁基亚磺酰基)氨基)-2-氟-3-(2-氟-5-硝基苯基)丙 酸乙酯(216mg,0.57mmol)和5ml乙醇,加入10%的pd/c(30mg),反应体系于氢 气氛围下室温搅拌过夜。抽滤,乙醇洗涤滤饼,滤液旋干后得到200mg黄色固体, 收率:100%。
[0374]
步骤3:3-((叔丁基亚磺酰基)氨基)-3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺基)-2-氟苯基)-2-氟丙酸乙酯的合成
[0375]
向反应瓶中加入4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(82 mg,0.23mmol),3-(5-氨基-2-氟苯基)-3-((叔丁基亚磺酰基)氨基)-2-氟丙酸 乙酯(80mg,0.23mmol),dipea(106mg,0.82mmol)和5ml四氢呋喃,加入 hatu(163mg,0.42mmol),反应混合物室温搅拌过夜。反应体系倒入20ml水中, 乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化(dcm/meoh=20/1),得到35 mg白色固体,收率:29%。
[0376]
步骤4:n-(3-(1-((叔丁基亚磺酰基)氨基)-2-氟-3-羟丙基)-4-氟苯基)
ꢀ‑
4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0377]
室温下,向3-((叔丁基亚磺酰基)氨基)-3-(5-(4-环丙基-2-(4-氟-2-甲基 苯氧基)-5-(三氟甲基)苯甲酰胺基)-2-氟苯基)-2-氟丙酸乙酯(35mg,0.051mmol) 及5mg氯化锂的2ml甲醇溶液中加入10mg硼氢化钠,室温下搅拌4小时后体系 倒入10ml水中。乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化 (dcm/meoh=20/1),得到15mg白色固体,收率:43%。
[0378]
步骤5:n-(3-(1-氨基-2-氟-3-羟丙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基 苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0379]
将n-(3-(1-((叔丁基亚磺酰基)氨基)-2-氟-3-羟丙基)-4-氟苯基)-4-环 丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺(15mg,0.023mmol)的2ml 氯化氢/乙酸乙酯溶液(2m)室温搅拌过夜,体系旋干加入10ml水中,碳酸钠调 节ph值至碱性,乙酸乙酯萃取,有机相干燥并旋干后经prep-hplc纯化,得到4mg 白色固体,收率:32%。
[0380]
lc/ms:m/z=539.2[m+h]
+
.
[0381]
1h nmr(400mhz,d
6-dmso)δ0.56-0.58(2h,m),0.99-1.07(2h,m),2.11-2.14 (1h,m),2.16(3h,s),3.50-3.72(2h,m),4.26-4.30(1h,m),4.37-4.45(0.5h,m), 4.50-4.57(0.5h,m),4.95(1h,brs),6.35(1h,s),7.07-7.16(3h,m),7.22(1h,d,j=8.1 hz),7.53-7.61(1h,m),7.77-7.83(1h,m),7.92(1h,s),10.40-10.42(1h,m).
[0382]
实施例23
[0383]
n-(3-(1-氨基-2,2-二氟-3-羟丙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺
[0384][0385]
步骤1:3-((叔丁基亚磺酰基)氨基)-2,2-二氟-3-(2-氟-5-硝基苯基)丙酸 乙酯的合成
[0386]
将锌粉(195mg,3.0mmol)和2-溴-2,2-二氟乙酸乙酯(404mg,2.0mmol)的无 水四氢呋喃溶液搅拌回流30分钟。然后在该温度下将n-(2-氟-5-硝基亚苄基)-2
‑ꢀ
甲基丙烷-2-亚磺酰胺(272mg,1.0mmol)的无水thf溶液缓慢加入到混合物中。回 流搅拌1.5小时后,将反应混合物过滤并将滤液浓缩。粗品经prep-tlc纯化 (dcm/meoh=50/1),得到190mg白色固体,收率:48%。
[0387]
步骤2:n-(3-(1-氨基-2,2-二氟-3-羟丙基)-4-氟苯基)-4-环丙基-2-(4-氟-2
‑ꢀ
甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0388]
以相应的试剂为原料,用于实施例22相同的方法可得到实施例23
[0389]
lc/ms:m/z=557.2[m+h]
+
.
[0390]
实施例24
[0391]
4-环丙基-n-(3-(1,3-二氨基丙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三 氟甲基)苯甲酰胺
[0392][0393]
步骤1:叔丁基(3-氨基-1-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟 甲基)苯甲酰胺基)-2-氟苯基)丙基)氨基甲酸酯的合成
[0394]
向反应瓶中加入1-(5-(4-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺基)-2-氟苯基)-3-羟丙基)氨基甲酸叔丁酯(100mg,0.16mmol), dipea(41mg,0.32mmol)和5ml二氯甲烷,室温滴加甲基黄酰氯(22mg,0.19 mmol),反应混合物室温搅拌1小时。反应体系旋干后溶于5ml无水四氢呋喃中, 加入~10mg氨基钠,室温反应1小时。反应液倒入10ml冰水中,乙酸乙酯萃取, 有机相干燥并旋干,经prep-hplc纯化,得到6mg黄色油状物,收率:6%。
[0395]
步骤2:(4-环丙基-n-(3-(1,3-二氨基丙基)-4-氟苯基)-2-(4-氟-2-甲基苯 氧基)-5-(三氟甲基)苯甲酰胺的合成
[0396]
将(叔丁基(3-氨基-1-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺基)-2-氟苯基)丙基)氨基甲酸酯(6mg,0.01mmol)的2ml氯化氢/二氧 六环溶液(2m)室温搅拌2小时,体系旋干后加入10ml水中,碳酸钠调节ph 值至碱性,乙酸乙酯萃取,有机相干燥并旋干后经prep-hplc纯化,得到2mg白 色固体,收率:40%。
[0397]
lc/ms:m/z=520.2[m+h]
+
.
[0398]
1h nmr(400mhz,d
6-dmso)δ0.56-0.58(2h,m),0.99-1.07(2h,m),1.62-1.65 (2h,m),2.11-2.16(4h,m),2.60-2.70(2h,m),4.12-4.14(1h,m),6.35(1h,s),7.02-7.16 (3h,m),7.20-7.23(1h,m),7.48-7.55(1h,m),7.76-7.78(1h,m),7.91(1h,s),10.38 (1h,s).
[0399]
实施例25
[0400]
2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(羟基(2-氧代吡咯烷-3-基)甲基)苯基)
ꢀ‑
5-(三氟甲基)苯甲酰胺
[0401][0402]
步骤1:2-氟-5-(2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)苯甲 酸甲
7.64(2h,m),7.78(1h,d,j=8.4hz),7.89(1h,d,j=7.6hz),7.97(1h,s), 10.56(1h,s).
[0416]
实施例26
[0417]
n-(3-(2-氨基-1-羟基-2-氧代乙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺
[0418][0419]
室温下,向n-(3-(2-氨基-2-氧代乙酰基)-4-氟苯基)-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺(48mg,0.10mmol)的2ml四氢呋喃溶液中加入10mg 硼氢化钠,室温下搅拌4小时后体系倒入10ml水中。乙酸乙酯萃取,有机相干燥 并旋干,经prep-tlc纯化(dcm/meoh=20/1),得到25mg白色固体,收率:52%。
[0420]
lc/ms:m/z=481.1[m+h]
+
.
[0421]
1h nmr(400mhz,d
6-dmso)δ2.14(3h,s),5.08(1h,d,j=7.2hz),6.24(1h,d, j=7.2hz),6.80(1h,d,j=8.0hz),7.12-7.26(4h,m),7.37(1h,s),7.45(1h,s), 7.61-7.64(1h,m),7.75-7.80(2h,m),7.97(1h,d,j=2.4hz),10.54(1h,s).
[0422]
实施例27
[0423]
n-(3-(1-氨基-1-氧代丙烷-2-基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三 氟甲基)苯甲酰胺
[0424][0425]
步骤1:2-(2-氟-5-硝基苯基)丙酸甲酯的合成
[0426]
将2-(2-氟-5-硝基苯基)乙酸(199mg,1.0mmol),碳酸钾(414mg,3mmol), 及碘甲烷(284mg,2.0mmol)的5ml四氢呋喃溶液室温搅拌过夜,反应体系过滤, 滤液旋干,经硅胶柱层析纯化(pe/ea=20/1),得到80mg黄色固体,收率:35%。
[0427]
步骤2:2-(2-氟-5-硝基苯基)丙酰胺的合成
[0428]
将2-(2-氟-5-硝基苯基)丙酸甲酯(80mg,0.35mmol)的5ml氨甲醇溶液50℃ 搅拌过夜,反应体系旋干,经prep-tlc纯化(pe/ea=5/1),得到60mg黄色固 体,收率:80%。
[0429]
步骤3:2-(5-氨基-2-氟苯基)丙酰胺的合成
[0430]
向反应瓶中加入2-(2-氟-5-硝基苯基)丙酰胺(60mg,0.28mmol)和5ml甲醇, 加入10%的pd/c(10mg),反应体系于氢气氛围下室温搅拌过夜。抽滤,甲醇洗涤 滤饼,滤液旋干后得到50mg浅黄色固体,收率:98%。
[0431]
步骤4:n-(3-(1-氨基-1-氧代丙烷-2-基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰胺的合成
[0432]
向反应瓶中加入2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(31mg,0.10 mmol),2-(5-氨基-2-氟苯基)丙酰胺(18mg,0.10mmol),dipea(26mg,0.20mmol) 和2ml四氢呋喃,加入hatu(57mg,0.15mmol),反应混合物室温搅拌过夜。反 应体系倒入10ml水中,乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化 (pe/ea=2/1),得到25mg白色固体,收率:52%。
[0433]
lc/ms:m/z=479.1[m+h]
+
.
[0434]
1hnmr(400mhz,d
6-dmso)δ0.56-0.59(2h,m),1.02-1.04(2h,m),1.31(3h,d, j=7.6hz),2.10-2.14(1h,m),2.16(3h,s),3.82(1h,q,j=7.6hz),6.35(1h,s),6.94 (1h,s),7.06-7.14(3h,m),7.21(1h,d,j=8.4hz),7.41(1h,s),7.56-7.59(1h,m), 7.66-7.68(1h,m),77.90(1h,s),10.42(1h,s).
[0435]
实施例28
[0436]
4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(4-羟基丁烷-2-基)苯基)-5
‑ꢀ
(三氟甲基)苯甲酰胺
[0437][0438]
步骤1:(e)-3-(2-氟-5-硝基苯基)丁-2-烯酸乙酯的合成
[0439]
将含量为60%的钠氢(308mg,7.7mmol)悬浮于干燥的5ml四氢呋喃,氮气保 护并降温至0℃,缓慢滴加入磷酰基乙酸三乙酯(1.48g,6.6mmol),该混合物在冰 浴下搅拌反应30分钟后,冰浴下向反应体系滴加1-(2-氟-5-硝基苯基)乙-1-酮(1.0 g,5.5mmol),反应溶液室温搅拌2小时,反应体系用氯化铵溶液淬灭,乙酸乙酯 萃取,有机相干燥旋干,经硅胶柱层析纯化(pe/ea=5/1),得到900mg灰色固体, 收率:64%。
[0440]
步骤2:3-(5-氨基-2-氟苯基)丁酸乙酯的合成
[0441]
将e)-3-(2-氟-5-硝基苯基)丁-2-烯酸乙酯(900mg,3.56mmol)溶于25ml甲 醇,置换氢气后,加入氢氧化钯(90mg,10%wt),反应在氢气氛围下搅拌反应4 小时,反应体系直接过滤,滤液旋干,得到750mg灰色固体,收率:95%。
[0442]
步骤3:3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)
ꢀ‑
2-氟苯基)丁酸乙酯的合成
[0443]
向反应瓶中加入4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(354 mg,1mmol),3-(5-氨基-2-氟苯基)丁酸乙酯(268mg,1.2mmol),dipea(387mg,3mmol)和2ml四氢呋喃,加入hatu(456mg,1.2mmol),反应混合物室温搅拌 过夜。反应体系倒入10ml水中,乙酸乙酯萃取,有机相干燥并旋干,经硅胶柱层 析纯化(pe/ea=2/1),得到450mg白色固体,收率:80%。
[0444]
步骤4:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(4-羟基丁烷-2-基)苯 基)-5-(三氟甲基)苯甲酰胺的合成
[0445]
向反应瓶中加入3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯 甲
酰胺基)-2-氟苯基)丁酸乙酯(450mg,0.8mmol),无水氯化锂(13mg,0.3mmol), 和15ml甲醇,分批加入硼氢化钠(152mg,4mmol),反应混合物室温搅拌2小时。 反应体系加稀盐酸淬灭,乙酸乙酯萃取,有机相干燥并旋干,经硅胶柱层析纯化 (dcm/meoh=30/1),得到370mg白色固体,收率:90%。
[0446]
lc/ms:m/z=520.1[m+h]
+
.
[0447]
1hnmr(400mhz,d
6-dmso)δ0.54-0.60(2h,m),1.02-1.08(2h,m),1.16(3h,d, j=6.8hz),1.74-1.78(2h,m),2.07-2.19(4h,m),3.62-3.65(2h,m),4.42-4.44(1h,m), 5.77(1h,s),6.39(1h,s),7.01-7.14(3h,m),7.20(1h,dd,j=9.2hz,2.8hz),7.44-7.52 (1h,m),7.56(1h,dd,j=6.6hz,2.4hz),7.91(1h,s),10.36(1h,s).
[0448]
实施例29
[0449]
n-(3-(4-氨基丁烷-2-基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺
[0450][0451]
步骤1:4-环丙基-n-(3-(4-(1,3-二氧代异吲哚啉-2-基)丁烷-2-基)-4-氟苯 基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0452]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(4-羟基丁烷-2-基)苯基)-5
‑ꢀ
(三氟甲基)苯甲酰胺(104mg,0.2mmol),邻苯二甲酰亚胺(44mg,0.3mmol),及 三苯基磷(105mg,0.4mmol)溶于8ml四氢呋喃,氮气保护室温下滴加diad(121 mg,0.6mmol),反应溶液室温搅拌3小时,反应体系加水,乙酸乙酯萃取,有机相 干燥旋干,经硅胶柱层析纯化(pe/ea=3/1),得到80mg灰色固体,收率:62%。
[0453]
步骤2:n-(3-(4-氨基丁烷-2-基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺的合成
[0454]
将4-环丙基-n-(3-(4-(1,3-二氧代异吲哚啉-2-基)丁烷-2-基)-4-氟苯基)-2-[0455]
(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺(80mg,0.12mmol)溶于8ml乙 醇和2ml水合肼,反应体系加水,乙酸乙酯萃取,有机相干燥旋干,经prep-tlc 纯化(dcm/meoh=15/1),得到25mg白色固体,收率:40%。
[0456]
lc/ms:m/z=519.1[m+h]
+
.
[0457]
1hnmr(400mhz,d
6-dmso)δ0.54-0.60(2h,m),1.02-1.08(2h,m),1.18(3h,d, j=6.8hz),1.65-1.75(2h,m),2.07-2.19(4h,m),2.55-2.59(2h,m),3.05-3.10(1h,m), 6.39(1h,s),7.04-7.13(3h,m),7.19(1h,dd,j=9.2hz,2.8hz),7.44-7.52(1h,m), 7.61(1h,dd,j=6.6hz,2.4hz),7.91(1h,s),10.38(1h,s).
[0458]
实施例30
[0459]
n-(3-(1-氨基丙-2-基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三 氟甲基)苯甲酰胺
[0460][0461]
步骤1:(2-(2-氟-5-硝基苯基)丙基)氨基甲酸叔丁酯的合成
[0462]
将2-(2-氟-5-硝基苯基)丙酰胺(212mg,1.0mmol),bh
3-thf(3ml,3mmol, 1.0m)和10ml四氢呋喃溶液于50℃搅拌2小时,加入15ml甲醇淬灭反应,混 合物搅拌30分钟后,直接向反应体系加入(boc)2o(436mg,2.0mmol),室温搅拌1 小时。体系直接旋干,经硅胶柱层析纯化(pe/ea=3/1),得到180mg灰白色固体, 收率:60%。
[0463]
步骤2:n-(3-(1-氨基丙-2-基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺的合成
[0464]
以相应底物为原料,根据实施例3相同的方案,得到实施例30
[0465]
lc/ms:m/z=505.2[m+h]
+
.
[0466]
1hnmr(400mhz,d
6-dmso)δ0.54-0.61(2h,m),1.00-1.08(2h,m),1.18(3h,d, j=6.9hz),2.07-2.19(4h,m),2.64-2.69(1h,m),2.72-2.77(1h,m),2.94-3.01(1h,m), 6.39(1h,s),7.01-7.14(3h,m),7.20(1h,dd,j=9.2hz,2.8hz),7.44-7.52(1h,m), 7.57(1h,dd,j=6.6hz,2.4hz),7.91(1h,s),10.37(1h,s).
[0467]
实施例31
[0468]
4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(1-氟-3-羟丙基)苯基)-5-(三 氟甲基)苯甲酰胺
[0469][0470]
步骤1:3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)
ꢀ‑
2-氟苯基)-3-氧代丙酸甲酯的合成
[0471]
将碳酸二甲酯(450mg,5mmol),及60%含量的钠氢(100mg,2.5mmol)悬浮于 15ml干燥四氢呋喃,室温下加入n-(3-乙酰基-4-氟苯基)-4-环丙基-2-(4-氟-2
‑ꢀ
甲基苯氧基)-5-(三氟甲基)苯甲酰胺(245mg,0.5mmol),溶液70℃搅拌6小时, 反应体系冰浴降温并加入氯化铵溶液淬灭反应,乙酸乙酯萃取,有机相干燥浓缩干, 经硅胶柱层析纯化(pe/ea=2/1),得到165mg黄色固体,收率:60%。
[0472]
步骤2:3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)
ꢀ‑
2-氟苯基)-3-羟基丙酸甲酯的合成
[0473]
将3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)-2
‑ꢀ
氟苯基)-3-氧代丙酸甲酯(165mg,0.3mmol)和5ml甲醇,分批加入硼氢化钠(57 mg,1.5mmol),室温搅拌反应1小时后加入稀盐酸淬灭反应,乙酸乙酯萃取,有 机相干燥并浓缩干,经硅胶快速柱层析纯化(pe/ea=1/1),得到125mg黄色固 体,收率:76%。
[0474]
步骤3:3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)
ꢀ‑
2-氟苯基)-3-氟丙酸甲酯的合成
[0475]
向反应瓶中加入3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯 甲酰胺基)-2-氟苯基)-3-羟基丙酸甲酯(125mg,0.23mmol)和5ml二氯甲烷,在
ꢀ‑
45℃左右向反应体系加入dast(74mg,0.46mmol),反应体系于-45℃搅拌2小 时。反应体系加水淬灭,乙酸乙酯萃取,有机相干燥浓缩干经硅胶柱层析纯化 (pe/ea=2/1)得到40mg灰白色固体,收率:32%。
[0476]
步骤4:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(1-氟-3-羟丙基)苯基)
ꢀ‑
5-(三氟甲基)苯甲酰胺的合成
[0477]
向3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)-2
‑ꢀ
氟苯基)-3-氟丙酸甲酯(40mg,0.07mmol),无水氯化锂(4mg,0.1mmol)和3ml 甲醇的混合液中分批加入硼氢化钠(27mg,0.7mmol),室温搅拌反应1小时后加 入稀盐酸淬灭反应,乙酸乙酯萃取,有机相干燥并浓缩干,经硅胶prep-tlc纯化 (dcm/meoh=30/1),得到25mg白色固体,收率:66%。
[0478]
lc/ms:m/z=524.2[m+h]
+
.
[0479]
实施例32
[0480]
4-环丙基-n-(3-(1,1-二氟-3-羟丙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺
[0481][0482]
步骤1:3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)
ꢀ‑
2-氟苯基)-3,3-二氟丙酸甲酯的合成
[0483]
向反应瓶中加入3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯 甲酰胺基)-2-氟苯基)-3-氧代丙酸甲酯(200mg,0.37mmol)和15ml二氯甲烷,在 室温下向反应体系加入dast(119mg,0.74mmol),反应体系于室温搅拌2小时。反 应体系加水淬灭,乙酸乙酯萃取,有机相干燥浓缩干经硅胶柱层析纯化(pe/ea=2/1) 得到45mg灰白色固体,收率:21%。
[0484]
步骤2:4-环丙基-n-(3-(1,1-二氟-3-羟丙基)-4-氟苯基)-2-(4-氟-2-甲基苯 氧基)-5-(三氟甲基)苯甲酰胺的合成
[0485]
以相应底物为原料,根据实施例31相同的方案,得到实施例32
[0486]
lc/ms:m/z=542.2[m+h]
+
.
[0487]
实施例33
[0488]
4-环丙基-n-(3-(1,1-二氟-2-((2-羟乙基)氨基)-2-氧代乙基)-4-氟苯基)
ꢀ‑
2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺
[0489][0490]
步骤1:n-(3-(2-((2-((叔丁基二甲基甲硅烷基)氧基)乙基)氨基)-2
‑ꢀ
氧代乙酰基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲 酰胺的合成
[0491]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-(((2-羟乙基)氨基)
ꢀ‑
2-氧代乙酰基)苯基)-5-(三氟甲基)苯甲酰胺(100mg,0.18mmol),tea(101mg, 1mmol)溶于10ml二氯甲烷,室温下加入tbsotf(95mg,0.36mmol),反应体系 直接旋干,经硅胶柱层析纯化(pe/ea=5/1),得到90mg,收率:74%。
[0492]
步骤2:n-(3-(2-(((2-((叔丁基二甲基甲硅烷基)氧基)乙基)氨基)
ꢀ‑
1,1-二氟-2-氧乙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺的合成
[0493]
向反应瓶中加入n-(3-(2-((2-((叔丁基二甲基甲硅烷基)氧基)乙基) 氨基)-2-氧代乙酰基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟 甲基)苯甲酰胺(90mg,0.13mmol)和5ml二氯甲烷,在室温下向反应体系加入 dast(65mg,0.4mmol),反应体系于室温搅拌2小时。反应体系加水淬灭,乙酸 乙酯萃取,有机相干燥浓缩干经硅胶柱层析纯化(pe/ea=5/1)得到18mg灰白色 固体,收率:19%。
[0494]
步骤3:4-环丙基-n-(3-(1,1-二氟-2-((2-羟乙基)氨基)-2-氧代乙基)-4
‑ꢀ
氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0495]
向反应瓶中加入n-(3-(2-(((2-((叔丁基二甲基甲硅烷基)氧基)乙基) 氨基)-1,1-二氟-2-氧乙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三 氟甲基)苯甲酰胺(18mg),tbaf(0.2ml,1m)和2ml四氢呋喃,反应体系于室温 搅拌1小时。反应体系加水,乙酸乙酯萃取,有机相用稀盐酸反洗2次,干燥浓缩 后经prep-tlc纯化(dcm/meoh=20/1)得到5mg灰白色固体,收率:31%。
[0496]
lc/ms:m/z=585.2[m+h]
+
.
[0497]
实施例34
[0498]
n-(3-(2-氨基乙氧基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三 氟甲基)苯甲酰胺
[0499][0500]
步骤1:(2-(5-(4-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲 酰胺基)-2-氟苯氧基)乙基)氨基甲酸叔丁酯的合成
[0501]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-羟基苯基)-5-(三氟甲基) 苯甲酰胺(46mg,0.1mmol),碳酸钾(41mg,0.3mmol),及(2-溴乙基)氨基甲酸 叔丁酯(33mg,0.15mmol)的3ml乙腈溶液100℃搅拌2小时,反应体系过滤,滤 液旋干,得到90mg黄色固体,粗品未纯化直接用于下步反应。
[0502]
步骤2:n-(3-(2-氨基乙氧基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰胺的合成
[0503]
将(2-(5-(4-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺 基)-2-氟苯氧基)乙基)氨基甲酸叔丁酯(90mg,粗品)的5ml盐酸乙酸乙酯溶 液室温搅拌反应1小时,反应体系旋干后加水,碳酸钠调ph至碱性,乙酸乙酯萃 取,旋干后经prep-tlc纯化(dcm/meoh=12/1),得到20mg白色固体,收率: 39%(2步)。
[0504]
lc/ms:m/z=507.2[m+h]
+
.
[0505]
1h nmr(400mhz,d
6-dmso)δ0.56-0.61(2h,m),0.99-1.08(2h,m),2.11-2.13 (1h,m),2.15(3h,s),2.91(2h,d,j=5.8hz),3.94(2h,d,j=5.8hz),6.38(1h,s), 7.03-7.23(5h,m),7.52-7.61(1h,m),7.91(1h,s),10.41(1h,s).
[0506]
表一:按照与上述实施例所阐述操作类似的操作,以相应的试剂为原料制备以下化 合物。
[0507]
[0508]
[0509][0510]
实施例46
[0511]
4-环丙基-n-(3-(1,3-二氨基丁基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5-(三 氟甲基)苯甲酰胺
[0512][0513]
步骤1:叔丁基-(1-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺基)-2-氟苯基)-3-(羟基亚氨基)丁基)氨基甲酸酯的合成
[0514]
将(1-(5-(4-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺 基)-2-氟苯基)-3-氧代丁基)氨基甲酸叔丁酯(63mg,0.1mmol),醋酸钠(16mg, 0.2mmol)及盐酸
羟胺(14mg,0.2mmol)的3ml乙醇溶液室温搅拌过夜。反应体系 倒入10ml水中,乙酸乙酯萃取,有机相干燥后旋干,得到70mg黄色固体。
[0515]
步骤2:4-环丙基-n-(3-(1,3-二氨基丁基)-4-氟苯基)-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺的合成
[0516]
将上一步反应所得粗品溶于5ml甲醇,加入0.1ml浓盐酸及50mg pd/c (10%)。反应体系在0.2mpa压力的氢气氛围下搅拌6小时。过滤,滤液旋干后 经prep-tlc纯化(dcm/meoh=10/1),得到3mg白色固体,两步收率:5%。
[0517]
lc/ms:m/z=534.2[m+h]
+
.
[0518]
实施例47
[0519]
n-(3-(2-氨基-1-氟乙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺
[0520][0521]
步骤1:n-(3-(2-氨基-1-羟乙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺的合成
[0522]
将n-(3-(2-氨基-2-氧乙酰基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰胺(104mg,0.2mmol)溶于3ml四氢呋喃,0℃下加入四氢 铝锂(23mg,0.6mmol),反应体系室温搅拌过夜。反应液倒入10ml水中,乙酸 乙酯萃取,有机相干燥后旋干,经prep-tlc纯化(dcm/meoh=10/1),得到25mg 黄色固体,收率:25%。
[0523]
步骤2:n-(3-(2-氨基-1-氟乙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺的合成
[0524]
将n-(3-(2-氨基-1-羟乙基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰胺(25mg,0.05mmol)溶于3ml二氯甲烷,体系冷却至
ꢀ‑
20℃后加入二乙胺基三氟化硫(8mg,0.05mmol),0℃搅拌反应1小时。反 应液倒入10ml水中,乙酸乙酯萃取,有机相旋干后经prep-tlc纯化 (dcm/meoh=15/1),得到8mg类白色固体,收率:32%。
[0525]
lc/ms:m/z=509.2[m+h]
+
.
[0526]
1hnmr(400mhz,d
6-dmso)δ0.58-0.60(2h,m),1.02-1.07(2h,m),1.18(3h,d, j=7.0hz),2.13-2.17(4h,m),2.64-2.69(1h,m),2.72-2.77(1h,m),2.94-3.01(1h,m), 6.28(1h,s),7.05-7.13(3h,m),7.20(1h,dd,j=9.2hz,2.8hz),7.47-7.51(1h,m), 7.57(1h,dd,j=6.6hz,2.4hz),7.91(1h,s),10.37(1h,s).
[0527]
实施例48
[0528]
n-(3-(4-氨基-4-氧代丁烷-2-基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰胺
[0529][0530]
将3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)-2
‑ꢀ
氟苯基)丁酸乙酯(56mg,0.1mmol)的5ml氨甲醇溶液(7m)室温搅拌过夜, 反应体系直接旋干,粗品用少量乙酸乙酯打浆,得到35mg白色固体,收率:66%。
[0531]
lc/ms:m/z=533.2[m+h]
+
.
[0532]
实施例49
[0533]
4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(3-羟基-1-(1h-咪唑-1-基)丙 基)苯基)-5-(三氟甲基)苯甲酰胺
[0534][0535]
步骤1:4-环丙基-n-(3-(1,3-二羟丙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰胺的合成
[0536]
将3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)-2
‑ꢀ
氟苯基)-3-氧代丙酸甲酯(55mg,0.1mmol)溶于3ml甲醇,室温下加入硼氢化钠 (38mg,1.0mmol)。反应体系室温搅拌6小时后倒入10ml水中,乙酸乙酯萃取, 有机相旋干后经prep-tlc纯化(dcm/meoh=20/1),得到30mg黄色固体,收率: 58%。
[0537]
步骤2:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(3-羟基-1-(1h-咪唑
ꢀ‑
1-基)丙基)苯基)-5-(三氟甲基)苯甲酰胺的合成
[0538]
将4-环丙基-n-(3-(1,3-二羟丙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺(30mg,0.06mmol)溶于3mlnmp,加入羰基二咪唑(16mg, 0.1mmol)。反应体系于150℃搅拌两天。直接用prep-hplc纯化得8mg白色固 体,收率:24%。
[0539]
lc/ms:m/z=572.2[m+h]
+
.
[0540]
实施例50
[0541]
4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-氧代-1,4-二氮杂-5-基)苯基)
ꢀ‑
5-(三氟甲基)苯甲酰胺
[0542][0543]
步骤1:叔丁基(3-(2-溴乙酰氨基)-1-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰胺基)-2-氟苯基)丙基)氨基甲酸酯的合成
[0544]
将叔丁基(3-氨基-1-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基) 苯甲酰胺基)-2-氟苯基)丙基)氨基甲酸酯(62mg,0.1mmol)及三乙胺(20mg, 0.2mmol)溶于5ml二氯甲烷,体系冷却至0℃后加入溴乙酰溴(20mg,0.1 mmol)。反应液室温搅拌1小时后旋干,粗品经prep-tlc纯化(pe/ea=2/1), 得到55mg黄色固体,收率:74%。
[0545]
步骤2:n-(3-(1-氨基-3-(2-溴乙酰氨基)丙基)-4-氟苯基)-4-环丙基-2-(4
‑ꢀ
氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0546]
将叔丁基(3-(2-溴乙酰氨基)-1-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺基)-2-氟苯基)丙基)氨基甲酸酯(55mg,0.07mmol)溶于 5ml盐酸乙酸乙酯溶液搅拌反应1小时,反应体系旋干后得目标产物的盐酸盐, 直接用于下一步。
[0547]
步骤3:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-氧代-1,4-二氮杂-5
‑ꢀ
基)苯基)-5-(三氟甲基)苯甲酰胺的合成
[0548]
将上步产物溶于5ml四氢呋喃,加入碳酸钾(37mg,0.2mmol)后室温搅拌过 夜。过滤,滤液旋干后经prep-tlc纯化(dcm/meoh=10/1),得到16mg类白 色固体,两步收率:39%。
[0549]
lc/ms:m/z=560.2[m+h]
+
.
[0550]
实施例51
[0551]
4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-氧六氢嘧啶-4-基)苯基)-5
‑ꢀ
(三氟甲基)苯甲酰胺
[0552][0553]
将4-环丙基-n-(3-(1,3-二氨基丙基)-4-氟苯基)-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺(51mg,0.1mmol)溶于3ml四氢呋喃,加入碳酸钾(37mg, 0.2mmol)及三光气(30mg,0.1mmol)后室温搅拌6小时。过滤,滤液旋干后经 prep-tlc纯化(dcm/meoh=30/1),得到20mg白色固体,收率:36%。
[0554]
lc/ms:m/z=546.2[m+h]
+
.
[0555]
1h nmr(400mhz,d
6-dmso)δ0.57-0.60(2h,m),1.00-1.06(2h,m),1.70-1.77 (1h,m),2.00-2.03(1h,m),2.12-2.16(4h,m),2.92-2.94(1h,m),3.09-3.11(1h,m), 4.72-4.74(1h,m),6.34-6.37(2h,m),6.48(1h,s),7.05-7.23(4h,m),7.63-7.67(2h,m), 7.89(1h,s),10.53(1h,s).
[0556]
实施例52
[0557]
n-(3-氨基-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲 酰胺
[0558][0559]
步骤1:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-硝基苯基)-5-(三氟甲 基)苯甲酰胺的合成
[0560]
向反应瓶中加入4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(35mg, 0.1mmol),4-氟-3-硝基苯胺(16mg,0.1mmol),dipea(26mg,0.2mmol)和2ml四 氢呋喃,再加入hatu(38mg,0.1mmol),反应混合物室温搅拌过夜。反应体系倒 入10ml水中,乙酸乙酯萃取,有机相依次用1m的稀盐酸,1m氢氧化钠水溶液 及饱和食盐水各反洗两次,干燥,旋干,得到40mg黄色固体,收率:82%。
[0561]
步骤2:n-(3-氨基-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲 基)苯甲酰胺的合成
[0562]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-硝基苯基)-5-(三氟甲基) 苯甲酰胺(40mg,0.08mmol)溶于5ml甲醇,加入10mg pd/c(10%)。反应体 系在0.2mpa压力的氢气氛围下搅拌过夜。反应液过滤,滤液旋干后经prep-tlc 纯化(dcm/meoh=30/1),得到26mg白色固体,收率:68%。
[0563]
lc/ms:m/z=463.1[m+h]
+
.
[0564]
1h nmr(400mhz,d
6-dmso)δ0.55-0.58(2h,m),1.01-1.05(2h,m),2.08-2.15 (4h,m),5.20(2h,s),6.34(1h,s),6.74-6.76(1h,m),6.90-6.92(1h,m),7.07-7.08(2h, m),7.19-7.21(2h,m),7.87(1h,s),10.13(1h,s).
[0565]
实施例53
[0566]
n-(3-(4-氨基-5,5,5-三氟戊烷-2-基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯 氧基)-5-(三氟甲基)苯甲酰胺
[0567]
[0568]
步骤1:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(4-氧代丁烷-2-基)苯 基)-5-(三氟甲基)苯甲酰胺的合成
[0569]
将3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)-2
‑ꢀ
氟苯基)丁酸乙酯(281mg,0.5mmol)的5ml四氢呋喃溶液在氮气保护条件下冷却 至-70℃,滴加二异丁基氢化铝(1m正己烷溶液,0.5ml,0.5mmol),加毕后反应 体系于-70℃搅拌1小时。反应倒入20ml水中,乙酸乙酯萃取,有机相干燥并旋 干,经prep-tlc纯化(pe/ea=3/1),得到140mg黄色固体,收率:54%。
[0570]
步骤2:n-(3-(4-((叔丁基亚磺酰基)亚氨基)丁烷-2-基)-4-氟苯基)-4
‑ꢀ
环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0571]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(4-氧代丁烷-2-基)苯基)-5
‑ꢀ
(三氟甲基)苯甲酰胺(140mg,0.27mmol),碳酸铯(88mg,0.27mmol),及叔丁基 亚磺酰胺(33mg,0.27mmol)的3ml二氯甲烷溶液40℃搅拌过夜,反应体系过滤, 滤液旋干,得到165mg黄色固体,粗品直接用于下步反应。
[0572]
步骤3:n-(3-(4-((叔丁基亚磺酰基)氨基)-5,5,5-三氟戊烷-2-基)-4-氟苯 基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0573]
将n-(3-(4-((叔丁基亚磺酰基)亚氨基)丁烷-2-基)-4-氟苯基)-4-环丙基
ꢀ‑
2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺(165mg,0.27mmol)及四丁基 氟化铵(26mg,0.1mmol)的5ml四氢呋喃溶液于氮气保护下冷却至0℃,加入(三 氟甲基)三甲基硅烷(38mg,0.27mmol),反应液于0℃搅拌2小时,体系倒入20ml 水中,乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化(pe/ea=1/1),得到 30mg黄色固体,两步收率:16%。
[0574]
步骤4:n-(3-(4-氨基-5,5,5-三氟戊烷-2-基)-4-氟苯基)-4-环丙基-2-(4-氟
ꢀ‑
2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0575]
将n-(3-(4-((叔丁基亚磺酰基)氨基)-5,5,5-三氟戊烷-2-基)-4-氟苯基)
ꢀ‑
4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺(30mg,0.04mmol) 的5ml盐酸乙酸乙酯溶液室温搅拌1小时,反应体系旋干后加水,碳酸钠调ph 至碱性,乙酸乙酯萃取,有机相干燥旋干,经prep-tlc纯化(dcm/meoh=10/1), 得到12mg类白色固体,收率:48%。
[0576]
lc/ms:m/z=587.2[m+h]
+
.
[0577]
1h nmr(400mhz,d
6-dmso)δ0.57-0.59(2h,m),1.02-1.04(2h,m),1.16-1.22 (3h,m),1.75-1.77(1h,m),1.90-1.98(2h,m),2.10-2.15(4h,m),2.70-2.75(0.5h,m), 3.21-3.26(0.5h,m),6.39(1h,s),7.00-7.19(4h,m),7.45-7.51(1h,m),7.55-7.60(1h, m),7.90(1h,s),10.37-10.38(1h,m).
[0578]
实施例54
[0579]
n-(3-(5-(叔丁基氨基)-4-羟基戊烷-2-基)-4-氟苯基)-4-环丙基-2-(4-氟-2
‑ꢀ
甲基苯氧基)-5-(三氟甲基)苯甲酰胺
[0580][0581]
步骤1:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(1-(环氧乙烷-2-基) 丙-2-基)苯基)-5-(三氟甲基)苯甲酰胺的合成
[0582]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(4-氧代丁烷-2-基)苯基)-5
‑ꢀ
(三氟甲基)苯甲酰胺(45mg,0.087mmol)溶于2mldmso,依次加入叔丁醇钾(23 mg,0.20mmol)及三甲基碘化亚砜(22mg,0.10mmol)反应液室温搅拌4小时,体系 倒入10ml水中,乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化(pe/ea=2/1), 得到20mg白色固体,收率:43%。
[0583]
步骤2:n-(3-(5-(叔丁基氨基)-4-羟基戊烷-2-基)-4-氟苯基)-4-环丙基-2
‑ꢀ
(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0584]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(1-(环氧乙烷-2-基)丙-2
‑ꢀ
基)苯基)-5-(三氟甲基)苯甲酰胺(20mg,0.038mmol)溶于2ml dmf,加入 叔丁胺(15mg,0.20mmol)后升温至100℃搅拌6小时,体系倒入10ml水中, 乙酸乙酯萃取,有机相干燥并旋干,经prep-tlc纯化(dcm/meoh=10/1),得 到8mg白色固体,收率:35%。
[0585]
lc/ms:m/z=605.3[m+h]
+
.
[0586]
1h nmr(400mhz,d
6-dmso)δ0.56-0.58(2h,m),1.02-1.23(14h,m),1.60-1.68 (2h,m),1.97-2.02(1h,m),2.10-2.14(4h,m),3.24-3.26(2h,m),3.60-3.62(1h,m), 6.36-6.37(1h,m),7.06-7.12(3h,m),7.19-7.21(1h,m),7.41-7.44(1h,m),7.63-7.67 (1h,m),7.89(1h,s),10.36-10.37(1h,m).
[0587]
实施例55
[0588]
n-(3-(4-(叔丁基氨基)-3-羟基丁烷-2-基)-4-氟苯基)-4-环丙基-2-(4-氟-2
‑ꢀ
甲基苯氧基)-5-(三氟甲基)苯甲酰胺
[0589]
[0590]
步骤1:2-(2-氟-5-硝基苯基)-n-甲氧基-n-甲基乙酰胺的合成
[0591]
向反应瓶中加入2-氟-5-硝基苯乙酸(3000mg,15.1mmol),n,o-二甲基羟胺盐 酸盐(1510mg,15.5mmol),dipea(3870mg,30.0mmol)和50ml四氢呋喃,再加 入hatu(7600mg,20.0mmol),反应混合物室温搅拌4小时。反应体系倒入200ml 水中,乙酸乙酯萃取,有机相依次用1m的稀盐酸,1m氢氧化钠水溶液及饱和食盐 水各反洗两次,干燥,旋干,得到2900mg黄色固体,收率:79%。
[0592]
步骤2:2-(2-氟-5-硝基苯基)-n-甲氧基-n-甲基丙酰胺的合成
[0593]
将2-(2-氟-5-硝基苯基)-n-甲氧基-n-甲基乙酰胺(1000mg,4.1mmol)溶于10 mldmf,依次加入碳酸铯(2608mg,8.0mmol)及碘甲烷(582mg,4.1mmol)。反应 液室温搅拌过夜。体系倒入100ml水中,乙酸乙酯萃取,有机相用食盐水反洗两 次,干燥,旋干,得到940mg黄色固体,收率:89%。
[0594]
步骤3:2-(5-氨基-2-氟苯基)-n-甲氧基-n-甲基丙酰胺的合成
[0595]
将2-(2-氟-5-硝基苯基)-n-甲氧基-n-甲基丙酰胺(940mg,3.7mmol)溶于20ml 甲醇,加入100mg pd/c(10%)。反应体系在0.2mpa压力的氢气氛围下搅拌过夜。 反应液过滤,滤液旋干,得到700mg黄色固体,收率:84%。
[0596]
步骤4:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(1-(甲氧基(甲基) 氨基)-1-氧丙烷-2-基)苯基)-5-(三氟甲基)苯甲酰胺的合成
[0597]
向反应瓶中加入4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(210 mg,0.6mmol),2-(5-氨基-2-氟苯基)-n-甲氧基-n-甲基丙酰胺(130mg,0.6mmol),dipea(155mg,1.2mmol)和5ml四氢呋喃,再加入hatu(340mg,0.9mmol), 反应混合物室温搅拌4小时。反应体系倒入20ml水中,乙酸乙酯萃取,有机相依 次用1m的稀盐酸,1m氢氧化钠水溶液及饱和食盐水各反洗两次,干燥,旋干,得 到230mg黄色固体,收率:71%。
[0598]
步骤5:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(1-氧代丙烷-2-基)苯 基)-5-(三氟甲基)苯甲酰胺的合成
[0599]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(1-(甲氧基(甲基)氨基)
ꢀ‑
1-氧丙烷-2-基)苯基)-5-(三氟甲基)苯甲酰胺(230mg,0.4mmol)的5ml四氢 呋喃溶液在氮气保护条件下冷却至-70℃,滴加二异丁基氢化铝(1m正己烷溶液, 0.4ml,0.4mmol),加毕后反应体系于-70℃搅拌1.5小时。反应倒入20ml水中, 乙酸乙酯萃取,有机相干燥旋干,得到200mg黄色固体,收率:97%。
[0600]
步骤6:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(1-(环氧乙烷-2-基) 乙基)苯基)-5-(三氟甲基)苯甲酰胺的合成
[0601]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(1-氧代丙烷-2-基)苯基)-5
‑ꢀ
(三氟甲基)苯甲酰胺(100mg,0.20mmol)溶于2mldmso,依次加入叔丁醇钾(34 mg,0.30mmol)及三甲基碘化亚砜(44mg,0.20mmol)反应液室温搅拌过夜,体系倒 入10ml水中,乙酸乙酯萃取,有机相干燥旋干,经prep-tlc纯化(pe/ea=2/1), 得到60mg白色固体,收率:58%。
[0602]
步骤7:n-(3-(4-(叔丁基氨基)-3-羟基丁烷-2-基)-4-氟苯基)-4-环丙基-2
‑ꢀ
(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0603]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(1-(环氧乙烷-2-基)乙基) 苯
基)-5-(三氟甲基)苯甲酰胺(52mg,0.10mmol)溶于2mldmf,加入0.5ml氨 水后密封升温至100℃搅拌6小时,体系倒入10ml水中,乙酸乙酯萃取,有机相 干燥并旋干,经prep-tlc纯化(dcm/meoh=10/1),得到30mg白色固体,收率: 56%。
[0619]
lc/ms:m/z=537.2[m+h]
+
.
[0620]
1h nmr(400mhz,d
6-dmso)δ0.55-0.59(2h,m),1.01-1.05(2h,m),2.10-2.14 (4h,m),2.86-2.89(1h,m),3.03-3.06(1h,m),3.97-4.00(2h,m),4.04-4.08(1h,m), 5.83(1h,d,j=5.2hz),6.36(1h,s),7.05-7.11(3h,m),7.17-7.22(2h,m),7.65-7.68 (1h,m),7.89(1h,s),10.45(1h,s).
[0621]
实施例58
[0622]
n-(3-(3-氨基环丁氧基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺
[0623][0624]
步骤1:叔丁基(3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯 甲酰胺基)-2-氟苯氧基)环丁基)氨基甲酸酯的合成
[0625]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-羟基苯基)-5-(三氟甲基) 苯甲酰胺(93mg,0.2mmol),(3-羟基环丁基)氨基甲酸叔丁酯(37mg,0.2mmol), 及三苯基磷(105mg,0.4mmol)溶于3ml四氢呋喃,氮气保护室温下滴加diad(80 mg,0.4mmol),反应溶液室温搅拌3小时。系倒入水中,乙酸乙酯萃取,有机相干 燥旋干,经prep-tlc纯化(pe/ea=1/1),得到85mg类白色固体,收率:67%。
[0626]
步骤2:n-(3-(3-氨基环丁氧基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧 基)-5-(三氟甲基)苯甲酰胺的合成
[0627]
将叔丁基(3-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰 胺基)-2-氟苯氧基)环丁基)氨基甲酸酯(63mg,0.1mmol)的5ml盐酸乙酸乙酯 溶液室温搅拌1小时,反应体系旋干后加水,碳酸钠调ph至碱性,乙酸乙酯萃取, 有机相干燥旋干,经prep-tlc纯化(dcm/meoh=10/1),得到40mg类白色固体, 收率:75%。
[0628]
lc/ms:m/z=533.2[m+h]
+
.
[0629]
1h nmr(400mhz,d
6-dmso)δ0.57-0.61(2h,m),1.01-1.06(2h,m),1.75-1.81 (1h,m),1.90-2.15(7h,m),2.25-2.31(1h,m),2.71-2.76(1h,m),2.98-3.02(0.5h,m), 3.56-3.58(0.5h,m),4.22-4.25(0.5h,m),4.79-4.81(0.5h,m),6.40(1h,s),7.00-7.21 (5h,m),7.32-7.41(1h,m),7.89(1h,s),10.38-10.39(1h,m).
[0630]
实施例59
[0631]
4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-(甲基磺酰胺基)乙氧基) 苯基)-5-(三氟甲基)苯甲酰胺
[0632][0633]
将n-(3-(2-氨基乙氧基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺(51mg,0.1mmol)及dipea(26mg,0.2mmol)溶于3ml四 氢呋喃,室温下加入甲基磺酰氯(12mg,0.1mmol),反应溶液室温搅拌3小时。体 系倒入水中,乙酸乙酯萃取,有机相干燥旋干,经prep-tlc纯化(pe/ea=1/1), 得到45mg白色固体,收率:78%。
[0634]
lc/ms:m/z=585.2[m+h]
+
.
[0635]
1h nmr(400mhz,d
6-dmso)δ0.56-0.60(2h,m),1.01-1.05(2h,m),2.10-2.15 (4h,m),2.96(3h,s),3.37-3.40(2h,m),4.03-4.06(2h,m),6.37(1h,s),7.05-7.07(2h, m),7.16-7.22(3h,m),7.33-7.34(1h,m),7.55-7.57(1h,m),7.90(1h,s),10.41(1h,s).
[0636]
实施例60
[0637]
4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(3,3,3-三氟-2-羟基丙氧基)苯 基)-5-(三氟甲基)苯甲酰胺
[0638][0639]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-羟基苯基)-5-(三氟甲基) 苯甲酰胺(46mg,0.1mmol),碳酸钾(41mg,0.3mmol)及3-溴-1,1,1-三氟丙烷-2-醇(19 mg,0.1mmol)的3mlnmp溶液110℃搅拌过夜,反应体系倒入10ml水中,乙 酸乙酯萃取,有机相干燥旋干,经prep-tlc纯化(ea),得到35mg白色固体, 收率:52%。
[0640]
lc/ms:m/z=576.1[m+h]
+
.
[0641]
实施例61
[0642]
4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-氧代-2-(((2,2,2-三氟乙 基)氨基)乙氧基)苯基)-5-(三氟甲基)苯甲酰胺
[0643][0644]
步骤1:2-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)
ꢀ‑
2-氟苯氧基)乙酸乙酯的合成
[0645]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-羟基苯基)-5-(三氟甲基) 苯甲酰胺(46mg,0.1mmol),碳酸钾(28mg,0.2mmol),及溴乙酸乙酯(17mg,0.1 mmol)的3ml乙腈溶液60℃搅拌2小时,反应体系过滤,滤液旋干,得到55mg 黄色固体,粗品直接用于下步反应。
[0646]
步骤2:2-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)
ꢀ‑
2-氟苯氧基)乙酸的合成
[0647]
将2-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)-2
‑ꢀ
氟苯氧基)乙酸乙酯(55mg,0.1mmol)溶于2ml甲醇,加入1ml水及一水合氢氧 化锂(17mg,0.4mmol),反应液室温搅拌6小时,反应体系倒入10ml水中,1m 稀盐酸调节ph值至酸性,乙酸乙酯萃取,有机相干燥旋干,得到45mg白色固体, 收率:87%。
[0648]
步骤3:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-氧代-2-(((2,2,2
‑ꢀ
三氟乙基)氨基)乙氧基)苯基)-5-(三氟甲基)苯甲酰胺的合成
[0649]
向反应瓶中加入2-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯 甲酰胺基)-2-氟苯氧基)乙酸(42mg,0.08mmol),2,2,2-三氟乙基胺(10mg,0.1 mmol),dipea(26mg,0.2mmol)和3ml四氢呋喃,再加入hatu(38mg,0.1mmol), 反应混合物室温搅拌4小时。反应体系倒入10ml水中,乙酸乙酯萃取,有机相干 燥,旋干,经prep-tlc纯化(pe/ea=1/1),得到35mg白色固体,收率:73%。
[0650]
lc/ms:m/z=603.2[m+h]
+
.
[0651]
1h nmr(400mhz,d
6-dmso)δ0.56-0.58(2h,m),1.03-1.06(2h,m),2.10-2.14 (4h,m),3.90-3.99(2h,m),4.65(2h,s),6.35(1h,s),7.04-7.11(2h,m),7.20-7.22(2h, m),7.48(1h,d,j=7.6hz),7.88(1h,s),7.17(1h,t,j=6.4hz),10.44(1h,s).
[0652]
实施例62
[0653]
(2-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺基)-2
‑ꢀ
氟苯氧基)乙基)氨基甲酸酯
[0654][0655]
步骤1:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-羟基乙氧基)苯基)
ꢀ‑
5-(三氟甲基)苯甲酰胺的合成
[0656]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-羟基苯基)-5-(三氟甲基) 苯
甲酰胺(92mg,0.2mmol),碳酸钾(41mg,0.3mmol),及溴乙醇(25mg,0.2mmol) 的3mlnmp溶液110℃搅拌5小时,反应体系倒入15ml水中,乙酸乙酯萃取, 有机相干燥,旋干,得到100mg黄色固体。
[0657]
步骤2:(2-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺 基)-2-氟苯氧基)乙基)1h-咪唑-1-羧酸酯的合成
[0658]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-羟基乙氧基)苯基)-5
‑ꢀ
(三氟甲基)苯甲酰胺(80mg,0.16mmol)及cdi(32mg,0.2mmol)的4ml四氢呋 喃溶液50℃搅拌4小时。反应体系旋干后得到的粗品直接用于下步反应。
[0659]
步骤3:(2-(5-(4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺 基)-2-氟苯氧基)乙基)氨基甲酸酯的合成
[0660]
将上一步反应产物溶于5ml氨-二氧六环溶液(1m)反应液于50℃搅拌4小 时,旋干,粗品经prep-hplc纯化,得到20mg白色固体,两步收率:23%。
[0661]
lc/ms:m/z=551.2[m+h]
+
.
[0662]
1h nmr(400mhz,d
6-dmso)δ0.57-0.59(2h,m),1.03-1.06(2h,m),2.10-2.15 (4h,m),4.16-4.17(2h,m),4.25-4.26(2h,m),6.38(1h,s),7.05-7.22(5h,m),7.55-7.57 (1h,m),7.91(1h,s),10.41(1h,s).
[0663]
实施例63
[0664]
4-环丙基-n-(2-(2,3-二羟基丙氧基)吡啶-4-基)-2-(4-氟-2-甲基苯氧基)-5
‑ꢀ
(三氟甲基)苯甲酰胺
[0665]
实施例64
[0666]
n-(2-(3-(叔丁基氨基)-2-羟基丙氧基)吡啶-4-基)-4-环丙基-2-(4-氟-2
‑ꢀ
甲基苯氧基)-5-(三氟甲基)苯甲酰胺
[0667][0668]
步骤1:2-(((2,2-二甲基-1,3-二氧戊环-4-基)甲氧基)吡啶-4-胺的合成
[0669]
称取2-氯吡啶-4-胺(128mg,1.0mmol)及丙酮缩甘油(264mg,2.0mmol)于烧瓶, 加入金属钠(46mg,2.0mmol),所得混合物于130℃搅拌2小时,反应体系冷却后 倒入15ml水中,乙酸乙酯萃取,有机相干燥,旋干,经柱层析纯化(pe/ea=1/1) 得到100mg黄色油状物,产率:44%。
[0670]
步骤2:4-环丙基-n-(2-(((2,2-二甲基-1,3-二氧杂戊环-4-基)甲氧基)吡啶 基-4-基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0671]
向反应瓶中加入4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酸(142 mg,0.4mmol),2-(((2,2-二甲基-1,3-二氧戊环-4-基)甲氧基)吡啶-4-胺(100mg, 0.44mmol),dipea(103mg,0.8mmol)和5ml四氢呋喃,再加入hatu(228mg,0.6mmol),反应混合物室温搅拌4小时。反应体系倒入20ml水中,乙酸乙酯萃取, 有机相干燥,旋干,经prep-tlc纯化(pe/ea=3/1),得到130mg白色固体,收 率:58%。
[0672]
步骤3:4-环丙基-n-(2-(2,3-二羟基丙氧基)吡啶-4-基)-2-(4-氟-2-甲基苯 氧
基)-5-(三氟甲基)苯甲酰胺的合成
[0673]
将4-环丙基-n-(2-(((2,2-二甲基-1,3-二氧杂戊环-4-基)甲氧基)吡啶基-4
‑ꢀ
基)-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺(130mg,0.23mmol)的5ml 盐酸乙酸乙酯溶液室温搅拌1小时,反应体系旋干后加水,碳酸钠调ph至碱性, 乙酸乙酯萃取,有机相干燥旋干,经prep-tlc纯化(dcm/meoh=10/1),得到105 mg白色固体,收率:87%。
[0674]
lc/ms:m/z=521.2[m+h]
+
.
[0675]
1h nmr(400mhz,d
6-dmso)δ0.58-0.60(2h,m),1.02-1.06(2h,m),2.10-2.13 (4h,m),3.40-3.50(2h,m),3.74-3.79(1h,m),4.08-4.13(1h,m),4.22-4.26(1h,m), 6.39(1h,s),7.04-7.16(5h,m),7.91(1h,s),8.02(1h,d,j=5.6hz),10.72(1h,s).
[0676]
步骤4:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(2-(环氧乙烷-2-基甲氧基)吡 啶-4-基)-5-(三氟甲基)苯甲酰胺的合成
[0677]
将4-环丙基-n-(2-(2,3-二羟基丙氧基)吡啶-4-基)-2-(4-氟-2-甲基苯氧基)
ꢀ‑
5-(三氟甲基)苯甲酰胺(104mg,0.2mmol),碳酸钾(41mg,0.3mmol),及甲基 黄酰氯(23mg,0.2mmol)的3ml乙腈溶液室温搅拌1小时,再升至60℃搅拌2小 时,反应体系过滤,滤液旋干,得到120mg黄色固体,粗品直接用于下步反应。
[0678]
步骤5:n-(2-(3-(叔丁基氨基)-2-羟基丙氧基)吡啶-4-基)-4-环丙基-2-(4
‑ꢀ
氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0679]
将上一步所得产物溶于2ml dmf,加入叔丁胺(73mg,1.0mmol)后升温至 100℃搅拌6小时,体系倒入10ml水中,乙酸乙酯萃取,有机相干燥并旋干,经 prep-tlc纯化(dcm/meoh=10/1),得到15mg类白色固体,两步收率:13%。
[0680]
lc/ms:m/z=576.2[m+h]
+
.
[0681]
实施例65
[0682]
4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-羟基-3-(2-羟基乙酰氨基) 丙氧基)苯基)-5-(三氟甲基)苯甲酰胺
[0683][0684]
步骤1:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(环氧乙烷-2-基甲氧基) 苯基)-5-(三氟甲基)苯甲酰胺的合成
[0685]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-羟基苯基)-5-(三氟甲基) 苯甲酰胺(92mg,0.2mmol)溶于3mldmf,加入碳酸钾(55mg,0.4mmol)及间硝 基苯磺酸缩水甘油酯(52mg,0.2mmol)。反应液60℃搅拌6小时。体系倒入20ml 水中,乙酸乙酯萃取,有机相干燥旋干,经prep-tlc纯化(pe/ea=3/1),得到100 mg类白色固体,收率:96%。
[0686]
步骤2:n-(3-(3-氨基-2-羟基丙氧基)-4-氟苯基)-4-环丙基-2-(4-氟-2-甲基 苯氧基)-5-(三氟甲基)苯甲酰胺的合成
[0687]
将4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(环氧乙烷-2-基甲氧基)苯 基)-5-(三氟甲基)苯甲酰胺(52mg,0.10mmol)溶于2mldmf,加入0.5ml氨 水后密封升温至
100℃搅拌6小时,体系倒入10ml水中,乙酸乙酯萃取,有机相 干燥并旋干,经prep-tlc纯化(dcm/meoh=10/1),得到30mg白色固体,收率: 56%。
[0688]
步骤3:4-环丙基-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-羟基-3-(2-羟基乙 酰氨基)丙氧基)苯基)-5-(三氟甲基)苯甲酰胺的合成
[0689]
向反应瓶中加入羟基乙酸(5mg,0.06mmol),n-(3-(3-氨基-2-羟基丙氧基)
ꢀ‑
4-氟苯基)-4-环丙基-2-(4-氟-2-甲基苯氧基)-5-(三氟甲基)苯甲酰胺(30mg,0.06 mmol),dipea(26mg,0.2mmol)和3ml四氢呋喃,再加入hatu(38mg,0.1mmol), 反应混合物室温搅拌4小时。反应体系倒入20ml水中,乙酸乙酯萃取,有机相干 燥,旋干,经prep-tlc纯化(dcm/meoh=20/1),得到20mg白色固体,收率: 61%。
[0690]
lc/ms:m/z=595.2[m+h]
+
.
[0691]
1h nmr(400mhz,d
6-dmso)δ0.56-0.59(2h,m),1.01-1.06(2h,m),2.12-2.15 (4h,m),3.18-3.23(1h,m),3.35-3.38(1h,m),3.81(2h,d,j=6.0hz),3.85-3.92(3h, m),5.31(1h,d,j=4.8hz),5.50(1h,t,j=5.6hz),6.37(1h,s),7.05-7.08(2h,m), 7.15-7.21(3h,m),7.54(1h,d,j=6.8hz),7.70-7.73(1h,m),7.90(1h,s),10.40(1h, s).
[0692]
表二:按照与上述实施例所阐述操作类似的操作,以相应的试剂为原料制备以下化 合物。
[0693]
[0694]
[0695]
[0696]
[0697]
[0698]
[0699]
[0700]
[0701]
[0702][0703]
实施例113
[0704]
(s)-5-氯-n-(2-(2,3-二羟基丙氧基)吡啶-4-基)-2-(4-氟-2-甲基苯氧基)-4-(三氟甲基) 苯甲酰胺
[0705][0706]
步骤1:(r)-2-((2,2-二甲基-1,3-二氧戊环-4-基)甲氧基)吡啶-4-胺的合成
[0707]
称取2-氯吡啶-4-胺(128mg,1.0mmol)及(r)-(-)-甘油醇缩丙酮(264mg,2.0mmol) 于烧瓶,加入金属钠(46mg,2.0mmol),所得混合物于130℃搅拌2小时,反应体 系冷却后倒入15ml水中,乙酸乙酯萃取,有机相干燥,旋干,经柱层析纯化 (pe/ea=1/1)得到120mg黄色油状物,产率:54%。
[0708]
步骤2:(r)-5-氯-n-(2-((2,2-二甲基-1,3-二氧戊环-4-基)甲氧基)吡啶-4-基)-2-(4
‑ꢀ
氟-2-甲基苯氧基))-4-(三氟甲基)苯甲酰胺的合成
[0709]
向反应瓶中加入5-氯-2-(4-氟-2-甲基苯氧基)-4-(三氟甲基)苯甲酸(186mg,0.54 mmol),(r)-2-((2,2-二甲基-1,3-二氧戊环-4-基)甲氧基)吡啶-4-胺(120mg,0.54mmol), dipea(129mg,1.00mmol)和5ml四氢呋喃,再加入hatu(266mg,0.7mmol), 反应混合物室温搅拌4小时。反应体系倒入20ml水中,乙酸乙酯萃取,有机相干 燥,旋干,经prep-tlc纯化(pe/ea=3/1),得到180mg白色固体,收率:60%。
[0710]
步骤3:(s)-5-氯-n-(2-(2,3-二羟基丙氧基)吡啶-4-基)-2-(4-氟-2-甲基苯氧 基)-4-(三氟甲基)苯甲酰胺的合成
[0711]
将(r)-5-氯-n-(2-((2,2-二甲基-1,3-二氧戊环-4-基)甲氧基)吡啶-4-基)-2-(4-氟-2-甲 基苯氧基))-4-(三氟甲基)苯甲酰胺(100mg,0.18mmol)的5ml盐酸乙酸乙酯溶液室 温搅拌1小时,反应体系旋干后加水,碳酸钠调ph至碱性,乙酸乙酯萃取,有机 相干燥旋干,经prep-tlc纯化(dcm/meoh=10/1),得到80mg白色固体,收率: 86%。
[0712]
lc/ms:m/z=515.1[m+h]
+
.
[0713]
1h nmr(400mhz,d
6-dmso)δ2.16(3h,s),3.40-3.43(2h,m),3.75-3.79(1h, m),4.09-4.13(1h,m),4.23-4.27(1h,m),4.64(1h,t,j=5.6hz),4.92(1h,d,j=5.2 hz),7.09-7.16(5h,m),7.21(1h,d,j=9.2hz),8.05(1h,d,j=5.6hz),8.08(1h,s), 10.94(1h,s).
[0714]
实施例114
[0715]
(r)-5-氯-n-(2-(2,3-二羟基丙氧基)吡啶-4-基)-2-(4-氟-2-甲基苯氧基)-4-(三氟甲 基)苯甲酰胺
[0716][0717]
步骤1:(s)-2-((2,2-二甲基-1,3-二氧戊环-4-基)甲氧基)吡啶-4-胺的合成
[0718]
称取2-氯吡啶-4-胺(128mg,1.0mmol)及(s)-(+)-甘油醇缩丙酮(264mg,2.0mmol) 于烧瓶,加入金属钠(46mg,2.0mmol),所得混合物于130℃搅拌2小时,反应体 系冷却后倒入15ml水中,乙酸乙酯萃取,有机相干燥,旋干,经柱层析纯化 (pe/ea=1/1)得到130mg黄色油状物,产率:58%。
[0719]
步骤2:(s)-5-氯-n-(2-((2,2-二甲基-1,3-二氧戊环-4-基)甲氧基)吡啶-4-基)-2-(4
‑ꢀ
氟-2-甲基苯氧基))-4-(三氟甲基)苯甲酰胺的合成
[0720]
向反应瓶中加入5-氯-2-(4-氟-2-甲基苯氧基)-4-(三氟甲基)苯甲酸(186mg,0.54 mmol),(s)-2-((2,2-二甲基-1,3-二氧戊环-4-基)甲氧基)吡啶-4-胺(120mg,0.54mmol), dipea(129mg,1.00mmol)和5ml四氢呋喃,再加入hatu(266mg,0.7mmol), 反应混合物室温搅拌4小时。反应体系倒入20ml水中,乙酸乙酯萃取,有机相干 燥,旋干,经prep-tlc纯化(pe/ea=3/1),得到205mg白色固体,收率:68%。
[0721]
步骤3:(r)-5-氯-n-(2-(2,3-二羟基丙氧基)吡啶-4-基)-2-(4-氟-2-甲基苯氧 基)-4-(三氟甲基)苯甲酰胺的合成
[0722]
将(s)-5-氯-n-(2-((2,2-二甲基-1,3-二氧戊环-4-基)甲氧基)吡啶-4-基)-2-(4-氟-2-甲 基苯氧基))-4-(三氟甲基)苯甲酰胺(100mg,0.18mmol)的5ml盐酸乙酸乙酯溶液室 温搅拌1小时,反应体系旋干后加水,碳酸钠调ph至碱性,乙酸乙酯萃取,有机 相干燥旋干,经prep-tlc纯化(dcm/meoh=10/1),得到75mg白色固体,收率: 81%。
[0723]
lc/ms:m/z=515.1[m+h]
+
.
[0724]
1h nmr(400mhz,d
6-dmso)δ2.16(3h,s),3.40-3.43(2h,m),3.75-3.79(1h, m),4.09-4.13(1h,m),4.23-4.27(1h,m),4.64(1h,t,j=5.6hz),4.92(1h,d,j=5.2 hz),7.09-7.16(5h,m),7.21(1h,d,j=9.2hz),8.05(1h,d,j=5.6hz),8.08(1h,s), 10.94(1h,s).
[0725]
实施例117
[0726]
(r)-5-氯-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-羟基-3-(2-羟基乙酰氨基)丙氧基) 苯基)-4-(三氟甲基))苯甲酰胺
[0727][0728]
步骤1:5-氯-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-羟基苯基)-4-(三氟甲基)苯甲
酰胺 的合成
[0729]
向反应瓶中加入5-氯-2-(4-氟-2-甲基苯氧基)-4-(三氟甲基)苯甲酸(209mg,0.6 mmol),5-氨基-2-氟苯酚(76mg,0.6mmol),dipea(155mg,1.2mmol)和5ml四 氢呋喃,再加入hatu(340mg,0.9mmol),反应混合物室温搅拌4小时。反应体系 倒入20ml水中,乙酸乙酯萃取,有机相依次用1m的稀盐酸,1m氢氧化钠水溶 液及饱和食盐水各反洗两次,干燥,旋干,得到185mg黄色固体,收率:68%。
[0730]
步骤2:(r)-5-氯-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(环氧乙烷-2-基甲氧基)苯 基)-4-(三氟甲基)苯甲酰胺的合成
[0731]
将5-氯-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-羟基苯基)-4-(三氟甲基)苯甲酰胺(91 mg,0.2mmol)溶于3mldmf,加入碳酸钾(55mg,0.4mmol)及(r)-(-)-间硝基苯磺 酸缩水甘油酯(52mg,0.2mmol)。反应液60℃搅拌6小时。体系倒入20ml水中, 乙酸乙酯萃取,有机相干燥旋干,经prep-tlc纯化(pe/ea=3/1),得到100mg 类白色固体,收率:96%。
[0732]
步骤3:(r)-n-(3-(3-氨基-2-羟基丙氧基)-4-氟苯基)-5-氯-2-(4-氟-2-甲基苯氧 基)-4-(三氟甲基)苯甲酰胺的合成
[0733]
将(r)-5-氯-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(环氧乙烷-2-基甲氧基)苯基)-4-(三 氟甲基)苯甲酰胺(100mg,0.19mmol)溶于2mldmf,加入0.5ml氨水后密封升温 至100℃搅拌6小时,体系倒入10ml水中,乙酸乙酯萃取,有机相干燥并旋干, 经prep-tlc纯化(dcm/meoh=10/1),得到75mg白色固体,收率:73%。
[0734]
步骤4:(r)-5-氯-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-羟基-3-(2-羟基乙酰氨基) 丙氧基)苯基)-4-(三氟甲基))苯甲酰胺的合成
[0735]
向反应瓶中加入羟基乙酸(10mg,0.12mmol),(r)-n-(3-(3-氨基-2-羟基丙氧 基)-4-氟苯基)-5-氯-2-(4-氟-2-甲基苯氧基)-4-(三氟甲基)苯甲酰胺(64mg,0.12 mmol),dipea(52mg,0.4mmol)和3ml四氢呋喃,再加入hatu(76mg,0.2mmol), 反应混合物室温搅拌4小时。反应体系倒入20ml水中,乙酸乙酯萃取,有机相干 燥,旋干,经prep-tlc纯化(dcm/meoh=20/1),得到45mg白色固体,收率: 63%。
[0736]
lc/ms:m/z=589.1[m+h]
+
.
[0737]
1h nmr(400mhz,d
6-dmso)δ2.18(3h,s),3.17-3.24(1h,m),3.34-3.39(1h, m),3.81-3.83(2h,m),3.88-3.93(3h,m),5.33(1h,d,j=4.8hz),5.52(1h,t,j=5.6 hz),7.09-7.23(6h,m),7.53(1h,dd,j=7.6hz,2.0hz),7.72-7.75(1h,m),8.04(1h,s), 10.63(1h,s).
[0738]
实施例118
[0739]
(s)-5-氯-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-羟基-3-(2-羟基乙酰氨基)丙氧基)苯 基)-4-(三氟甲基))苯甲酰胺
[0740][0741]
步骤1:(s)-5-氯-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(环氧乙烷-2-基甲氧基)
苯 基)-4-(三氟甲基)苯甲酰胺的合成
[0742]
将5-氯-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-羟基苯基)-4-(三氟甲基)苯甲酰胺(91 mg,0.2mmol)溶于3mldmf,加入碳酸钾(55mg,0.4mmol)及(s)-(+)-间硝基苯磺 酸缩水甘油酯(52mg,0.2mmol)。反应液60℃搅拌6小时。体系倒入20ml水中, 乙酸乙酯萃取,有机相干燥旋干,经prep-tlc纯化(pe/ea=3/1),得到95mg类 白色固体,收率:92%。
[0743]
步骤2:(s)-n-(3-(3-氨基-2-羟基丙氧基)-4-氟苯基)-5-氯-2-(4-氟-2-甲基苯氧 基)-4-(三氟甲基)苯甲酰胺的合成
[0744]
将(s)-5-氯-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(环氧乙烷-2-基甲氧基)苯基)-4-(三 氟甲基)苯甲酰胺(95mg,0.19mmol)溶于2ml dmf,加入0.5ml氨水后密封升温 至100℃搅拌6小时,体系倒入10ml水中,乙酸乙酯萃取,有机相干燥并旋干, 经prep-tlc纯化(dcm/meoh=10/1),得到80mg白色固体,收率:82%。
[0745]
步骤3:(s)-5-氯-2-(4-氟-2-甲基苯氧基)-n-(4-氟-3-(2-羟基-3-(2-羟基乙酰氨基) 丙氧基)苯基)-4-(三氟甲基))苯甲酰胺的合成
[0746]
向反应瓶中加入羟基乙酸(10mg,0.12mmol),(s)-n-(3-(3-氨基-2-羟基丙氧 基)-4-氟苯基)-5-氯-2-(4-氟-2-甲基苯氧基)-4-(三氟甲基)苯甲酰胺(64mg,0.12 mmol),dipea(52mg,0.4mmol)和3ml四氢呋喃,再加入hatu(76mg,0.2mmol), 反应混合物室温搅拌4小时。反应体系倒入20ml水中,乙酸乙酯萃取,有机相干 燥,旋干,经prep-tlc纯化(dcm/meoh=20/1),得到50mg白色固体,收率: 70%。
[0747]
lc/ms:m/z=589.1[m+h]
+
.
[0748]
1h nmr(400mhz,d
6-dmso)δ2.18(3h,s),3.17-3.24(1h,m),3.34-3.39(1h, m),3.81-3.83(2h,m),3.88-3.93(3h,m),5.33(1h,d,j=4.8hz),5.52(1h,t,j=5.6 hz),7.09-7.23(6h,m),7.53(1h,dd,j=7.6hz,2.0hz),7.72-7.75(1h,m),8.04(1h,s), 10.63(1h,s).
[0749]
表三:按照与上述实施例所阐述操作类似的操作,以相应的试剂为原料制备以 下化合物。
[0750]
[0751]
[0752]
[0753][0754]
成药性试验
[0755]
试验例1:化合物对hek293细胞的人类nav1.8离子通道的抑制活性试验
[0756]
1:测试化合物配方
[0757]
试剂除用于酸碱滴定的naoh和koh外,均从sigma(st.louis,mo)公司购 买。测试化合物的最终浓度均在当天配制,再溶于细胞外液。细胞外液(mm)为: nacl,137;kcl,4;cacl2,1.8;mgcl2,1;hepes,10;glucose 10;ph 7.4(naoh 滴定)。细胞内液(mm)为aspartic acid,140;mgcl2,2;egta 11;hepes,10; ph 7.2(csoh滴定)。所有测试化合物溶液均含1μm ttx。
[0758]
测试化合物的保存浓度为3mm。溶于二甲基亚砜(dmso)。测试当天再溶于 细胞外液,配置成要求浓度。
[0759]
测试化合物溶剂
[0760][0761]
2:测试方法
[0762]
2.1:细胞
[0763]
所有实验都在室温下进行。每个细胞都以自身为对照。
[0764]
2.1.1:化合物的测试
[0765]
化合物均采用利用自身重力的灌流系统进行灌流。每个浓度至少测试一个细胞。 在电流稳定(或5分钟)后,再比较化合物使用前后的电流大小变化来计算化合物的 阻断作用。
[0766]
2.1.2:试验细胞
[0767]
nav1.8离子通道稳态表达的hek293细胞。
[0768]
2.1.3:实验仪器
[0769]
膜片钳放大器:patch clamp pc-505b(warner instruments)/multiclamp 700a (axon instrument)
[0770]
数模转换器:digidata 1440a(axon cns)/digidata 1550a(axon instruments)
[0771]
微操控仪:mp-225(sutter instrument)
[0772]
倒置显微镜:tl4(olympus)
[0773]
玻璃微电极拉制仪:pc-10(narishige)
[0774]
微电极玻璃毛细管:b12024f(武汉微探科学仪器有限公司)
[0775]
2.2:电生理
[0776]
将细胞转移到灌流槽中,用细胞外液进行灌流。细胞内液(mm)为aspartic acid, 140;mgcl2,2;egta 11;hepes,10;ph 7.2(csoh滴定)。细胞内液分批少量储存 于-80度冰箱,实验当天融化。电极用pc-10(narishige,japan)拉制。全细胞膜 片钳记录,噪音用采样频率的五分之一进行过滤。
[0777]
2.3:测试电压方程(resting)及结果
[0778]
将细胞钳制在
–
80mv,然后用持续10毫秒方波去极化到10mv,以得到nav1.8 电流。这一程序每5秒重复一次。检测方波引发的最大电流,待其稳定后,灌流测 试化合物,当反应稳定后,计算阻断的强度。
[0779]
表四:化合物对nav1.8的抑制率(100nm浓度下的抑制率/%:a》=80,80》b》=50, 50》c》=20,d《20)
[0780]
实施例抑制活性实施例抑制活性实施例抑制活性1b2d3a4b5b6b7a8a9a10a11a12b13c14b15c16d17d18d19a20b21b22a23b24a25c26c27a28c29b30b31b32c33d34b35a36a37a38b39a40b41a42a43b44b45na
ꢀꢀꢀꢀ
vx-150b
[0781]
表五(续表四):化合物对nav1.8的抑制率(100nm浓度下的抑制率/%:a》=80, 80》b》=50,50》c》=20,d《20)
[0782][0783][0784]
本专利多个实施例相对于vx-150(临床二期)具有较为明显的活性优势,另有 部分实施例的活性与之相当。
[0785]
试验例2:化合物对hek293细胞herg离子通道的抑制活性试验
[0786]
该实验作为化合物心脏安全性实验。
[0787]
1:试验仪器
[0788]
膜片钳仪器:pc-505b、mc-700a
[0789]
微操控仪器:mp—225
[0790]
拉制电极仪器:pc-10(narishige,japan)
[0791]
2:药物配制
[0792]
化合物除用于酸碱滴定的naoh和koh外,均从sigma(st.louis,mo)公司购 买。测试化合物的最终浓度均在当天配制,再溶于细胞外液。细胞外液(mm)为:nacl, 137;kcl,4;cacl2,1.8;mgcl2,1;hepes,10;glucose 10;ph 7.4(naoh滴定)。所有 测试化合物和对照化合物溶液均含0.3%dmso。细胞内液(mm)为:k aspartate,130; mgcl2,5;egta 5;hepes,10;tris-atp 4;ph 7.2(koh滴定)。
[0793]
3:试验方法
[0794]
细胞:所有实验都在室温下进行。每个细胞都以自身为对照。
[0795]
化合物的测试:化合物均采用利用自身重力的灌流系统进行灌流。每个浓度至 少测试两个细胞。在电流稳定(或5分钟)后,再比较化合物使用前后的电流大小变化 来计算化合物的阻断作用。
[0796]
阳性对照:阳性对照cisapride浓度选择是根据它对细胞敏感性测试,阻断率90% 左右的浓度为阳性对照最佳浓度。经测试cisapride为100nm时,阻断率为90%左右, 故阳性对照cisapride定为100nm。方法和测试化合物一样。
[0797]
电生理:将细胞转移到灌流槽中,用细胞外液进行灌流。细胞内液(mm)为:k aspartate,130;mgcl2,5;egta 5;hepes,10;tris-atp 4;ph 7.2(koh滴定)。细胞 内液分批少量储存于-80度冰箱,实验当天融化。电极用pc-10(narishige,japan) 拉制。全细胞膜片钳记录,噪音用采样频率的五分之一进行过滤。
[0798]
测试过程和结果:将细胞钳制在
–
80mv,然后用持续4秒方波去极化到40mv, 再用持续2秒方波超极化到-40mv,以得到herg尾电流。这一程序每20秒重复一次。 herg尾电流是纯herg电流。检测第二个方波引发的最大尾电流,待其稳定后,灌 流测试化合物,当反应稳定后,计算阻断的强度。
[0799]
表六:化合物对herg抑制的ic50测试结果
[0800]
实施例ic50(um)实施例ic50(um)13.23610.5383.01043.811422.311615.61176.01194.2vx-1507.0
ꢀꢀ
[0801]
化合物对herg的强抑制会产生心脏qt间期延长等严重的心脏安全风险。从 表9数据可见:本专利部分化合物对herg的抑制明显弱于vx-150(临床二期), 因此很可能会表现出更好的心脏安全性。
[0802]
试验例3:化合物对nav离子通道亚型选择性测试
[0803]
实验的目的是为了调查化合物对稳态表达的人类na离子通道细胞(nav1.1, nav1.3,nav1.4,nav1.5,nav1.6,nav1.7)的作用。在na离子电流稳定后,比 较化合物应用前后na通道电流的大小,可以得到化合物对na离子通道的影响。
[0804]
1:测试化合物配方
[0805]
化合物除用于酸碱滴定的naoh和koh外,均从sigma(st.louis,mo)公司购 买。测试化合物的最终浓度均在当天配制,再溶于细胞外液。细胞外液(mm)为:nacl, 137;kcl,4;cacl2,1.8;mgcl2,1;hepes,10;glucose 10;ph 7.4(naoh滴定)。
[0806]
测试化合物的保存浓度为9 mm。溶于二甲基亚砜(dmso)。测试当天再溶 于细胞外液,配置成1 um的筛选浓度。
[0807]
2:测试方法
[0808]
2.1:细胞
[0809]
所有实验都在室温下进行。每个细胞都以自身为对照。
[0810]
2.1.1化合物的测试
[0811]
化合物均采用利用自身重力的灌流系统进行灌流。每个浓度至少测试1个细胞。 在电流稳定(或5分钟)后,再比较化合物使用前后的电流大小变化来计算化合物的阻 断作用。
[0812]
2.1.2实验细胞/试剂
[0813]
nav1.1,nav1.3,nav1.4,nav1.5,nav1.6离子通道稳态表达的hek293细胞。 nav1.7离子通道稳态表达的cho细胞。
[0814]
2.1.3实验仪器
[0815]
膜片钳放大器:patch clamp pc-505b(warner instruments)/multiclamp 700a (axon instrument)
[0816]
数模转换器:digidata 1440a(axon cns)/digidata 1550a(axon instruments)
[0817]
微操控仪:mp-225(sutter instrument)
[0818]
倒置显微镜:tl4(olympus)
[0819]
玻璃微电极拉制仪:pc-10(narishige)
[0820]
微电极玻璃毛细管:b12024f(武汉微探科学仪器有限公司)
[0821]
2.2电生理
[0822]
将细胞转移到灌流槽中,用细胞外液进行灌流。细胞内液(mm)为aspartic acid, 140;mgcl2,2;egta 11;hepes,10;ph 7.2(csoh滴定)。细胞内液分批少量储存于
ꢀ‑
80度冰箱,实验当天融化。电极用pc-10(narishige,japan)拉制。全细胞膜片钳 记录,噪音用采样频率的五分之一进行过滤。
[0823]
2.3测试电压方程(resting)及结果
[0824]
将细胞钳制在
–
80mv,然后用持续10毫秒方波去极化到-10mv,以得到na离 子通道电流。这一程序每5秒重复一次。检测方波引发的最大电流,待其稳定后,灌 流测试化合物,当反应稳定后,计算阻断的强度。
[0825]
表七:化合物在1um浓度下对nav亚型的抑制率
[0826]
实施例nav1.1nav1.3nav1.4nav1.5nav1.6nav1.71《1%13.4%《1%7.4%《1%9.5%1041.5%4.3%《1%《1%2.8%1.3%1144.8%4.4%2.7%5.9%8.3%《1%1161.2%3.7%《1%《1%2.6%《1%117《1%1.2%《1%5.0%《1%《1%
119《1%《1%1.4%2.8%5.1%《1%vx-150《1%2.2%3.6%15.4%1.7%8.7%
[0827]
可见,本专利部分化合物对nav离子通道具有良好的亚型选择性。特别是对于可 能引起心脏副作用的nav1.5,本专利部分化合物抑制作用明显弱于vx-150(临床二 期),因此很可能会表现出更好的安全性。
[0828]
试验例4:化合物大鼠体内药代动力学测试
[0829]
sd大鼠,雄性(购于上海西普尔-必凯实验动物有限公司)。各受试化合物以 口服(100mg/kg,每组3只)给药方式单次给予sd大鼠进行药代动力学研究。受试 化合物给药当天配制,采用5%dmso+95%saline对受试化合物进行混悬,并经涡旋2 min,超声5min之后配制成给药体系。口服给药前动物需禁食10-14小时,并于给药4 小时后恢复给食。sd大鼠经灌胃口服给药后,经颈静脉采集药代动力学样本,采集 时间点为:给药前、给药后15min、30min、1h、2h、4h、6h、8h和24h,每个时 间点采集3个全血样本,采集量约0.2ml,并经肝素钠抗凝。血液样本采集后立即置 于冰上,于1小时之内离心分离血浆(离心条件:6800转/分钟,6分钟,2-8℃)。收 集的血浆分析前存放于
–
80℃冰箱内。
[0830]
表八:部分化合物在100mg/kg剂量下的药代动力学测试结果
[0831][0832][0833]
本次大鼠药代实验中,对比化合物vx-150是一个前药(wo2015089361,化合 物9),给药后检测的是其原药(wo2014120808,化合物10)的血药浓度。前述体 外成药性实验均采用原药(wo2014120808,化合物10)进行。
[0834]
vx-150原药溶解性极低,固体给药吸收效果非常差,因此被开发成前药以解决 溶解性问题。而本专利部分化合物在不进行前药修饰的情况下,其大鼠药代动力学 的表现即可大幅优于vx-150。
[0835]
从以上成药性研究数据可以看出,本发明化合物对nav1.8离子通道活性具有明 显的抑制作用,部分化合物的细胞活性,离子通道选择性,herg安全性,大鼠药 代动力学等成药性参数与临床二期的vx-150相比具有明显的优势,可用作nav1.8 抑制剂,在镇痛、心房纤维性颤动、布加综合征等领域具有广阔的应用前景。
