1.本发明属于医药学化合物技术领域,尤其涉及一种组蛋白去乙酰化酶与微管双靶标抑制剂的合成方法与应用。
背景技术:
2.目前,癌症(cancer)是由细胞的不正常增生引起的。目前治疗癌症的传统方法包括手术、放疗、化疗免疫疗法、基因治疗等。由于影响肿瘤发生发展的原因十分复杂,并且治疗过程中易产生耐药性及肿瘤的复发,使得肿瘤治疗的难度更大。
3.组蛋白脱乙酰酶(hdac)是催化从特定组蛋白位点处,特别是在启动子区和增强子区移除乙酰基基团的酶,该酶是调节细胞基因转录的必要部分。hdac还以间接方式通过介导非组蛋白蛋白质(如dna结合蛋白、转录因子、信号转导子、dna修复和伴侣蛋白)的乙酰化作用来调节基因表达(ververis k等人,biologics:targets andtherapy[生物制剂:靶标和疗法]7:47-60,2013;vitt d等人,targeting histone acetylation[靶向组蛋白乙酰化].在:rscdrug discovery series[rsc药物发现系列]第48期:epigenetics fordrugdiscovery[药物发现的表观遗传学].编辑:nessa carey.theroyal society ofchemistry[皇家化学学会],2016中)。
[0004]
已经描述了hdac抑制剂引起生长停滞,随后引起肿瘤细胞分化或凋亡,而正常细胞不受影响。如在由marks等人(nature reviewscancer[癌症自然评论],2001,第1卷,第194-202页)的评论文章中所总结的,hdac抑制剂在g1和/或g2期引起细胞周期停滞。在几乎所有转化的细胞类型(包括源自血液和上皮肿瘤的细胞系)中,体外记录了生长抑制作用。已经将hdac抑制剂的细胞生长抑制机制描述为细胞周期抑制剂cdkn1a(p21)表达的特异性诱导。
[0005]
由hdac抑制剂治疗许多癌症类型已经在可获得的文献中进行了描述。hdac抑制对在肿瘤相关过程中起关键作用的许多蛋白质(如 her2/neu、vegf、raf-1、细胞周期蛋白a和b、bax、bad、p53、c-myc、胱天蛋白酶3、p21、以及erα)的表达具有影响。根据villar-garea 等人(int.j.cancer[国际癌症杂志]:112,171-178(2004))的综述,癌症应被认为是表观遗传以及遗传性疾病,并且使用hdac抑制剂的主要目标将是恢复通过启动子相关的组蛋白脱乙酰化作用已经转录沉默的那些肿瘤抑制基因的基因表达。drummond等人 (annu.rev.pharmacol.toxicol.[药理学与毒理学年评]2005.45:495-528)综述了癌细胞中的组蛋白和非组蛋白底物的分子机制和结果,这些组蛋白和非组蛋白底物是hdac的效应物,然而hdac还促进除了组蛋白以外的若干关键蛋白质的乙酰化作用。根据所述综述,乙酰化作用是负责调节关键细胞内途径的许多蛋白质的关键翻译后修饰,并且这些底物中的许多是组织/发育特异性的(eklf、 gata-1、erα、myod)、致癌的(c-myb)、肿瘤抑制性的(p53)、或甚至普遍存在的(tfiie、tfiif、tcf、hnf-4)转录因子。那些蛋白质的调整可以导致诱导细胞周期停滞、分化、和凋亡,所有这些都是用于治疗癌症的所期望的机制。kelly等人
(expert opin invest drugs[调研药物专家评论],11(12),2002)提供了关于hdac抑制剂总体上的进一步的综述,以及它们在癌症疗法中的应用。
[0006]
官方us nih网站http://clinicaltrials.gov列出了(状态: 2016年2月)针对用hdac抑制剂治疗的癌症适应症的545例临床试验,特别是各种形式的白血病(例如,cml、cll、aml)、骨髓增生异常综合征、包括非霍奇金氏淋巴瘤的淋巴瘤、多发性骨髓瘤、浆细胞肿瘤、一般实体肿瘤、小肠癌、间皮瘤、前列腺癌、乳腺癌(男性和女性)、肺癌(包括非小细胞和小细胞)、神经内分泌肿瘤、恶性上皮肿瘤、胰腺癌、皮肤癌(包括黑素瘤)、多发性骨髓瘤、宫颈癌、肾细胞癌、头颈癌、胃癌、卵巢癌、肝癌、结肠癌、直肠癌、胸腺瘤、输卵管癌、腹膜癌、鼻咽癌、前庭神经鞘瘤、脑膜瘤、听神经瘤、神经纤维瘤病2型、甲状腺癌、尿路上皮癌、神经胶质瘤、脑癌、食管癌、星形胶质细胞瘤、间变性少突神经胶质细胞瘤、巨细胞性成胶质细胞瘤、成胶质细胞瘤、神经胶质肉瘤、混合型胶质瘤和脑肿瘤。
[0007]
为解决上述问题,现有技术cn201980026022.6用于癌症治疗的包含hdac抑制剂、lag-3抑制剂和pd-1抑制剂或pd-l1抑制剂的组合,公开hdac抑制剂与lag-3抑制剂和pd-1抑制剂或pd-l1抑制剂组合用于制造用于治疗癌症的药物的用途。
[0008]
其中该hdac抑制剂是i类hdac特异性的;
[0009]
其中该hdac抑制剂是通式i的分子。
[0010][0011]
其中
[0012]
r1、r4和r5独立地是氢、1-4c-烷基、卤素、或1-4c-烷氧基,
[0013]
r2和r3独立地是氢或1-4c-烷基,
[0014]
r6是-t1-q1,其中t1是键或1-4c-亚烷基,
[0015]
或者q1被r61和/或r62取代并且是aa1、hh1、ha1、ha2、ha3、 ha4或ah1,或q1是未取代的并且是ha2、ha3或ha4;
[0016]
但上述的为单靶点抑制剂。
[0017]
通过上述分析,现有技术存在的问题及缺陷为:
[0018]
(1)现有技术中抑制剂为单靶点抑制剂,使得抑制剂活性偏低,不能更有效的抑制癌细胞增殖,另一方面使用单靶点抑制剂容易产生耐药性,使药物的抗肿瘤活性进一步降低。
[0019]
(2)现有技术中的抑制剂合成方法工艺繁琐,成本高。
[0020]
解决以上问题及缺陷的意义为:化疗作为治疗癌症的传统方法在临床中被广泛使用。然而大多数化疗药物只作用于一个靶点,经过一段时间的治疗后,可能导致耐药性。此
外单靶点药物的有效性也有限,不能强效抑制肿瘤的增殖和转移。但调节两个或更多相关靶点的药物则可能在癌症治疗中产生协同治疗效果,因此越来越多的多靶点抑制剂被研究者们所开发并且在临床研究中取得了成功。设计多靶点抑制剂能够抑制两种或两种以上的抗肿瘤药物设计靶点,能够阻断两条或两条以上的肿瘤发生发展的相关通路,因此具有更高的疗效且不易产生耐药性。
技术实现要素:
[0021]
为克服抗癌药物有限的疗效和耐药性,本发明公开实施例提供了一种组蛋白去乙酰化酶与微管双靶标抑制剂的合成方法与应用。
[0022]
所述技术方案如下:一种组蛋白去乙酰化酶与微管双靶标抑制剂,分子结构通式为:
[0023][0024]
在一实施例中,所述组蛋白去乙酰化酶与微管双靶标抑制剂的分子结构式左侧苯环为3,4,5三甲氧基取代,右侧苯环为双取代,r2基团为甲氧基、三氟甲氧基、氟原子中的一种;
[0025]
中间r1取代基为氢原子、甲基、腈基、硝基、三氟甲基中的一种所有化合物的结构中的所有的碳原子和氢原子包含多种同位素,所述多种同位素碳原子包含c
12
,c
14
,氢原子包括h1,h2和h3。
[0026]
在一实施例中,所述组蛋白去乙酰化酶与微管双靶标抑制剂分子结构式的结构骨架为查尔酮骨架。
[0027]
在一实施例中,所述组蛋白去乙酰化酶与微管双靶标抑制剂ic
50
值为49.9微摩尔~58.9微摩尔,优选49.9微摩尔。
[0028]
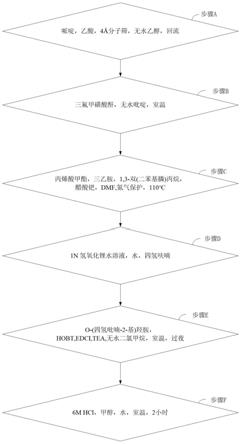
本发明的另一目的在于提供一种所述组蛋白去乙酰化酶与微管双靶标抑制剂的合成方法,包括:
[0029]
步骤a:哌啶,乙酸,分子筛,无水乙醇,回流;
[0030]
步骤b:三氟甲磺酸酐,无水吡啶,室温;
[0031]
步骤c:丙烯酸甲酯,三乙胺,1,3-双(二苯基膦)丙烷,醋酸钯, dmf,氮气保护,110℃;
[0032]
步骤d:1n氢氧化锂水溶液,水,四氢呋喃;
[0033]
步骤e:o-(四氢吡喃-2-基)羟胺,hobt,edci,tea,无水二氯甲烷,室温,过夜;
[0034]
步骤f:6m hcl,甲醇,水,室温,2小时。
[0035]
具体合成方法的化学分子式合成路线包括:
[0036][0037]
在一实施例中,所述vi 1-15包括:
[0038]
[0039]
[0040][0041]
本发明的另一目的在于提供一种所述组蛋白去乙酰化酶与微管双靶标抑制剂在制备治疗肺癌药物、肝癌药物、治疗乳腺癌药物、软巢癌药物、前列腺癌药物、胃癌药物、甲状腺癌药物、神经母细胞瘤药物、白血病药物、骨髓瘤药物、胰腺癌药物中的用途。
[0042]
结合上述的所有技术方案,本发明所具备的优点及积极效果为:本发明中的化合物都是双靶点抑制剂,区别于单靶点抑制剂、比单靶点抑制剂活性更高,能更有效的抑制癌细胞增殖,且不易耐药。同时也区别于联合用药,联合用药存在药物之间的复杂相互作用、副作用叠加、代谢不可知性高、病人依从性差等缺点。双靶点抑制剂可顺利解决上述问题。本策略可应用于抗肿瘤新药的发现。
[0043]
本发明涉及的双靶点抑制剂可应用于抗肿瘤治疗,其中包括:肺癌、肝癌、乳腺癌、软巢癌、前列腺癌、胃癌、甲状腺癌、神经母细胞瘤、白血病、骨髓瘤、胰腺癌。本发明中的化合物,对肿瘤细胞的杀伤能力极强,对某些细胞的ic
50
值甚至在pm级别。
[0044]
当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本发明的公开。
附图说明
[0045]
此处的附图被并入说明书中并构成本说明书的一部分,示出了符合本公开的实施例,并与说明书一起用于解释本公开的原理。
[0046]
图1是本发明实施例提供的组蛋白去乙酰化酶与微管双靶标抑制剂合成方法流程图。
具体实施方式
[0047]
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。
[0048]
本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本发明所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。
[0049]
本发明实施例提供的组蛋白去乙酰化酶与微管双靶标抑制剂分子结构式为:
[0050][0051]
其中,组蛋白去乙酰化酶与微管双靶标抑制剂分子结构式的结构骨架为查尔酮骨架,左侧苯环为3,4,5三甲氧基取代,右侧苯环为双取代,r2基团可以是甲氧基、三氟甲氧基、氟原子。
[0052]
中间r1取代基为氢原子、甲基、腈基、硝基、三氟甲基。所有化合物的结构中的所有的碳原子和氢原子包含各种同位素,如碳原子包含c
12
,c
14
,氢原子包括h1,h2和h3。
[0053]
本发明中,所述组蛋白去乙酰化酶与微管双靶标抑制剂ic
50
值为 49.9微摩尔~58.9微摩尔。优选49.9微摩尔。
[0054]
本发明实施例提供的组蛋白去乙酰化酶与微管双靶标抑制剂可应用是抗肿瘤,其中包括:肺癌、肝癌、乳腺癌、软巢癌、前列腺癌、胃癌、甲状腺癌、神经母细胞瘤、白血病、骨髓瘤、胰腺癌。
[0055]
如图1所示,本发明实施例提供的组蛋白去乙酰化酶与微管双靶标抑制剂合成方法包括:
[0056]
步骤a:哌啶,乙酸,分子筛,无水乙醇,回流;
[0057]
步骤b:三氟甲磺酸酐,无水吡啶,室温;
[0058]
步骤c:丙烯酸甲酯,三乙胺,1,3-双(二苯基膦)丙烷,醋酸钯, dmf,氮气保护,110
℃;
[0059]
步骤d:1n氢氧化锂水溶液,水,四氢呋喃;
[0060]
步骤e:o-(四氢吡喃-2-基)羟胺,hobt,edci,tea,无水二氯甲烷,室温,过夜;
[0061]
步骤f:6m hcl,甲醇,水,室温,2小时。
[0062]
在本发明一优选实施例中,具体合成方法的化学分子式合成路线包括:
[0063][0064]
下面结合合成方法对每步的制备过程进行描述。
[0065]
化合物i的合成:
[0066][0067]
α位r1取代的3,4,5三甲氧基苯乙酮(45.2mmol,1倍量)溶于50 毫升无水乙醇,加入相应的3羟基4r2取代的苯甲醛(45.2mmol,1 倍量),再加入10毫升哌啶和5毫升冰乙酸,最后加入适量分子筛。混合物回流反应2天。用硅藻土过滤去除分子筛和固体杂质,用乙醇冲洗滤饼。所得乙醇溶液蒸干再用乙酸乙酯溶解,用氯化钠饱和水溶液清洗3遍,乙酸乙酯层用无水硫酸钠干燥。石油醚:乙酸乙酯=3:1分离纯化得到纯品i。
[0068]
化合物ii的合成:
[0069][0070]
将化合物i(16.2mmol,1倍量)溶于40毫升无水吡啶中,将该溶液置于冰浴中搅拌,滴加入三氟甲磺酸酐(3毫升,19.5mmol,1.2 倍量)。混合液转到室温搅拌反应过夜。加入150毫升1m盐酸溶液,用乙酸乙酯萃取三遍,收集乙酸乙酯层并用氯化钠饱和水溶液清洗3 遍,乙酸乙酯层用无水硫酸钠干燥。石油醚:乙酸乙酯=4:1分离纯化得到纯品ii。
[0071]
化合物iii的合成:
[0072][0073]
在室温下及氩气保护下,将化合物ii(10mmol,1倍量)溶于无水 dmf(50ml)中,向该溶液中依次添加三乙胺(2.79毫升,20mmol, 2倍量)、丙烯酸甲酯(9毫升,100mmol,10倍量)、1,3-双-(二苯基膦)-丙烷(0.412g,1mmol,0.1倍量)和催化量的醋酸钯(ii)。该反应混合物在115℃下搅拌反应16小时。在减压下移除dmf,并在乙酸乙酯(200ml)中提取残余物,并用1n hcl溶液(2x50 ml)、饱和碳酸氢钠溶液(100ml)和盐水(100ml)洗涤有机相在硫酸钠上干燥,过滤并浓缩。通过柱色谱法纯化(石油醚:乙酸乙酯=5:1) 得到化合物iii纯品。
[0074]
化合物iv的合成:
[0075][0076]
将化合物iii(5mmol)溶于15毫升四氢呋喃中,再加入15毫升1m 氢氧化锂水溶液,混合物室温搅拌过夜,点板加测原料iii反应完全后,将四氢呋喃减压蒸除,加10毫升水稀释溶液,用1m hcl溶液将溶液ph值调至2-3。通过过滤收集所得固体,双蒸水清洗滤饼3 遍,将滤饼干燥过夜得到化合物iv为纯品。
[0077]
化合物v的合成:
[0078][0079]
将化合物iv(1mmol,1倍量)溶于15毫升无水二氯甲烷中,在0℃下向该溶液依次加入o-(四氢吡喃-2-基)羟胺(0.129克,1.1mmol, 1.1倍量)、hobt(0.162克,1.2mmol,1.2倍量)、edci(0.288克, 1.5mmol,1.5倍量)和三乙胺(210微升,1.5mmol,1.5倍量)。混合液转到室温搅拌反应过夜。不经处理直接拌样上硅胶柱分离纯化。石油醚:乙酸乙酯=1:1分离
纯化得到纯品v。
[0080]
化合物vi的合成:
[0081][0082]
将化合物v(0.5mmol)溶于10毫升甲醇中,室温下向该溶液加入1 毫升6m盐酸水溶液。室温搅拌2小时,加压蒸除甲醇和水,再用甲醇复溶,拌样上硅胶柱分离纯化。洗脱液为二氯甲烷:甲醇=40:1,产物点三氯化铁水溶液显色为紫红色,经分离纯化得到纯品vi。
[0083]
下面结合实验数据对本发明的积极效果作进一步描述
[0084]
1.化合物氢谱与高分辨质谱结果
[0085][0086]
vi 1:(反式)-n-羟基-3-(2-甲氧基-5-((反式)-3-氧基-3-(3,4,5
‑ꢀ
三甲氧基苯基)丙基-1-烯-1-基)苯基)丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.73(s,1h),9.37(s,1h),9.05(brs, 1h),7.80(d,j=15.9hz,1h),7.60(d,j=15.8hz,1h),7.58(d,j= 15.9hz,1h),7.32(d,j=8.7hz,1h),7.02(s,2h),6.72(d,j=8.7hz, 1h),6.71(d,j=15.8hz,1h),6.56(s,1h),3.83(s,6h),3.75(s,3h). 高分辨质谱值[m+h
+
]:400.1392.
[0087][0088]
vi 2:(反式)-n-羟基-3-(5-((反式)-3-氧代-3-(3,4,5-三甲氧基苯基)丙-1-烯-1-基)-2-(三氟甲氧基)苯基)丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.73(s,1h),9.06(s,1h),7.81(d,j =15.9hz,1h),7.60(d,j=15.8hz,1h),7.59(d,j=15.9hz,1h),7.53 (d,j=8.6hz,1h),7.04(s,2h),6.85(d,j=8.6hz,1h),6.71(d,j= 15.8hz,1h),6.68(s,1h),3.83(s,6h),3.72(s,3h).高分辨质谱值 [m+h
+
]:468.1270.
[0089][0090]
vi 3:(反式)-3-(2-氟-5-((反式)-3-氧代-3-(3,4,5-三甲氧基苯基) 丙基-1-烯-1-基)苯基)-n-羟基丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.73(s,1h),9.04(s,1h),7.81(d,j =15.8hz,1h),7.57-7.61(m,3h),7.11(d,j=8.6hz,1h),7.04(s,2h), 6.72(d,j=15.6hz,1h),6.67(s,1h),3.83(s,6h),3.72(s,3h).高分辨质谱值[m+h
+
]:402.1348.
[0091][0092]
vi 4:(反式)-n-羟基-3-(2-甲氧基-5-((反式)-2-甲基-3-氧基-3
‑ꢀ
(3,4,5-三甲氧基苯基)丙基-1-烯-1-基)苯基)丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.73(s,1h),9.03(brs,1h), 7.65-7.70(m,2h),7.58(d,j=8.7hz,1h),7.15-7.17(m,2h),7.00(s, 2h),6.57(d,j=15.9hz,1h),3.92(s,3h),3.81(s,6h),3.76(s,3h), 2.21(s,3h).高分辨质谱值[m+h
+
]:402.1706.
[0093][0094]
vi 5:(反式)-n-羟基-3-(5-((反式)-2-甲基-3-氧代-3-(3,4,5-三甲氧基苯基)丙-1-烯-1-基)-2-(三氟甲氧基)苯基)丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.73(s,1h),9.03(brs,1h), 7.65-7.70(m,2h),7.59(d,j=8.6hz,1h),7.16-7.18(m,2h),7.01(s, 2h),6.61(d,j=15.9hz,1h),3.82(s,6h),3.75(s,3h),2.22(s,3h). 高分辨质谱值[m+h
+
]:482.1422.
[0095][0096]
vi 6:(反式)-3-(2-氟-5-((反式)-2-甲基-3-氧代-3-(3,4,5-三甲氧基苯基)丙基-1-烯-1-基)苯基)-n-羟基丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.73(s,1h),9.03(s,1h),7.66-7.71 (m,2h),7.60(d,j=8.7hz,1h),7.17-7.19(m,2h),7.03(s,2h),6.61(d, j=15.9hz,1h),3.81(s,6h),3.76(s,3h),2.23(s,3h).高分辨质谱值 [m+h
+
]:416.1507.
[0097][0098]
vi 7:(反式)-3-(5-((反式)-2-腈基-3-氧代-3-(3,4,5-三甲氧基苯基)丙-1-烯-1-基)-2-甲氧基苯基)-n-羟基丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.73(s,1h),9.05(s,1h),7.93(s, 1h),7.82(d,j=15.9hz,1h),7.50(d,j=8.8hz,1h),7.04(s,2h), 6.86(d,j=8.8hz,1h),6.73(d,j=15.9hz,1h),6.68(s,1h),3.90(s, 3h),3.83(s,6h),3.72(s,3h).高分辨质谱值[m+h
+
]:468.1270.
[0099][0100]
vi 8:(反式)-3-(5-((反式)-2-腈基-3-氧代-3-(3,4,5-三甲氧基苯基)丙-1-烯-1-基)-2-(三氟甲氧基)苯基)-n-羟基丙烯酰胺1h nmr(400mhz,dmso-d6)δ10.72(s,1h),9.06(s,1h),7.96(s, 1h),7.84(d,j=15.8hz,1h),7.52(d,j=8.7hz,1h),7.03(s,2h), 6.89(d,j=8.7hz,1h),6.74(d,j=15.8hz,1h),6.70(s,1h),3.83(s, 6h),3.72(s,3h).高分辨质谱值[m+h
+
]:493.1218.
[0101][0102]
vi 9:(反式)-3-(5-((反式)-2-腈基-3-氧代-3-(3,4,5-三甲氧基苯基)丙-1-烯-1-基)-2-氟苯基)-n-羟基丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.72(s,1h),9.04(s,1h),7.92(s, 1h),7.85(d,j=15.8hz,1h),7.61(d,j=8.7hz,1h),7.11(d,j=8.7 hz,1h),7.04(s,2h),6.73(d,j=15.8hz,1h),6.71(s,1h),3.82(s,6h), 3.71(s,3h).高分辨质谱值[m+h
+
]:427.1305.
[0103][0104]
vi 10:(反式)-n-羟基-3-(2-甲氧基-5-((顺式)-2-硝基-3-氧基-3
‑ꢀ
(3,4,5-三甲氧基苯基)丙基-1-烯-1-基)苯基)丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.72(s,1h),9.04(s,1h),8.00(s, 1h),7.86(d,j=15.9hz,1h),7.60(d,j=8.8hz,1h),7.04(s,2h), 6.89(d,j=8.8hz,1h),6.75(d,j=15.9hz,1h),6.68(s,1h),3.91(s, 3h),3.83(s,6h),3.72(s,3h).高分辨质谱值[m+h
+
]:459.1343.
[0105][0106]
vi 11:(反式)-n-羟基-3-(5-((顺式)-2-硝基-3-氧代-3-(3,4,5-三甲氧基苯基)丙-1-烯-1-基)-2-(三氟甲氧基)苯基)丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.73(s,1h),9.06(s,1h),8.01(s, 1h),7.85(d,j=15.8hz,1h),7.61(d,j=8.7hz,1h),7.03(s,2h), 6.89(d,j=8.7hz,1h),6.74(d,j=15.8hz,1h),6.70(s,1h),3.83(s, 6h),3.71(s,3h).高分辨质谱值[m+h
+
]:513.1120.
[0107][0108]
vi 12:(反式)-3-(2-氟-5-((顺式)-2-硝基-3-氧代-3-(3,4,5-三甲氧基苯基)丙基-1-烯-1-基)苯基)-n-羟基丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.72(s,1h),9.04(s,1h),8.02(s, 1h),7.85(d,j=15.8hz,1h),7.60(d,j=8.6hz,1h),7.11(d,j=8.6 hz,1h),7.04(s,2h),6.73(d,j=15.8hz,1h),6.70(s,1h),3.82(s,6h), 3.71(s,3h).高分辨质谱值[m+h
+
]:447.1121.
[0109][0110]
vi 13:(反式)-n-羟基-3-(2-甲氧基-5-((顺式)-2-三氟甲基-2-(3,4,5
‑ꢀ
三甲氧基苯甲酰基)乙烯基)苯基)丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.72(s,1h),9.04(s,1h),7.96(s, 1h),7.84(d,j=15.9hz,1h),7.55(d,j=8.8hz,1h),7.04(s,2h), 6.87(d,j=8.8hz,1h),6.73(d,j=15.9hz,1h),6.69(s,1h),3.92(s, 3h),3.83(s,6h),3.72(s,3h).高分辨质谱值[m+h
+
]:482.1426.
[0111][0112]
vi 14:(反式)-n-羟基-3-(2-三氟甲氧基-5-((顺式)-2-三氟甲基-2
‑ꢀ
(3,4,5-三甲氧基苯甲酰基)乙烯基)苯基)丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.73(s,1h),9.05(s,1h),8.01(s, 1h),7.85(d,j=15.8hz,1h),7.56(d,j=8.7hz,1h),7.03(s,2h), 6.87(d,j=8.7hz,1h),6.73(d,j=15.8hz,1h),6.70(s,1h),3.83(s, 6h),3.71(s,3h).高分辨质谱值[m+h
+
]:536.1141.
[0113][0114]
vi 15:(反式)-n-羟基-3-(2-氟-5-((顺式)-2-三氟甲基-2-(3,4,5
‑ꢀ
三甲氧基苯甲酰基)乙烯基)苯基)丙烯酰胺 1h nmr(400mhz,dmso-d6)δ10.73(s,1h),9.05(s,1h),8.02(s, 1h),7.85(d,j=15.8hz,1h),7.56(d,j=8.7hz,1h),7.09(d,j=8.7 hz,1h),7.04(s,2h),6.73(d,j=15.8hz,1h),6.71(s,1h),3.82(s,6h), 3.72(s,3h).高分辨质谱值[m+h
+
]:470.1228.
[0115]
2.化合物v1-v15抑制微管聚合的实验结果:
[0116][0117][0118]
从结果可以看出15个化合物中,化合物v4对微管聚合的抑制活性最强。ic
50
(某个酶催化反应,抗原抗体反应等被抑制一半时抑制剂的浓度。另外,ic
50
值可以用来衡量药物诱导凋亡的能力,即诱导能力越强,该数值越低,抑制能力越强)值为49.9微摩尔。
[0119]
3.化合物v1-v15对五种hdac亚型酶活性抑制实验结果:
[0120][0121][0122]
从结果可以看出15个化合物为hdac8选择性抑制剂,抑制 hdac8的ic50值均在微摩尔或亚微摩尔浓度范围内。这也证明了 15个化合物确实为微管聚合与hdac双靶点抑制剂。
[0123]
4.化合物v1-v15对三种肿瘤细胞的增值抑制活性结果:
[0124][0125][0126]
从该实验结果可以看出,15个化合物均能够在纳摩尔范围内抑制三种肿瘤细胞的增殖。
[0127]
本发明属于双靶点抗肿瘤化合物,既可以有效抑制组蛋白去乙酰化酶(hdac),同时也可以有效抑制微管的聚合(tubulinpolymerization)。由于是双靶点抑制剂,所以能够在体外强效抑制多种肿瘤细胞的增殖,ic
50
值皆在纳摩尔级别。适用的癌种广泛;涵盖了多种实体瘤和血液瘤。
[0128]
本领域技术人员在考虑说明书及实践这里公开的公开后,将容易想到本公开的其
它实施方案。本技术旨在涵盖本公开的任何变型、用途或者适应性变化,这些变型、用途或者适应性变化遵循本公开的一般性原理并包括本公开未公开的本技术领域中的公知常识或惯用技术手段。说明书和实施例仅被视为示例性的,本公开的真正范围和精神由所附的权利要求指出。
[0129]
应当理解的是,本公开并不局限于上面已经描述并在附图中示出的精确结构,并且可以在不脱离其范围进行各种修改和改变。本公开的范围应由所附的权利要求来限制。
