用于制备酸化乳产品的方法
1.序列表的引用
2.本技术含有计算机可读形式的序列表。该计算机可读形式通过引用并入本文。
技术领域
3.本发明涉及使用转谷氨酰胺酶和蛋白酶制备酸化乳产品。
背景技术:
4.酸化乳产品的市场在世界范围内不断增长,并且人们对提高此类产品的质量和经济性很感兴趣。
5.使用转谷氨酰胺酶修饰食物蛋白(包括乳蛋白)在现有技术中是已知的。例如,ep 0671885描述了用于产生乳样产品的方法,该方法包括转谷氨酰胺酶处理,然后酸化。在本文中,经证明用转谷氨酰胺酶处理的乳样产品(其中酸化作为生物发酵进行)可展示出半固体酸奶的稠度(consistency)。已知在发酵乳产品的制造期间用转谷氨酰胺酶处理可增加产品的粘度。wo 2007/060288证明在发酵乳产品(如酸奶)的生产期间添加转谷氨酰胺酶可以降低乳底物的蛋白质含量,从而仍然获得具有高粘度的酸奶。
6.ep 1186238 a2披露了用于提高干酪产量的方法,该方法包括用凝乳酶(milk coagulating enzyme)处理乳原料,然后从乳清中分离干酪凝块,其中部分水解的乳清蛋白已在用凝固酶处理之前添加到乳原料中。部分水解的乳清蛋白可以通过加热、化学还原或酶促还原切割、或使用例如胰蛋白酶的蛋白酶处理获得。包含部分水解的乳清蛋白的乳原料可以在用凝固酶处理之前用转谷氨酰胺酶处理。未披露对乳底物进行酸化以获得酸化乳产品。亦未披露酶处理对结构特性(如颗粒性/成片性、粘度或脱水收缩)的影响。
7.wo 2010/089376披露了用于制备酸化乳产品的方法,其中将转谷氨酰胺酶与蛋白酶组合使用。经证明添加蛋白酶可减少发酵时间。披露了在ec 3.4.21、3.4.22、3.4.23或3.4.24中任一项中进行了分类的蛋白酶的用途,特别是在ec 3.4.21.62、ec 3.4.22.2、ec 3.4.23.4、ec 3.4.24.28中进行了分类的蛋白酶,即枯草杆菌蛋白酶a(viii型)、木瓜蛋白酶、凝乳酶(chymosin)、着色酶n(colorase n)、optimase或蛋白酶n(protease n)“天野株式会社(amano)”。经实验证明,(ec 3.4.24)对发酵时间具有有益作用。
技术实现要素:
8.使用转谷氨酰胺酶可以增加发酵乳制品(如酸奶)的粘度并减少其脱水收缩(乳清分离)。然而,酶处理可能造成其他质地缺陷,主要是颗粒性或成片性。本发明表明,蛋白酶与转谷氨酰胺酶的组合可以降低酸奶产品的颗粒性/成片性,从而改善其目视外观和口感,同时获得所期望的粘度增加和脱水收缩减少。
9.特别地,已经发现与其他内肽酶相比,转谷氨酰胺酶与胰蛋白酶样或赖氨酸特异性内肽酶的组合带来整体上更好的质地、使粘度增加并使脱水收缩减少。
10.本发明提供了用于制备酸化乳产品的方法,该方法包括:
11.(a)用转谷氨酰胺酶和胰蛋白酶样或赖氨酸特异性内肽酶处理乳底物;以及
12.(b)通过与化学酸化剂和/或乳酸菌一同孵育来酸化乳底物以产生酸化乳产品;
13.其中步骤(a)在步骤(b)之前或期间进行。
14.优选地,胰蛋白酶样内肽酶在ec 3.4.21.4中进行了分类。
15.优选地,赖氨酸特异性内肽酶在ec 3.4.21.4中进行了分类。
附图说明
16.图1示出了实例1的酸奶的感官评价结果。
17.图2示出了实例2的酸奶的感官评价结果。
具体实施方式
18.本发明提供了用于制备酸化乳产品的方法,该方法包括:
19.(a)用转谷氨酰胺酶和胰蛋白酶样或赖氨酸特异性内肽酶处理乳底物;以及
20.(b)通过与化学酸化剂和/或乳酸菌一同孵育来酸化乳底物以产生酸化乳产品;
21.其中步骤(a)在步骤(b)之前或期间进行。
22.如本文所用,术语“乳底物”可以涵盖任何获得自哺乳动物的乳或乳产品,优选牛乳、绵羊乳或山羊乳。在一个实施例中,乳底物可以源自全脂乳。在优选实施例中,乳底物可以源自减脂乳,如1%脂肪乳、0.1%脂肪乳、半脱脂乳或脱脂乳。乳底物可以是复原脱脂乳粉、酪蛋白、乳清蛋白(wpi或wpc)、乳蛋白浓缩物、或其任意组合。乳底物可以例如通过膜过滤技术或蒸发进行浓缩。乳底物可以是uht乳。
23.乳底物可以是已经过标准化和/或均质化的。乳底物可以是已经过巴氏杀菌或以其他方式热处理的。
24.在本发明上下文中的酸化乳产品是通过酸化产生的乳基产品。
25.在一个实施例中,通过与乳酸菌一同孵育来进行酸化,该乳酸菌优选地属于链球菌属(streptococcus)、乳球菌属(lactococcus)、乳杆菌属(lactobacilllus)、明串珠菌属(leuconostoc)、假明串珠菌属(pseudoleuconostoc)、片球菌属(pediococcus)、丙酸杆菌属(propionibacterium)、肠球菌属(enterococcus)、短杆菌属(brevibacterium)、或双歧杆菌属(bifidobacterium)、或其任意组合。通过与一种或多种乳酸菌一同孵育进行的酸化可以称为发酵。
26.在一个实施例中,酸化是通过与嗜热乳酸菌一同孵育进行的。
27.在一个实施例中,酸化是通过与嗜温乳酸菌一同孵育进行的。
28.在另一个实施例中,酸化是通过与化学酸化剂、优选葡萄糖酸-δ-内酯(gdl)一同孵育进行的。
29.酸化乳产品可以是勺取型酸化乳产品(例如,搅拌型酸奶、凝固型酸奶或脱乳清酸奶)或者饮用型酸化乳产品(例如,饮料型酸奶(drinking yoghurt)、开菲尔乳(kefir)或酪乳)。
30.搅拌型酸奶可以通过在发酵罐中进行酸化而产生,其中所形成的酸凝胶例如被酸化后(当已获得所期望的ph时)的搅动破坏。可以将搅拌后的产品部分冷却至20℃-30℃,并
且可以添加调味成分。将搅拌后的产品泵送至灌装线并灌装进零售容器中。然后可以将搅拌型酸奶产品冷却且然后储存。
31.凝固型酸奶可以在零售容器中酸化,并且酸化后可以不搅动。酸化后,可以将凝固型酸奶冷却且然后储存。冷却可以在急速冷冻器通道(blast chiller tunnel)或冷藏储存室中进行。
32.如本文所用的术语“酸化后”意指当酸化结束并获得所期望的ph时。
33.脱乳清酸奶(如希腊酸奶(greek yoghurt)或浓缩酸奶(labneh))是已经过脱乳清以去除其大部分乳清的酸奶,使得稠度比未脱乳清的酸奶更高,同时保留了酸奶独特的酸味。
34.如果使用化学酸化剂,则所期望的ph可以为例如约ph 4.5。
35.如果使用微生物发酵进行酸化,则酸化后的ph可以优选为3.5和5.5之间、最优选为4和5之间。
36.在一个实施例中,酸化乳产品是搅拌型酸奶,其中搅动在酸化步骤期间或之后进行。
37.在一个实施例中,将酸化乳产品冷却,优选地立即冷却。
38.搅拌型酸奶可以在发酵罐中冷却至大约20℃-25℃。然后,可以进行搅动(例如通过搅拌)来破坏凝胶。然后可以将酸奶泵送至灌装线,接着通过冷却通道中的急速冷冻或冷藏储存室中慢一些的冷冻进行第二冷却步骤达到大约5℃的储存温度。
39.可替代地,对于搅拌型酸奶,可以首先搅拌酸化产品来破坏凝胶,然后通过通向灌装站的管线中的热交换器将该产物冷却至大约20℃-25℃,且然后在通过冷却通道中的急速冷冻或冷藏储存室中慢一些的冷冻进行的第二冷却步骤中冷却至大约5℃的储存温度。
40.用于凝固型酸奶的方法可以是:酸奶在零售瓶中酸化(在调温室中进行)后,通过冷却通道中的急速冷冻或冷藏储存室中慢一些的冷冻冷却至大约5℃的储存温度。
41.本发明的方法可以进一步包括酸化后的储存步骤。储存步骤可以在搅动(例如,通过搅拌或泵送)和/或冷却(一次或多次)后进行,优选地在两者之后进行。储存可以在低温下进行,优选地在低于10℃、更优选地在0℃-10℃(如4℃-6℃)下进行。
42.在优选实施例中,酸化乳产品是酸奶、凝固型酸奶、搅拌型酸奶、脱乳清酸奶、饮料型酸奶、开菲尔乳、酪乳、新鲜干酪、新鲜奶酪(fromage frais)、鲜奶油(creme fraiche)、夸克奶酪(quark)、农家干酪(cottage cheese)或发酵乳。
43.在更优选的实施例中,酸化乳产品是勺取型酸化乳产品,优选酸奶。
44.在本发明的方法中,巴氏杀菌步骤优选地在步骤(b)之前进行。这可能是为了热灭活微生物和/或为了更好地控制酸化。酸化前的巴氏杀菌也可以使酸化乳产品具有更好的结构。
45.巴氏杀菌可以例如在80℃-95℃下进行1-30分钟,如在80℃-85℃下进行30分钟、或在90℃-95℃下进行2-5分钟。
46.在本发明的方法中,步骤(a)可以在步骤(b)之前进行。巴氏杀菌步骤可以在步骤(a)之后且步骤(b)之前进行。在这种情况下,巴氏杀菌将在酸化前灭活酶。
47.在步骤(a)中,用转谷氨酰胺酶和胰蛋白酶样或赖氨酸特异性内肽酶处理乳底物。酶处理可以依次进行。例如,可以将胰蛋白酶样或赖氨酸特异性内肽酶添加至乳底物,并且
一段时间后、例如像30-60分钟后,添加转谷氨酰胺酶。或者可以首先用胰蛋白酶样或赖氨酸特异性内肽酶进行处理,任选地接着进行巴氏杀菌步骤,并且然后添加转谷氨酰胺酶(例如同时添加酸化剂)。可替代地,转谷氨酰胺酶可以在添加酸化剂之前、例如像30-60分钟之前,或之后、例如像30-60分钟之后添加。
48.可替代地,可以将转谷氨酰胺酶添加至乳底物,并且一段时间后、例如像30-60分钟后,添加胰蛋白酶样或赖氨酸特异性内肽酶。或者可以首先用转谷氨酰胺酶进行处理,任选地接着进行巴氏杀菌步骤,并且然后添加胰蛋白酶样或赖氨酸特异性内肽酶(例如同时添加酸化剂)。或者胰蛋白酶样或赖氨酸特异性内肽酶可以在添加酸化剂之前、例如像30-60分钟之前,或之后、例如像30-60分钟之后添加。
49.在优选实施例中,同时进行步骤(a)和步骤(b)。酶和酸化剂两者可以同时添加或基本同时添加。或者可以先添加胰蛋白酶样或赖氨酸特异性内肽酶,然后添加转谷氨酰胺酶,然后再添加酸化剂。或者可以先添加胰蛋白酶样或赖氨酸特异性内肽酶,然后添加酸化剂,然后再添加转谷氨酰胺酶。或者可以先添加酸化剂,然后添加胰蛋白酶样或赖氨酸特异性内肽酶,然后再添加转谷氨酰胺酶。或者可以先添加转谷氨酰胺酶,然后添加胰蛋白酶样或赖氨酸特异性内肽酶,然后再添加酸化剂。或者可以先添加转谷氨酰胺酶,然后添加酸化剂,然后再添加胰蛋白酶样或赖氨酸特异性内肽酶。或者可以先添加酸化剂,然后添加转谷氨酰胺酶,然后再添加胰蛋白酶样或赖氨酸特异性内肽酶。
50.在优选实施例中,步骤(a)在步骤(b)之前和/或期间进行。即添加酶,并且在孵育一段时间、例如0.5-3小时之后添加酸化剂并继续孵育。
51.在优选实施例中,巴氏杀菌步骤在步骤(a)之前进行。
52.在另一个优选实施例中,步骤(a)和步骤(b)同时进行,并且巴氏杀菌步骤在步骤(a)之前进行。
53.在优选实施例中,步骤(a)在步骤(b)之前和/或期间进行,并且巴氏杀菌步骤在步骤(a)之前进行。
54.如果步骤(a)在步骤(b)之前进行,则酶处理可以例如在40℃-55℃(如在45℃-55℃)下进行15分钟至10小时(如进行30分钟至3小时)。
55.进行步骤(b)中的酸化直至达到所期望的ph。本领域熟知如何选择酸化的最适温度和孵育时间。酸化可以例如在40℃-45℃下进行3-10小时(如进行4-7小时)。较低温度(如低至20℃-30℃)可以用于嗜温培养。
56.在优选实施例中,与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品具有更细腻的质地。在另一个优选实施例中,与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品具有更低的颗粒性和/或结块性质地。在另一个优选实施例中,与通过相同方法但没有用转谷氨酰胺酶和胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品具有更浓稠的质地。优选地,质地通过将酸化乳产品的样品置于黑色塑料勺的背面来进行目视评价。
57.在另一个优选实施例中,与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品的粘度降低至多25%,优选地降低至多20%、至多15%、至多10%,如至多5%。粘度可以通过使酸化乳产品在4℃下凝固1小时、然
后在25℃下以50rpm持续70秒进行粘度测量来确定。
58.在另一个优选实施例中,与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品在4℃下储存16天后已经多排出至多10%、如至多5%的乳清。排出的乳清的量可以使用如下公式计算:(酸奶样品的重量-固相的重量)/(酸奶样品的重量)*100%。
59.在另一个优选实施例中,酸化乳产品在4℃下储存16天后已经排出至多1%的乳清。
60.在另一个优选实施例中,与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品在4℃下储存16天后已经多排出至多10%、如至多5%的乳清;或者,如果通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品在4℃下储存16天后排出乳清为零,则步骤(a)和(b)之后获得的酸化乳产品已经排出至多1%的乳清。
61.在另一个优选实施例中,与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品在4℃下储存6天然后以3500rpm离心15分钟后已经多排出至多10%、如至多5%的乳清。
62.在另一个优选实施例中,与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品具有更细腻的质地,其中该质地通过将该酸化乳产品的样品置于黑色塑料勺的背面来进行目视评价;并且与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品的粘度降低至多25%,其中该粘度通过使该酸化乳产品在4℃下凝固1小时、然后在25℃下以50rpm持续70秒进行粘度测量来确定。
63.在另一个优选实施例中,与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品具有更细腻的质地,其中该质地通过将该酸化乳产品的样品置于黑色塑料勺的背面来进行目视评价;并且与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品在4℃下储存16天后已经多排出至多10%、优选地至多5%的乳清;或者,如果通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品在4℃下储存16天后排出乳清为零,则步骤(a)和(b)之后获得的酸化乳产品已经排出至多1%的乳清,其中排出的乳清的量使用如下公式计算:(酸奶样品的重量-固相的重量)/(酸奶样品的重量)*100%。
64.在另一个优选实施例中,与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品的粘度降低至多25%,其中该粘度通过使该酸化乳产品在4℃下凝固1小时、然后在25℃下以50rpm持续70秒进行粘度测量来确定;并且与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品在4℃下储存16天后已经多排出至多10%、优选地至多5%的乳清;或者,如果通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品在4℃下储存16天后排出乳清为零,则步骤(a)和(b)之后获得的酸化乳产品已经排出至多1%的乳清,其中排出的乳清的量使用如下公式计算:(酸奶样品的重量-固相的重量)/(酸奶样品的重量)*100%。
65.在另一个优选实施例中,与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内
肽酶处理而制备的酸化乳产品相比,该酸化乳产品具有更细腻的质地,其中该质地通过将该酸化乳产品的样品置于黑色塑料勺的背面来进行目视评价;并且与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品的粘度降低至多25%,其中该粘度通过使该酸化乳产品在4℃下凝固1小时、然后在25℃下以50rpm持续70秒进行粘度测量来确定;并且与通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品相比,该酸化乳产品在4℃下储存16天后已经多排出至多10%、优选地至多5%的乳清;或者,如果通过相同方法但没有用胰蛋白酶样或赖氨酸特异性内肽酶处理而制备的酸化乳产品在4℃下储存16天后排出乳清为零,则步骤(a)和(b)之后获得的酸化乳产品已经排出至多1%的乳清,其中排出的乳清的量使用如下公式计算:(酸奶样品的重量-固相的重量)/(酸奶样品的重量)*100%。
66.胰蛋白酶样或赖氨酸特异性内肽酶
67.在本发明的方法中,将乳底物用胰蛋白酶样或赖氨酸特异性内肽酶处理。
68.在本发明的上下文中,胰蛋白酶样内肽酶是在精氨酸和/或赖氨酸的羧基末端侧进行特异性切割的内肽酶。即该胰蛋白酶样内肽酶在精氨酸或赖氨酸或两者的羧基末端侧进行特异性切割。在优选实施例中,胰蛋白酶样内肽酶在精氨酸和赖氨酸的羧基末端侧进行特异性切割。
69.在本发明的上下文中,赖氨酸特异性内肽酶是在赖氨酸的羧基末端侧进行特异性切割的内肽酶。赖氨酸特异性内肽酶也可以称为赖氨酰基特异性内肽酶。
70.优选地,胰蛋白酶样或赖氨酸特异性内肽酶具有在arg或lys(以较大者为准)之后切割的特异性,该特异性比其在ala、asp、glu、ile、leu、met、phe、tyr或val(以较大者为准)中任一个之后切割的特异性高至少100倍。
71.在实施例中,胰蛋白酶样或赖氨酸特异性内肽酶具有在arg或lys(以较大者为准)之后切割的特异性,该特异性比其在ala、asp、glu、ile、leu、met、phe、tyr或val(以较大者为准)中任一个之后切割的特异性高至少10倍、如至少20倍或至少50倍。在另一个实施例中,胰蛋白酶样或赖氨酸特异性内肽酶具有在arg或lys(以较大者为准)之后切割的特异性,该特异性比其在ala、asp、glu、ile、leu、met、phe、tyr或val(以较大者为准)中任一个之后切割的特异性高至少200倍、如至少500倍或至少1000倍。
72.优选地,这种特异性的确定应该在一定ph值下进行,在该值下内肽酶的活性为其最适ph下内肽酶活性的至少一半。优选地,使用如wo 2008/125685(将其通过引用并入)的实例3中所述的suc-aap-x-pna底物来确定任何此类相对特异性。
73.优选地,将在本发明的方法中使用的胰蛋白酶样内肽酶在ec3.4.21.4中进行了分类。
74.优选地,将在本发明的方法中使用的赖氨酸特异性内肽酶在ec3.4.21.50中进行了分类。
75.任何胰蛋白酶样或赖氨酸特异性内肽酶可以用于本发明的方法中。酶的来源对于成功的结果并不重要。
76.将在本发明的方法中使用的胰蛋白酶样或赖氨酸特异性内肽酶可以源自任何来源。其可以源自动物,例如,其可以是猪或牛胰蛋白酶。这种猪或牛胰蛋白酶可以提取自例如猪或牛的胰腺,或者该胰蛋白酶可以在微生物中(如在丝状真菌或酵母中、或在细菌中)
表达。
77.将在本发明的方法中使用的胰蛋白酶样或赖氨酸特异性内肽酶可以源自微生物,如源自丝状真菌或酵母、或源自细菌。
78.内肽酶可以例如源自如下属的菌株:蘑菇属(agaricus),例如双孢蘑菇(a.bisporus);ascovaginospora属;曲霉属(aspergillus),例如黑曲霉(a.niger)、泡盛曲霉(a.awamori)、臭曲霉(a.foetidus)、日本曲霉(a.japonicus)、米曲霉(a.oryzae);念珠菌属(candida);毛壳菌属(chaetomium);chaetotomastia属;网柄菌属(dictyostelium),例如盘基网柄菌(d.discoideum);镰孢属(fusarium),例如尖孢镰孢(f.oxysporum)、腐皮镰孢(f.solani)、镰孢属物种(f.sp.);克鲁维酵母属(kluveromyces),例如脆壁克鲁维酵母(k.fragilis)、乳酸克鲁维酵母(k.lactis);毛霉属(mucor),例如爪哇毛霉(m.javanicus)、高大毛霉(m.mucedo)、细孢毛霉(m.subtilissimus);脉孢菌属(neurospora),例如粗糙脉孢菌(n.crassa);枝霉属(rhinocladiella);根毛霉属(rhizomucor),例如微小根毛霉(r.pusillus);根霉属(rhizopus),例如少根根霉(r.arrhizus)、日本根霉(r.japonicus)、匍枝根霉(r.stolonifer);核盘霉属(sclerotinia),例如白腐核盘霉(s.libertiana);圆酵母属(torula);球拟酵母属(torulopsis);木霉属(trichoderma),例如里氏木霉(t.reesei);毛癣菌属(trichophyton),例如红色毛癣菌(t.rubrum);维氏核盘菌属(whetzelinia),例如大豆维氏核盘菌(w.sclerotiorum);束丝放线菌属(actinosynnema),例如奇迹束丝放线菌(a mirum);芽孢杆菌属(bacillus),例如芽孢杆菌属物种(b.sp.)、凝结芽孢杆菌(b.coagulans)、环状芽孢杆菌(b.circulans)、巨大芽孢杆菌(b.megaterium)、休闲地芽孢杆菌(b.novalis)、枯草芽孢杆菌(b.subtilis)、短小芽孢杆菌(b.pumilus)、嗜热脂肪芽孢杆菌(b.stearothermophilus)、苏云金芽孢杆菌(b.thuringiensis);双歧杆菌属,例如动物双歧杆菌(b.animalis)、两歧双歧杆菌(b.bifidum)、婴儿双歧杆菌(b.infantis)、乳双歧杆菌(b.lactis)、长双歧杆菌(b.longum);金黄杆菌属(chryseobacterium);柠檬酸杆菌属(citrobacter),例如弗氏柠檬酸杆菌(c.freundii);梭菌属(clostridium),例如产气荚膜梭菌(c.perfringens);色二孢属(diplodia),例如棉色二孢(d.gossypina);肠杆菌属(enterobacter),例如产气肠杆菌(e.aerogenes)、阴沟肠杆菌(e.cloacae);爱德华氏菌属(edwardsiella)、迟钝爱德华菌(e.tarda);欧文氏菌属(erwinia),例如草生欧文氏菌(e.herbicola);埃希氏菌属(escherichia),例如大肠杆菌(e.coli);克雷伯氏菌属(klebsiella),例如肺炎克雷伯氏菌(k.pneumoniae);韩国生工菌属(kribbella),例如黄色韩国生工菌(k.flavida);库茨涅尔氏菌属(kutzneria),例如白色库茨涅尔氏菌(k.albida);微球菌属(miriococcum);漆斑菌属(myrothesium);毛霉属;脉孢菌属,例如粗糙脉孢菌;变形杆菌属(proteus),例如普通变形杆菌(p.vulgaris);普罗维登斯菌属(providencia),例如斯氏普罗维登斯菌(p.stuartii);密孔菌属(pycnoporus),例如朱红密孔菌(pycnoporus cinnabarinus)、血红密孔菌(pycnoporus sanguineus);瘤胃球菌属(ruminococcus),例如扭链瘤胃球菌(r.torques);沙门氏菌属(salmonella),例如鼠伤寒沙门氏菌(s.typhimurium);沙雷氏菌属(serratia),例如液化沙雷氏菌(s.liquefasciens)、粘质沙雷氏菌(s.marcescens);希瓦氏菌属(shewanella),例如武氏希瓦氏菌(s.woodyi);志贺菌属(shigella),例如弗氏志贺菌(s.flexneri);链霉菌属
(streptomyces),例如抗生链霉菌(s.antibioticus)、栗色球孢链霉菌(s.castaneoglobisporus)、紫红链霉菌(s.violeceoruber);栓菌属(trametes);木霉属,例如里氏木霉、绿色木霉(t.viride);耶尔森氏菌属(yersinia),例如小肠结肠炎耶尔森氏菌(y.enterocolitica)。
79.在优选实施例中,内肽酶源自真菌。在另一个优选实施例中,内肽酶源自细菌。
80.在优选实施例中,胰蛋白酶样内肽酶源自镰孢属的菌株、优选尖孢镰孢,例如具有本技术的示为seq id no:1的氨基酸序列(swissprot号p35049),或具有与seq id no:1具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性的氨基酸序列。
81.在优选实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11或seq id no:12中任一个具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
82.在更优选实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6或seq id no:12中任一个具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
83.在甚至更优选实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:1、seq id no:2、seq id no:3、seq id no:4或seq id no:12中任一个具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
84.在另一个优选实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:1或seq id no:12中任一个具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
85.在最优选实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:1具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
86.在另一个优选实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:2具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
87.在另一个优选实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:3具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
88.在另一个优选实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:4具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
89.在另一个优选实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下
氨基酸序列,该氨基酸序列与本技术的seq id no:12具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
90.在另一个实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:5具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
91.在另一个实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:6具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
92.在另一个实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:7具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
93.在另一个实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:8具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
94.在另一个实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:9具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
95.在另一个实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:10具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
96.在另一个实施例中,将在本发明的方法中使用的胰蛋白酶样内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:11具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
97.在优选实施例中,赖氨酸特异性内肽酶源自无色杆菌属(achromobacter)的菌株、优选水解无色杆菌(achromobacter lyticus),例如具有本技术的示为seq id no:15的氨基酸序列,或具有与seq id no:15具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性的氨基酸序列。
98.在最优选实施例中,将在本发明的方法中使用的赖氨酸特异性内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:15具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
99.在优选实施例中,将在本发明的方法中使用的胰蛋白酶样或赖氨酸特异性内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:1、seq id no:2、seq id no:3、seq id no:4、seq id no:5、seq id no:6、seq id no:7、seq id no:8、seq id no:9、seq id no:10、seq id no:11、seq id no:12或seq id no:15中任一个具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
100.在另一个优选实施例中,将在本发明的方法中使用的胰蛋白酶样或赖氨酸特异性内肽酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:1、seq id no:12或seq id no:15中任一个具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
101.出于本发明的目的,使用如在emboss软件包(emboss:欧洲分子生物学开放软件包(emboss:the european molecular biology open software suite),rice等人,2000,trends genet.[遗传学趋势]16:276-277)(优选6.6.0版本或更新版本)的尼德尔程序中所实施的尼德曼-翁施算法(needleman-wunsch algorithm)(needleman和wunsch,1970,j.mol.biol.[分子生物学杂志]48:443-453)来确定两个氨基酸序列之间的序列同一性作为“最长同一性”的输出。使用的参数是空位开放罚分10、空位延伸罚分0.5以及eblosum62(blosum62的emboss版本)取代矩阵。为了使尼德尔程序报告最长同一性,必须在命令行中指定非简化(nobrief)选项。尼德尔标记的“最长同一性”的输出计算如下:
[0102]
(相同的残基x 100)/(比对长度-比对中的空位总数)
[0103]
胰蛋白酶样或赖氨酸特异性内肽酶可以是细胞外的。它可以在其n-末端具有信号序列,该信号序列在分泌期间被切除。
[0104]
胰蛋白酶样或赖氨酸特异性内肽酶可以源自本文提及的任一来源。术语“源自”在本发明的上下文中意指酶可以从其天然存在的生物中分离,即内肽酶的氨基酸序列与天然多肽具有同一性。术语“源自”还意指酶可以在宿主生物中重组产生,重组产生的酶具有与天然酶具有同一性的氨基酸序列,或具有修饰的氨基酸序列(例如具有缺失、插入和/或被取代的一个或多个氨基酸),即重组产生的酶是天然氨基酸序列的突变体。天然酶的含义中包括天然变体。此外,术语“源自”包括通过例如肽合成而合成产生的酶。术语“源自”还包括已经通过例如糖基化、磷酸化等在体内或体外修饰的酶。对于重组产生的酶,术语“源自”指酶的身份而不是重组产生酶的宿主生物的身份。
[0105]
可以通过使用任何合适的技术从微生物获得胰蛋白酶样或赖氨酸特异性内肽酶。例如,酶制剂可通过发酵合适的微生物和之后通过本领域已知的方法从所得的发酵液或微生物分离内肽酶制剂而获得。胰蛋白酶样或赖氨酸特异性内肽酶还可以通过使用重组dna技术而获得。这种方法通常包括培养用重组dna载体转化的宿主细胞,该载体包含编码胰蛋白酶样或赖氨酸特异性内肽酶的dna序列,并且该dna序列与合适的表达信号可操作地连接,使得其能在允许酶表达的条件下在培养基中表达酶,并从培养物回收酶。还可以将dna序列掺入宿主细胞的基因组中。dna序列可以是基因组、cdna或合成来源的、或它们的任何组合,并且可以按照本领域已知的方法进行分离或合成。
[0106]
胰蛋白酶样或赖氨酸特异性内肽酶可以是纯化的。如本文所用的术语“纯化的”包括基本上不含来自生产生物的不溶组分的胰蛋白酶样或赖氨酸特异性内肽酶蛋白。术语“纯化的”还包括基本上不含来自获得酶的天然生物的不溶组分的胰蛋白酶样或赖氨酸特异性内肽酶蛋白。优选地,还可以从酶的来源生物和培养基的一些可溶组分分离。更优选地,可以通过一种或多种单元操作来进行分离:过滤、沉淀或色谱。
[0107]
优选地,胰蛋白酶样或赖氨酸特异性内肽酶纯化自其生产生物。更优选地,胰蛋白酶样或赖氨酸特异性内肽酶纯化自其生产生物,这意味着该胰蛋白酶样或赖氨酸特异性内肽酶制剂不包含活的生产生物细胞。
[0108]
因此,胰蛋白酶样或赖氨酸特异性内肽酶可以是纯化的,即仅存在少量的其他蛋白质。表述“其他蛋白质”具体涉及其他酶。如本文所用的术语“纯化的”还指去除其他组分,特别是存在于胰蛋白酶样或赖氨酸特异性内肽酶的来源细胞中的其他蛋白质并且最特别是存在于胰蛋白酶样或赖氨酸特异性内肽酶的来源细胞中的其他酶。胰蛋白酶样或赖氨酸
特异性内肽酶可以是“基本上纯的”,即不含来自产生该内肽酶的生物(即,例如用于重组产生胰蛋白酶样或赖氨酸特异性内肽酶的宿主生物)的其他组分。优选地,胰蛋白酶样或赖氨酸特异性内肽酶是至少40%(w/w)纯,更优选至少50%、60%、70%、80%或者甚至至少90%纯的酶蛋白制剂。
[0109]
术语胰蛋白酶样或赖氨酸特异性内肽酶包括酶的催化活性必需的任何辅助化合物,例如像合适的受体或辅因子,其可以或者可以不天然存在于反应系统中。
[0110]
胰蛋白酶样或赖氨酸特异性内肽酶可以呈适合于所讨论用途的任何形式,例如像,呈干粉或颗粒、无粉尘颗粒、液体、稳定化液体或受保护酶的形式。
[0111]
胰蛋白酶样或赖氨酸特异性内肽酶能以如下浓度添加:0.1-10微克酶蛋白/g乳蛋白、优选地0.5-5微克酶蛋白/g乳蛋白、更优选地1-5微克酶蛋白/g乳蛋白或3-5微克酶蛋白/g乳蛋白。
[0112]
剂量将取决于参数,如温度、孵育时间和酸奶配方。本领域技术人员将知道如何确定最佳酶剂量。
[0113]
根据本发明,胰蛋白酶样内肽酶活性可以通过本领域已知的任何方法确定。另外,赖氨酸特异性内肽酶活性可以通过本领域已知的任何方法确定。
[0114]
胰蛋白酶样和赖氨酸特异性内切蛋白酶水解生色底物ac-arg-对硝基-苯胺(ac-arg-pna)和/或ac-lys-对硝基-苯胺(ac-arg-pna)。释放的pna在405nm处出现吸收增加,这与酶活性成比例。当ac-arg-pna或ac-lys-pna与酶在ph 8.0、37℃下一同孵育时,一个kmtu与每分钟产生1微摩尔对硝基苯胺的酶的量有关。活性可以相对于已知强度的猪胰腺胰蛋白酶标准品来确定。
[0115]
转谷氨酰胺酶
[0116]
在本发明的方法中,将乳底物用转谷氨酰胺酶处理。
[0117]
将在本发明的方法中使用的转谷氨酰胺酶可以获得自任何来源,特别地获得自丝状真菌或酵母、或获得自细菌。
[0118]
转谷氨酰胺酶可以例如源自如下属的菌株:蘑菇属,例如双孢蘑菇;ascovaginospora属;曲霉属,例如黑曲霉、泡盛曲霉、臭曲霉、日本曲霉、米曲霉;念珠菌属;毛壳菌属;chaetotomastia属;网柄菌属,例如盘基网柄菌;镰孢属,例如尖孢镰孢、腐皮镰孢、镰孢属物种;克鲁维酵母属,例如脆壁克鲁维酵母、乳酸克鲁维酵母;毛霉属,例如爪哇毛霉、高大毛霉、细孢毛霉;脉孢菌属,例如粗糙脉孢菌;枝霉属;根毛霉属,例如微小根毛霉;根霉属,例如少根根霉、日本根霉、匍枝根霉;核盘霉属,例如白腐核盘霉;圆酵母属;球拟酵母属;木霉属,例如里氏木霉;毛癣菌属,例如红色毛癣菌;维氏核盘菌属,例如大豆维氏核盘菌;束丝放线菌属,例如奇迹束丝放线菌;芽孢杆菌属,例如芽孢杆菌属物种、凝结芽孢杆菌、环状芽孢杆菌、巨大芽孢杆菌、休闲地芽孢杆菌、枯草芽孢杆菌、短小芽孢杆菌、嗜热脂肪芽孢杆菌、苏云金芽孢杆菌;双歧杆菌属,例如动物双歧杆菌、两歧双歧杆菌、婴儿双歧杆菌、乳双歧杆菌、长双歧杆菌;金黄杆菌属;柠檬酸杆菌属,例如弗氏柠檬酸杆菌;梭菌属,例如产气荚膜梭菌;色二孢属,例如棉色二孢;肠杆菌属,例如产气肠杆菌、阴沟肠杆菌;爱德华氏菌属、迟钝爱德华菌;欧文氏菌属,例如草生欧文氏菌;埃希氏菌属,例如大肠杆菌;克雷伯氏菌属,例如肺炎克雷伯氏菌;韩国生工菌属,例如黄色韩国生工菌;库茨涅尔氏菌属,例如白色库茨涅尔氏菌;微球菌属;漆斑菌属;毛霉属;脉孢菌属,例如粗糙脉孢菌;变
形杆菌属,例如普通变形杆菌;普罗维登斯菌属,例如斯氏普罗维登斯菌;密孔菌属,例如朱红密孔菌、血红密孔菌;瘤胃球菌属,例如扭链瘤胃球菌;沙门氏菌属,例如鼠伤寒沙门氏菌;沙雷氏菌属,例如液化沙雷氏菌、粘质沙雷氏菌;希瓦氏菌属,例如武氏希瓦氏菌;志贺菌属,例如弗氏志贺菌;链霉菌属,例如抗生链霉菌、栗色球孢链霉菌、紫红链霉菌;栓菌属;木霉属,例如里氏木霉、绿色木霉;耶尔森氏菌属,例如小肠结肠炎耶尔森氏菌。
[0119]
在优选实施例中,转谷氨酰胺酶源自真菌。在另一个优选实施例中,转谷氨酰胺酶源自细菌。
[0120]
在优选实施例中,转谷氨酰胺酶源自链霉菌属的菌株,优选茂原链霉菌(s.mobaraensis)或利迪链霉菌(s.lydicus),更优选茂原链霉菌。
[0121]
在优选实施例中,将在本发明的方法中使用的转谷氨酰胺酶具有如下氨基酸序列,该氨基酸序列与本技术的seq id no:13或seq id no:14或其转谷氨酰胺酶活性片段具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
[0122]
在优选实施例中,将在本发明的方法中使用的转谷氨酰胺酶具有如下氨基酸序列,该氨基酸序列与seq id no:13或seq id no:14的成熟多肽具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
[0123]
在更优选实施例中,将在本发明的方法中使用的转谷氨酰胺酶具有如下氨基酸序列,该氨基酸序列与seq id no:13具有至少50%,如至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%、或100%同一性。
[0124]
转谷氨酰胺酶可以是细胞外的。它可以在其n-末端具有信号序列,该信号序列在分泌期间被切除。
[0125]
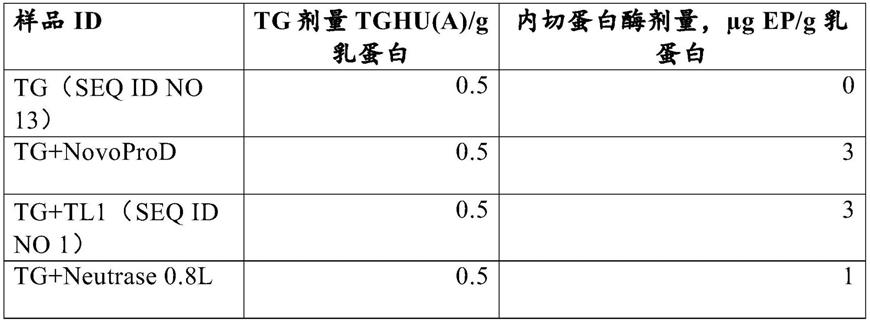
可以通过使用任何合适的技术从微生物获得转谷氨酰胺酶。例如,酶制剂可通过发酵合适的微生物和之后通过本领域已知的方法从所得的发酵液或微生物分离转谷氨酰胺酶制剂而获得。转谷氨酰胺酶还可以通过使用重组dna技术而获得。这种方法通常包括培养用重组dna载体转化的宿主细胞,该载体包含编码转谷氨酰胺酶的dna序列,并且该dna序列与合适的表达信号可操作地连接,使得其能在允许酶表达的条件下在培养基中表达酶,并从培养物回收酶。还可以将dna序列掺入宿主细胞的基因组中。dna序列可以是基因组、cdna或合成来源的、或它们的任何组合,并且可以按照本领域已知的方法进行分离或合成。
[0126]
转谷氨酰胺酶可以是纯化的。如本文所用的术语“纯化的”包括基本上不含来自生产生物的不溶组分的转谷氨酰胺酶蛋白。术语“纯化的”还包括基本上不含来自获得酶的天然生物的不溶组分的转谷氨酰胺酶蛋白。优选地,还可以从酶的来源生物和培养基的一些可溶组分分离。更优选地,可以通过一种或多种单元操作来进行分离:过滤、沉淀或色谱。
[0127]
优选地,转谷氨酰胺酶纯化自其生产生物。更优选地,转谷氨酰胺酶纯化自其生产生物,这意味着该转谷氨酰胺酶制剂不包含活的生产生物细胞。
[0128]
因此,转谷氨酰胺酶可以是纯化的,即仅存在少量的其他蛋白质。表述“其他蛋白质”具体涉及其他酶。如本文所用的术语“纯化的”还指去除其他组分,特别是存在于转谷氨酰胺酶的来源细胞中的其他蛋白质并且最特别是存在于转谷氨酰胺酶的来源细胞中的其他酶。转谷氨酰胺酶可以是“基本上纯的”,即不含来自产生该转谷氨酰胺酶的生物(即,例如用于重组产生转谷氨酰胺酶的宿主生物)的其他组分。优选地,转谷氨酰胺酶是至少40%
(w/w)纯,更优选至少50%、60%、70%、80%或者甚至至少90%纯的酶蛋白制剂。
[0129]
术语转谷氨酰胺酶包括酶的催化活性必需的任何辅助化合物,例如像合适的受体或辅因子,其可以或者可以不天然存在于反应系统中。
[0130]
转谷氨酰胺酶可以呈适合于所讨论用途的任何形式,例如像,呈干粉或颗粒、无粉尘颗粒、液体、稳定化液体或受保护酶的形式。
[0131]
转谷氨酰胺酶能以如下浓度添加:0.1-5tghu(a)/g乳蛋白、优选0.2-1tghu(a)/g乳蛋白。剂量将取决于参数,如温度和孵育时间。本领域技术人员将知道如何确定最佳酶剂量。
[0132]
根据本发明,转谷氨酰胺酶活性可以通过本领域已知的任何方法确定。例如,可以通过对因在自由氨基(6-氨基己酸)与谷氨酰胺(z-gln-gly)的酰基之间形成异肽键而释放的氨进行定量来分析转谷氨酰胺酶活性,如下文所描述:
[0133]
使用的化学品和酶:
[0134]
z-gln-gly。例如西格玛公司(sigma)c6154
[0135]
6-氨基己酸。例如西格玛公司07260
[0136]
还原型l-谷胱甘肽。例如西格公司g4251
[0137]
α-酮戊二酸盐。例如西格玛公司k3752
[0138]
nadh
[0139]
l-gldh。例如罗氏制药公司(roche)107735
[0140]
mops。例如西格玛公司m-1254
[0141]
转谷氨酰胺酶标准品
[0142]
方法:
[0143]
向75myl酶溶液(溶解于0.1m mops/5mm还原型l-谷胱甘肽,ph 7.0)中添加50myl 1%6-氨基己酸和75myl 1%z-gln-gly以及75myl(含0.44g/l nadh、2.5g/lα-酮戊二酸盐的0.1m mops(ph7.0))。
[0144]
在30℃下通过动态测量来追踪340nm处的吸光度并保持5min。
[0145]
酶活性是相对于转谷氨酰胺酶标准品确定的,该标准品经过校准与转谷氨酰胺酶单位定义相匹配(folk,j.e.和cole,p.w.(1966)biochim.biophys.acta.[生化与生物物理学报]241,5518-5525)。结果表示为tghu(a)。
[0146]
实例
[0147]
方法
[0148]
粘度测量
[0149]
使用快速粘度分析仪(rapid visco analyzer,rva)4500(波通仪器公司(perten instruments),瑞典)测量粘度。将30g酸奶样品转移至rva杯中,并且允许在测量前于冰箱中凝固1h。在25℃下以50rpm持续130秒进行测量。为简单起见,展示70秒后的粘度读数。
[0150]
自发脱水收缩的评价
[0151]
将50g新鲜酸奶样品转移至50ml nunc离心管中,并冷藏储存16天。称量出储存后在酸奶顶部分离的游离乳清,并将量表示为酸奶重量的%。
[0152]
强制脱水收缩测试
[0153]
将30g酸奶样品以3500rpm(=2643x g)离心15min,并且在去除上清液(乳清)后记
录剩余固体的重量。排出的乳清的量使用如下公式计算:(酸奶样品的重量-固相的重量)/(酸奶样品的重量)*100%。
[0154]
对质地的目视评价
[0155]
通过将酸奶样品置于黑色塑料勺的背面(这种情况下易于观察到结块或颗粒性和流动/稀薄质地)来评价酸奶样品的目视外观。
[0156]
感官评价
[0157]
由6名已经参与基本感官筛选并熟悉酸奶质地评价的评估者进行感官评价。样品通过3位数代码匿名化。在评级测试中评价酸奶,其中评估者以目视和口感参数、在1-7级量表上对酸奶评级。参数为:目视:颗粒性/成片性外观、光泽度、浓稠度、脱水收缩;口感:口腔浓稠度、对牙齿的黏着性、苦味和沙质/沙砾质口感。
[0158]
实例1.
[0159]
使用转谷氨酰胺酶和多种内切蛋白酶的组合的搅拌型低脂酸奶
[0160]
该实例的目的是比较使用转谷氨酰胺酶和多种内切蛋白酶的组合产生的搅拌型酸奶的味道和质地。
[0161]
低脂搅拌型酸奶的实验室规模生产
[0162]
0.5%脂肪含量的低巴氏杀菌脱脂乳购自当地超市,并且未经进一步标准化用于酸奶生产。将乳等分成100g小份,并在90℃下巴氏杀菌持续5分钟,然后冷却至酸化温度43℃。将起子培养物(lyofast y450b,萨科公司(sacco),意大利)和酶添加至乳中,并且在43℃下进行酸化持续4-5小时,直至ph达到4.5。在起子培养物后立即同时添加转谷氨酰胺酶和内切蛋白酶。内切蛋白酶的给予是基于初始剂量反应测试,其中对不同剂量下酶对酸奶外观和粘度的影响进行了研究(结果未显示)。为当前实例选择了剂量,该剂量相比于未处理的参比品带来最细腻的产品和更高的粘度。
[0163]
novoprod、neutrase、alcalase和ronozym proact均为内切蛋白酶,但非胰蛋白酶样或赖氨酸特异性的。这些酶分别在ec 3.4.21.62、3.4.24.28、3.4.21.62和3.4.21.1中进行了分类。
[0164]
当ph降至终值时,使用勺破坏酸奶凝胶,然后通过使用剪切混合器(ultra turrax,ika集团(ika),德国)以最低速度将酸奶混合20秒。将酸奶转移至盖有盖子的塑料杯中,并冷藏储存直至评价。储存6天后进行粘度测量、目视和感官评价,而在储存16天后评价脱水收缩。
[0165]
表1.酶处理概述。给予是基于初步剂量反应测试(结果未显示)
[0166]
[0167][0168]
结果与讨论
[0169]
结果总结于表2中。单独使用转谷氨酰胺酶制备的参比酸奶具有轻微的颗粒性/成片性外观。除了alcalase(其带来了结块性和更高的颗粒性质地)之外,内切蛋白酶的添加带来了外观上一定程度的改善。特别地,使用tg和tl1或neutrase的组合制备的酸奶是细腻的,没有可见的成片性。
[0170]
典型地,将转谷氨酰胺酶添加到酸奶中以增加粘度,并且改善的细腻度不应以影响粘度为代价。通常,用tg和内切蛋白酶的组合制备的酸奶显示出粘度略微低于单独用tg制备的酸奶。然而,根据其他实验室规模的试验(结果未显示),已知以所述方法但未添加转谷氨酰胺酶或内切蛋白酶而生产的低脂搅拌型酸奶的粘度低于本试验中任一样品的粘度。与使用neutrase的酸奶相比,使用tl1制备的酸奶保留了更高的粘度。
[0171]
使用转谷氨酰胺酶的优点之一是减少储存期间的脱水收缩。如表2所示,在单独使用转谷氨酰胺酶生产的参比酸奶中未观察到脱水收缩。相比之下,测试的5种内切蛋白酶中有3种在储存期间导致一定程度的乳清分离,这不是所期望的。值得注意的是,tl1不会导致脱水收缩,而使用neutrase的酸奶有显著的脱水收缩。
[0172]
图1示出了酸奶的感官评价结果。除了alcalase之外的所有内切蛋白酶均改善了外观,使得颗粒性/成片性外观减少且光泽度提高。另外,就对牙齿的黏着性降低和沙质/沙砾质减少而言,口感得到改善。目视浓稠度和口感浓稠度均有一定程度的降低,但与其他经内切蛋白酶处理的酸奶相比,用tl1和novoprod处理的酸奶被认为相对更浓稠。样品均不被认为具有明显苦味,然而用alcalase和ronozym proact处理的酸奶被认为具有比其他酸奶更明显的苦味。
[0173]
表2.储存6天后评价酸奶的目视外观和粘度,并且储存16天后测量脱水收缩。
[0174][0175]
结论
[0176]
通过几个参数进行评价,转谷氨酰胺酶与内切蛋白酶tl1的组合带来了整体最佳
的质地和味道。用tl1制备的酸奶的外观比用大多数其他内切蛋白酶(除了neutrase)制备的酸奶更细腻,并且tl1不会引起苦味。tl1不会导致脱水收缩,而使用neutrase的酸奶在储存期间出现显著的脱水收缩。
[0177]
实例2.
[0178]
使用转谷氨酰胺酶和tl1的组合的搅拌型低脂酸奶的中试规模生产(pilot scale production)
[0179]
该实例的目的是表明,与单独使用转谷氨酰胺酶生产的酸奶相比,使用转谷氨酰胺酶和tl1组合生产的低脂酸奶的质地更细腻。低脂搅拌型酸奶的中试规模生产
[0180]
生牛乳获得自当地农场,并且标准化为0.1%脂肪和3.5%蛋白质含量。将乳在95℃下巴氏杀菌持续5分钟,并且冷却至酸化温度43℃。将起子培养物(lyofast y450b,萨科公司,意大利)以及tg(seq id no 13)和内切蛋白酶tl1(seq id no 1)添加至乳中,并且在43℃下进行酸化持续5-6小时,直至ph达到4.5。
[0181]
首先手动混合酸奶凝胶以破坏凝胶,然后通过使用剪切混合器(ytron-z,ytron工艺技术公司(ytron process technology),德国)进行混合。调整频率,目标是获得尽可能细腻的产品。每份样品的使用频率示于表3中。高剪切混合后,将酸奶在管式冷却器中冷却至20℃-22℃,并包装于用盖子密封的200ml塑料杯中。将酸奶冷藏储存直至评价。
[0182]
在储存9-10天、14天和21天后进行粘度测量和强制脱水收缩测试。储存1周和2周后进行感官评价。
[0183]
表3.包括在中试研究中的处理概述
[0184][0185]
结果与讨论
[0186]
图2示出了储存2周后酸奶的感官评价结果。参比酸奶的浓稠度最低(无论是在视觉上还是在口中),并且显示出最高的脱水收缩。同时,将参比酸奶评价为非常有光泽且细腻(低/无颗粒性或成片性)。另一方面,仅用tg处理的酸奶被认为明显更浓稠且表现出更低的脱水收缩,但也具有更高的颗粒性/成片性外观和更明显的沙质/沙砾质口感。这些质地缺陷的程度与使用的酶剂量有关。将tl1内切蛋白酶与tg一同应用对目视和口感质地特征有积极影响。与仅用tg处理的酸奶相比,该外观被评为颗粒性/成片性较低,且沙质/沙砾质口感减少。同时,粘度得以保留并且脱水收缩未增强。酸奶味道宜人,不具苦味。
[0187]
储存期间分3次测量的酸奶样品粘度示于表4中。根据该数据,显然在整个储存时间内经所有酶处理的酸奶具有比参比品更高的粘度。另外可见,与单独使用tg相比,使用tg和tl1内切蛋白酶的组合能够获得相似程度的粘度增加,因此内切蛋白酶处理不会影响酸
奶的浓稠度。
[0188]
离心(强制脱水收缩)后从酸奶中排出的乳清的量是保水能力的量度,并且与储存期间发生的自发脱水收缩倾向相关。从表5中展示的数据可见,所有酶处理均显著降低了强制脱水收缩,并且与仅添加tg的酸奶相比,tl1内切蛋白酶与tg的组合并没有导致更高的脱水收缩。
[0189]
结论
[0190]
与未处理的参比酸奶相比,酸化期间在脂肪含量为0.1%的酸奶乳中添加tg和tl1内切蛋白酶的组合可使酸奶的粘性更大并且改善了乳清的保留。同时,与仅添加tg的酸奶相比,获得了无成片性且更细腻的质地。酸奶口感好,且味道宜人,不具苦味。
[0191]
表4:酸奶样品的粘度
[0192][0193]
表5:酸奶样品的强制脱水收缩:离心后排出的乳清,所示的值为%w/w。
[0194][0195]
实例3.
[0196]
使用转谷氨酰胺酶和tl1的组合的搅拌型全乳酸奶
[0197]
该实例的目的是表明,与单独使用转谷氨酰胺酶相比,使用转谷氨酰胺酶和tl1的组合可以生产质地更细腻的全乳搅拌型酸奶。全乳搅拌型酸奶的实验室规模生产
[0198]
3.5%脂肪含量的低巴氏杀菌全乳购自当地超市,并且未经进一步标准化用于酸奶生产。将乳等分成100ml小份,并在90℃下巴氏杀菌持续5分钟,并冷却至酸化温度43℃。将起子培养物(lyofast y450b,萨科公司,意大利)以及转谷氨酰胺酶(seq id no 13)和tl1(seq id no 1)添加至乳中,并且在43℃下进行酸化持续4-5小时,直至ph达到4.5。产生通过每种处理获得的两种酸奶(表6)。
[0199]
然后,通过使用勺破坏酸奶凝胶,然后使用剪切混合器(ultra turrax)以最低速度混合20秒。将酸奶转移至盖有盖子的塑料杯中,并冷藏储存直至评价。储存6天后进行粘度、强制脱水收缩测试和目视评价。
[0200]
表6.
[0201][0202]
结果与讨论
[0203]
未添加酶的对照全乳酸奶具有细腻的外观,但也是测试酸奶中最稀薄的,从表7中展示的粘度可见。以增加的剂量添加tg增加了酸奶的粘度,但也会逐渐导致更高的颗粒性、成片性质地。因此,具有颗粒性质地缺陷的外观限制了单独使用tg可以实现的粘度。
[0204]
添加了tg和tl1的组合的酸奶具有细腻的外观,且同时比对照酸奶更浓稠。使用0.5tghu(a)/g蛋白质的tg和tl1的组合实现了与使用0.4tghu(a)/g蛋白质的tg而不使用tl1相似的粘度,但在细腻度方面质地明显更好。
[0205]
tl1与不同浓度的转谷氨酰胺酶一同添加对乳清的保留没有任何显著的影响,如通过强制脱水收缩测试测量的(结果见表7)。
[0206]
表7.储存6天后评价的目视外观、粘度和强制脱水收缩。
[0207][0208]
结论
[0209]
与未处理的参比酸奶相比,酸化期间在脂肪含量为3.5%的酸奶乳中添加tg和tl1内切蛋白酶的组合可使酸奶的粘性更大并且改善了乳清的保留。同时获得了无成片性且细腻的质地。
[0210]
实例4.
[0211]
起子培养物前在搅拌型低脂酸奶中添加转谷氨酰胺酶和蛋白酶
[0212]
该实例的目的是表明,当在起子培养物前添加酶时,使用转谷氨酰胺酶和tl1的组合可以生产质地更细腻的搅拌型酸奶。
[0213]
搅拌型酸奶的实验室规模生产
[0214]
0.5%脂肪含量的低巴氏杀菌脱脂乳购自当地超市,并且未经进一步标准化用于酸奶生产。将乳等分成100g小份,并在90℃下巴氏杀菌持续5分钟,然后冷却至酸化温度43℃。将转谷氨酰胺酶(seq id no 13)和内切蛋白酶tl1(seq id no 1)添加至乳中,并孵育1
或2小时,然后添加起子培养物(lyofast y450b,萨科公司,意大利)。为了参比,试验中包括不含酶的乳。另外,还包括其中在起子培养物后立即添加酶的样品以便比较。在43℃下进行酸化持续4-5小时,直至ph达到4.5。
[0215]
当ph降至终值时,使用勺破坏酸奶凝胶,然后通过使用剪切混合器(ultra turrax)以最低速度将酸奶混合20秒。将酸奶转移至盖有盖子的塑料杯中,并冷藏储存直至评价。储存6天后进行粘度测量、目视评价和强制脱水收缩测试。
[0216]
表8.酶处理概述。
[0217][0218]
结果与讨论
[0219]
未添加酶的对照酸奶具有细腻的外观,但也是测试酸奶中最稀薄的,从表7中展示的粘度可见。与未处理的对照酸奶相比,添加0.3或0.5tghu(a)/g的tg增加了酸奶的粘度。当在起子培养物前添加tg时,粘度增加较高,这种情况预期为用于交叉结合的总反应时间更长。同时,增加的交叉结合导致更高的颗粒性和结块性质地。当内切蛋白酶tl1与tg一同给予时,与单独给予相同剂量(0.5tghu(a)/g蛋白质)tg的酸奶相比,或者甚至与较低剂量(0.3tghu(a)/g蛋白质)tg的酸奶相比,所得的酸奶质地更细腻。针对所有测试的添加时间点对改善情况进行了观察,即在起子培养物前1h或2h或起子培养物后立即给予酶的情况下的酸奶。
[0220]
表9.储存6天后评价的目视外观、粘度和强制脱水收缩。
[0221][0222]
结论
[0223]
与单独添加相当或较低剂量tg的酸奶相比,内切蛋白酶和转谷氨酰胺酶的组合改善了质地。这些酸奶更细腻,同时仍然保留所期望的浓稠度并且减少了脱水收缩。无论在起子培养物前还是在起子培养物后立即添加酶均实现了改善,因此影响不限于酶添加的特定时间点。
[0224]
实例5.
[0225]
使用转谷氨酰胺酶和猪胰蛋白酶或来自水解无色杆菌的赖氨酸特异性蛋白酶的组合的低脂搅拌型酸奶
[0226]
该实例的目的是表明,猪胰蛋白酶和来自水解无色杆菌的赖氨酸特异性蛋白酶是否具有与内切蛋白酶tl1相同的作用。
[0227]
低脂搅拌型酸奶的实验室规模生产
[0228]
0.5%脂肪含量的低巴氏杀菌脱脂乳购自当地超市,并且未经进一步标准化用于酸奶生产。将乳等分成100g小份,并在95℃下巴氏杀菌持续5分钟,然后冷却至酸化温度43℃。将起子培养物(lyofast y450b,萨科公司,意大利)和酶添加至乳中,并且在43℃下进行酸化持续4-5小时,直至ph达到4.5。在起子培养物后立即同时添加转谷氨酰胺酶和内切蛋白酶(猪胰蛋白酶(seq id no:12)或来自水解无色杆菌的赖氨酸特异性蛋白酶(alp)(seq id no:15))。内切蛋白酶的给予受实例1启发。根据实例1中的描述进行酸奶生产方法以及粘度和脱水收缩测试等分析。测试前,从胰蛋白酶粗品制剂中纯化猪胰蛋白酶,以去除胰凝乳蛋白酶和其他酶活性。
[0229]
表10.酶处理概述。
[0230][0231]
表11.储存6天后评价的酸奶的目视外观、粘度和强制脱水收缩,以及储存9天后测量的脱水收缩
[0232][0233][0234]
结果与讨论
[0235]
结果总结于表11中。经tg处理的酸奶具有颗粒性,而经所有蛋白酶+tg处理的样品的颗粒性均较低。猪胰蛋白酶+tg的剂量反应和alp+tg的剂量反应使得颗粒性逐渐改善,直至在最高剂量下产生细腻的酸奶。最高剂量的alp+tg样品产生了细腻的酸奶,但不影响由转谷氨酰胺酶构建的质地,如通过粘度测量的。总体而言,tg+alp3样品是所有测试组合中的最佳酸奶。
