1.本实用新型涉及医疗诊断技术领域,更具体地说,是涉及一种循环肿瘤细胞智能分选系统。
背景技术:
2.在医疗诊断领域,循环肿瘤细胞(circulating tumor cell,ctc)是存在于人体外周血中的各类肿瘤细胞的统称,因自发或诊疗操作从实体肿瘤病灶(原发灶、转移灶)脱落,大部分ctc在进入外周血后发生凋亡或被吞噬,少数能够逃逸并发展成为转移灶,进而增加恶性肿瘤患者死亡风险。从人体外周血中检测到ctc相关信息在早期诊断、辅助诊断、评估预后、快速判断化疗效果、体内耐药性检测及肿瘤复发转移监测等应用中具有重大临床意义。
3.肿瘤转移患者每毫升全血中通常只含有极少的ctc(数量级分别高达109红细胞和106白细胞中只存在1-100个ctc),因此要实现ctc的精确检测非常困难,很容易漏检,要把循环肿瘤细胞从血液中分选出来,就更加困难。
4.目前ctc的主要分选技术,一是基于物理学差异的分离方法(如密度梯度离心法,微孔过滤方法等),根据ctc的大小、密度、力学和介电性能等物理特性将ctc筛选出来。其操作简单,但由于ctc的异质性,以及和白细胞在尺寸上有较多的重叠,分类的样本中会混合大量的白细胞且ctc丢失率高;二是基于生物学性质差异分离法(如基于磁性纳米颗粒的亲和性分选),根据通过细胞表面特异性表达的蛋白质生物标志物分离靶细胞,其捕获率、灵敏度较低,并且操作繁琐,使用特异性抗体成本较高。
5.另外,基于流式细胞仪技术,通过荧光检测方法,可以实现单细胞的检测和分选,在医学的临床研究和应用中具有广泛应用,用于细胞内基因表达鉴定、药物筛选以及肿瘤等疾病的早期诊断等。但是,流式细胞仪技术在检测细胞时,需要细胞排列成一条单一的线,细胞一个一个的通过检测系统,因此检测时间较长。将流式细胞仪应用到循环肿瘤检测上,需要从上千万个血细胞中检测和分选出几个循环肿瘤细胞,在时间上不具有可行性。
6.虽然循环肿瘤的检测技术,已经取得了很大的进步,并有一些实际产品已经在临床应用,但是目前的循环肿瘤检测产品仍然存在价格昂贵、操作复杂、检测时间长以及准确率、灵敏度不高等问题。
技术实现要素:
7.本实用新型实施例的目的在于提供一种循环肿瘤细胞智能分选系统,以解决现有技术中存在的循环肿瘤检测产品价格昂贵、操作复杂、检测时间长以及准确率、灵敏度不高的技术问题。
8.为实现上述目的,本实用新型采用的技术方案是:提供一种循环肿瘤细胞智能分选系统,包括具有微流控管道的微流控模块、设置于所述微流控管道的周边的显微图像采集模块,以及与所述显微图像采集模块电性连接的图像识别模块,所述微流控模块用于使
预处理后的人体外周血在所述微流控管道中连续流动,所述显微图像采集模块用于连续采集所述微流控管道中的细胞图像,所述图像识别模块用于识别所述细胞图像并控制所述微流控管道内的液体流向以从血细胞中筛选出循环肿瘤细胞。
9.可选地,所述微流控模块包括具有所述微流控管道的微流控芯片、与所述微流控管道连通且用于将预处理后的人体外周血注入所述微流控管道的注射组件,与所述微流控管道连通且用于收集分选出的循环肿瘤细胞的收集器,以及与所述微流控管道连通且用于收集废液的废液缸。
10.可选地,所述注射组件包括第一注射器、与所述第一注射器连接且用于将所述第一注射器内的预处理后的人体外周血泵入所述微流控管道内的第一注射泵,以及用于连通所述第一注射器和所述微流控管道的第一注射软管。
11.可选地,所述注射组件还包括与所述第一注射器平行设置的第二注射器、与所述第二注射器连接且用于将所述第二注射器内的鞘液泵入所述微流控管道内的第二注射泵,以及用于连通所述第二注射器和所述微流控管道的第二注射软管。
12.可选地,所述微流控管道包括主管道,所述主管道具有位于管道上游且与所述第一注射软管连通的粘弹性血液样本液体入口、位于管道下游且与所述收集器连通的分选通道,以及位于管道下游且与所述废液缸连通的废液出口,所述主管道内还具有与所述显微图像采集模块对应的图像采集区域,所述主管道的管道下游设置有用于控制所述主管道内的流体的流动方向的电磁阀。
13.可选地,所述微流控管道包括主管道,所述主管道具有位于管道上游且与所述第一注射软管连通的血液样本液体入口、位于管道上游且与所述第二注射软管连通的鞘液入口、位于管道下游且与所述收集器连通的分选通道,以及位于管道下游且与所述废液缸连通的废液出口,所述主管道内还具有与所述显微图像采集模块对应的图像采集区域,所述主管道的管道下游设置有用于控制所述主管道内的流体的流动方向的电磁阀。
14.可选地,所述收集器与所述分选通道之间通过分选软管连通,所述废液缸与所述废液出口之间通过流出软管连通。
15.可选地,所述显微图像采集模块包括设置有通孔的载物台、设置于所述通孔下方的显微物镜、设置于所述通孔上方的光源、设置于所述通孔上方的相机,以及用于调焦的调焦装置,所述通孔用于容置所述微流控芯片,所述相机用于实时拍摄流入所述微流控管道中的流动细胞图像。
16.可选地,所述图像识别模块与所述相机通过传输线连接且用于识别所述流动细胞图像。
17.可选地,所述图像识别模块与所述电磁阀电性连接且用于控制所述电磁阀的打开或关闭。
18.本实用新型提供的循环肿瘤细胞智能分选系统的有益效果在于:与现有技术相比,本实用新型的循环肿瘤细胞智能分选系统,包括具有微流控管道的微流控模块、设置于微流控管道的周边的显微图像采集模块,以及与显微图像采集模块电性连接的图像识别模块,微流控模块用于使预处理后的人体外周血在微流控管道中连续流动,显微图像采集模块用于连续采集微流控管道中的细胞图像,图像识别模块用于识别细胞图像并控制微流控管道的液体流向以从血细胞中筛选出循环肿瘤细胞,该智能分选系统成本低廉、操作简单、
检测时间短且准确率高,无需借助药物和其他医疗设备,对医护和患者友好,具有广泛的适用性。
附图说明
19.为了更清楚地说明本实用新型实施例中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本实用新型的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
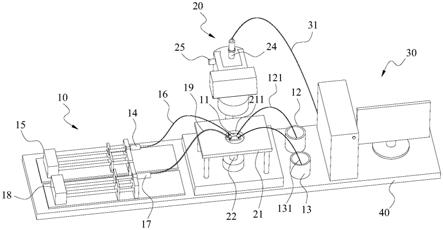
20.图1为本实用新型实施例提供的循环肿瘤细胞智能分选系统的立体结构示意图;
21.图2为本实用新型实施例提供的循环肿瘤细胞智能分选系统的主视结构示意图;
22.图3为本实用新型实施例提供的循环肿瘤细胞智能分选系统的俯视结构示意图;
23.图4为本实用新型实施例提供的循环肿瘤细胞智能分选系统的侧视结构示意图;
24.图5为本实用新型一个实施例提供的微流控管道的立体结构示意图;
25.图6为本实用新型另一个实施例提供的微流控管道的立体结构示意图。
26.其中,图中各附图标记:
27.10、微流控模块;11、微流控芯片;111、粘弹性血液样本液体入口;112、分选通道;113、废液出口;114、图像采集区域;115、电磁阀;116、血液样本液体入口;117、鞘液入口;12、收集器;121、分选软管连通;13、废液缸;131、流出软管;14、第一注射器;15、第一注射泵;16、第一注射软管;17、第二注射器;18、第二注射泵;19、第二注射软管;20、显微图像采集模块;21、载物台;211、通孔;22、显微物镜;23、光源;24、相机;25、调焦装置;30、图像识别模块;31、传输线;40、底座。
具体实施方式
28.为了使本实用新型所要解决的技术问题、技术方案及有益效果更加清楚明白,以下结合附图及实施例,对本实用新型进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本实用新型,并不用于限定本实用新型。
29.需要说明的是,当元件被称为“固定于”或“设置于”另一个元件,它可以直接在另一个元件上或者间接在该另一个元件上。当一个元件被称为是“连接于”另一个元件,它可以是直接连接到另一个元件或间接连接至该另一个元件上。
30.需要理解的是,术语“长度”、“宽度”、“上”、“下”、“前”、“后”、“左”、“右”、“竖直”、“水平”、“顶”、“底”、“内”、“外”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本实用新型和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本实用新型的限制。
31.此外,术语“第一”、“第二”仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括一个或者更多个该特征。在本实用新型的描述中,“多个”的含义是两个或两个以上,除非另有明确具体的限定。
32.近年来,微流控技术在循环肿瘤检测中得到越来越广泛的使用。微流控芯片11技术基于ctc的物理特性或生化特性或两种特性的结合来富集ctc,所需样品量小、流速可控
而且能够捕获活细胞。
33.请一并参阅图1至图4,现对本实用新型实施例提供的循环肿瘤细胞智能分选系统进行说明。所述循环肿瘤细胞智能分选系统,包括微流控模块10、显微图像采集模块20和图像识别模块30。其中,微流控模块10内具有微流控管道且用于使预处理后的人体外周血在微流控管道中连续流动,显微图像采集模块20设置于微流控管道的周边,且用于连续采集微流控管道中的细胞图像,图像识别模块30与显微图像采集模块20电性连接,且用于接收细胞图像并识别细胞图像,根据识别的细胞图像控制微流控管道内的液体流向以从血细胞中筛选出循环肿瘤细胞。
34.本实用新型提供的循环肿瘤细胞智能分选系统,与现有技术相比,其包括具有微流控管道的微流控模块10、设置于微流控管道的周边的显微图像采集模块20,以及与显微图像采集模块20电性连接的图像识别模块30,微流控模块10用于使预处理后的人体外周血在微流控管道中连续流动,显微图像采集模块20用于连续采集微流控管道中的细胞图像,图像识别模块30用于识别细胞图像并控制微流控管道的液体流向以从血细胞中筛选出循环肿瘤细胞,该智能分选系统成本低廉、操作简单、检测时间短且准确率高,无需借助药物和其他医疗设备,对医护和患者友好,具有广泛的适用性。
35.其中,经过预处理的人体外周血含有大量血细胞及ctc,经过细胞核染或不核染,当对细胞进行核染时,如果需要细胞分选之后仍然具有活性,可以使用不影响细胞活性的染色剂,并且用缓冲液进行稀释。本实用新型实施例的预处理过程简单,采用稀释后的人体外周血或者仅进行初期密度梯度离心的人体外周血作为样本,无需去除外周血中与循环肿瘤物理特性相似从而极难分离的白细胞,只需简单的进行核染或者不进行核染。
36.在本实用新型的一个实施例中,微流控模块10包括微流控芯片11、注射组件、收集器12和废液缸13。其中,微流控芯片11内具有上述微流控管道,注射组件与微流控管道连通且用于将预处理后的人体外周血注入微流控管道内,收集器12与微流控管道连通且用于收集分选出的循环肿瘤细胞,废液缸13与微流控管道连通且用于收集废液,该废液即不含循环肿瘤细胞的血液。在本实施例中,采用经过预处理后的人体外周血作为样本,注入到注射组件,再通过注射组件注入到微流控芯片11中。
37.微流控芯片11具有扁平的横截面(例如50um*200um),因为后续的显微图像采集模块20采用显微镜来放大,因此采集图像的景深较小,通常只有几个微米到几十个微米,为了能够让采集到的图像在显微镜焦平面上,使得成像清晰,可以采用以下两种方法:第一、通过向注射组件内通入鞘液形成鞘流,从而将血液挤压为一个薄层,通过图像采集区域114;第二、对血液进行缓冲稀释时,采用具有粘弹性的缓冲液(例如使用透明质酸(ha)溶液或者聚乙烯吡咯烷酮(pvp)溶液),使样本自身形成粘弹性液体,利用粘弹性液体在扁平微流控管道内的粘弹性聚焦机理,使细胞排列到中心位置平面内,通过图像采集区域114。
38.在本实用新型的一个实施例中,请参阅图1至图4,注射组件包括第一注射器14、第一注射泵15和第一注射软管16。其中,第一注射泵15与第一注射器14连接,且第一注射泵15用于将第一注射器14内的预处理后的人体外周血泵入微流控管道内,第一注射软管16用于连通第一注射器14和微流控管道。在本实施例中,采用经过预处理后的人体外周血作为样本,注入到第一注射器14中,通过第一注射泵15以适当的速度注入到微流控芯片11中,该预处理后的人体外周血自身能够形成粘弹性液体。
39.在本实施例中,请结合图5,微流控管道包括主管道,该主管道具有粘弹性血液样本液体入口111、分选通道112和废液出口113。其中,粘弹性血液样本液体入口111位于管道上游且与第一注射软管16连通,分选通道112位于管道下游且与收集器12连通,废液出口113位于管道下游且与废液缸13连通。另外,主管道内还具有图像采集区域114,该图像采集区域114与显微图像采集模块20对应。在主管道的管道下游设置有用于控制主管道内的流体的流动方向的电磁阀115。具体地,图像识别模块30与电磁阀115电性连接且用于控制电磁阀115的打开或关闭。
40.在本实施例中,当图像识别模块30检测到图像识别区域中有循环肿瘤细胞通过时,控制管道下游的电磁阀115进行工作产生一个抽吸力改变微流控芯片11内的流体流动的轨迹,使得循环肿瘤细胞进入分选通道112,从而实现细胞的分选。当没有检测到循环肿瘤细胞时,电磁阀115关闭,样品流从粘弹性血液样本液体入口111进入,从废液出口113流出。电磁阀115控制流向的控制通道与电磁阀115相连接,当电磁阀115工作时,废液通道关闭,通道内的流体改变流动方向。其中,废液出口113后连接废液缸13,用来收集废液;分选通道112分选出来的循环肿瘤细胞流入收集器12,用来收集循环肿瘤细胞。
41.在本实用新型的另一个实施例中,请参阅图1至图4,注射组件还包括第二注射器17、第二注射泵18和第二注射软管19。其中,第二注射器17与第一注射器14平行设置,以节省空间;第二注射泵18与第二注射器17连接,且第二注射泵18用于将第二注射器17内的鞘液泵入微流控管道内,第二注射软管19用于连通第二注射器17和微流控管道。在本实施例中,将预处理后的人体外周血通过第一注射泵15通过微流控芯片11中,利用第二注射泵18通入鞘液,从而将血液挤压为一个薄层,保持样本中各类细胞在管道内压缩流动状态,以满足显微成像系统的景深要求。
42.在本实施例中,请结合图6,微流控管道包括主管道,该主管道具有血液样本液体入口116、鞘液入口117、分选通道112和废液出口113。其中,血液样本液体入口116位于管道上游且与第一注射软管16连通,鞘液入口117位于管道上游且与第二注射软管19连通,分选通道112位于管道下游且与收集器12连通,废液出口113位于管道下游且与废液缸13连通。另外,主管道内还具有图像采集区域114,该图像采集区域114与显微图像采集模块20对应。在主管道的管道下游设置有用于控制主管道内的流体的流动方向的电磁阀115。具体地,图像识别模块30与电磁阀115电性连接且用于控制电磁阀115的打开或关闭。
43.在本实施例中,当图像识别模块30检测到图像识别区域中有循环肿瘤细胞通过时,控制管道下游的电磁阀115进行工作产生一个抽吸力改变微流控芯片11内的流体流动的轨迹,使得循环肿瘤细胞进入分选通道112,从而实现细胞的分选。当没有检测到循环肿瘤细胞时,电磁阀115关闭,样品流从血液样本液体入口116和鞘液入口117进入,从废液出口113流出。电磁阀115控制流向的控制通道与电磁阀115相连接,当电磁阀115工作时,废液通道关闭,通道内的流体改变流动方向。其中,废液出口113后连接废液缸13,用来收集废液;分选通道112分选出来的循环肿瘤细胞流入收集器12,用来收集循环肿瘤细胞。
44.在本实用新型的一个实施例中,请参阅图1及图3,收集器12与分选通道112之间通过分选软管连通121,废液缸13与废液出口113之间通过流出软管131连通。
45.在本实用新型的一个实施例中,请参阅图1至图4,显微图像采集模块20包括载物台21、显微物镜22、光源23、相机24和调焦装置25。其中,载物台21上设置有通孔211,显微物
镜22设置于通孔211的下方,光源23设置于通孔211的上方且与显微物镜22正对设置,相机24设置于通孔211的上方,调焦装置25用于调焦。上述通孔211用于容置微流控芯片11,相机24用于实时拍摄流入微流控管道的图像采集区域114的流动细胞图像。
46.在本实施例中,将微流控芯片11放置于载物台21上,通过光源23照亮微流控管道内的细胞,光源23要有足够的强度,以保证在以很小的曝光时间(例如小于10μs或其他更小的时间,这样可以避免长曝光时间引起的运动模糊问题)进行图像采集时,仍然有足够的图像亮度;选择合适倍率的显微物镜22,以便拍摄到合适的微流控管道内的细胞图像;调焦装置25进行调焦,以便拍摄到清晰的各种流动细胞图像(可以采用自动调焦或手动调焦),相机24实时拍摄流入微流控芯片11中通过图像采集区域114中的各种流动细胞图像。
47.在本实用新型的一个实施例中,请参阅图1及图2,图像识别模块30与相机24通过传输线31连接且用识别流动细胞图像。在本实施例中,相机24实时拍摄的流动细胞图像通过传输线31送入到图像识别模块30,图像识别模块30对流动细胞图像进行识别。其中,图像识别模块30可以采用机器学习或者深度学习等人工智能的计算网络,如卷积神经网络模型。
48.具体地,在图像识别模块30中对ctc的检测,基于细胞形态学鉴定。与正常血细胞比较,ctc具有结构、功能和代谢的异常,如细胞核大、深染、畸形、核浆比高和大小不一等。在检测之前,需要训练ctc的分类器模型(例如通过深度学习,训练一个ctc识别模型)。模型的训练,需要大量的标记图像,但是对实际的肿瘤病人的血液样本进行图像采集,1ml血液中只有几个或几十个ctc细胞,但是却含有几百万甚至上千万个血细胞,采集到的图像,绝大部分是不包含循环肿瘤细胞的,而让专业医生在几百万或几千万个血液细胞中标记出几个或几十个循环肿瘤细胞,工作量太大,是无法实现的。本实用新型实施例可以采用如下方法来实现循环肿瘤细胞的标注和训练:首先将各类培养的癌症细胞(比如乳腺癌细胞、肺癌细胞、肝癌细胞等,数量可以选择比如大于1万个或10万个),混入1ml抽取的正常人的血液中,通过上述微流控模块10和显微图像采集模块20,采集到含有大量癌细胞的图像,然后由专业医生根据循环肿瘤细胞与血液细胞在形态学上的不同进行循环肿瘤细胞的标注;然后依据这些标注的图像,训练一个循环肿瘤细胞分类模型;最后将确诊的癌症患者的人体外周血通过上述的微流控模块10和显微图像采集模块20,采集一系列的细胞图像,送入到上述已经训练好的模型中进行检测,降低判断阈值,得到疑似循环肿瘤的细胞图像,然后让专业医生进行判断,去除分类错误的细胞图像,将分类正确的循环肿瘤细胞图像加入训练集,重新训练,不断更新分类模型。这样通过不断扩大样本训练数据集,最终使得分类模型的准确率不断提高。
49.在本实用新型的一个实施例中,请参阅图1至图4,循环肿瘤细胞智能分选系统还包括底座40,微流控模块10、显微图像采集模块20和图像识别模块30依次设置于底座40上。
50.以上所述仅为本实用新型的较佳实施例而已,并不用以限制本实用新型,凡在本实用新型的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本实用新型的保护范围之内。
