1.本发明涉及基因测序技术领域,具体涉及一种试剂盒及其制备测序用靶核苷酸的方法。
背景技术:
2.第二代测序(ngs)已经发展成为分子生物学中一种非常强大的工具,使得基因组鉴定、基因检测、药物发现和疾病诊断等领域取得了快速进展。随着第二代测序(ngs)技术的不断进步,单次测序的核酸的数量正在增加。这使得研究人员能够对更大量的样本进行测序,并且每个样本的reads数得到提升,从而能够检测该样本中的微小序列变化。第二代测序技术(ngs)通过检测出患者体内存在的罕见等位基因或者突变,在肿瘤检测领域,有着极其广泛的应用。但是在基于现有的国产化测序平台所使用的at连接建库方式对于低频突变的检出,灵敏度较低。建库过程中容易造成含有罕见突变的拷贝丢失。
技术实现要素:
3.根据第一方面,在一实施例中,提供一种试剂盒,所述试剂盒包含第一接头序列、第二接头序列、短寡核苷酸序列;
4.所述第一接头序列的5’末端被腺苷酸化,所述第一接头序列的3’末端修饰有间隔子(sp acer);3’末端的间隔子可以阻止3'端外切酶和3'端聚合酶发挥作用,在反应中作为阻断基团;
5.从5’端到3’端,所述第一接头序列包含反义接头互补区、第一引物(index1)结合区;
6.从5’端到3’端,所述第二接头序列包含第二引物结合区以及可与所述反义接头互补区反向互补配对的正义接头互补区;
7.所述短寡核苷酸序列可与所述第一接头序列上靠近5’末端的部分序列反向互补配对。
8.根据第二方面,在一实施例中,提供一种使用第一方面所述试剂盒制备测序用靶核苷酸的方法,包括:
9.第一连接步骤,包括用连接酶将所述第一接头序列与所述短寡核苷酸序列退火,形成含双链结构的第一连接产物;
10.第二连接步骤,包括将所述第一连接产物连接至靶核苷酸,得到第二连接产物;
11.第三连接步骤,包括向第二连接产物所在的反应体系中加入所述第二接头序列,通过竞争性链置换作用,使得所述第二连接产物上的短寡核苷酸序列被第二接头序列置换,得到连接有所述第二接头序列的第三连接产物,即为所述测序用靶核苷酸。
12.依据上述实施例的一种试剂盒及其制备测序用靶核苷酸的方法,本发明提供了特殊设计的接头序列以及对所述接头的修饰,无接头二聚体产生,且降低了样本dna片段的嵌合体形成。
附图说明
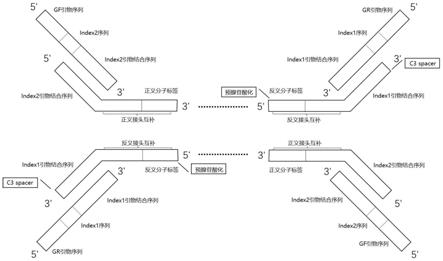
13.图1为一种实施例的的测序接头结构示意图。
14.图2为一种实施例的含双链结构的adapter1和短oligo退火产物结构示意图。
15.图3为实施例1的质控结果图。
16.图4为实施例2的质控结果图。
17.图5为实施例3的测序深度结果图。
18.图6为25ng起始量下分别用cn110248675a专利中的接头(adapter)和本发明实施例1中的接头(adapter)进行实验的测序结果有效深度。
具体实施方式
19.下面通过具体实施方式结合附图对本发明作进一步详细说明。其中不同实施方式中类似元件采用了相关联的类似的元件标号。在以下的实施方式中,很多细节描述是为了使得本技术能被更好的理解。然而,本领域技术人员可以毫不费力的认识到,其中部分特征在不同情况下是可以省略的,或者可以由其他元件、材料、方法所替代。在某些情况下,本技术相关的一些操作并没有在说明书中显示或者描述,这是为了避免本技术的核心部分被过多的描述所淹没,而对于本领域技术人员而言,详细描述这些相关操作并不是必要的,他们根据说明书中的描述以及本领域的一般技术知识即可完整了解相关操作。
20.另外,说明书中所描述的特点、操作或者特征可以以任意适当的方式结合形成各种实施方式。同时,方法描述中的各步骤或者动作也可以按照本领域技术人员所能显而易见的方式进行顺序调换或调整。因此,说明书和附图中的各种顺序只是为了清楚描述某一个实施例,并不意味着是必须的顺序,除非另有说明其中某个顺序是必须遵循的。
21.本文中为部件所编序号本身,例如“第一”、“第二”等,仅用于区分所描述的对象,不具有任何顺序或技术含义。而本技术所说“连接”、“联接,”如无特别说明,均包括直接和间接连接(联接)。
22.根据第一方面,在一实施例中,提供一种试剂盒,所述试剂盒包含第一接头序列、第二接头序列、短寡核苷酸序列;
23.所述第一接头序列的5’末端被腺苷酸化,所述第一接头序列的3’末端修饰有间隔子(sp acer);3’末端的间隔子可以阻止3'端外切酶和3'端聚合酶发挥作用,在反应中作为阻断基团;
24.从5’端到3’端,所述第一接头序列包含反义接头互补区、第一引物(index1)结合区;
25.从5’端到3’端,所述第二接头序列包含第二引物(index2)结合区以及可与所述反义接头互补区反向互补配对的正义接头互补区;
26.所述短寡核苷酸序列(亦称截短链、短oligo)可与所述第一接头序列上靠近5’末端的部分序列反向互补配对。
27.第一接头序列、第二接头序列、寡核苷酸序列可以独立包装于不同的容器中,或同一容器的不同腔室中,形成套装试剂盒,使用时,再将第一接头序列与所述短寡核苷酸序列退火,形成双链结构的第一连接产物,后续再加入靶核苷酸、第二接头序列进行反应。
28.在一实施例中,所述反义接头互补区含有反义分子标签序列。
29.在一实施例中,所述反义分子标签序列位于所述第一接头序列的5’末端。
30.在一实施例中,所述短寡核苷酸序列的3’末端被阻断。
31.在一实施例中,所述短寡核苷酸序列的3’末端修饰有阻断基团,用于阻止该末端延伸。
32.在一实施例中,所述短寡核苷酸序列的3’末端修饰有双脱氧核苷酸残基。
33.在一实施例中,所述短寡核苷酸序列的长度为9~11nt,优选为9~10nt。该长度不包含3’末端修饰的双脱氧核苷酸残基。短寡核苷酸序列过长会导致在接头2的连接反应中连接效率降低,构建文库失败。过短会造成接头序列在退火时无法特异性退火,无法进行下一步的连接。
34.在一实施例中,所述反义分子标签序列的长度为5~7nt,优选为5~6nt,更优选为5nt。
35.在一实施例中,所述反义分子标签序列为随机序列。
36.在一实施例中,所述第一接头序列包含如下核苷酸序列:
37.5'-/rapp/nnnnnaagtcggaggccaagcggtcttaggaa/spacer c3/-3'。
38.所述第二接头序列包含如下核苷酸序列:
39.5'-ggctcacagaacgacatggctacgatccgacttnnnnn-3'。
40.所述短寡核苷酸序列包含如下核苷酸序列:
41.5'-gacttnnnn/ddn/-3';
[0042]“/rapp/”表示预腺苷酸化修饰,“spacer c3”表示spacer c3修饰,“/ddn/”表示2’,3
’‑
双脱氧修饰的核苷酸,“n表示”a、t、g、c四种碱基中的任一种碱基,第一接头序列中的“nnnnn”表示反义分子标签,第二接头序列中的“nnnnn”表示正义分子标签,所述正义分子标签与所述反义分子标签反向互补。
[0043]
在一实施例中,所述第一接头序列包含seq id no.1~17所示序列中的至少一种。
[0044]
在一实施例中,所述第二接头序列包含seq id no.18~34所示序列中的至少一种。
[0045]
在一实施例中,所述短寡核苷酸序列包含seq id no.35~51所示序列中的至少一种。
[0046]
在一实施例中,所述第一接头序列包含如下核苷酸序列:
[0047]
5'-/rapp/gtctaaagtcggaggccaagcggtcttaggaa/spacer c3/-3'。
[0048]
在一实施例中,所述第二接头序列包含如下核苷酸序列:
[0049]
5'-ggctcacagaacgacatggctacgatccgactttagac-3'。
[0050]“/rapp/”表示预腺苷酸化修饰,“spacer c3”表示spacer c3修饰。
[0051]
在一实施例中,所述短寡核苷酸序列包含如下核苷酸序列中的至少一种:
[0052]
5'-ccgactttaga/ddc/-3';
[0053]
5'-cgactttaga/ddc/-3';
[0054]
5'-gactttaga/ddc/-3';
[0055]“/ddc/”表示2',3'-双脱氧修饰的胞嘧啶核苷酸。
[0056]
根据第二方面,在一实施例中,提供一种使用第一方面所述试剂盒制备测序用靶核苷酸的方法,包括:
[0057]
退火步骤,包括用连接酶将所述第一接头序列与所述短寡核苷酸序列退火,形成含双链结构的退火产物;
[0058]
第一连接步骤,包括将所述退火产物连接至靶核苷酸,得到第一连接产物;
[0059]
第二连接步骤,包括向第一连接产物所在的反应体系中加入所述第二接头序列,通过竞争性链置换作用,使得所述第一连接产物上的短寡核苷酸序列被第二接头序列置换,得到连接有所述第二接头序列的第二连接产物,即为所述测序用靶核苷酸。
[0060]
在一实施例中,所述第一接头序列与所述第二接头序列退火的温度-所述第一接头序列与所述短寡核苷酸序列退火的温度≥5℃。
[0061]
在一实施例中,所述第一接头序列与所述第二接头序列退火的温度-所述第一接头序列与所述短寡核苷酸序列退火的温度≥8℃。
[0062]
在一实施例中,所述第一接头序列与所述第二接头序列退火的温度-所述第一接头序列与所述短寡核苷酸序列退火的温度≥10℃。
[0063]
在一实施例中,所述第一接头序列与所述第二接头序列退火的温度可以为40~45℃,包括但不限于40℃、41℃、42℃、43℃、44℃、45℃。
[0064]
在一实施例中,所述第一接头序列与所述短寡核苷酸序列退火的温度可以为25~35℃,优选为27~35℃,包括但不限于25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃。
[0065]
在一实施例中,所述退火步骤中,所述连接酶包含t4dna连接酶、在k159处具有氨基酸取代的t4dna连接酶中的至少一种。
[0066]
在一实施例中,所述氨基酸取代是k159s。
[0067]
在一实施例中,第一连接步骤中,所述靶核苷酸包含末端修复后的靶核苷酸。
[0068]
在一实施例中,所述含双链结构的退火产物在加入第一连接反应体系前的初始浓度为20~40μmol/l。
[0069]
在一实施例中,第一连接步骤中,向第一连接反应体系中加入的所述含双链结构的第一连接产物的体积为2μl,第一连接反应体系的体积为30μl。
[0070]
在一实施例中,第二连接步骤中,所述第二接头序列在加入第二连接反应体系前的初始浓度为10~20μmol/l。
[0071]
在一实施例中,第二连接步骤中,向第二连接反应体系中加入的所述第二接头序列的体积为4μl,第二连接反应体系的体积为10μl。
[0072]
在一实施例中,第一连接步骤中,所述靶核苷酸的起始投入量≥5ng,优选为5~25ng。
[0073]
在一实施例中,第一连接步骤中,所述退火产物与靶核苷酸通过平末端连接方式连接。
[0074]
在一实施例中,还包括对所述第二连接产物进行纯化、捕获、再次纯化,得到测序用靶核苷酸。
[0075]
基于现有技术存在的缺陷,在一实施例中,本发明设计了一种基于mgi测序平台实现高灵敏度低平突变检测的平末端连接建库体系,能够在低投入量下,表现出比现有at连接更高的灵敏度和转化效率,更有利于低频突变的检出。
[0076]
在一实施例中,本发明涉及构建第二代测序(ngs)文库,用于全基因组测序、靶向
重测序、基于测序的筛选分析、宏基因组学、甲基化测序或需要为ngs制备样品的任何其他应用。具体涉及一种在gene+seq 2000、gene+seq200和dnbseq-t7平台上适用的,实现高灵敏度低平突变检测的平末端连接建库体系以及应用。
[0077]
在一实施例中,本发明的目的在于提高片段转化效率,获得更高的文库复杂度和测序深度,以达到能在早期肿瘤早筛中更加灵敏的检测出低频突变。
[0078]
在一实施例中,本发明提供的建库方法包括一步末端修复反应、两步连接反应、一步pcr扩增反应、三步纯化反应。
[0079]
在一实施例中,末端修复反应体系中,t4多核苷酸激酶(pnk)和t4 dna聚合酶(t4dna polymerase)将来源于样本的dna片段末端修复形成平末端,不同于传统的建库方法形成的粘性末端。
[0080]
在一实施例中,如图1所示,本发明提供的建库方法的连接反应中,使用了一种突变型的t4 dna连接酶——k159s。此种突变体k159s酶不能利用atp腺苷酸化反应底物,因此只有预腺苷酸化的底物可以被连接。
[0081]
在一实施例中,在连接反应中,除了使用了特殊的连接酶,所使用的接头也经过了特殊的修饰,此种经过特殊修饰的接头(adapter)序列,包括接头1(adapter1,即第一接头序列)、接头2(adapter2,即第二接头序列)和短oligo(即短寡核苷酸序列)。详细序列见表1。
[0082]
表1接头序列
[0083][0084]
上述序列中,“/rapp/”表示预腺苷酸化修饰,“spacer c3”表示spacer c3修饰,“/ddn/”表示2’,3
’‑
双脱氧修饰的核苷酸,“n”表示a、t、g、c四种碱基中的任意一种碱基,“nnnnn”表示正义分子标签和与正义分子标签反向互补的反义分子标签。
[0085]
下划波浪线标示的序列为接头互补区,接头互补区中有一部分序列(n碱基序列)为分子标签,剩余部分为非分子标签的接头互补区。具体地,adapter1中下划波浪线标示的序列为反义接头互补区,adapter2中下划波浪线标示的序列为正义接头互补区,adapter1中的反义接头互补区与adapter2中的正义接头互补区反向互补。
[0086]
adapter1中的“nnnnn”为反义分子标签,adapter2中的“nnnnn”为正义分子标签,两者反向互补。正义分子标签、反义分子标签统称分子标签(umi)。
[0087]
单下划线标示的序列为引物结合区。具体地,adapter1中单下划线标示的序列为第一引物结合区,adapter2中单下划线标示的序列为第二引物结合区。
[0088]
在一实施例中,各序列的说明如下:
[0089]
1、如图1所示,adapter1(第一接头序列)的结构如下:此序列由5'端到3'端,依次为反义接头互补区、index1引物(第一引物)结合区,其中反义接头互补区包含反义分子标签(umi)。adapter1 5'端进行预腺苷酸化修饰,3'端c3 spacer修饰。5'端进行预腺苷酸化修饰使其在连接反应中能够被k159s酶利用,与样本dna片段3'oh能够发生连接反应;c3 spacer主要用于模仿核糖的3'和5'羟基间的三碳间隔,或"替代"一个序列中未知的碱基。3'-sp acer c3可以阻止3'端外切酶和3'端聚合酶发挥作用,在此反应中作为阻断基团。
[0090]
2、如图2所示,短oligo(短寡核苷酸序列)的结构如下:此序列为一段短的核苷酸序列,此序列的3'端核苷酸进行双脱氧修饰。adapter1上5'端10bp长度的序列和短oligo配对,形成部分双链结构,用于第一次连接反应。
[0091]
3、如图1所示,adapter2(第二接头序列):此序列由5'端到3'端,依次为index2引物结合区(第二引物结合区)、可与adapter1的反义接头互补区反向互补的正义接头互补区,其中正义接头互补区包含与adapter1中的反义分子标签反向互补的正义分子标签。
[0092]
设计的混合特异分子标签接头adapter和umi如表2所示。
[0093]
表2混合特异分子标签接头adapter1、adapter2和短oligo序列
[0094]
[0095][0096]
在一实施例中,建库的流程包括两步连接过程,第一步连接反应,在k159s突变酶的作用下,通过平末端连接方式将adapter1与短oligo退火形成的部分双链结构的产物(如图2所示),连接到修复后的dna片段上;第二步连接反应,通过竞争性链置换作用,adapter2将短oligo链置换,连接到第一次连接产物上。adapter序列和短oligo序列经过精密的设计,以保证竞争性链置换过程高效进行。
[0097]
在一实施例中,本发明pcr扩增反应使用的是与混合特异分子标签接头配套的双index接头引物。
[0098]
在一实施例中,本发明提供了一种突变型的t4 dna连接酶——k159s。此种突变体k159s酶不能利用atp腺苷酸化反应底物,因此只有预腺苷酸化的底物可以被连接。因此减少了样本dna片段自连的嵌合体的形成
[0099]
在一实施例中,本发明提供了一种特殊修饰后的接头,adapter1 5'端进行预腺苷
酸化修饰,3'端c3 spacer修饰;短oligo 3'端核苷酸进行双脱氧修饰。最大限度地提高转换效率,减少接头二聚体的生成。
[0100]
在一实施例中,本发明提供了一种独特的两部连接体系,降低了嵌合体形成概率,并且几乎无接头二聚体产生。因此,与传统的基于at连接的方法相比,这种策略提供了更高的转换效率和文库复杂性,实现了高灵敏度的低频突变检测。
[0101]
在一实施例中,本发明提供的一种混合特异分子标签接头,所述混合特异分子标签接头的正义分子标签和反义分子标签均使用所述的特异分子标签umi组;通过使用本发明的特异分子标签umi组,所述混合特异分子标签接头在建库时,解决了碱基不平衡问题,且能提高接头与目标dna序列的连接效率及目标dna序列的有效利用率。
[0102]
在一实施例中,本发明提供的一种混合特异分子标签接头,不同特异分子标签umi在所述的混合特异分子标签接头中的摩尔数相同,由于各分子标签无明显的偏好性,为了保证连接的均匀性,因此,将各分子标签在所述的混合特异分子标签接头中的摩尔数相同。
[0103]
在一实施例中,本发明提供的特异分子标签umi组,可以确定两个相似的序列reads是来自不同的原始片段,还是仅仅是在pcr扩增文库时产生的,来自相同的原始片段。
[0104]
传统的at连接,由于分子标签位于接头连接端,为保证正常的at连接,通常会在分子标签下游1bp引入固定t-a碱基对。该碱基对在gene+seq 2000、gene+seq200和dnbseq-t7平台会导致整张芯片信号过曝光,造成分子标签及下游序列测序错误。在一实施例中,本发明设计的接头序列末尾分子标签下游碱基组成随机,避免了过曝的问题。
[0105]
以下实施例中,如无特别说明,“室温”是指23℃
±
2℃。
[0106]
以下实施例中,如无特别说明,“80%乙醇”均是指体积百分浓度为80%的乙醇,亦称“80%v/v乙醇”,是由乙醇与nf-h2o(无核酸酶水,亦称nuclease-free water)按照80:20的体积比配制而成。
[0107]
以下实施例中,te缓冲液(te buffer)购自invitrogen,货号12090015。组成如下:10mm tris-hcl(ph 8.0)、0.1mm edta。
[0108]
实施例1短oligo序列设计
[0109]
本实施例针对短寡核苷酸(oligo)的序列进行了设计。
[0110]
本实施例adapter 1序列为:5'-/rapp/gtctaaagtcggaggccaagcggtcttaggaa/spacer c3/-3';adapter 2序列为:5'-ggctcacagaacgacatggctacgatccgactttagac-3'。
[0111]“rapp”表示被预腺苷酸化。
[0112]“spacer c3”表示c3阻断基团。
[0113]
短寡核苷酸(短oligo)的序列有三种不同长度的设计见表3。
[0114]
表3三种短寡核苷酸序列
[0115]
[0116][0117]
上述adapter 1与每种短oligo形成一个反应体系,具体地,第一份adapter 1与短oligo1形成第一个反应体系,第二份adapter 1与短oligo 2形成第2个反应体系,第三份adapt er 1与短oligo 3形成第3个反应体系。按照以下步骤进行退火:
[0118]
(1)根据adapter 1及短oligo的合成总量,分别加入相应体积的接头退火缓冲液,经充分混匀、短暂离心以及室温静置溶解10min,制备成adapter 1、短oligo的摩尔浓度分别为100μmol/l的接头寡核苷酸链退火工作液。
[0119]
(2)对应分子标签的adapter 1和短oligo退火工作液,各取25μl至新的pcr管中,震荡混匀后,置于pcr仪中按照表4程序进行梯度降温退火,得到包含各分子标签的接头母液(50μmol/l)。使用agilent dna 1000芯片对各接头母液进行质控。
[0120]
表4退火温度设置
[0121][0122]
(3)质控合格的接头母液,等体积进行混合,得到混合接头母液。使用时,使用te缓冲液,根据需要进行稀释并分装保存在-20
±
5℃环境中。
[0123]
本实施例提供了一种利用平末端连接建库体系构建文库的方法,包括如下步骤:
[0124]
(1)末端修复
[0125]
提前将xgen prism dna library prep kit置于冰盒,待试剂溶解后振荡混匀并离心。按照表5配制末端修复mix(mix1),振荡混匀并离心。
[0126]
表5末端修复试剂(end repair master mix)
[0127]
组分单反应体积(volume-per reacation,μl)end repair buffer6end repair enzyme3总体积9
[0128]
配制后的混合液按照每个反应9μl,依次分装至50μl dna样本中,振荡混匀并离心。按照表6反应条件在恒温混匀仪或pcr仪上孵育。孵育完成后,降至室温,高速离心机短暂离心,将蒸发起的液滴收集入管内。
[0129]
表6末端修复反应程序(end repair program)
[0130]
步骤温度时间120℃30min24℃hold
[0131]
末端修复后,将147.5μl ampure磁珠(2.5倍体积)加入末端修复后的反应液,吹打混匀十次,孵育10min。放置磁力架上,等待2~5分钟至液体澄清,弃去上清液,避免吸取磁珠。加入160μl现配80%乙醇孵育30s。弃去上清液,用20μl枪头吸去剩余液体,干燥磁珠。用提前配制好的连接1反应液(mix2)回溶。
[0132]
(2)连接1反应
[0133]
将溶解后的ligation 1buffer、ligation 1enzyme及adapter1和短oligo的退火产物振荡混匀并离心。按照表7配制连接1反应液(mix 2),充分振荡混匀并离心后按照每个反应30μl于冰上分装至各反应管,振荡混匀并离心后将反应管置于pcr仪上按照表8程序进行反应。
[0134]
表7连接1反应液(ligation 1master mix)
[0135][0136]
表7中,adapter 1与短oligo的退火产物在加入连接1反应液前的初始浓度为20μmol/l,取2μl退火产物加入连接1反应液后,退火产物在体系中的终浓度为20μmol/l*2μl/30μl≈1.3μmol/l。
[0137]
表8连接1反应程序
[0138]
步骤温度时间120℃15min265℃15min34℃hold
[0139]
(3)连接2反应
[0140]
将溶解后的ligation 2buffer、ligation 2enzyme a、ligation 2enzyme b及adapte r2振荡混匀并离心。按照表9配制连接2反应液(mix 3),充分振荡混匀并离心后按照每个反应10μl于冰上分装至各反应管,振荡混匀并离心后将反应管置于pcr仪上按照表10程序进行反应。
[0141]
表9连接2反应液(ligation 2master mix)
[0142]
组分单反应体积(μl)ligation 2buffer4.5adapter 24ligation 2enzyme a0.5ligation 2enzyme b1
总体积(μl)10
[0143]
表8中,adapter 2在加入连接1反应液前的的初始浓度为20μmol/l,取4μl adapter 2加入连接2反应液后,adapter 2在体系中的终浓度为20μmol/l*4μl/30μl≈2.7μmol/l。
[0144]
表10连接2反应程序(ligation 2program)
[0145]
步骤温度时间165℃30min24℃hold
[0146]
(4)连接2反应后纯化
[0147]
连接2反应完成后,将100μl peg/nacl(2.5倍体积)加入连接反应后的反应液,吹打混匀十次,孵育10min。放置磁力架上,等待2~5分钟至液体澄清,弃去上清液,避免吸取磁珠。加入160μl现配80%乙醇孵育30s。弃去上清液,用20μl枪头吸去剩余液体,干燥磁珠。从磁力架上取下离心管,加入20μl te缓冲液(ph 8.0),用移液器将磁珠与te吹打混匀,室温下孵育5min。孵育结束,将离心管短暂离心,置于磁力架上至完全澄清。将上清纯化产物转移到新的pcr管中,每管取1μl做labchip质控。
[0148]
(5)捕获前pcr(non-c-pcr)
[0149]
提前将双index接头引物工作液及2
×
kapa hifi hotstart readymix置于室温解冻,解冻后试剂振荡混匀并离心。向20μl回溶的溶液中加入5μl te双index接头引物工作液和25μl 2
×
kapa hifi hotstart readymix。将样本置于pcr仪中,按照表11程序进行pcr扩增。
[0150]
表11pcr程序
[0151][0152]
(6)pcr后纯化
[0153]
pcr反应结束后,将65μl peg/nacl(1.3倍体积)加入pcr反应后的反应液,吹打混匀十次,孵育10min。孵育结束,将离心管短暂离心并置于磁力架上至澄清,弃上清。保持离心管于磁力架上,向各离心管中依次加入200μl体积分数为80%的乙醇水溶液,关紧管盖颠倒漂洗3次,弃上清,用20μl枪头吸去剩余液体。将离心管打开盖子置于磁力架上晾干至磁珠表面哑光。从磁力架上取下离心管,加入31μl te缓冲液(ph 8.0),用移液器将磁珠与te吹打混匀,室温下孵育5min。孵育结束,将离心管短暂离心,置于磁力架上至完全澄清。将上清纯化产物转移到新的1.5ml离心管中备用。
[0154]
制得的样本接头连接产物labchip的质控结果见图3。
[0155]
图3为三种短寡核苷酸建库接头连接产物labchip指控结果。从图3(a)可见,短oli go1的连接效率较低,中间产物较多(a);从图3(b)、图3(c)可见,短oligo2和短olig o3的连
接效率显著提高,中间产物明显减少。
[0156]
实施例2adapter 1、adapter 2最适浓度的探索
[0157]
为了探究adapter 1、adapter 2的最适浓度设置浓度梯度实验,adapter 1设置三个浓度,分别为:20p(p是指μmol/l,后续用p表示的浓度含义与此相同)、30p和40p;adapter 2设置两个浓度,分别为10p和20p。五组实验按照实施例1进行实验操作,短寡核苷酸序列为短寡核苷酸3。实验结果如图4所示。
[0158]
adapter 1的浓度20p、30p、40p均是指adapter 1在加入表7所示的连接1反应液前的初始浓度。加入连接1反应液的实际是adapter 1与短oligo退火后的含双链结构的核苷酸序列,含双链结构的核苷酸序列是由adapter 1与短oligo等摩尔混合后反应得到,因此,ada pter 1在加入连接1反应液前的初始浓度等同于含双链结构的核苷酸序列加入连接1反应液前的初始浓度。
[0159]
adapter 2的浓度10p、20p均是指adapter 2在加入表9所示的连接2反应液前的初始浓度。
[0160]
图4为adapter 1、adapter 2出库浓度和labchip质控结果。adapter1不同浓度(20p、30p、40p)建库,最终文库浓度结果(a);adapter 1不同浓度(20p、30p、40p)接头连接产物labchip结果(b);adapter 2不同浓度(10p、20p)建库,最终文库浓度结果(c);adapter2不同浓度(10p、20p)接头连接产物labchip结果(d)。从图4(a)可见,adapter1在浓度为20μmol/l时,文库浓度最高,随着adapter1浓度的升高,文库浓度逐渐降低;从图4(b)可见,adapter1在不同浓度时连接效率相近;从图4(c)可见,adapter 2的浓度为20μmol/l时,文库浓度明显较高,adapter 2的浓度为10μmol/l时,文库浓度明显较低;从图4(d)可见,adapter 2的浓度为20μmol/l时,连接效率较高,adapter 2的浓度为10μmol/l时,连接效率较低。
[0161]
实施例3 5ng、10ng、25ng起始样本投入,起始建库,dnbseq-t7测序结果。
[0162]
两个不同样本分别做5ng、10ng、25ng起始投入,按照实施例1所述方法进行建库,短寡核苷酸序列为短寡核苷酸3,完成文库制备之后,使用dnbseq-t7测序仪进行测序。测序深度结果如图5。
[0163]
图5为不同起始量下平末端连接和传统at连接(具体方法参考文献:j.f.hess,t.a.kohl,m.kotrov
á
,k.t.paprotka,v.mohr,t.hutzenlaub,m.br
ü
ggemann,r.zen gerle,s.niemann,n.paust,library preparation for next generation sequencing:a review ofautomation strategies,biotechnology advances,volume 41,2020,107537,issn 0734-9750,)有效深度对比图。5ng起始建库,左边平末端连接,右边at连接(a)10ng起始建库,左边平末端连接,右边at连接,同种颜色的点代表相同的样本(b)25ng起始建库,左边平末端连接,右边at连接,同种颜色的点代表相同的样本(c)。从图5可见,在5ng、10ng、25ng起始样本投入下,平末端连接的有效深度均高于at连接方式。
[0164]
实施例4
[0165]
使用公开号为cn110248675a的中国专利《利用竞争性链置换构建下一代测序(ngs)文库》中的adapter和本发明实施例1的adapter同时进行实验,25ng起始样本投入,起始建库,分别用nextseq cn500和dnbseq-t7测序结果。
[0166]
具体地,同一个样本分两份做25ng起始投入,一份使用cn110248675a专利中的
adapt er进行实验,记作实验a,另一份使用本实施例1中的adapter进行实验,短寡核苷酸序列为短寡核苷酸3,记作实验b。按照实施例1所述方法进行建库,完成文库制备之后,实验a用nextseq cn500进行测序,实验b用dnbseq-t7进行测序,测序有效深度结果如图6所示。
[0167]
实验a使用了cn110248675a专利说明书的表1中seq id no:1~98所示的所有序列(参见该专利说明书第65~73段)。
[0168]
图6为25ng起始量下分别用cn110248675a专利中的adapter和本发明实施例1中ada pter进行实验的测序结果有效深度。a代表cn110248675a专利中的adapter,b代表本发明实施例1中的adapter。从图6可见,本发明实施例1中的adapter在25ng起始投入时,有效深度为1541
×
,高于cn110248675a专利中的adapter的有效深度1323
×
。
[0169]
在一实施例中,本发明中的两条接头序列可以适配mgi平台,除此之外,第一接头的截短链序列长度不同,并且本发明中对第一接头的截短链序列进行了特殊设计,第一接头的截短链和第一接头长序列的退火温度与第二接头序列和第一接头长序列的退火温度相差10℃,提高了接头的连接效率。并且,cn110248675a专利中包含了8bp的umi(分子标签),umi长度的增加会占据插入片段的测序数据量之外,8bp的umi在后续的靶向捕获中易造成靶向捕获效率偏低。在一实施例中,本发明使用长度为5bp的umi,在保证了低屏突变检出的同时,捕获效率以及有效数据量不至于下降太严重。
[0170]
在一实施例中,本发明涉及构建第二代测序(ngs)文库,用于全基因组测序、靶向重测序、基于测序的筛选分析、宏基因组学或需要为ngs制备样品的任何其他应用。
[0171]
在一实施例中,适用于本发明的平台包括但不限于gene+seq 2000、gene+seq200、dn bseq-t7平台。
[0172]
在一实施例中,本发明提供了特殊设计的接头序列以及对所述接头的修饰,无接头二聚体产生,且降低了样本dna片段的嵌合体形成。因此,本发明提供了一种基于国产测序平台实现高灵敏度低平突变检测的平末端连接建库体系,该建库方法表现出比现有at连接更高的灵敏度和转化效率,更有利于低频突变的检出。
[0173]
以上应用了具体个例对本发明进行阐述,只是用于帮助理解本发明,并不用以限制本发明。对于本发明所属技术领域的技术人员,依据本发明的思想,还可以做出若干简单推演、变形或替换。
