一种编码sars-cov-2抗原的mrna及mrna疫苗
技术领域
1.本发明属于生物医药技术领域,具体涉及一种编码sars-cov-2抗原的mrna及mrna疫苗。
背景技术:
2.mrna是以dna的一条链作为模板转录而来、携带有遗传信息、可以指导蛋白质合成的单链核糖核酸,从1961年发现mrna至2019年,市面上尚无mrna药物获批应用于临床。然而,近十年来,mrna递送系统和核酸化学的不断发展推进了mrna疗法的临床前开发,加速了mrna发展成为一种新型核酸药物的进程。2021年获紧急授权使用的两款mrna疫苗在新冠疫情爆发后短短一年时间左右便推向临床,且保护效力超过90%,体现了mrna疫苗的优越性。mrna疫苗不但生产周期较短,而且不涉及细胞培养和发酵工程,几个月内即可通过普通gmp完成生产,可快速应对突发性传染病,极大地降低了mrna药物的研发成本。两款mrna疫苗为抑制新冠疫情的传播起到了至关重要的作用,也让人们对mrna技术未来给蛋白质替代疗法、癌症免疫疗法、crispr基因编辑等其他领域带来的改变充满期待。
3.新型冠状病毒(sars-cov-2)通过刺突蛋白(s蛋白)s1亚基的受体结合域(rbd)与宿主细胞表面的血管紧张素转换酶2(ace2)受体蛋白结合,造成宿主感染。两款紧急授权使用的新冠mrna疫苗均使用目前最为常见的四组分复合脂质纳米载体(包括阳离子或可离子化主脂质、结构脂质、胆固醇和聚乙二醇化脂质)递送编码新型冠状病毒(sars-cov-2)刺突蛋白(s蛋白)的mrna序列,诱导机体产生免疫反应,但两者递送载体的组成成分不同,造成了二者之间在疫苗的运输、储存方式上有很大区别。另外,现有的mrna疫苗可能会引起潜在的不良反应。伴随着疫情防控常态化,疫苗需求在全球市场依然持续增长,开发多样化的mrna、递送系统以及mrna疫苗,有利于改变mrna疫苗的运输和储存方式,缓解市场供应链中原料短缺和mrna疫苗供不应求的局面,是本领域亟待解决的问题。
技术实现要素:
4.针对现有技术的不足,本发明的目的在于提供一种编码sars-cov-2抗原的mrna及mrna疫苗,所述mrna可编码sars-cov-2s1亚基的受体结合域;包含其的mrna疫苗的稳定性好,摄取效率高,制剂组分简单,能够介导高水平的蛋白表达。
5.为达到此发明目的,本发明采用以下技术方案:
6.第一方面,本发明提供一种编码sars-cov-2抗原的mrna,所述mrna的编码区包含如seq id no.1所示的核苷酸序列,或与所述核苷酸序列具有至少60%(例如65%、70%、80%、85%、90%、95%等)同一性的序列。
7.本发明提供的mrna为编码新型冠状病毒s1亚基的受体结合域(receptor binding domain,rbd)的全长序列,和/或至少一个蛋白片段。
8.所述seq id no.1编码s1亚基的rbd,具体如下:
9.auguucguguuccuggugcugcugccucuggugucuucucagagagugcagccaaccgaaagcaucgu
gcgcuuuccaaacaucaccaaccuguguccuuucggagaaguguucaacgccaccagauucgccagcguguacgccuggaauagaaaaagaaucucuaacugcguggccgacuacagcgugcuguacaacagcgccuccuucagcaccuucaaguguuacggcguguccccuacaaagcugaacgaccugugcuucaccaauguguacgccgacagcuucgugaucagaggcgacgaggugcggcagauugcuccuggccaaacaggcaagaucgcugauuauaauuacaaacugcccgaugauuucaccggaugugucaucgccuggaacagcaacaaccuggacagcaaggugggcggcaacuacaacuaccuguacagacuguucaggaaaucuaaucugaagccuuuugagcgggacaucagcaccgagaucuaccaggcuggcagcaccccuugcaacggcguggaaggcuucaacugcuacuucccccugcagagcuacggauuucagccuacaaacggcguuggcuaucagcccuaccggguggucgugcugagcuuugagcugcuccacgccccugccacagugugcggccccaagaaguccaccaaucugguuaagaacaagugcgugaacuucugauaauag。
10.优选地,所述mrna的编码区核苷酸序列来源于野生型sars-cov-2,或突变株d614g、alpha(b.1.1.7)、beta(b.1.351、b.1.351.2、b.1.351.3)、gamma(p.1、p.1.1、p.1.2)、delta(b.1.617.2、ay.1、ay.2、ay.3)、eta(b.1.525)、iota(b.1.526)、kappa(b.1.617.1)、lambda(c.37)、a.23.1、a.23.1.2中的任意一种或至少两种的组合。
11.优选地,所述mrna的编码区的核苷酸序列经过密码子优化。
12.优选地,所述密码子优化包括gc含量、密码子偏好性、mrna二级结构、mrna不稳定序列、核糖体结合位点、抑制位点、相邻密码子关联性等优化,以提高mrna的翻译效率和蛋白折叠正确率。
13.优选地,所述mrna的编码区核苷酸序列中包含经过化学修饰的碱基。
14.优选地,所述化学修饰的碱基包括如下结构中的任意一种或至少两种的组合:
[0015][0016]
其中,r代表连接的五碳糖。
[0017]
优选地,所述化学修饰的碱基包括ψ、me1ψ、5-mou、5-moc。
[0018]
优选地,所述mrna的编码区核苷酸序列中的尿嘧啶经过化学修饰。
[0019]
优选地,所述mrna的编码区核苷酸序列中的全部尿嘧啶经过化学修饰。
[0020]
优选地,所述mrna还包含帽子结构、非翻译区或聚腺苷酸中的任意一种或至少两种的组合。
[0021]
第二方面,本发明提供一种mrna疫苗,所述mrna疫苗包括如第一方面所述的mrna以及递送载体。
[0022]
优选地,所述递送载体包括含有脂样分子和脂质分子的脂样纳米粒;所述脂样分子的结构与脂质分子的结构不同。
[0023]
优选地,所述脂样分子具有如式i、式ii、式iii或式iv中任一项所示结构:
[0024][0025]
其中,r1选自c1~c50直链或支链烷基、c2~c50直链或支链不饱和烃基、c3~c50脂环烃基、c2~c50脂杂环基、c6~c50芳香烃基或c6~c50含芳香环的脂环烃基中的任意一种。
[0026]
r2、r3各自独立地选自氢、c1~c50直链或支链烷基、c2~c50直链或支链不饱和烃基、c3~c50脂环烃基、c2~c50脂杂环基、c6~c50芳香烃基或c6~c50含芳香环的脂环烃基中的任意一种。
[0027]r4-为一价阴离子。
[0028]
n代表亚甲基的个数,选自0~10的整数,例如可以为0、1、2、3、4、5、6、7、8、9或10。
[0029]
本发明中,所述c1~c50直链或支链烷基可以为c2、c5、c10、c12、c15、c18、c20、c22、c25、c28、c30、c32、c35、c38、c40、c42、c45或c48等的直链或支链烷基。
[0030]
所述c2~c50直链或支链不饱和烃基可以为c3、c5、c10、c12、c15、c18、c20、c22、c25、c28、c30、c32、c35、c38、c40、c42、c45或c48等的直链或支链不饱和烃基,所述“不饱和烃基”意指基团中含有至少一个c=c双键或至少一个c≡c三键。
[0031]
所述c3~c50脂环烃基可以为c3、c5、c10、c12、c15、c18、c20、c22、c25、c28、c30、c32、c35、c38、c40、c42、c45或c48等的脂环烃基,所述“脂环烃基”意指非芳香性碳环基团,包括饱和脂环烃基或不饱和脂环烃基;所述饱和脂环烃基包含单环、多环(包含2个、3个或4个环的稠环)、螺环,示例性地包括但不限于:环己烷基、环庚烷基、金刚烷基等;所述“不饱和脂环烃基”意指脂环烃基团中含有至少一个c=c双键或至少一个c≡c三键,示例性地包括但不限于:环己烯基、环庚烯基等。
[0032]
所述c2~c50脂杂环基可以为c3、c5、c10、c12、c15、c18、c20、c22、c25、c28、c30、c32、c35、c38、c40、c42、c45或c48等的脂杂环基,即在脂环烃基中引入杂原子后形成的基团,所述脂环烃基的含义如前文所述,此处不再赘述。
[0033]
所述c6~c50芳香烃基可以为c6、c9、c10、c12、c15、c18、c20、c22、c25、c28、c30、c32、c35、c38、c40、c42、c45或c48等的芳香烃基,示例性地包括但不限于:苯基、萘基、联苯基、蒽基、菲基等。
[0034]
所述c6~c50(例如c6、c9、c10、c12、c15、c18、c20、c22、c25、c28、c30、c32、c35、c38、c40、c42、c45或c48等)含芳香环的脂环烃基,即在脂环烃基上引入芳香环后形成的基团,所述脂环烃基的含义如前文所述,此处不再赘述。
[0035]
本发明中,所述脂杂环基中的杂原子包括但不限于n、p、o或s。
[0036]
优选地,所述r1选自c6~c20(例如c8、c10、c12、c14、c15、c16、c17、c18、c19或c20等)直链烷基或c6~c20(例如c8、c10、c12、c14、c15、c16、c17、c18、c19或c20等)直链烯烃基中的任意一种。
[0037]
优选地,所述r2、r3各自独立地选自氢、c6~c20(例如c8、c10、c12、c14、c15、c16、c17、c18、c19或c20等)直链烷基或c6~c20(例如c8、c10、c12、c14、c15、c16、c17、c18、c19或c20等)直链烯烃基中的任意一种。
[0038]
优选地,所述r1选自如下基团中的任意一种,所述r2、r3各自独立地氢或如下基团中的任意一种:
[0039][0040]
其中,波浪线标记处代表基团的连接键。
[0041]
优选地,所述r
4-选自br-、i-、cl-、oh-或no
3-,进一步优选为i-。
[0042]
优选地,所述n为1。
[0043]
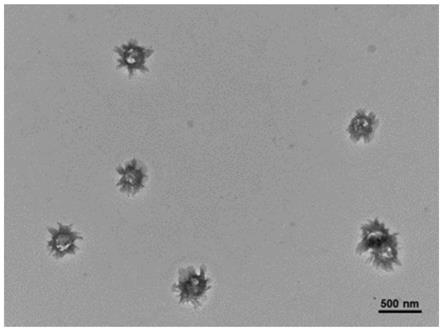
优选地,所述脂样分子具有如下结构中的任意一种:
[0044]
[0045]
[0046]
[0047]
[0048][0049][0050]
优选地,所述脂样分子包括tb-uc18。
[0051]
优选地,所述脂样分子中n原子与mrna中p原子的摩尔比(简称为氮磷比)为(0.2~
20):1,例如可以为0.3:1、0.5:1、0.6:1、0.8:1、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1或20:1等,进一步优选为(1~3):1,更进一步优选为1.5:1。
[0052]
优选地,所述脂样分子和脂质分子的摩尔比为1:(0.1~10),例如可以为0.2:1、0.3:1、0.5:1、0.6:1、0.8:1、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1或10:1等,进一步优选为1:1。
[0053]
优选地,所述脂质分子包括非阳离子脂质。
[0054]
优选地,所述非阳离子脂质包括1,2-二芥酰-sn-甘油-3-磷酸胆碱(depc)、1,2-二肉豆蔻酰-sn-甘油-3-磷酸胆碱(dmpc)、1,2-二油酰-sn-甘油-3-磷酸胆碱(dopc)、1,2-二棕榈酰-sn-甘油-3-磷酰胆碱(dppc)、1,2-二硬脂酰-sn-甘油-3-磷酰胆碱(dspc)、氢化大豆磷脂酰胆碱(hspc)、1-棕榈酰-2-油酰基卵磷脂(popc)、1-硬脂酰-2-油酰磷脂酰胆碱(sopc)、1,2-肉豆蔻-sn-甘油-3-磷酰乙醇胺(dmpe)、1,2-二油烯-sn-甘油-3-磷酰乙醇胺(dope)、1,2-二棕榈酰-sn-甘油-3-磷酰乙醇胺(dppe)、二硬脂酰磷脂酰乙醇胺(dspe)、1-棕榈酰-2-油酰磷脂酰乙醇胺(pope)、1-硬脂酰-2-油酰-磷脂酰乙醇胺(sope)、1,2-二肉豆蔻酰-sn-甘油-3-磷酸甘油(dmpg)、二油酰磷脂酰甘油(dopg)、1,2-棕榈酰磷脂酰甘油(dppg)、1,2-二硬脂酰-sn-甘油-3-磷酸甘油(dspg)、1-棕榈酰-2-油酰-sn-甘油-3-磷酸甘油(popg)、胆固醇(chol)、3β-[n-(n',n'-二甲基胺乙基)胺基甲酰基]胆固醇(dc-chol)、鞘磷脂、神经酰胺、脑磷脂、脑苷脂或二酰基甘油中的任意一种或至少两种的组合,进一步优选为1,2-二油烯-sn-甘油-3-磷酰乙醇胺(dope)和/或1-棕榈酰-2-油酰磷脂酰乙醇胺(pope)。
[0055]
优选地,所述mrna疫苗的水合粒径为200~350nm,例如可以为210nm、230nm、250nm、270nm、290nm、300nm、310nm、330nm或340nm,以及上述点值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
[0056]
优选地,所述mrna疫苗的给药方式包括肌肉注射、皮内注射、静脉注射或动脉注射,进一步优选为肌肉注射或静脉注射。
[0057]
本发明提供的mrna疫苗具有如下优势:递送载体仅有双组份,制剂组分简单,热稳定性好,摄取效率高,可高效翻译出目的蛋白,肌肉给药后可在给药部位检测到高水平蛋白表达,免疫小鼠后可产生特异性的体液免疫和细胞免疫,且无明显的体内毒性和补体激活效应。
[0058]
第三方面,本发明提供一种如第二方面所述的mrna疫苗的制备方法,所述制备方法包括:将mrna溶液与递送载体混合,得到所述mrna疫苗。
[0059]
优选地,所述mrna溶液的溶剂为缓冲溶液(水性溶剂),对应得到的mrna溶液为水相。
[0060]
优选地,所述缓冲溶液的ph值为3~8,例如可以为3.2、3.5、3.8、4、4.2、4.5、4.8、5、5.5、5.5、5.8、6、6.2、6.5、6.8、7、7.2、7.5或7.8,以及上述点值之间的具体点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
[0061]
优选地,所述mrna溶液中mrna的浓度为5~500ng/μl,例如可以为8ng/μl、10ng/μl、15ng/μl、20ng/μl、25ng/μl、30ng/μl、40ng/μl、50ng/μl、100ng/μl、150ng/μl、200ng/μl、250ng/μl、300ng/μl、350ng/μl、400ng/μl或450ng/μl,以及上述点值之间的具体点值,限于
篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
[0062]
优选地,所述制备方法具体包括:将脂样分子、脂质分子与有机溶剂混合,得到包含递送载体的有机相;所述有机相与mrna溶液混合,得到所述mrna疫苗。
[0063]
优选地,所述有机溶剂为与水互溶的有机溶剂,进一步优选为醇类溶剂。
[0064]
优选地,所述有机溶剂包括甲醇和/或乙醇。
[0065]
优选地,所述有机相与mrna溶液的体积比为1:(0.05~20),例如可以为1:0.1、1:0.3、1:0.5、1:0.7、1:0.9、1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:11、1:13、1:15、1:17或1:19等,进一步优选为1:9。
[0066]
第四方面,本发明提供一种药物组合物,所述药物组合物包括如第一方面所述的mrna或如第二方面所述的mrna疫苗。
[0067]
相对于现有技术,本发明具有以下有益效果:
[0068]
本发明提供的mrna可编码sars-cov-2rbd;包含所述mrna的mrna疫苗的制剂组分简单,热稳定性好,摄取效率高,肌肉给药后可在给药部位检测到高水平蛋白表达,免疫小鼠后可产生特异性的体液免疫和细胞免疫,且无明显的体内毒性和补体激活效应,具有优异的安全性,为sars-cov-2治疗提供了新的思路。
附图说明
[0069]
图1为所述mrna疫苗的水合粒径测试结果图;
[0070]
图2为所述mrna疫苗的电位测试结果图;
[0071]
图3为所述mrna疫苗的透射电镜图;
[0072]
图4为所述mrna疫苗的溶血实验测试结果图;
[0073]
图5为所述mrna疫苗在细胞中介导的rbd蛋白表达水平测试结果图;
[0074]
图6为所述mrna疫苗中的递送载体给药后的小鼠肌肉给药部位的生物发光图;
[0075]
图7为所述mrna疫苗在体内介导体液免疫产生的抗原特异性结合抗体的表达水平测试结果图;
[0076]
图8为所述mrna疫苗在体内介导体液免疫产生的中和抗体表达水平测试结果图;
[0077]
图9a为所述mrna疫苗在体内介导细胞免疫产生的细胞因子ifn-γ表达水平测试结果图;
[0078]
图9b为所述mrna疫苗在体内介导细胞免疫产生的细胞因子il-2表达水平测试结果图;
[0079]
图9c为所述mrna疫苗在体内介导细胞免疫产生的细胞因子il-4表达水平测试结果图;
[0080]
图9d为所述mrna疫苗在体内介导细胞免疫产生的细胞因子il-10表达水平测试结果图;
[0081]
图10为所述mrna疫苗免疫balb/c小鼠过程中的小鼠体重测试图;
[0082]
图11a为所述mrna疫苗免疫balb/c小鼠第1天的给药部位成像图;
[0083]
图11b为所述mrna疫苗免疫balb/c小鼠第28天的给药部位成像图;
[0084]
图12a为所述mrna疫苗对人血清c3a补体含量的影响测试结果图;
[0085]
图12b为所述mrna疫苗对人血清c5a补体含量的影响测试结果图。
具体实施方式
[0086]
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
[0087]
实施例1
[0088]
一种编码sars-cov-2抗原的mrna,其编码区的序列为seq id no.1所示的核苷酸序列;所述mrna的制备方法如下:以野生型sars-cov-2新型冠状病毒基因组序列(genbank:mn908947.3)为基础,对rbd序列进行密码子优化,随后体外合成sars-cov-2新型冠状病毒rbd抗原mrna。
[0089]
实施例2
[0090]
一种mrna疫苗,包括实施例1提供的mrna以及递送载体;所述递送载体为含有脂样分子tb-uc18和脂质分子(1,2-二油烯基-sn-甘油-3-磷酰乙醇胺,dope)的脂样纳米粒;tb-uc18中n原子与mrna中p原子的摩尔比(即氮磷比)为1.5:1,tb-uc18与dope的摩尔比为1:1。
[0091]
所述mrna疫苗的制备方法包括如下步骤:
[0092]
(1)将实施例1提供的mrna溶解至ph值为7.4的pbs缓冲溶液中,得到浓度为22ng/μl的mrna溶液;
[0093]
(2)将脂样分子tb-uc18和脂质分子dope以摩尔比1:1溶解于乙醇中,得到tb-uc18浓度为0.6mg/ml、dope浓度为0.49mg/ml的有机相;
[0094]
(3)将步骤(2)得到的有机相与步骤(1)得到的mrna溶液以体积比1:9混合均匀,使tb-uc18与mrna的氮磷比为1.5:1,tb-uc18与dope的摩尔比为1:1,得到所述mrna疫苗,以下称为pftcmvac;在用于动物实验时,将制备所述mrna疫苗的各组分浓度提高2.5倍(氮磷比、tb-uc18与dope的摩尔比均保持不变)。
[0095]
对所述mrna疫苗以及其中的递送载体进行表征,具体如下:
[0096]
一、粒径和电位
[0097]
通过纳米粒度电位仪(美国布鲁克海文仪器公司)测定所述mrna疫苗的粒径和电位图,得到的水合粒径测试结果图如图1所示,电位测试结果图如图2所示,结果显示,所述mrna疫苗的水合粒径为200~300nm,分散度为0.14,电位为负40毫伏左右。
[0098]
二、形貌特征
[0099]
取2.5μl所述mrna疫苗置于铜网上,过夜自然干燥后通过透射电子显微镜(日立ht7700)观察到mrna疫苗的形貌特征,得到的透射电镜图如图3所示,结果显示所述mrna疫苗制剂呈现纳米花状,其粒径和水合粒径基本一致,为200~300nm。
[0100]
三、生物相容性及内体逃逸能力测试
[0101]
取100μl不同浓度(浓度分别为0、15μm、30μm、60μm、120μm)的所述mrna疫苗与100μl体积分数为4%、ph值分别为5.4、6.5和7.4的红细胞溶液混合,在96孔透明平底板37℃孵育1h,将平板以1000
×
g离心5min,取70μl上清液转移到透明的96孔板中,在酶标仪上读取540nm处的吸光值。阳性对照(1%曲拉通x-100)的吸光值设定为100%溶血率;实验组溶血率(%)=实验组的吸光值/阳性对照的吸光值,得到的溶血测试结果图如图4所示;结果显示,在ph值为7.4时,不同浓度的所述mrna疫苗均显示良好的生物相容性;在ph值为5.4和6.5时,所述mrna疫苗的溶血率呈现剂量依赖性,表明mrna疫苗具有一定的内体逃逸功能。
[0102]
四、在细胞水平检测mrna疫苗制剂介导的rbd蛋白表达水平
[0103]
取10μl的所述mrna疫苗加入90μl隔夜贴壁的293t细胞(20000细胞/孔)中;293t细胞在培养箱中培养24h后,离心后上清液-20℃冻存备用;细胞沉淀加100μl pbs缓冲溶液重悬后冻融2次并超声10min后离心取上清液,利用rbd elisa检测试剂盒检测两者rbd蛋白的表达水平,得到的结果如图5所示,细胞上清液rbd蛋白浓度约为195ng/ml,细胞裂解液中rbd蛋白浓度约为21ng/ml,表明所述mrna疫苗能够在细胞中介导高水平的rbd蛋白表达。
[0104]
五、mrna疫苗中递送载体的体内递送效率
[0105]
以c57bl/6j小鼠为实验对象,通过肌肉给药的方式向小鼠体内注入负载萤火虫荧光素酶mrna的递送系统(即将实施例2中编码sars-cov-2抗原的mrna替换为萤火虫荧光素酶mrna,其他参数均相同),按mrna量为0.5mg/kg进行肌肉给药;给药4h后,按150mg/kg剂量腹腔给荧光酶底物,10min后通过珀金埃尔默小动物成像仪对进行小鼠进行整体成像,观察肌肉给药部位mrna表达为蛋白的水平,得到的生物发光图结果如图6所示,小鼠肌肉给药部位呈现明显的萤火虫荧光素酶发出的生物发光信号,表明所述mrna疫苗中的递送载体具有较高的体内递送效率,可高效翻译出目的蛋白。
[0106]
六、评估mrna疫苗制剂介导的细胞免疫和体液免疫
[0107]
(1)以balb/c小鼠为实验对象,将其随机分成2组(实验组和未处理组),每组5只;实验组每只小鼠分别在第1天进行第一次肌肉给药,在第14天进行第二次肌肉给药,每次给药的剂量为100μl所述mrna疫苗制剂(含30mg的mrna)。
[0108]
(2)距第一次给药后第28天收集小鼠血液,分离血清梯度稀释,通过elisa试剂盒(南京诺唯赞生物科技股份有限公司提供)法检测小鼠体内所产生的总igg及其亚型igg1和igg2a抗体,得到的表达水平测试结果如图7所示,所述mrna疫苗(pftcmvac)能够有效诱导小鼠的细胞免疫,产生高水平的抗原特异性结合抗体,滴度分别达到134000、23800、13100。
[0109]
(3)取所述mrna疫苗制剂免疫小鼠部分血清,56℃加热灭活30min,利用病毒替代试剂盒(南京金斯瑞生物科技有限公司提供)检测小鼠血清抗体的中和活性,得到的中和抗体表达水平测试结果如图8所示,结果表明,小鼠血清抗体中和活性呈现血清浓度依赖性。
[0110]
(4)在距第一次给药后第28天收集小鼠脾脏,在无菌条件下制备成单细胞悬液,按1000000脾细胞/孔铺板于96孔板中,加入终浓度为10mg/ml的重组rbd蛋白(北京索莱宝科技有限公司提供)培养48h,离心去上清;通过elisa试剂盒(深圳达科为生物技术股份有限公司)测定细胞因子ifn-γ、il-2、il-4、il-10的表达水平,得到的细胞因子表达水平测试结果分别如图9a、图9b、图9c、图9d所示,所述mrna疫苗(pftcmvac)制剂免疫小鼠脾脏经过相关抗原重刺激后ifn-γ浓度为241pg/ml,il-2浓度为197pg/ml,il-4浓度为51pg/ml,il-10未在检测限范围内,其中il-2和对照组有显著性差异。
[0111]
七、评估mrna疫苗制剂的安全性
[0112]
(1)每周对上述实验中的balb/c小鼠体重进行2次称量,监测体重变化,得到的小鼠体重测试图如图10所示;另外,在小鼠第一次肌肉给药后的第1天和第28天对小鼠给药部位进行拍照,监测局部过敏反应,得到的给药部位成像图分别如图11a和图11b所示;结合图10、图11a和图11b可知,与pbs对照组相比,所述mrna疫苗(pftcmvac)制剂组的小鼠体重无减轻,且给药部位未发生明显的过敏反应,表明本发明提供的mrna疫苗制剂无明显的急性反应。
[0113]
(2)取不同浓度的所述mrna疫苗制剂(使mrna浓度当量分别为4μg/ml,8μg/ml,16μ
g/ml,32μg/ml,64μg/ml)加入正常人血清,在37℃孵育1h后,通过elisa试剂盒(武汉伊莱瑞特生物科技股份有限公司提供)测定血清中c3a和c5a补体的含量,得到的测试结果如图12a和图12b所示,相较于pbs对照组,不同剂量的mrna疫苗制剂均未增加血清c3a和c5a补体含量,说明本发明提供的mrna疫苗中不含聚乙二醇化脂质分子,避免了因使用聚乙二醇化脂质分子而引起潜在的补体反应,具有优异的安全性。
[0114]
综上所述,本发明提供的mrna编码rbd,包含所述mrna的mrna疫苗的制剂组分简单,热稳定性好,摄取效率高,肌肉给药后可在给药部位检测到高水平蛋白表达,免疫小鼠后可产生特异性的体液免疫和细胞免疫,且无明显的体内毒性、过敏反应和补体激活效应,具有优异的安全性。
[0115]
申请人声明,本发明通过上述实施例来说明本发明的一种编码sars-cov-2抗原的mrna及mrna疫苗,但本发明并不局限于上述工艺步骤,即不意味着本发明必须依赖上述工艺步骤才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
