1.本发明涉及慢病毒体外转染人造血干细胞培养技术领域,特别是涉及一种慢病毒体外转染人造血干细胞的试剂和试剂盒。
背景技术:
2.现有的慢病毒体外转染人造血干细胞普遍存在效率低的问题,虽然有研究显示,向培养基中添加各种预激活因子可以提高效率;但是,使用高浓度的预激活因子不仅大大的增加了生产成本,而且效果也不尽如意。
3.因此,如何提高慢病毒体外转染人造血干细胞转染效率是业界的研究重点和难点。
技术实现要素:
4.本发明的目的是提供一种新的慢病毒体外转染人造血干细胞的试剂和试剂盒。本发明的具体技术方案如下:
5.本发明公开了一种慢病毒体外转染人造血干细胞的试剂,由细胞体外预激活培养基和慢病毒感染培养基组成;所述细胞体外预激活培养基为dmem培养基,其中添加有50ng/ml的scf、60ng/ml的flt3l、5ng/ml的tpo、10ng/ml的il3、5ng/ml的il15和5ng/ml的il21;所述慢病毒感染培养基为dmem培养基,其中添加有6μmol/l的dmpge2和40μg/ml的ploxamer407。
6.本发明在dmem培养基中添加特定组分和浓度的添加剂,即细胞体外预激活培养基中添加50ng/ml的scf、60ng/ml的flt3l、5ng/ml的tpo、10ng/ml的il3、5ng/ml的il15和5ng/ml的il21;慢病毒感染培养基中添加6μmol/l的dmpge2和40μg/ml的ploxamer407;不仅能够提高转染效率,而且采用相对较低浓度的添加剂,也减低了生产成本。
7.优选的,所述慢病毒感染培养基中还添加有维生素b3。
8.本发明还公开了一种慢病毒体外转染人造血干细胞的试剂盒,包括本发明的试剂;或者,独立包装的dmem培养基和scf、flt3l、tpo、il3、il15、il21、dmpge2和ploxamer407。
9.本发明还公开了一种慢病毒体外转染人造血干细胞的方法,包括采用本发明的试剂中的细胞体外预激活培养基对造血干细胞进行体外预激活培养处理,然后采用慢病毒感染培养基对预激活的细胞进行干细胞培养。
10.本发明的有益效果在于:
11.本发明慢病毒体外转染人造血干细胞的试剂和试剂盒,以dmem培养基为基础,添加特定组分和浓度的添加剂,不仅能够提高病毒转染效率,而且生产成本低。
具体实施方式
12.慢病毒体外转染人造血干细胞已经是比较成熟的技术,有被应用于临床;但是,存
在费用高昂的问题,例如bb305病毒的最终产品售价为180万美元,不是一般病患能够承担。
13.本发明意在通过提高转染效率,降低转染时的成本,以此降低慢病毒体外转染人造血干细胞的最终成本。可以理解,转染效率高,就能够获得更多的最终成品,相应的就能够降低最终产品的价格。
14.因此,本发明研发了一种新的细胞体外预激活培养基和慢病毒感染培养基;所述细胞体外预激活培养基为dmem培养基,其中添加有50ng/ml的scf、60ng/ml的flt3l、5ng/ml的tpo、10ng/ml的il3、5ng/ml的il15和5ng/ml的il21;所述慢病毒感染培养基为dmem培养基,其中添加有6μmol/l的dmpge2和40μg/ml的ploxamer407。
15.通过对培养基组分的优化和改进,不仅提高了转染效率,培养成本较低,能够有效的降低慢病毒体外转染人造血干细胞的成本。
16.下面通过具体实施例对本发明作进一步详细说明。以下实施例仅对本发明进行进一步说明,不应理解为对本发明的限制。
17.实施例
18.一、材料和方法
19.1.分离脐带血单核细胞
20.1)采集新生儿脐带血10ml,4℃保存;
21.2)超净工作台内,将采集的10ml脐带血转移到50ml离心管;
22.3)加入等体积dpbs,混匀稀释,室温静置15min;
23.4)在新的50ml离心管中加入15ml密度梯度分离液(lymphoprep
tm
,stemcell);
24.5)倾斜放置装有梯度分离液的50ml离心管,将步骤4)的血液样品沿离心管内壁缓慢加入;
25.6)步骤5)完成后,600g离心15min;
26.7)离心后,吸取白膜层细胞到新的50ml离心管中;
27.8)加入6倍白膜层样品体积的dpbs,上下颠倒充分混匀,400g离心8min;
28.9)离心后,弃上清,加入10ml的dpbs重悬,400g离心8min,弃上清,获得脐带血单核细胞,用于0.5ml dpbs重悬,备用。
29.2.脐带血cd34+造血干细胞制备
30.本例采用stemcell technologies试剂盒进行脐带血cd34+造血干细胞分离纯化,详细如下:
31.1)向“1.分离脐带血单核细胞”制备的脐带血单核细胞中加入终浓度100μl/ml的easysep cd34+分离试剂,混匀,室温放置15min;
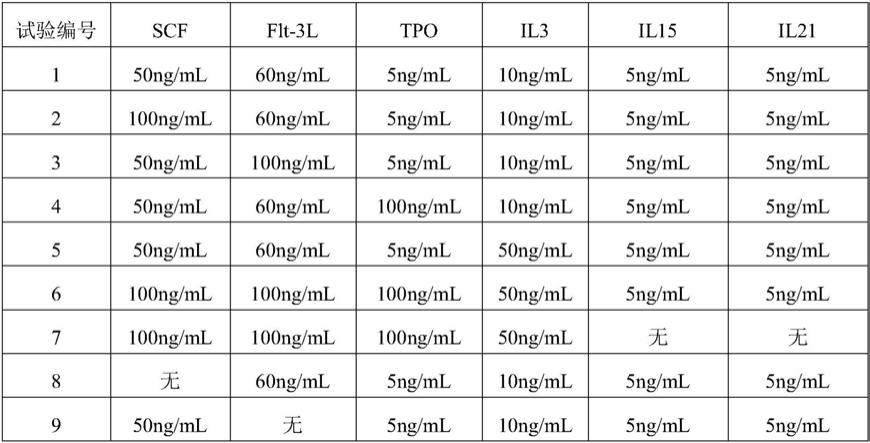
32.2)对rapidspheres进行40s振荡,使其混匀,然后,将其加入到步骤1)的产物中,混匀,室温2min;rapidspheres的终浓度为50μl/ml;
33.3)向步骤2)的产物中加入1.5ml的dpbs,混匀;
34.4)将离心管置于磁力架上,室温放置5min,然后,倒掉上清,再加入1.5ml的dpbs,混匀,磁力架放置5min,弃上清液,如此重复三次;
35.5)步骤4)弃上清液后,加入12ml的dpbs吹打混匀,将产物平均分为若干份,分别转移到10ml离心管中,400g离心8min,弃上清液,沉淀备用。
36.3.预激活培养
37.本例采用dmem培养基,向其中添加不同浓度的scf、flt3l、tpo、il3、il15、il21作为动员造血干细胞体外预激活培养处理的细胞体外预激活培养体系。具体的,各组分即用量见表1。
38.表1 dmem培养基中各组分的浓度
[0039][0040][0041]
按照表1配制了11个细胞体外预激活培养体系。
[0042]
动员造血干细胞体外预激活培养处理,详细如下:
[0043]
1)将各细胞体外预激活培养体系分别加入“2.脐带血cd34+造血干细胞制备”的细胞沉淀,重悬混匀;
[0044]
2)采用细胞计数器,统计重悬后的细胞浓度,并将所有细胞悬浮液的浓度都调整为1
×
106个/ml;
[0045]
3)在37℃,5%co2的培养箱中培养六天,每两天换液一次,培养到第六天时,进行cd34抗体免疫染色,采用流式鉴定cd34阳性率。
[0046]
其中,cd34阳性率越高,说明本试验的细胞体外预激活培养体系效果越好。
[0047]
4.构建gfp慢病毒载体
[0048]
目的表达基因为seq id no.1所示的ef1a-gfp,慢病毒骨架载体为pcdh。选择snabi和sali位点将pcdh线性化,设计gibson组装引物扩增ef1a-gfp编码区片段,gibson引物如seq id no.2所示和seq id no.3所示序列。
[0049]
具体的,取0.25pmol的ef1a-gfp gibson引物扩增产物,与0.05pmol的线性化pcdh载体混合,采用去离子水定容至10μl,再加入10μl的2
×
gibson assembly master mix混匀。50℃反应1小时,然后立即置冰上。使用stbl3感受态细胞进行热激转化,在氨苄青霉素抗性的固体lb平板上37℃培养18小时,挑单克隆测序。
[0050]
ef1a-gfp序列seq id no.1:
[0051]
3000transfection reagent(invitrogen,l3000001)转染293t细胞,培养22小时后收集细胞培养上清,使用0.45μm膜过滤,向滤液中加入全能核酸酶(benzonase),加入量为每50ml滤液加全能核酸酶(benzonase)5μl,37℃消化3h,将消化后的病毒上清液转移至超速离心管中,40000g离心1h,倒去上清,使用dmem培养基500μl重悬病毒,分装为50μl每管,-80℃保存。
[0060]
6.鉴定慢病毒滴度
[0061]
将293t细胞消化吹打为单细胞悬液,进行细胞计数后,使用dmem(10%fbs)培养基稀释成1
×
105cells/ml悬液,并加入终浓度为6μg/ml的polybrene(hexadimethrine bromide),充分混匀按照1ml每孔的量加入12孔板中。取12μl病毒液,以五倍的梯度进行稀释,获得三个梯度稀释的稀释病毒液,将稀释病毒液以每孔10μl的量加入到前述已经加入293t细胞的孔中,并且,每个样本重复两个孔。预留两个孔加入10μl dmem培养基,替换病毒稀释液,作为阴性对照。以上加样完成后,在37℃、5%co2培养箱中培养48小时。
[0062]
培养完成后,收集细胞,使用tiangen的基因组dna提取试剂盒,提取细胞的基因组dna。
[0063]
对基因组dna进行浓度测定,并将其定量稀释为50ng/μl的浓度。对作为标准品的质粒进行十倍梯度稀释,获得10
8-104拷贝/ml的标准品稀释液。
[0064]
荧光定量pcr反应体系10μl,其中包括2pmol荧光探针和引物混合物和4μl样品比例制备荧光定量反应液。
[0065]
使用steponeplus real-time pcr system探针法标准程序进行荧光定量pcr扩增。并采用标准品制备标准曲线,以此计算各样品apob和gag两个基因的拷贝数,按照gag拷贝数/apob拷贝数计算vcn,进一步的按照以下公式计算病毒滴度:
[0066]
titer(tu/ml)=(10^5(细胞数量)
×
vcn(平均每个细胞gag基因拷贝数))/(病毒液体积(ml))
[0067]
其中,荧光探针和引物混合物包括,seq id no.4所示序列的apob基因正向引物,seq id no.5所示序列的反向引物,对应的seq id no.6所示序列的探针,探针5’端具有hex荧光基团,3’端具有bhq1淬灭基团;以及seq id no.7所示序列的gag基因正向引物,seq id no.8所示序列的反向引物,对应的seq id no.9所示序列的探针,探针5’端具有fam荧光基团,3’端具有bhq1淬灭基团。
[0068]
seq id no.4:5
’‑
tgaaggtggaggacattcctcta-3’[0069]
seq id no.5:5
’‑
ctggaattgcgatttctggtaa-3’[0070]
seq id no.6:5
’‑
cgagaatcaccctgccagacttccgt-3’[0071]
seq id no.7:5
’‑
ggttgtagctgtcccagtatttgtc-3’[0072]
seq id no.8:5
’‑
ggagctagaacgattcgcagtta-3’[0073]
seq id no.9:5
’‑
acagccttctgatgtttctaacaggccagg-3’[0074]
7.慢病毒感染
[0075]
以“3.预激活培养”获得的最优的细胞体外预激活培养体系培养的造血干细胞进行试验。具体包括:
[0076]
1)收集上述最优预激活培养体系体外培养预激活的造血干细胞到10ml离心管,400g离心6min;
[0077]
2)弃上清,加入2ml的dpbs重悬,400g离心6min;
[0078]
3)再次加入上述最优预激活培养体系重悬细胞,并通过计数,将其浓度调整为1
×
106个/ml;
[0079]
4)将病毒滴度为7
×
108tu/ml的携带gpf的慢病毒7μl加到100μl的细胞重悬液中,混匀;
[0080]
5)按照表2加入不同的添加剂,混匀,将细胞转移接种到96孔板中,37℃,5%co2培养箱中感染22h。
[0081]
表2按照dmem培养基中的浓度添加的促感染辅剂
[0082]
试验编号dmpge2ploxamer407维生素b3protamineum17116μmol/l40μg/ml无无无26μmol/l40μg/ml10μg/ml无无36μmol/l无无无无4无40μg/ml无无无56μmol/l40μg/ml无10μg/ml40nmol/l
[0083]
6)感染22h后,吹打培养基,使细胞重悬,然后转移到含有2ml dpbs的15ml离心管中;
[0084]
7)400g离心6min,弃上清,加入2ml的dpbs重悬细胞,400g离心6min,弃上清,加入1ml细胞体外预激活培养基重悬;
[0085]
8)继续体外培养六天,每两天换一次培养基,培养第六天后,收集细胞到一个新的15ml离心管中;
[0086]
11)400g离心6min,弃上清,加入4ml的dpbs重悬细胞,将其平均分到两管新15ml离心管中,即每管2ml,400g离心6min;
[0087]
12)弃上清,两管细胞一个进行流式鉴定细胞gfp蛋白表达情况,一个进行pcr扩增鉴定细胞病毒插入拷贝数(vcn);
[0088]
a)流式细胞术
[0089]
采用40μm滤网过滤后,采用流式细胞仪鉴定表达gfp蛋白阳性细胞情况;
[0090]
b)pcr扩增
[0091]
采用tiangen试剂盒提取细胞基因组dna,并将dna浓度定量稀释为50ng/μl;对作为标准品的质粒进行十倍梯度稀释,获得10
8-104拷贝/ml的标准品稀释液;荧光定量pcr反应体系10μl,其中包括2pmol荧光探针和引物混合物和4μl样品比例制备荧光定量反应液;按照前述条件进行荧光定量pcr反应,并计算各个样品apob和gag基因的拷贝数,并根据gag拷贝数/apob拷贝数计算vcn。
[0092]
二、结果及分析
[0093]
1.细胞体外预激活培养体系筛选结果
[0094]
11个细胞体外预激活培养体系的流式分析结果显示,表1试验1的cd34阳性率最高,为93.15%;表1试验2至试验6的阳性率差不多,均在91.83%至92.12%之间;表1试验7的阳性率最差,为90.26%;表1试验8至11的阳性率结果接近,均在91.43%至91.79%之间。
[0095]
由此可见,试验1的效果最佳,因此选择dmem培养基中添加50ng/ml的scf、60ng/ml的flt3l、5ng/ml的tpo、10ng/ml的il3、5ng/ml的il15和5ng/ml的il21作为本试验的细胞体
外预激活培养基,即最优细胞体外预激活培养体系。
[0096]
2.慢病毒感染培养基筛选试验结果
[0097]
试验结果显示,表2试验1,6μmol/l的dmpge2和40μg/ml的ploxamer407两者组合的助转染效果最好,vcn值可以达到约3.1;表2试验2和试验5与试验1的效果相当。其余试验3和4的vcn值约为1.8-2.1,对照试验的vcn值为0.6。
[0098]
感染率方面,表2试验1最终的感染率结果为34.7%,表2试验2的感染率结果约为34.9%,表2试验5的感染率为34.7%;试验3和4的感染率分别为20.6%、20.8%。
[0099]
由此可见,6μmol/l的dmpge2和40μg/ml的ploxamer407两者组合的助转染效果可以满足使用需求,另外,可以根据需求添加维生素b3。
[0100]
以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于此。对本发明技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干推演或替换。
