检测人间充质干细胞影响t细胞增殖活性试剂盒及方法
技术领域
1.本发明涉及细胞增殖检测技术领域,具体涉及检测人间充质干细胞影响t细胞增殖活性的试剂盒及方法。
背景技术:
2.人间充质干细胞(human mesenchymal stem cells,hmscs)是一类贴壁培养后呈成纤维细胞样形态(纺锤形和梭形)、可在体外自我更新并具有成骨、成脂、成软骨等分化能力的干细胞。人间充质干细胞可由多种人体组织(如骨髓、脐带、胎盘、脂肪等)分离得到,也可以通过分化或转分化等方式获得;不同来源的人间充质干细胞在基因表达和分化能力方面存在差异。mscs主要在抗炎、调节免疫等方面起着重要作用。随着对mscs的理解越来越深入,其成药性的可能也大大增加。
3.msc的质量控制涉及到细胞形态、染色体核型、细胞活率、细胞表面标志物、成瘤性、三系分化能力、免疫调节能力及微生物检测等。其中,免疫调节能力检测包括:经炎症因子(ifn-γ或者ifn-γ联合tnf-α)诱导后表达吲哚胺2,3-双加氧酶(ido);与t淋巴细胞共培养,能抑制t淋巴细胞增殖及分泌ifn-γ、tnf-α。涉及t淋巴细胞增殖检测的实验主要有cck-8方法,但由于t淋巴细胞和msc细胞数量都可以用cck8检测到,因此检测不够敏感,并结果会受msc细胞增殖等生物学因素影响。
技术实现要素:
4.本发明的目的在于提供检测人间充质干细胞影响t细胞增殖活性试剂盒及方法。本发明所述试剂盒能够更加敏感的测出msc细胞对t细胞的增殖抑制活性。
5.本发明提供了检测人间充质干细胞影响t细胞增殖活性的试剂盒,所述试剂盒包括:整合了荧光素酶基因的t淋巴细胞、荧光底物和人间充质干细胞。
6.优选的是,所述荧光素酶基因的核苷酸序列如seq id no.1所示。
7.优选的是,所述试剂盒还包括整合了荧光素酶基因的t淋巴细胞的培养基和人间充质干细胞培养基。
8.优选的是,所述试剂盒还包括酶标板。
9.本发明还提供了一种检测人间充质干细胞抑制t细胞增殖能力的方法,包括以下步骤:
10.制备携带荧光素酶基因的慢病毒,将所述携带荧光素酶基因的慢病毒感染t淋巴细胞,得到整合了荧光素酶基因的t淋巴细胞;
11.将整合了荧光素酶基因的t淋巴细胞与人间充质干细胞共培养,加入荧光底物,测定荧光值,计算人间充质干细胞对t淋巴细胞的抑制率。
12.优选的是,所述慢病毒包括携带荧光素酶基因的lenti-ef1a-luciferase-puro慢病毒载体。
13.优选的是,所述慢病毒中还含有pgk启动子和嘌呤霉素抗性基因。
14.优选的是,所述整合了荧光素酶基因的t淋巴细胞与人间充质干细胞共培养的数量比为(1~10):1。
15.优选的是,所述共培养包括:培养人间充质干细胞贴壁并增殖至55~65%,加入整合了荧光素酶基因的t淋巴细胞共培养96h。
16.优选的是,按照以下公式计算人间充质干细胞对t淋巴细胞的抑制率:抑制率=[(c-a)-(d-b)]/(c-a)
×
100%;其中,a为整合了荧光素酶基因的t淋巴细胞的培养基组的荧光值平均值,b为人间充质干细胞组的荧光值平均值,c为整合了荧光素酶基因的t淋巴细胞组的荧光值平均值,d为整合了荧光素酶基因的t淋巴细胞与人间充质干细胞共培养组的荧光值平均值。
[0017]
本发明提供了检测人间充质干细胞影响t细胞增殖活性试剂盒。本发明所述试剂盒采用慢病毒表达系统用luciferase标记t细胞,将标记过luciferase的t细胞与msc体外共培养后,可通过酶标仪测定细胞荧光素酶发光值测定被标记t细胞的活细胞数量,从而计算msc对t细胞的抑制率。本发明所述试剂盒在检测时只检测活的t淋巴细胞,因此能够更加敏感的测出msc细胞对t细胞的增殖抑制活性。
附图说明
[0018]
图1为本发明实施例1提供的lenti-ef1a-luciferase-puro慢病毒载体结构图;
[0019]
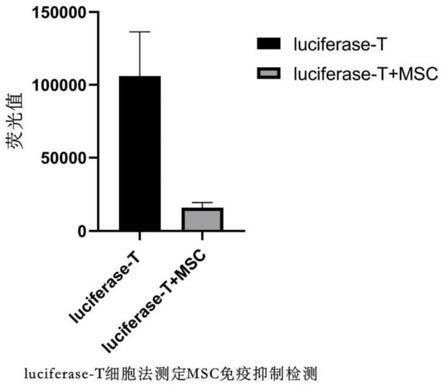
图2为本发明实施例2提供的msc对t细胞抑制率结果图;
[0020]
图3为本发明实施例3提供的msc对t细胞抑制率结果图;
[0021]
图4为本发明实施例3提供的cck8法测定msc对t细胞抑制率结果图;
[0022]
图5为本发明提供的制备和检测的流程图。
具体实施方式
[0023]
本发明提供了检测人间充质干细胞(msc)影响t细胞增殖活性的试剂盒,所述试剂盒包括:整合了荧光素酶基因的t淋巴细胞、荧光底物和人间充质干细胞。间充质干细胞的基础研究及药物开发中,需要检测msc对t细胞(免疫细胞)的抑制能力。目前常规检测方法是应用健康献血员的外周血单个核细胞作为靶细胞进行测试,存在不够灵敏和稳定差的限制性问题,针对此问题,本发明利用慢病毒表达系统将luciferase标记t细胞(含有puro筛选基因),通过筛选扩增获得工程性luciferase-t细胞(luci-t),并应用于t细胞增殖活性检测。本发明利用荧光素酶报告活性检测luciferase-t活细胞数量,因此检测更加灵敏准确,同时luci-t能够成批次制备并质检,保证检测结果的稳定性。在本发明中,所述荧光素酶基因的核苷酸序列如seq id no.1所示:gaattcgccaccatggaagacgccaaaaacataaagaaaggcccggcgccattctatccgctggaagatggaaccgctggagagcaactgcataaggctatgaagagatacgccctggttcctggaacaattgcttttacagatgcacatatcgaggtggacatcacttacgctgagtacttcgaaatgtccgttcggttggcagaagctatgaaacgatatgggctgaatacaaatcacagaatcgtcgtatgcagtgaaaactctcttcaattctttatgccggtgttgggcgcgttatttatcggagttgcagttgcgcccgcgaacgacatttataatgaacgtgaattgctcaacagtatgggcatttcgcagcctaccgtggtgttcgtttccaaaaaggggttgcaaaaaattttgaacgtgcaaaaaaagctcccaatcatccaaaaaattattatcatggattctaaaacggattaccagggatttcagtcgatgtacacgttcgtcacatctcatctacctcccggttttaatgaatacgattttgtgccagagtccttcga
tagggacaagacaattgcactgatcatgaactcctctggatctactggtctgcctaaaggtgtcgctctgcctcatagaactgcctgcgtgagattctcgcatgccagagatcctatttttggcaatcaaatcattccggatactgcgattttaagtgttgttccattccatcacggttttggaatgtttactacactcggatatttgatatgtggatttcgagtcgtcttaatgtatagatttgaagaagagctgtttctgaggagccttcaggattacaagattcaaagtgcgctgctggtgccaaccctattctccttcttcgccaaaagcactctgattgacaaatacgatttatctaatttacacgaaattgcttctggtggcgctcccctctctaaggaagtcggggaagcggttgccaagaggttccatctgccaggtatcaggcaaggatatgggctcactgagactacatcagctattctgattacacccgagggggatgataaaccgggcgcggtcggtaaagttgttccattttttgaagcgaaggttgtggatctggataccgggaaaacgctgggcgttaatcaaagaggcgaactgtgtgtgagaggtcctatgattatgtccggttatgtaaacaatccggaagcgaccaacgccttgattgacaaggatggatggctacattctggagacatagcttactgggacgaagacgaacacttcttcatcgttgaccgcctgaagtctctgattaagtacaaaggctatcaggtggctcccgctgaattggaatccatcttgctccaacaccccaacatcttcgacgcaggtgtcgcaggtcttcccgacgatgacgccggtgaacttcccgccgccgttgttgttttggagcacggaaagacgatgacggaaaaagagatcgtggattacgtcgccagtcaagtaacaaccgcgaaaaagttgcgcggaggagttgtgtttgtggacgaagtaccgaaaggtcttaccggaaaactcgacgcaagaaaaatcagagagatcctcataaaggccaagaagggcggaaagatcgccgtgtgataatctaga,即本发明所述荧光素酶为firefly luciferase,firefly luciferase(由554个氨基酸构成,约50kd)可将荧光素酶基因整合到预期观察的细胞染色体dna上以表达荧光素酶,培养出能稳定表达荧光素酶的细胞,当细胞分裂、转移、分化时,荧光素酶也会得到持续稳定的表达。荧光素酶在atp,氧存在的条件下,催化荧光素的氧化反应才可以发光,因此仅在活细胞内才会产生发光现象,并且发光光强度与标记细胞的数目线性相关。本发明采用慢病毒表达系统用luciferase标记t细胞,将标记过luciferase的t细胞与msc体外共培养后,可通过酶标仪测定细胞荧光素酶发光值测定被标记t细胞的活细胞数量,从而计算msc对t细胞的抑制率。
[0024]
在本发明中,所述试剂盒还包括整合了荧光素酶基因的t淋巴细胞的培养基和人间充质干细胞培养基。本发明所述t淋巴细胞的培养基和人间充质干细胞培养基优选为购自北京科霖恩生物科技有限公司的免疫细胞培养基msc培养基。此两种培养基的原材料大多购自sigma公司,纯度高、内毒素小于0.125u/ml,所培养细胞在形态和多向分化能力方面效果优于其他厂家培养基。因此,试验研究结果也更稳定。
[0025]
在本发明中,所述试剂盒优选还包括酶标板,更优选为96孔板。
[0026]
本发明还提供了一种检测人间充质干细胞抑制t细胞增殖能力的方法,包括以下步骤:
[0027]
制备携带荧光素酶基因的慢病毒,将所述携带荧光素酶基因的慢病毒感染t淋巴细胞,得到整合了荧光素酶基因的t淋巴细胞;
[0028]
将整合了荧光素酶基因的t淋巴细胞与人间充质干细胞共培养,加入荧光底物,测定荧光值,计算人间充质干细胞对t淋巴细胞的抑制率。
[0029]
本发明制备携带荧光素酶基因的慢病毒,将所述携带荧光素酶基因的慢病毒感染t淋巴细胞,得到整合了荧光素酶基因的t淋巴细胞。在本发明中,所述慢病毒优选包括携带荧光素酶基因的lenti-ef1a-luciferase-puro慢病毒载体。本发明对携带荧光素酶基因的慢病毒的构建方法没有特殊限定,采用本领域技术人员熟知的常规载体构建方法即可。在本发明中,所述慢病毒中优选还含有pgk启动子和嘌呤霉素抗性基因。本发明对所述感染的
方法没有特殊限定,采用本领域技术人员熟知的常规慢病毒感染方法即可。
[0030]
将整合了荧光素酶基因的t淋巴细胞与人间充质干细胞共培养,加入荧光底物,测定荧光值,计算人间充质干细胞对t淋巴细胞的抑制率。在本发明中,所述整合了荧光素酶基因的t淋巴细胞与人间充质干细胞共培养的数量比为(1~10):1。在本发明中,所述共培养优选包括:培养人间充质干细胞贴壁并增殖至55~65%,加入整合了荧光素酶基因的t淋巴细胞共培养96h。在本发明中,增殖至55~65%进行共培养,能够保证msc较好的状态,如果过晚,两种细胞共培养时不能保证msc的状态(会由于细胞增殖过密而状态变差);如果过早,msc还没有进入贴壁增殖较好状态。在本发明中,共培养96h进行测定,能够更好地测出差异。在本发明中,优选按照以下公式计算人间充质干细胞对t淋巴细胞的抑制率:抑制率=[(c-a)-(d-b)]/(c-a)
×
100%;其中,a为整合了荧光素酶基因的t淋巴细胞的培养基组的荧光值平均值,b为人间充质干细胞组的荧光值平均值,c为整合了荧光素酶基因的t淋巴细胞组的荧光值平均值,d为整合了荧光素酶基因的t淋巴细胞与人间充质干细胞共培养组的荧光值平均值。具体的,a中不含细胞,仅含整合了荧光素酶基因的t淋巴细胞的培养基;b中含有人间充质干细胞,以及人间充质干细胞培养基;c含整合了荧光素酶基因的t淋巴细胞,以及整合了荧光素酶基因的t淋巴细胞的培养基;d中含共培养的人间充质干细胞和整合了荧光素酶基因的t淋巴细胞,以及人间充质干细胞培养基和整合了荧光素酶基因的t淋巴细胞的培养基。本发明检测方法去除了本底,更加准确和敏感。本发明制备和检测的流程图如图5所示。
[0031]
下面结合具体实施例对本发明所述的检测人间充质干细胞影响t细胞增殖活性试剂盒及方法做进一步详细的介绍,本发明的技术方案包括但不限于以下实施例。
[0032]
实施例1
[0033]
(一)luciferase慢病毒的制备
[0034]
1.luciferase慢病毒载体的构建
[0035]
lenti-ef1a-luciferase-puro慢病毒载体结构图如图1所示。
[0036]
首先利用pcr方法获得luciferase片段,采用ecori、xbai酶切位点亚克隆至lenti-ef1a-luciferase-puro慢病毒载体中,之后将pgk启动子和嘌呤霉素抗性基因亚克隆至载体中,形成带有puro抗性的luciferase慢病毒载体。获得序列正确的luciferase菌株和质粒。
[0037]
2.luciferase质粒载体提取
[0038]
(1)菌体获得:取luciferase菌株5ul加5ml含amp的lb液体培养基,把离心管放入摇床37℃,220rpm,8h培养,取小摇菌液300ul接种于锥形瓶中300ml的lb培养基中(共接9个瓶子2.5l培养基),同时加入氨苄霉素300ul(50mg/ml)37℃、220rpm培养12h;收获lb培养过夜的细菌,在6000g,4℃条件下离心15min,加入125ml buffer p1(也可以称取适量发酵罐发酵获得菌体)重悬细菌。
[0039]
(2)质粒提取:使用qiagen大提试剂盒提取质粒。
[0040]
(3)检测dna质粒的浓度1130μg/ml、260/280:1.90、260/230:2.31。
[0041]
3.luciferase慢病毒制备
[0042]
a.质粒转染及病毒收集
[0043]
培养293t细胞,细胞培养24h融合至85%左右时用磷酸钙沉淀法将步骤2制备得到
的luciferase质粒载体转染293t细胞,制备得到含luciferase的慢病毒。
[0044]
b.病毒上清浓缩:
[0045]
含luciferase的慢病毒经0.45um滤器过滤后,得到病毒上清液,100k超滤离心管浓缩纯化,得到纯化后的luciferase慢病毒。
[0046]
luciferase慢病毒荧光值检测结果如表1,根据表1可知,luciferase慢病毒制备成功,luciferase的表达量可以用于后续实验。
[0047]
表1 luciferase慢病毒荧光值检测结果
[0048][0049]
(二)luciferase-t细胞制备
[0050]
1.外周血单个核细胞获取
[0051]
(1)外周血采集:抽取新鲜血液(肝素抗凝)或机采浓缩白细胞血(一般用枸橼酸钠或edta钠抗凝)
[0052]
(2)外周血单个核细胞分离:血液样本准备:肝素抗凝全血可直接置入50ml离心管混匀备用(可收集自体血浆用于培养),机采浓缩白细胞则需用生理盐水1~2倍稀释,混匀备用(无法收集有效的自体血浆)。
[0053]
吸取15ml淋巴细胞分离液到50ml离心管中,直接加入管底,不要触上方侧壁。将准备的血液样本,沿管壁轻轻加入已加入淋巴细胞分离液的离心管上层。设定离心机温度23度,离心力800g,加速4,减速3,离心30min。
[0054]
离心完成后,可见液体分为三层,小心收集中间白膜层细胞,即为外周血单个核细胞(pbmc)。
[0055]
2.t淋巴细胞的负分选
[0056]
采用dynabeads untouched
tm human t cell试剂盒(invitrogen catalog no.11344d)进行t细胞的负分选。使用dynamagtm-5磁体,以1
×
107个待分选单个核细胞为例,按照试剂盒的说明书,参照表2进行t淋巴细胞的负分选:
[0057]
表2负分选过程
[0058][0059]
4.t淋巴细胞的激活
[0060]
采用dynabeads
tm human t cell activator试剂盒对t细胞进行激活和扩增。
[0061]
5.t淋巴细胞的培养:每天观察细胞状态和密度,使t细胞密度保持在1
×
106/ml。发现细胞培养基变黄时,及时补充培养基,仍然保持细胞密度在1
×
106/ml。发现细胞结团时,使用移液管轻轻吹打,将大的细胞团吹散。当细胞体积超过培养瓶极限体积时,更换大培养皿或培养瓶,或者分为多个小皿培养。
[0062]
6.t细胞的病毒感染:t细胞的病毒感染:此时间定为d1.
[0063]
a.每孔补100ul完全培养液,此时细胞呈激活状态,每孔细胞为5
×
105个;
[0064]
b.留2孔做对照片t细胞,不感染病毒。其它孔根据luciferase病毒滴度(荧光值),按100ul/孔将病毒滴加到培养体系中,轻轻“十”字摇动,放于37℃,5%co2培养箱培养。
[0065]
7.luciferase-t细胞的扩增培养:
[0066]
d2.观察细胞扩增正常,则每孔半量补液。
[0067]
d3.观察细胞扩增正常,则再次每孔半量补液。
[0068]
d4.观察细胞扩增正常,每孔半量补液,加入2ug/孔嘌呤霉素。
[0069]
d5.观察细胞扩增正常,每孔半量补液。
[0070]
d6.观察细胞扩增正常,每孔半量补液。
[0071]
d7.观察细胞扩增正常,收集所有细胞,进行细胞计数和活率计数。
[0072]
8.酶标仪检测luciferase-t细胞荧光值的表达
[0073]
在d7时,可以检测luciferase-t细胞荧光值的表达情况。
[0074]
收集d7细胞,取1*105/孔luciferase-t细胞(3个复孔),酶标仪检测luciferase荧光值,荧光值大于1*104为合格luciferase-t细胞。
[0075]
9.冻存细胞
[0076]
酶标仪检测luciferase-t细胞荧光值合格细胞进入冻存程序。
[0077]
实施例2
[0078]
msc细胞抑制t细胞增殖检测试剂盒
[0079]
产品内容:
[0080]
luciferase-t细胞(细胞浓度2.5
×
105/ml,细胞总数>1
×
106)
[0081]
荧光底物(荧光素)(避光保存,100μl/孔,总体积>6ml)
[0082]
96孔白板
[0083]
培养基1(购自北京科霖恩生物科技有限公司的msc培养基;用于重悬测定msc,5ml)
[0084]
培养基2(购自北京科霖恩生物科技有限公司的免疫细胞培养基;用于重悬luciferase-t细胞,8ml)
[0085]
储存条件:
[0086]
luciferase-t细胞、msc标准品-80℃保存;
[0087]
荧光底物避光,-20℃保存。
[0088]
产品简介:
[0089]
采用慢病毒表达系统用luciferase标记t细胞,将标记过luciferase的t细胞与msc体外共培养后,可通过酶标仪测定细胞荧光素酶发光值测定被标记t细胞的活细胞数量,从而计算msc对t细胞的抑制率。
[0090]
test1操作步骤:
[0091]
d1消化msc细胞,计数,用msc培养基重悬细胞(msc细胞浓度5
×
104/ml),按5000/孔,布板96孔板(如表3中第1,3组接种),置于37℃、5%co2浓度培养。
[0092]
d3接种msc 72小时后,(表3中第3组)移除msc培养基,加入新的msc培养基和用免疫细胞培养基培养的lucifer-t细胞(细胞浓度2.5
×
105/ml)2.5
×
104/孔,共培养;(表3中第2组)接种lucifer-t细胞(细胞浓度2.5
×
105/ml)2.5
×
104/孔(含免疫细胞培养基);(表3中第0组)布板免疫细胞培养基(lucifer-t细胞培养基)100μl/孔。
[0093]
d7共培养96h加入荧光底物(100μl/孔),测定lucifer-t细胞荧光值。
[0094]
表3布板情况
[0095]
0lucifer-t培养基
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0lucifer-t培养基
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1msc5000
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1msc5000
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2lucifer-t25000
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2lucifer-t25000
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3msc+lucifer25000
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3msc+lucifer25000
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[0096]
数据分析:计算0,1,2,3组荧光值平均值a、b、c、d,msc对t细胞增殖抑制率=[(c-a)-(d-b)]/(c-a)
×
100%
[0097]
注意事项:
[0098]
本发明产品试剂为细胞产品,注意细胞储存条件,避免反复冻融;
[0099]
msc、luciferase-t细胞加样注意均一性;
[0100]
荧光底物应避光,并且测定时保证样品中无气泡;
[0101]
适用范围:
[0102]
本发明检测方法可检测msc对t细胞增殖抑制功能。
[0103]
试验结果如图2所示,test1抑制率:luciferase-t:msc 5:1,84.83%。
[0104]
实施例3
[0105]
luciferase-t细胞测定msc抑制功能
[0106]
1、在96孔板中接种msc,将培养板置于培养箱中培养;
[0107]
2、msc贴壁并增殖至60%左右时,加入luciferase-t细胞共培养96h;
[0108]
3、加入荧光底物,用酶标仪测定luciferase荧光值;
[0109]
4、分析数据,计算msc对t细胞抑制率。
[0110]
表4布板情况
[0111]
0lucifer-t培养基
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
0lucifer-t培养基
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1msc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1msc
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2lucifer-t
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
2lucifer-t
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3msc+lucifer
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3msc+lucifer
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[0112]
结果如图3所示,抑制率:
[0113]
luciferase-t:msc 1:1 86.17%
[0114]
luciferase-t:msc 5:1 83.21%
[0115]
luciferase-t:msc 10:1 84.59%
[0116]
与cck-8方法比较:
[0117]
1、在96孔板中接种msc,将培养板置于培养箱中培养;
[0118]
2、msc贴壁并增殖至60%左右时,加入t细胞共培养96h;
[0119]
3、每孔加入10ul cck8溶液;
[0120]
4、用酶标仪测定在450nm处的吸光度;
[0121]
5、分析数据,计算msc对t细胞抑制率。
[0122]
cck8法测定msc对t细胞抑制效果不稳定,因msc增殖情况不同,最终可出现负值(如图4所示)。此方法不够敏感。
[0123]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
