吡咯类bet降解剂及其应用
技术领域
1.本发明属于生物医药技术领域,具体涉及一种吡咯类bet降解剂及其应用。
背景技术:
2.近年来,肿瘤成为全球范围内导致人类死亡的主要原因之一。肿瘤普遍具有总体治愈率低且复发率高等特点,因此预防、治疗以及抑制肿瘤复发具有重要的科研价值,实现肿瘤的预防和治愈具有相当的紧迫性和挑战性。
3.bromodomains(brds)是能够特异性识别组蛋白中乙酰化赖氨酸残基的保守蛋白结构域。brds存在于不同的蛋白质中,对染色质组装和基因转录起着关键的调控作用。brds小分子抑制剂能够干扰brds结构域与乙酰化赖氨酸的特异性结合,从而阻断或部分阻断乙酰化赖氨酸在基因转录和调节染色质结构方面的作用。brds已被证明是高度可适配的靶点,而作用于brds的小分子抑制剂在疾病治疗中也有着广阔的应用前景,这进一步增进了科研工作者对brds蛋白及相关疾病的认知。
4.近年来,brds已成为流行的药物靶标,人类brds家族成员的生物学功能和疾病适应症也得到了详尽的阐述。brds蛋白与疾病的关联促进了以药物发现为目标的brds抑制剂的开发。这些小分子抑制剂主要有两方面的应用:首先,这些分子可以作为化学探针,探索brds蛋白在染色质信号通路及转录激活和沉默过程的生物学功能;其次,这些分子具有治疗各种人类疾病的潜力。brds小分子抑制剂的转化研究目前主要集中在bet家族,其家族包含brd2、brd3、brd4和brdt,研究人员正致力于开发高效和高选择性的bet抑制剂。新的bet抑制剂的出现将推进对疾病背景下转录调节知识的了解,并可能作为新的表观遗传学治疗药物来治疗许多临床疾病,如癌症、炎症性疾病、自身免疫病以及心血管疾病等。但现有小分子抑制剂结构类型较少,作为单药治疗效果不佳,临床收益差。
5.近年来,研发人员将protac技术应用到bet降解剂的开发,由于其独特的作用机制及在提高细胞活性上的巨大优势,为治疗由bet蛋白异常所致疾病提供新的思路。
技术实现要素:
6.通过研究bet蛋白的晶体结构模型、bet的构效关系及现有bet降解剂的开发策略,本发明提供了一种新型吡咯类bet降解剂及其应用,该类衍生物结构新颖,制备方法简单,所得降解剂具有良好的bet蛋白抑制活性及抗白血病细胞mv4-11增殖活性,较原靶头化合物活性提升明显,应用前景广阔。
7.为了实现上述目的,本发明采用以下技术方案:
8.通式(i)或(ii)的化合物,或其互变异构体、内消旋体、外消旋体、对映异构体、非对映异构体中一种或多种的混合物,或者其药学上可接受的盐,
[0009][0010]
a1、a2、b1、b2、c1、c2的结构及组成见下表:
[0011]
[0012][0013]
其中:
[0014]
d为未取代或取代的苯基、萘基、吡啶基或吡唑基,所述取代的苯基、萘基、吡啶基或吡唑基中取代基至少为一个,所述取代基各自独立地选自c
1-c6直链烷基或支链烷基、c
3-c6环烷基、3-8元杂环烷氧基,其中c
1-c6直链烷基或支链烷基、c
3-c6环烷基中的任意位置可以被羟基或巯基取代;
[0015]
m为1-6之间的整数;
[0016]
n为0-6之间的整数;
[0017]
r1为氢或甲基;
[0018]
cy选自3-8元杂环、3-8元环烷基、6-8元芳基或单键,所述杂环含有1-4个o、s、n杂原子,同时杂环可能与3-8元环烷基形成螺环或稠环;所述杂环、环烷基或芳基任选进一步被0-2个f、cl、br、i取代;
[0019]
x为ch2或羰基;
[0020]
y为氢、氟或氯;
[0021]
z为ch2,nh,o。
[0022]
进一步地,d选自苯基、4-吡啶基或1h-吡唑-4-基,所述的苯基、4-吡啶基或1h-吡唑-4-基任选进一步被以下基团中的一个或多个取代:氢、甲基、2-羟基丙-2-基、(四氢呋喃-3-基)氧基。
[0023]
更进一步地,通式(i)或(ii)的化合物选自以下化合物:
[0024]
[0025]
[0026]
[0027]
[0028]
[0029]
[0030]
[0031]
[0032][0033]
所述药学上可接受的盐是与盐酸、硫酸、磷酸、甲磺酸、对甲苯磺酸、柠檬酸、酒石酸、乙酸、马来酸或琥珀酸、富马酸、水杨酸、苯基乙酸或杏仁酸形成的盐。
[0034]
上述具有通式(i)所示的化合物或其混合物或其可接受的盐的制备方法,以1,3-二羰基类化合物和氨基芳基乙酮盐酸盐为起始原料,经过连续反应制备而成。
[0035]
具体步骤如下:
[0036]
(a)蛋白靶头a1关键中间体(a
1-4)的合成;
[0037][0038]
步骤1,通式氨基芳基乙酮衍生物(a
1-1)和乙酰丙酮(a
1-2)在乙醇中加热,得到化合物(a
1-3);
[0039]
步骤2,通式吡咯类衍生物(a
1-3)在三氯氧磷条件下,发生vilsmeier-haack反应得到化合物(a
1-4);
[0040]
(b)e3泛素化连接酶配体c
1-a、c
1-b关键中间体(c
1-3及c
1-4)的合成;
[0041][0042]
步骤3,通式含氟类芳基衍生物(c
1-1)与氨基类盐酸盐(c
1-2)在冰乙酸中加热,得到化合物(c
1-3);
[0043][0044]
中间体(c
1-4)是经购买的商业化产品;
[0045]
(c)通式(i)化合物的合成
[0046][0047]
步骤4,通式哌嗪类衍生物(b
1-a-1)与硝基类衍生物(b
1-a-2)经芳香亲核取代反应随后再经还原反应,得到化合物(b
1-a-3);
[0048]
步骤5,通式氨基类衍生物(b
1-a-3)和吡咯类衍生物(a
1-4)在焦亚硫酸钠存在下,经环合得到化合物(b
1-a-4);
[0049]
步骤6,通式吡咯类衍生物(b
1-a-4)在氢氧化钾的作用下水解,得到化合物(b
1-a-5);
[0050][0051]
步骤7,通式含氟类芳基衍生物(c
1-3)与氨基类衍生物(b
1-a-6),经芳香亲核取代反应,得到化合物(b
1-a-7);
[0052]
步骤8,通式boc保护的氨基衍生物(b
1-a-7)在三氟乙酸的作用下,脱除保护基得到化合物(b
1-a-8);
[0053][0054]
步骤9:通式吡咯类衍生物(b
1-a-5)与氨基衍生物(b
1-a-8)经酸胺缩合得到化合物(i);
[0055][0056]
步骤10:通式哌嗪类衍生物(b
1-b-1)与硝基类衍生物(b
1-a-2)经芳香亲核取代反应,得到化合物(b
1-b-2);
[0057]
步骤11,通式boc保护的氨基衍生物(b
1-b-2)在三氟乙酸的作用下,脱除保护基得到化合物(b
1-b-3);
[0058]
步骤12,通式氨基类衍生物(b
1-b-3)和溴代物(b
1-b-4)经亲核取代反应得到化合物(b
1-b-5);
[0059]
步骤13,通式硝基类衍生物(b
1-b-5)在铁粉/氯化铵的作用下还原,得到化合物(b
1-b-6);
[0060]
步骤14,通式氨基类衍生物(b
1-b-6)和吡咯类衍生物(a
1-4)在焦亚硫酸钠存在下,经环合得到化合物(b
1-b-7);
[0061]
步骤15,通式boc保护的氨基衍生物(b
1-b-7)在三氟乙酸的作用下,脱除保护基得到化合物(b
1-b-8);
[0062][0063]
步骤16,通式含氟类芳基衍生物(c
1-3)与氨基类衍生物(b
1-b-9),经芳香亲核取代反应,得到化合物(b
1-b-10);
[0064]
步骤17,通式boc保护的氨基衍生物(b
1-b-10)在三氟乙酸的作用下,脱除保护基得到化合物(b
1-b-11);
[0065][0066]
步骤18:通式吡咯类衍生物(b
1-b-8)与氨基衍生物(b
1-b-11)经酸胺缩合得到化合物(i);
[0067][0068]
步骤19:通式哌嗪类衍生物(b
1-b-3)与哌啶类衍生物(b
1-c-1)经亲核取代反应还原反应得到化合物(b
1-c-2);
[0069]
步骤20、步骤21:通式哌嗪类衍生物(b
1-c-2)与吡咯类衍生物(a
1-4)在焦亚硫酸钠存在下,经环合、脱除boc保护得到化合物再与化合物(c
1-3)经芳香亲核取代反应得到化合物(i);
[0070][0071]
步骤22、步骤23:通式含氟类芳基衍生物(c
1-3)与羟基类衍生物(b
1-d-1),经芳香亲核取代反应,脱除boc保护,得到化合物(b
1-d-3);
[0072]
步骤24:具体合成方法与步骤18一致;
[0073][0074][0075]
步骤26:通式哌嗪类衍生物(b
1-b-3)与溴代物(b
1-e-3)经亲核取代反应还原反应
得到化合物(b
1-e-4);
[0076]
步骤27、步骤28、步骤29:通式哌嗪类衍生物(b
1-e-4)经还原反应、与吡咯类衍生物(a
1-4)在焦亚硫酸钠存在下,经环合得到化合物(b
1-e-3),随后与b
1-e-2经click反应得到化合物(i);
[0077]
步骤34、步骤35、步骤36:具体合成方法与步骤19~21一致;
[0078][0079][0080]
步骤30、步骤31、步骤32、步骤33:具体合成方法与步骤4~6及步骤9一致。
[0081]
上述具有通式(ii)所示的化合物或其混合物或其可接受的盐的制备方法,是以1,3-二羰基类化合物和氨基芳基乙酮盐酸盐为起始原料,经过连续反应制备而成,具体步骤如下:
[0082]
(a)蛋白靶头a2关键中间体(a
2-7)的合成;
[0083][0084]
步骤34~38:具体合成方法与步骤1、2、4、5及6一致;
[0085]
(c)通式(ii)化合物的合成
[0086][0087]
步骤39:具体合成方法与步骤24一致;
[0088][0089]
步骤40:具体合成方法与步骤33一致。
[0090]
一种药物组合物,活性组分为通式(i)或(ii)的化合物,或者其互变异构体、内消旋体、外消旋体、对映异构体、非对映异构体中一种或多种混合物,或者其药学上可接受的盐。
[0091]
上述药物组合物在制备预防或治疗与brd蛋白相关临床病症的产品中应用。
[0092]
进一步地,所述与brd蛋白相关临床病症为类风湿关节炎、痛风关节炎黑色素瘤、肝癌、肾癌、急性白血病、多发性骨髓瘤,淋巴癌、非小细胞肺癌、前列腺癌、甲状腺癌、皮肤癌、结肠直肠癌、胰腺癌、卵巢癌、乳腺癌、骨髓增生异常综合症、食管癌、胃肠道癌或间皮瘤。
[0093]
与现有技术相比,本发明采用protac技术,提供了一类全新母核结构的bet蛋白降解剂,包括蛋白靶头a、连接子b、e3泛素化连接酶配体c。该类bet蛋白降解剂具有良好蛋白
抑制活性,与原蛋白靶头活性相当;在western blot实验中代表性化合物i-1能显著的降解brd4蛋白,在抗肿瘤细胞增殖实验中表现出较原蛋白靶头化合物更优异的细胞抑制活性,甚至达到亚纳摩尔水平(最高可达570倍),即该类化合物是通过与抑制剂完全不同的作用模式(即通过降解brd4蛋白)而发挥的抗肿瘤细胞增殖的作用。
[0094]
该类化合物以1,3-二羰基类化合物和氨基芳基乙酮盐酸盐衍生物为起始原料,经过连续反应获得如通式(ⅰ)及(ii)所示的吡咯衍生物,其制备方法路线较短,原料廉价易得,并且该制备方法具有普适性。同时,该类化合物具有优异的体外蛋白抑制活性及抗白血病细胞增殖活性,表明该类化合物是通过降解剂的机制降解异常致病bet蛋白进而发挥抗肿瘤细胞增殖活性。因此,可将该类衍生物开发为一类结构母核新颖的bet降解剂,以预防和治疗与该蛋白通路相关的疾病。
附图说明
[0095]
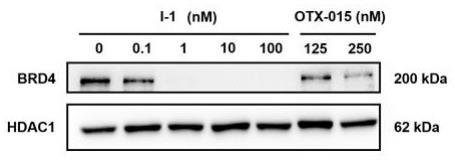
图1为化合物i-1的western blot实验结果。
具体实施方式
[0096]
在本发明中,化合物的结构是通过核磁共振(nmr)或/和质谱(ms)来确定的。nmr位移(δ)以10-6
(ppm)的单位给出。nmr的测定是用bruker avance-300或者bruker avance-400核磁仪,测定溶剂为氘代二甲基亚砜(dmso-d6)、氘代氯仿(cdc13)、氘代甲醇(cd3od),内标为四甲基硅烷(tms)。ms的测定用finnigan lcqad(esi)质谱仪(生产商:thermo,型号:finnigan lcq advantage max)。
[0097]
水溶性较大化合物制备采用是biotage快速纯化制备液相色谱flash isolera one,使用柱子采用的是常州三泰公司键合相系列快速分离柱(sw-5222-040-sp)。
[0098]
薄层层析硅胶板使用烟台黄海hsgf254或青岛gf254硅胶板,薄层色谱法(tlc)使用的娃胶板采用的规格是0.15mm~0.2mm,薄层层析分离纯化产品采用的规格是0.4mm~0.5mm柱层析一般使用烟台黄海硅胶200~300目硅胶为载体。
[0099]
本发明的已知的起始原料可以采用或按照本领域已知的方法来合成,或可购买自abcr gmbh&co.kg,acros organics,aldrich chemical company,韶远化学科技(accela chembio inc)、上海毕得医药科技有限公司、安耐吉化学、达瑞化学品等公司。
[0100]
实施例中无特殊说明,反应能够均在氩气氛或氮气氛下进行。
[0101]
氩气氛或氮气氛是指反应瓶连接一个约1l容积的氩气或氮气气球。
[0102]
氢气氛是指反应瓶连接一个约1l容积的氢气气球。
[0103]
氢化反应通常抽真空,充入氢气,反复操作3次。
[0104]
实施例中无特殊说明,溶液是指水溶液。
[0105]
实施例中无特殊说明,反应的温度为室温,为20℃~30℃。
[0106]
实施例中的反应进程的监测采用薄层色谱法(tlc),反应所使用的展开剂,纯化化合物采用的柱层析的洗脱剂的体系、薄层色谱法的展开剂体系以及快速纯化制备液相
18
c键合相分离柱体系包括:a:二氯甲烷/甲醇体系,b:正己烷/乙酸乙酯体系,c:石油醚/乙酸乙酯体系,d:乙酸乙酯/二氯甲烷体系,e:乙酸乙酯/二氯甲烷/正己烷,f:甲醇/水体系,g:甲醇/水/甲胺水溶液体系,h:乙腈/水体系,溶剂的体积比根据化合物的极性不同而进行调
节,也可以加入少量的三乙胺和醋酸等碱性或酸性试剂进行调节。
[0107]
实施例1
[0108]
2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)-n-(3-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氨基)丙基)乙酰胺(i-1)
[0109][0110]
步骤1,中间体3
[0111]
室温下,将2-氨基-1-苯基乙-1-酮1.0g、乙酸钠3.64g及乙酰丙酮0.87g溶于10ml体积分数50%乙醇水溶液中。加毕,升温至85℃,n2保护下反应3h。反应结束后,将反应液冷却至室温,向反应液中加入100ml水,水相用乙酸乙酯(100ml
×
3)萃取,合并有机相,水洗,无水硫酸钠干燥,抽滤,蒸干,粗品经柱层析纯化,得到淡黄色固体1.04g,收率为70.6%。esi-ms m/z:200.3[m+h]
+
。
[0112]
步骤2,中间体4
[0113]
冰浴条件下,将中间体3 0.70g溶于n,n-二甲基甲酰胺5ml中,控温(-5)℃-0℃,缓慢滴加三氯氧磷1.08g。滴毕,室温反应2h。反应结束后,冰浴条件下,控温(-5)℃-0℃,缓慢滴加5m乙酸钾水溶液3.5ml。滴毕,升温至105℃反应3h。反应结束后,将反应液冷却至室温,向反应液中加入20ml水,水相用乙酸乙酯(20ml
×
3)萃取,合并有机相,水洗,无水硫酸钠干燥,抽滤,蒸干,粗品经柱层析纯化,得到淡黄色固体0.57g,收率为71.6%。esi-ms m/z:
228.3[m+h]
+
。
[0114]
步骤3,中间体7
[0115]
室温下,将中间体5 1g、碳酸钾1.6g及中间体6 0.91g溶于n,n-二甲基甲酰胺5ml中。加毕,80℃反应1h。反应结束后,向反应液中加入20ml水,搅拌0.5h,抽滤,得到橙黄色固体1.7g,收率为95.0%。esi-ms m/z:309.3[m+h]
+
。
[0116]
步骤4,中间体8
[0117]
室温下,将中间体7 1g及铁粉1.81g、氯化铵1.04g混悬于75乙醇10ml中。加毕,氮气氛围下,室温反应3h。反应结束后,抽滤,减压浓缩滤液,得到紫色固体0.86g,收率为95.3%。esi-ms m/z:279.4[m+h]
+
。
[0118]
步骤5,中间体9
[0119]
室温下,将中间体4 0.5g、8 0.61g及焦亚硫酸钠0.042g溶于dmf 15ml中。加毕,升温至120℃反应48h。反应结束后,将反应液冷却至室温,向反应液中加入100ml水,水相用乙酸乙酯(50ml
×
3)萃取,合并有机相,水洗,无水硫酸钠干燥,抽滤,蒸干,粗品经柱层析纯化,得到淡黄色固体0.4g,收率为37.4%。esi-ms m/z:486.6[m+h]
+
。
[0120]
步骤6,中间体10
[0121]
室温下,将中间体9 0.4g、氢氧化钾0.14g溶于75乙醇10ml中。加毕,升温至40℃反应5h。反应结束后,将反应液冷却至室温,使用1m盐酸将ph调节至7,水相用乙酸乙酯(50ml
×
3)萃取,合并有机相,水洗,无水硫酸钠干燥,抽滤,蒸干,得到淡黄色固体0.36g,收率为95.5%。esi-ms m/z:458.5[m+h]
+
。
[0122]
步骤7,中间体13
[0123]
室温下,将中间体11 1g、12 0.76g溶于二氧六环15ml中。加毕,升温至100℃反应12h。反应结束后,将反应液冷却至室温,将反应液倒入100ml水中,搅拌1h,抽滤,干燥,得到淡紫色固体0.9g,收率为57.8%。esi-ms m/z:431.5[m+h]
+
。
[0124]
步骤8,中间体14
[0125]
冰浴条件下,将中间体13 0.9g溶于二氯甲烷10ml中,缓慢加入三氟乙酸2.38g。加毕,室温下反应12h。反应结束后,用饱和碳酸钾溶液将ph调节至8,水相用二氯甲烷(30ml
×
3)萃取,合并有机相,水洗,无水硫酸钠干燥,抽滤,蒸干,得到淡黄色固体0.5g,收率为72.4%。esi-ms m/z:331.3[m+h]
+
。
[0126]
步骤9,i-1
[0127]
冰浴条件下,将中间体10 0.2g,dipea0.11g,hatu 0.17g溶于dmf 5ml中,随后缓慢加入中间体14 0.16g。加毕,室温下反应6h。反应结束后,向反应液中加入30ml水,水相用乙酸乙酯(20ml
×
3)萃取,合并有机相,水洗,无水硫酸钠干燥,抽滤,蒸干,柱层析纯化得到淡黄色固体0.15g,收率为44.6%。esi-ms m/z:770.9[m+h]
+
。1h-nmr(400mhz,dmso-d6)δ12.21(s,1h),11.13(s,1h),10.71(s,0.33h,imidazole-nh),10.48(s,0.67h,imidazole-nh),7.94(s,1h),7.69
–
7.16(m,7h),7.15
–
6.61(m,5h),5.07(m,1h),3.60(m,1h),3.49
–
3.38(m,1h),3.35
–
3.27(m,2h),3.26
–
3.16(m,2h),3.10(m,3h),2.99(m,2h),2.95
–
2.80(m,1h),2.59(m,4h),2.50(m,5h),1.73(m,5h).
[0128]
实施例2
[0129]
n-(2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)
哌嗪-1-基)乙基)-2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氨基)乙酰胺(i-2)
[0130][0131]
步骤1,中间体16
[0132]
室温下,将中间体6 1g、碳酸钾2.66g及中间体15 1.19g溶于n,n-二甲基甲酰胺10ml中。加毕,80℃反应1h。反应结束后,向反应液中加入20ml水,搅拌0.5h,抽滤,得到橙黄色固体1.8g,收率为87.2%。esi-ms m/z:323.4[m+h]
+
。
[0133]
步骤2,中间体17
[0134]
冰浴条件下,将中间体16 0.9g溶于二氯甲烷10ml中,缓慢加入三氟乙酸4.78g。加毕,室温下反应12h。反应结束后,用饱和碳酸钾溶液将ph调节至8,水相用二氯甲烷(30ml
×
3)萃取,合并有机相,水洗,无水硫酸钠干燥,抽滤,蒸干,得到淡黄色固体0.5g,收率为80.6%。esi-ms m/z:223.3[m+h]
+
。
[0135]
步骤3,中间体19
[0136]
室温下,将中间体17 0.5g、18 0.61g及碳酸钾0.62g混悬于乙腈10ml中。加毕,升温至80℃反应24h。反应结束后,将反应液冷却至室温,经柱层析纯化,得到淡黄色固体0.5g,收率为60.8%。esi-ms m/z:366.4[m+h]
+
。
[0137]
步骤4,中间体20
[0138]
室温下,将中间体19 0.5g及铁粉0.76g、氯化铵0.44g混悬于75乙醇5ml中。加毕,氮气氛围下,室温反应3h。反应结束后,抽滤,减压浓缩滤液,得到紫色固体0.43g,收率为93.7%。esi-ms m/z:335.5[m+h]
+
。
[0139]
步骤5,中间体21
[0140]
室温下,将中间体4 0.28g、20 0.41g及焦亚硫酸钠0.023g溶于dmf 8ml中。加毕,升温至120℃反应48h。反应结束后,将反应液冷却至室温,向反应液中加入50ml水,水相用乙酸乙酯(30ml
×
3)萃取,合并有机相,水洗,无水硫酸钠干燥,抽滤,蒸干,粗品经柱层析纯化,得到淡黄色固体0.35g,收率为52.4%。esi-ms m/z:542.7[m+h]
+
。
[0141]
步骤6,中间体22
[0142]
冰浴条件下,将中间体21 0.35g溶于二氯甲烷6ml中,缓慢加入三氟乙酸1.1g。加毕,室温下反应12h。反应结束后,用饱和碳酸钾溶液将ph调节至8,水相用二氯甲烷(30ml
×
3)萃取,合并有机相,水洗,无水硫酸钠干燥,抽滤,蒸干,得到淡黄色固体0.2g,收率为70.1%。esi-ms m/z:443.6[m+h]
+
。
[0143]
步骤7,中间体24
[0144]
室温下,将中间体11 0.5g、23 0.28g溶于二氧六环8ml中。加毕,升温至100℃反应12h。反应结束后,将反应液冷却至室温,将反应液倒入20ml水中,水相用乙酸乙酯(15ml
×
3)萃取,合并有机相,水洗,无水硫酸钠干燥,抽滤,蒸干,柱层析纯化得到淡黄色固体0.5g,收率为71.3%。esi-ms m/z:388.4[m+h]
+
。
[0145]
步骤8,中间体25
[0146]
冰浴条件下,将中间体24 0.5g溶于二氯甲烷6ml中,缓慢加入三氟乙酸2.21g。加毕,室温下反应12h。反应结束后,用饱和碳酸钾溶液将ph调节至7,水相用二氯甲烷(30ml
×
3)萃取,合并有机相,水洗,无水硫酸钠干燥,抽滤,蒸干,得到淡黄色固体0.39g,收率为91.2%。esi-ms m/z:332.3[m+h]
+
。
[0147]
步骤9,i-2
[0148]
制备方法参照实施例1。esi-ms m/z:756.3[m+h]
+
。1h-nmr(300mhz,dmso-d6)δ12.17(s,1h),11.13(s,1h),10.64(s,0.33h,imidazole-nh),10.41(s,0.67h,imidazole-nh),8.04(br s,1h),7.59(m,1h),7.40(m,5h),7.14
–
6.65(m,6h),5.06(m,1h),4.03
–
3.85(m,2h),3.60(m,4h),3.32
–
3.19(m,2h),3.02(m,4h),2.94
–
2.78(m,1h),2.54(s,3h),2.42(m,2h),2.01
–
1.89(m,1h),1.75(m,5h).
[0149]
实施例3
[0150]
2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)-n-(4-(2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)丁基)乙酰胺(i-3)
[0151]
制备方法参照实施例1。esi-ms m/z:769.3[m+h]
+
。1h-nmr(500mhz,chloroform-d)δ9.11(s,1h),8.02(t,j=3.7hz,1h),7.75
–
7.65(m,3h),7.53
–
7.43(m,5h),7.36
–
7.26(m,2h),7.13(d,j=2.1hz,1h),7.07(dd,j=8.3,2.3hz,1h),5.13(t,j=5.9hz,1h),3.62
–
3.48(m,2h),3.39(ddd,j=11.9,6.2,4.5hz,2h),3.37
–
3.28(m,4h),3.15(d,j=0.7hz,2h),2.87
–
2.75(m,4h),2.71(s,2h),2.59
–
2.48(m,4h),2.01
–
1.88(m,2h).
[0152]
实施例4
[0153]
2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)-n-(3-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氧基)丙基)乙酰胺(i-4)
[0154]
制备方法参照实施例1。esi-ms m/z:771.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.71
–
7.63(m,2h),7.53
–
7.43(m,5h),7.36
–
7.27(m,2h),7.18
–
7.10(m,2h),7.07(dd,j=8.3,2.3hz,1h),5.13(t,j=5.9hz,1h),4.07(t,j=6.1hz,2h),3.44
–
3.35(m,2h),3.33(dt,j=11.9,5.3hz,2h),3.18
–
3.11(m,4h),2.82(dd,j=5.7,5.0hz,4h),2.71(s,2h),2.59
–
2.48(m,4h),2.01
–
1.84(m,5h).
[0155]
实施例5
[0156]
n-(2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)乙基)-2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氧基)乙酰胺(i-5)
[0157]
制备方法参照实施例1。esi-ms m/z:757.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.76(dd,j=7.8,1.2hz,1h),7.68(d,j=8.4hz,1h),7.62(t,j=4.4hz,1h),7.53
–
7.47(m,2h),7.50
–
7.40(m,3h),7.36
–
7.28(m,1h),7.21(dd,j=7.8,1.2hz,1h),7.14(d,j=2.1hz,1h),7.07(dd,j=8.4,2.2hz,1h),5.16
–
5.10(m,1h),4.57(s,2h),3.34
–
3.18(m,6h),2.71(s,2h),2.66
–
2.58(m,5h),2.62
–
2.52(m,3h),2.50(s,2h),1.96(td,j=7.5,5.9hz,2h).
[0158]
实施例6
[0159]
2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)-n-(2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氨基)乙基)乙酰胺(i-6)
[0160]
制备方法参照实施例1。esi-ms m/z:756.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),8.02(t,j=3.7hz,1h),7.75
–
7.65(m,3h),7.53
–
7.43(m,5h),7.36
–
7.26(m,2h),7.13(d,j=2.1hz,1h),7.07(dd,j=8.3,2.3hz,1h),5.13(t,j=5.9hz,1h),3.62
–
3.48(m,2h),3.39(ddd,j=11.9,6.2,4.5hz,2h),3.37
–
3.28(m,4h),3.15(d,j=0.7hz,2h),2.87
–
2.75(m,4h),2.71(s,2h),2.59
–
2.48(m,4h),2.01
–
1.88(m,2h).
[0161]
实施例7
[0162]
n-(2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)乙基)-2-((2-(2,6-二氧哌啶-3-基)-3-氧代异吲哚啉-4-基)氨基)乙酰胺(i-7)
[0163]
制备方法参照实施例2。esi-ms m/z:742.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.99(t,j=5.1hz,1h),7.75(t,j=4.4hz,1h),7.68(d,j=8.5hz,1h),7.53
–
7.43(m,4h),7.36
–
7.29(m,1h),7.22
–
7.12(m,3h),7.07(dd,j=8.4,2.2hz,1h),6.99(ddt,j=7.0,2.0,1.0hz,1h),4.28(t,j=6.0hz,1h),4.14(dd,j=5.1,1.3hz,2h),3.99(d,j=1.1hz,2h),3.34(dt,j=11.9,5.3hz,2h),3.33
–
3.21(m,3h),3.25
–
3.16(m,1h),2.71(s,2h),2.63(dt,j=7.1,5.5hz,5h),2.59
–
2.47(m,6h),1.72(td,j=7.5,6.0hz,2h).
[0164]
实施例8
[0165]
n-(2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)
哌嗪-1-基)乙基)-2-((2-(1-甲基-2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氨基)乙酰胺(i-8)
[0166]
制备方法参照实施例2。esi-ms m/z:770.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.90(t,j=5.1hz,1h),7.76
–
7.65(m,3h),7.53
–
7.42(m,5h),7.36
–
7.28(m,1h),7.21(dd,j=7.9,1.1hz,1h),7.14(d,j=2.1hz,1h),7.07(dd,j=8.4,2.2hz,1h),5.38(t,j=5.9hz,1h),4.22
–
4.09(m,2h),3.34(dt,j=11.9,5.3hz,2h),3.33
–
3.22(m,3h),3.21(dtd,j=14.3,5.6,4.3hz,1h),3.00(s,2h),2.71(s,2h),2.68
–
2.57(m,6h),2.61
–
2.53(m,1h),2.56
–
2.49(m,1h),2.50(s,2h),2.02
–
1.88(m,2h).
[0167]
实施例9
[0168]
n-(2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)乙基)-2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-5-基)氨基)乙酰胺(i-9)
[0169]
制备方法参照实施例2。esi-ms m/z:756.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.85(d,j=8.4hz,1h),7.71
–
7.64(m,2h),7.53
–
7.43(m,4h),7.36
–
7.29(m,1h),7.18
–
7.12(m,2h),7.11
–
7.04(m,2h),6.59(t,j=5.0hz,1h),5.07(t,j=5.9hz,1h),4.02(d,j=5.1hz,2h),3.38
–
3.18(m,6h),2.71(s,2h),2.63(dt,j=7.1,5.5hz,5h),2.61
–
2.48(m,5h),1.95(td,j=7.5,5.9hz,2h).
[0170]
实施例10
[0171]
n-(2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)乙基)-2-((2-(2,6-二氧哌啶-3-基)-6-氟-1,3-二氧异吲哚啉-5-基)氨基)乙酰胺(i-10)
[0172]
制备方法参照实施例2。esi-ms m/z:774.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.71
–
7.64(m,3h),7.53
–
7.43(m,4h),7.42(s,1h),7.36
–
7.28(m,1h),7.14(d,j=2.1hz,1h),7.07(dd,j=8.4,2.2hz,1h),6.94(t,j=5.1hz,1h),5.07(t,j=5.9hz,1h),4.14(d,j=5.1hz,2h),3.38
–
3.23(m,5h),3.21(dtd,j=14.1,5.6,4.4hz,1h),2.71(s,2h),2.68
–
2.53(m,8h),2.50(s,2h),1.95(td,j=7.5,5.9hz,2h).
[0173]
实施例11
[0174]
n-(2-(4-(2-(4-乙酰基-3-(4-(2-羟丙基-2-基)苯基)-5-甲基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)乙基)-2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氨基)乙酰胺(i-11)
[0175]
制备方法参照实施例2。esi-ms m/z:814.4[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.10(s,1h),7.90(t,j=5.1hz,1h),7.80(dd,j=7.9,1.1hz,1h),7.71
–
7.54(m,6h),7.46(t,j=7.8hz,1h),7.26(dd,j=7.9,1.1hz,1h),7.14(d,j=2.1hz,1h),7.07(dd,j=8.4,2.2hz,1h),5.13(t,j=5.9hz,1h),4.30(s,1h),4.22
–
4.09(m,2h),3.38
–
3.16(m,6h),2.71(s,2h),2.63(dt,j=7.1,5.6hz,5h),2.59
–
2.49(m,6h),1.96(td,j=7.5,5.9hz,2h),1.56(s,2h),1.51(s,2h).
[0176]
实施例12
[0177]
n-(2-(4-(2-(4-乙酰基-5-甲基-3-(4-((四氢呋喃-3-基)氧基)苯基)-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)乙基)-2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧
异吲哚啉-4-基)氨基)乙酰胺(i-12)
[0178]
制备方法参照实施例2。esi-ms m/z:842.4[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.10(s,1h),7.90(t,j=5.1hz,1h),7.80(dd,j=7.8,1.2hz,1h),7.71
–
7.65(m,2h),7.52
–
7.44(m,3h),7.37
–
7.30(m,2h),7.27(dd,j=7.9,1.3hz,1h),7.14(d,j=2.2hz,1h),7.03(dd,j=8.4,2.2hz,1h),5.13(t,j=5.9hz,1h),4.98(p,j=5.6hz,1h),4.22
–
4.09(m,2h),3.86
–
3.76(m,4h),3.38
–
3.16(m,6h),2.76(s,2h),2.68
–
2.60(m,5h),2.63
–
2.46(m,6h),2.49
–
2.40(m,1h),2.36(dq,j=14.1,5.3hz,1h),1.96(td,j=7.5,5.9hz,2h).
[0179]
实施例13
[0180]
n-(2-(4-(2-(4-乙酰基-5-甲基-3-(吡啶-4-基)-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基))哌嗪-1-基)乙基)-2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氨基)乙酰胺(i-13)
[0181]
制备方法参照实施例2。esi-ms m/z:757.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.34(s,1h),8.78
–
8.73(m,2h),7.90(t,j=5.1hz,1h),7.80(dd,j=7.9,1.1hz,1h),7.71
–
7.63(m,4h),7.46(t,j=7.8hz,1h),7.26(dd,j=7.9,1.1hz,1h),7.14(d,j=2.1hz,1h),7.07(dd,j=8.4,2.2hz,1h),5.13(t,j=5.9hz,1h),4.22
–
4.09(m,2h),3.34(dt,j=11.9,5.3hz,2h),3.33
–
3.22(m,3h),3.21(dtd,j=14.3,5.6,4.3hz,1h),2.74(s,2h),2.63(dt,j=7.1,5.5hz,5h),2.59
–
2.48(m,5h),1.96(td,j=7.5,5.9hz,2h).
[0182]
实施例14
[0183]
n-(2-(4-(2-(4-乙酰基-5-甲基-3-(1-甲基-1h-吡唑-4-基)-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)乙基)-2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氨基)乙酰胺(i-14)
[0184]
制备方法参照实施例2。esi-ms m/z:760.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.29(s,1h),7.90(t,j=5.1hz,1h),7.84
–
7.75(m,3h),7.71
–
7.65(m,2h),7.46(t,j=7.8hz,1h),7.26(dd,j=7.9,1.1hz,1h),7.13(d,j=2.1hz,1h),7.07(dd,j=8.4,2.2hz,1h),5.13(t,j=5.9hz,1h),4.22
–
4.09(m,2h),3.98(s,3h),3.38
–
3.16(m,7h),2.71(s,2h),2.63(dt,j=7.1,5.5hz,5h),2.59
–
2.49(m,6h),1.96(td,j=7.5,5.9hz,2h).
[0185]
实施例15
[0186]
4-(4-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)哌啶-1-基)-2-(2,6-二氧哌啶-3-基)异吲哚啉-1,3-二酮(i-15)
[0187]
制备方法参照实施例2。esi-ms m/z:739.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.76
–
7.65(m,2h),7.57
–
7.43(m,5h),7.36
–
7.29(m,1h),7.19
–
7.12(m,2h),7.07(dd,j=8.4,2.2hz,1h),5.10(t,j=5.9hz,1h),3.48(t,j=6.8hz,4h),3.40(ddd,j=11.9,6.0,4.8hz,2h),3.34(ddd,j=11.7,5.8,4.8hz,2h),2.74
–
2.63(m,7h),2.57(t,j=7.5hz,2h),2.50(s,3h),2.49(p,j=5.8hz,1h),2.01
–
1.88(m,2h),1.89
–
1.75(m,4h).
[0188]
实施例16
[0189]
4-(3-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)吡咯烷-1-基)-2-(2,6-二氧哌啶-3-基)异吲哚啉-1,3-二酮(i-16)
[0190]
制备方法参照实施例2。esi-ms m/z:725.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.77(dd,j=7.9,1.1hz,1h),7.68(d,j=8.5hz,1h),7.57
–
7.47(m,3h),
基)哌嗪-1-基)氮杂环丁烷-1-基)六氢环戊二烯[c]吡咯-2(1h)-基)-2-(2,6-二氧哌啶-3-基)异吲哚啉-1,3-二酮(i-25)
[0217]
制备方法参照实施例2。esi-ms m/z:820.4[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.78(dd,j=7.9,1.1hz,1h),7.68(d,j=8.5hz,1h),7.59(t,j=7.9hz,1h),7.53
–
7.43(m,4h),7.32(ddt,j=7.3,6.6,1.9hz,1h),7.21
–
7.12(m,2h),7.07(dd,j=8.4,2.2hz,1h),5.10(t,j=5.9hz,1h),3.44(d,j=5.3hz,4h),3.37
–
3.31(m,4h),3.00(d,j=5.1hz,4h),2.84(p,j=6.7hz,1h),2.80
–
2.69(m,7h),2.57(t,j=7.5hz,2h),2.50(s,2h),2.35(tt,j=6.9,5.3hz,2h),2.00
–
1.88(m,2h),1.75(t,j=6.7hz,3h).
[0218]
实施例26
[0219]
2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)-n-(2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氧基)乙基)乙酰胺(i-26)
[0220]
制备方法参照实施例2。esi-ms m/z:757.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.76
–
7.65(m,2h),7.62(t,j=4.4hz,1h),7.54
–
7.43(m,5h),7.36
–
7.28(m,1h),7.16
–
7.10(m,2h),7.07(dd,j=8.3,2.3hz,1h),5.13(t,j=5.9hz,1h),4.22(td,j=5.3,0.8hz,2h),3.42(dddd,j=11.9,10.6,5.3,3.3hz,4h),3.35(ddd,j=11.7,6.1,4.6hz,2h),3.15(s,2h),2.87
–
2.75(m,4h),2.71(s,2h),2.59
–
2.48(m,4h),2.01
–
1.88(m,2h).
[0221]
实施例27
[0222]
2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)-n-(2-(2-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氧基)乙氧基)乙基)乙酰胺(i-27)
[0223]
制备方法参照实施例2。esi-ms m/z:801.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.76(dd,j=7.9,1.1hz,1h),7.71
–
7.65(m,2h),7.53
–
7.43(m,5h),7.32(ddt,j=7.3,6.6,1.9hz,1h),7.17
–
7.10(m,2h),7.07(dd,j=8.3,2.3hz,1h),5.13(t,j=5.9hz,1h),4.24(td,j=6.2,1.0hz,2h),3.76(t,j=6.1hz,2h),3.57(t,j=5.3hz,2h),3.44
–
3.31(m,6h),3.15(s,1h),2.87
–
2.75(m,4h),2.71(s,2h),2.59
–
2.48(m,4h),1.96(td,j=7.5,5.9hz,2h).
[0224]
实施例28
[0225]
4-(2-(1-(2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基))哌嗪-1-基)乙基)-1h-1,2,3-三唑-4-基)乙氧基)-2-(2,6-二氧哌啶-3-基)异二氢吲哚-1,3-二酮(i-28)
[0226]
制备方法参照实施例2。esi-ms m/z:795.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.74(s,1h),7.72
–
7.65(m,2h),7.54
–
7.43(m,5h),7.32(ddt,j=7.3,6.6,1.9hz,1h),7.16
–
7.10(m,2h),7.07(dd,j=8.4,2.2hz,1h),5.13(t,j=5.9hz,1h),4.43(qt,j=11.7,6.5hz,2h),4.29(t,j=5.7hz,2h),3.32
–
3.26(m,4h),3.05
–
2.96(m,4h),2.71(s,2h),2.68
–
2.62(m,4h),2.59
–
2.48(m,4h),2.01
–
1.88(m,2h).
[0227]
实施例29
[0228]
4-((2-(1-(2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪
唑-6-基)哌嗪-1-基)乙基)-1h-1,2,3-三唑-4-基)乙基)氨基)-2-(2,6-二氧哌啶-3-基)异二氢吲哚-1,3-二酮(i-29)
[0229]
制备方法参照实施例2。esi-ms m/z:794.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.74(s,1h),7.72
–
7.65(m,2h),7.54
–
7.43(m,5h),7.32(ddt,j=7.3,6.6,1.9hz,1h),7.16
–
7.10(m,2h),7.07(dd,j=8.4,2.2hz,1h),5.13(t,j=5.9hz,1h),4.43(qt,j=11.7,6.5hz,2h),4.29(t,j=5.7hz,2h),3.32
–
3.26(m,4h),3.05
–
2.96(m,4h),2.71(s,2h),2.68
–
2.62(m,4h),2.59
–
2.48(m,4h),2.01
–
1.88(m,2h).
[0230]
实施例30
[0231]
4-(2-(1-(2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基))哌嗪-1-基)乙基)-1h-1,2,3-三唑-4-基)乙氧基)-2-(2,6-二氧哌啶-3-基)异二氢吲哚-1,3-二酮(i-30)
[0232]
制备方法参照实施例2。esi-ms m/z:795.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),7.74(s,1h),7.72
–
7.65(m,2h),7.54
–
7.43(m,5h),7.32(ddt,j=7.3,6.6,1.9hz,1h),7.16
–
7.10(m,2h),7.07(dd,j=8.4,2.2hz,1h),5.13(t,j=5.9hz,1h),4.43(qt,j=11.7,6.5hz,2h),4.29(t,j=5.7hz,2h),3.32
–
3.26(m,4h),3.05
–
2.96(m,4h),2.71(s,2h),2.68
–
2.62(m,4h),2.59
–
2.48(m,4h),2.01
–
1.88(m,2h).
[0233]
实施例31
[0234]
(2s,4r)-1-((s)-2-(2-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)乙酰氨基)-3,3-二甲基丁酰基)-4-羟基-n-((s)-1-(4-(4-甲基噻唑-5-基)苯基))乙基)吡咯烷-2-甲酰胺(i-31)
[0235]
制备方法参照实施例1。esi-ms m/z:884.4[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),8.37(s,1h),7.68(dd,j=8.8,3.9hz,2h),7.54
–
7.44(m,4h),7.41
–
7.34(m,2h),7.36
–
7.26(m,2h),7.29
–
7.23(m,2h),7.13(d,j=2.1hz,1h),7.03(dd,j=8.4,2.2hz,1h),5.12(dqt,j=8.2,6.2,1.0hz,1h),4.55
–
4.47(m,2h),4.50
–
4.42(m,1h),3.64
–
3.55(m,2h),3.45
–
3.31(m,4h),3.18(s,1h),2.90
–
2.80(m,5h),2.71(s,2h),2.50(s,2h),2.39(s,2h),2.00
–
1.87(m,2h),1.53(d,j=6.2hz,3h),0.99(s,6h).
[0236]
实施例32
[0237]
(2s,4r)-1-((s)-2-(3-(4-(2-(4-乙酰基-5-甲基-3-苯基-1h-吡咯-2-基)-1h-苯并[d]咪唑-6-基)哌嗪-1-基)丙酰胺基)-3,3-二甲基丁酰基)-4-羟基-n-((s)-1-(4-(4-甲基噻唑-5-基)苯基))乙基)吡咯烷-2-甲酰胺(i-32)
[0238]
制备方法参照实施例1。esi-ms m/z:898.4[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.11(s,1h),8.37(s,1h),7.70(dd,j=22.1,8.7hz,2h),7.54
–
7.44(m,4h),7.41
–
7.34(m,2h),7.36
–
7.26(m,2h),7.29
–
7.23(m,2h),7.15(d,j=2.2hz,1h),6.98(dd,j=8.4,2.4hz,1h),5.12(dqt,j=8.2,6.2,1.0hz,1h),4.53(d,j=9.0hz,1h),4.51
–
4.42(m,1h),4.42
–
4.36(m,1h),3.66
–
3.55(m,2h),3.35
–
3.26(m,4h),2.83
–
2.69(m,10h),2.53
–
2.47(m,5h),2.39(s,2h),2.01
–
1.90(m,2h),1.53(d,j=6.2hz,3h),0.99(s,7h).
[0239]
实施例33
[0240]
2-((4-(4-乙酰基-5-甲基-2-(6-(4-甲基哌嗪-1-基)-1h-苯并[d]咪唑-2-基)-1h-吡咯-3-基))苯基)氨基)-n-(3-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)
氨基)丙基)乙酰胺(ii-1)
[0241]
制备方法参照实施例1。esi-ms m/z:799.4[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.10(s,1h),7.80(t,j=3.7hz,1h),7.71
–
7.63(m,2h),7.59
–
7.52(m,2h),7.51(t,j=7.8hz,1h),7.42(t,j=4.4hz,1h),7.30(dd,j=7.9,1.1hz,1h),7.14(d,j=2.1hz,1h),7.07(dd,j=8.4,2.2hz,1h),7.02
–
6.96(m,2h),6.27(t,j=5.1hz,1h),5.13(t,j=5.9hz,1h),4.00(d,j=5.1hz,2h),3.39(td,j=6.3,3.7hz,2h),3.27(qdd,j=11.9,6.2,4.5hz,4h),3.13(td,j=6.3,4.3hz,2h),2.76(s,2h),2.72
–
2.60(m,4h),2.59
–
2.51(m,4h),2.26(s,2h),2.01
–
1.88(m,2h),1.75(p,j=6.3hz,2h).
[0242]
实施例34
[0243]
2-((4-(4-乙酰基-5-甲基-2-(6-(4-甲基哌嗪-1-基)-1h-苯并[d]咪唑-2-基)-1h-吡咯-3-基))苯基)氨基)-n-(3-((2-(2,6-二氧哌啶-3-基)-1,3-二氧异吲哚啉-4-基)氧基)丙基)乙酰胺(ii-2)
[0244]
制备方法参照实施例1。esi-ms m/z:800.3[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.10(s,1h),7.71
–
7.63(m,2h),7.59
–
7.52(m,2h),7.49(t,j=7.8hz,1h),7.31(t,j=4.3hz,1h),7.17
–
7.11(m,2h),7.07(dd,j=8.4,2.2hz,1h),7.04
–
6.97(m,2h),6.27(t,j=5.1hz,1h),5.13(t,j=5.9hz,1h),4.07(t,j=6.1hz,2h),4.00(d,j=5.1hz,2h),3.27(qdd,j=11.9,6.2,4.5hz,4h),3.16(td,j=6.4,4.4hz,2h),2.76(s,2h),2.72
–
2.60(m,4h),2.59
–
2.51(m,4h),2.26(s,2h),2.01
–
1.90(m,2h),1.94
–
1.85(m,2h).
[0245]
实施例35
[0246]
(2r,4s)-1-((r)-2-(2-((4-(4-乙酰基-5-甲基-2-(6-(4-甲基哌嗪-1-基)-1h-苯并[d]咪唑-2-基)-1h-吡咯-3-基)苯基)氨基)乙酰胺)-3,3-二甲基丁酰基)-4-羟基-n-((r)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)吡咯烷-2-甲酰胺(ii-3)
[0247]
制备方法参照实施例1。esi-ms m/z:913.5[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.10(s,1h),8.37(s,1h),7.76(d,j=9.0hz,1h),7.67(d,j=8.5hz,1h),7.58
–
7.51(m,2h),7.41
–
7.34(m,2h),7.32
–
7.23(m,3h),7.14(d,j=2.2hz,1h),7.03(dd,j=8.4,1.6hz,3h),6.31(t,j=5.1hz,1h),5.12(dqt,j=8.2,6.2,1.0hz,1h),4.54
–
4.44(m,2h),4.39(dd,j=5.8,5.0hz,1h),4.05(dd,j=5.1,1.5hz,2h),3.64
–
3.54(m,2h),3.27(qdd,j=11.9,6.0,4.6hz,4h),2.88(d,j=5.7hz,1h),2.76(s,2h),2.71
–
2.59(m,4h),2.53(s,2h),2.39(s,2h),2.26(s,2h),2.00
–
1.87(m,2h),1.53(d,j=6.2hz,3h),0.99(s,6h).
[0248]
实施例36
[0249]
(2r,4s)-1-((r)-2-(3-((4-(4-乙酰基-5-甲基-2-(6-(4-甲基哌嗪-1-基)-1h-苯并[d]咪唑-2-基)-1h-吡咯-3-基)苯基)氨基)丙酰胺基)-3,3-二甲基丁酰基)-4-羟基-n-((r)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)吡咯烷-2-甲酰胺(ii-4)
[0250]
制备方法参照实施例1。esi-ms m/z:927.5[m+h]
+
。1h nmr(500mhz,chloroform-d)δ9.10(s,1h),8.37(s,1h),7.68(dd,j=8.6,5.2hz,2h),7.58
–
7.52(m,2h),7.41
–
7.34(m,2h),7.32
–
7.23(m,3h),7.14(d,j=1.9hz,1h),7.06
–
6.96(m,3h),6.79(t,j=3.7hz,1h),5.12(dqt,j=8.2,6.2,1.0hz,1h),4.56
–
4.44(m,3h),3.66(dd,j=10.9,3.4hz,1h),3.55(dd,j=10.9,4.3hz,1h),3.50
–
3.39(m,2h),3.27(qdd,j=11.9,6.0,4.6hz,4h),2.83
–
2.74(m,3h),2.71
–
2.59(m,4h),2.58
–
2.51(m,5h),2.39(s,2h),2.26(s,2h),2.02
–
1.89(m,
2h),1.53(d,j=6.2hz,3h),0.99(s,6h).
[0251]
针对上述化合物对brd4蛋白结合能力的实验研究,具体如下:
[0252]
1、brd4蛋白结合能力测试
[0253]
alphascreen方法
[0254]
(1)实验材料及设备:brd4蛋白;pherastar fs plate reader(b mg labtech,germany);hepes,nacl,bsa,chaps;384低体积白板(corning,usa);枪头(axygen,usa);dmso(sigma,usa)。
[0255]
(2)对蛋白靶头化合物同时进行活性测定,靶头化合物活性见下表:
[0256][0257]
(3)实验原理:所得到的化合物均采取amplified luminscent proximity homogeneous assay(alphascreen)法来检测brd4蛋白的活性。供体株和受体株分别偶联了抗体针对蛋白多糖(aggrecan)的两个不同的抗体表位。当底物蛋白多糖结构完整的情况下,成对的珠子距离拉近,能产生光信号。当brd4蛋白和小分子化合物存在的情况下,能打断蛋白多糖的完整结构,光信号强度降低。从而来检测小分子与brd4蛋白结合力,该方法具有快速、简单、高效、灵敏、技术路线可靠等优点。同传统的蛋白酶活性检测技术(例如,基于fret的检测方法)比较,alphascreen优势在于能利用较大分子底物,尤是比较合适的brd4抑制剂活性测试方法。
[0258]
(4)实验步骤和方法:amplified luminscent proximity homogeneous assay(alphascreen)法,具体方法如下(以brd4为例):在ph值为7.4的室温条件下,每孔中配置50mm hepes、100mm nacl、0.1%(v%)bsa和0.05%(v%)chaps的混合缓冲溶液。配体从150μm以1:2的比例连续稀释得到24个梯度的浓度,并在每孔中加入4μl his标记brd4 250nm;孔板培养30分钟后加入4μl生物素化肽(h4k5kac8kac12kac16ac);再次培养30分钟后在弱光下加入25μg/ml的链霉亲和素包被的供体株4μl和25μg/ml的镍螯合物受体株4μl,然后在避光条件下培养60分钟后使用pherastar fs plate reader(b mg labtech,germany)设备读取光强,激发/发射光波长分别为680/570nm。
[0259]
表1部分化合物与brd4蛋白结合的测试结果
[0260][0261]
注:ic
50
活性分级(a级:20nm以下,b级:20~50nm,c级:50~100nm,d级:100nm以上)a未进行测试。
[0262]
2、目标化合物的体外抗肿瘤细胞活性测定
[0263]
用mtt法测定对血液肿瘤细胞mv4-11及实体瘤细胞22rv1、mda-mb-231肿瘤细胞株的抑制作用。
[0264]
(1)mtt法:利用活细胞线粒体中存在与nadp相关的脱氢酶能使外源性的mtt还原成难溶性的蓝紫色结晶物(formazan),并沉积在细胞中,而死细胞无此功能。再用二甲基亚砜(dmso)或三联液(10%sds-5%异丁醇-0.01mol/l hcl)溶解细胞中的紫色结晶物,用酶联免疫检测仪在570nm波长处测定其od值间接反应其活细胞量。
[0265]
(2)具体方法:将处于细胞对数生长期的要进行实验的肿瘤细胞按一定的细胞量接种于96孔培养板内,培养24h后加入所筛的样品(悬浮细胞接板后可直接加),细胞在37℃、5%(v%)co2条件下继续培养48小时后,加入mtt继续培养4小时,用dmso溶解结晶,在酶标仪下进行检测。
[0266]
表2目标化合物对细胞mv4-11、22rv1及mda-mb-231的体外抗肿瘤活性结果
[0267]
[0268][0269]
注:ic
50
活性分级(a级:20nm以下,b级:20~50nm,c级:50~100nm,d级:100nm以上)。
[0270]
(3)western blot实验:评价了代表性化合物i-1在特定浓度下对brd4蛋白的降解能力,实验结果表明(见图1),化合物i-1仅仅在1nm浓度下,即能明显降解brd4蛋白,表明化合物i-1是通过降解brd4蛋白而发挥抗mv4-11细胞增殖作用。
[0271]
(4)蛋白细胞抑制活性测试结果表明,本发明所提供化合物具有bet蛋白抑制及抗肿瘤细胞增殖效果。本发明化合物可用于治疗各种实质性器官癌,其中包括黑色素瘤、肝癌、肾癌、肺癌、前列腺癌、甲状腺癌、皮肤癌、结肠直肠癌、胰腺癌、卵巢癌、乳腺癌、睾丸癌、骨癌、脑癌、食管癌、胃肠道癌、软组织瘤、血癌、淋巴癌等,其中可以是由bet蛋白介导的癌症和炎症,也可以是不依赖于上述机制的癌症。western blot实验结果表明,本发明中代表性化合物i-1仅仅在1nm浓度下,即能明显降解brd4蛋白,表明化合物i-1是通过降解brd4蛋白而发挥抗mv4-11细胞增殖作用。因此,本发明提出,本发明化合物是brd4蛋白的降解剂,为brd4蛋白降解剂的开发提供物质基础,可能应用于多种肿瘤的治疗。
