ch3oh-h2o梯度洗脱得到所述化合物4和所述化合物5。
19.本发明所涉及的化合物可通过微生物发酵培养来获取含有丁内酯衍生物和肉桂酸衍生物的发酵物,再将发酵物通过ods c18柱层析、薄层层析、sephadex lh20凝胶柱层析及制备型 hplc等方法分离纯化得到。
20.本发明解决其技术问题所采用的技术方案之五是:
21.所述的次级代谢产物在制备抗肿瘤药物中的用途。
22.优选地,为化合物1~5或其衍生物在制备治疗肿瘤的药物中的用途。
23.本发明所涉及的设备、试剂、工艺、参数等,除有特别说明外,均为常规设备、试剂、工艺、参数等,不再作实施例。
24.本发明所列举的所有范围包括该范围内的所有点值。
25.本发明中,除有特别说明或在领域内有常用含义外,%均为质量百分比,比例均为质量比。
26.本发明中,所述“室温”即常规环境温度,可以为10~30℃。
27.本技术方案与
背景技术:
相比,它具有如下优点:
28.1.本发明的新培养方法推测可以有效激活真菌stachybotrys sp.m2021100lzh-1中沉默的次级代谢生物合成基因簇,产生在其他培养方法中难以获得的次级代谢产物,而这些次级代谢产物具有潜在的抗肿瘤活性。
29.2.本发明的新培养方法得到的次级代谢产物中,分离纯化得到4个丁内酯衍生物和1个肉桂酸衍生物,对kb、b16-f10、hepg-2三种肿瘤细胞的增殖具有抑制作用,有望成为抗肿瘤药物。
30.3.本发明采用的培养基原料易得,培养方法及分离纯化方法简单易放大,具备相当的工业实用价值。
附图说明
31.图1为stachybotrys sp.m2021100lzh-1在大米燕麦培养基中的次级代谢产物与传统大米培养的次级代谢产物的hplc谱图对比。
32.图2为对真菌stachybotrys sp.m2021100lzh-1固体发酵产物进行分离纯化的流程示意图。
具体实施方式
33.下面结合附图和实施例对本发明作进一步说明。本发明的下述实施例中列举了新培养方法下利用stachybotrys sp.m2021100lzh-1制备本发明所示化合物的实例,但并不以此为限。
34.实施例1新培养方法下stachybotrys sp.m2021100lzh-1的发酵生产及化合物的分离精制
35.1发酵生产
36.生产菌的发酵培养:挑取已活化且生长良好的stachybotrys sp.m2021100lzh-1菌落,接种于装有150ml真菌二号液体培养基[培养基组成(克/毫升):麦芽糖2%(即2g/100ml,下同),味精1%,kh2po
4 0.05%,mgso4·
7h2o 0.03%,葡萄糖1%,酵母膏0.3%,玉
米浆0.1%,甘露醇2%,海盐3.3%,水300ml]的500ml锥形瓶中,28℃、160r
·
min-1
条件下摇床培养48h后得到种子液。取适量菌株种子液,接种到大米燕麦培养基[大米47g,燕麦30g,水150ml]中,置于28℃的恒温培养箱中静置培养28天,获得菌株stachybotryssp.m2021100lzh-1的固体发酵产物。
[0037]
2浸膏的获得
[0038]
真菌stachybotryssp.m2021100lzh-1的固体发酵产物用甲醇重复浸泡提取3次后,合并提取液,减压浓缩后以水混悬,再用等体积的乙酸乙酯萃取3~4次,合并乙酸乙酯萃取液减压浓缩,得到菌株stachybotryssp.m2021100lzh-1的乙酸乙酯萃取浸膏。
[0039]
3化合物的分离精制
[0040]
采用odsc18柱层析(ch3oh-h2o梯度洗脱)对stachybotryssp.m2021100lzh-1的乙酸乙酯萃取浸膏进行分离,对比图1的hplc分析谱图发现,stachybotryssp.m2021100lzh-1菌株新培养方法——大米燕麦培养基的次级代谢产物,与传统大米培养的次级代谢产物相比,hplc图谱(图1)显示在20~40min时段有明显差异。差异部分主要存在40%(ch3oh:h2o)和50%(ch3oh:h2o)两个组分中,对这两个组分进一步通过odsc18柱层析、薄层层析、sephadexlh20凝胶柱层析以及半制备高效液相等方法进行分离纯化,最终从真菌stachybotryssp.m2021100lzh-1固体发酵产物的乙酸乙酯浸膏中得到5个化合物,提取流程如图2。
[0041]
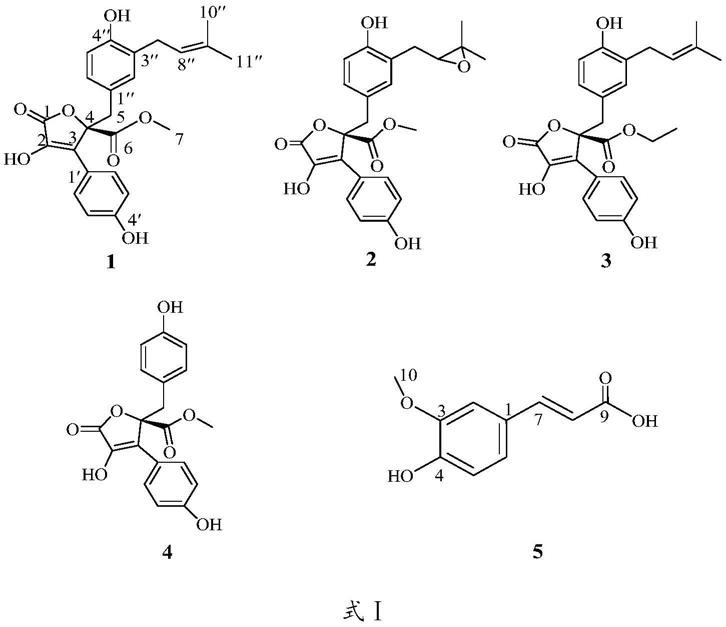
其中,odsc18柱层析的40%(ch3oh:h2o)组分先经sephadexlh-20凝胶柱层析(ch3oh)纯化,之后经半制备高效液相色谱40%乙腈(ch3cn:h2o,体积比40:60,3.0ml/min)等度洗脱制备得到化合物1、化合物2以及化合物3。odsc18柱层析的50%(ch3oh:h2o)组分经sephadexlh-20凝胶柱层析(ch3oh)纯化后,经半制备高效液相色谱30%~70%甲醇梯度洗脱(ch3oh:h2o,30%~70%0~40min,3.0ml/min)制备得到化合物4和化合物5。化合物1~5如表1所示。
[0042]
表1新培养方法下分离到的化合物1~5
[0043][0044]
实施例2化合物1~5的体外抗肿瘤实验
[0045]
1、材料和方法
[0046]
细胞系和药品配制:kb(人口腔上皮癌细胞株)、b16-f10(小鼠黑色素瘤细胞株)、hepg-2(人肝癌细胞株)。将这些细胞置于含10%胎牛血清的rpmi1640和dmem(hepg-2)培养液中,在37℃,5%饱和湿度的co2培养箱中培养。
[0047]
被测样品溶液的配制:测试样品为上述实施例1中分离精制的化合物1~5纯品。精密称取适量样品,用dmso配制成浓度为50mg/ml的溶液,再用相应培养液(不含胎牛血清)稀释成200μg/ml作为第一梯度浓度。再将第一梯度浓度对半稀释作为第二梯度浓度,再以第
二梯度对半稀释作为第三梯度浓度,以此类推,共设6个梯度药物浓度,每个药物浓度设定3个复孔。
[0048]
肿瘤细胞株的培养:取对数生长期的kb、b16-f10及hepg2细胞,以1
×
104/ml的初始浓度分别接种于96孔培养板中,每孔100μl,孵育12~20h。各孔中加入不同浓度药物100μl,空白组加入新鲜培养液(不含胎牛血清)100μl,置于5%co2培养箱中37℃恒温培养40~48 h后,取出96孔板,每孔加入100μl 4℃预冷的tca溶液(30%,w/v)固定细胞,tca溶液的终浓度为10%,静置5min后移入4℃冰箱中固定,30min后用去离子水冲洗5遍,室温晾干。每孔加入0.4%(w/v)的srb染液(1%的乙酸配制)50μl,染色30min后倒掉染液,用1%(v/v) 乙酸溶液冲洗5次,去除未与细胞结合的染料,室温晾干。用100μl非缓冲tris-base碱液(100 mm,ph=10.5)溶解与细胞蛋白结合的染料,水平摇床上振荡5min,用酶标仪于515nm处测定od值。
[0049]
各组均于570nm波长处测定各孔的od值,计算细胞生长抑制率(抑制率=(od空白-od 给药)/od空白
×
100%)。利用spss软件计算40~48h药物作用细胞的ic
50
值,取三个复孔浓度的ic
50
平均值。
[0050]
2、结果
[0051]
肿瘤细胞增殖的抑制作用在srb法测试中,化合物1~5对肿瘤细胞kb、b16-f10、hepg-2 的增殖抑制结果见表2。
[0052]
表2化合物1~5对三种肿瘤细胞体外增值抑制结果
[0053][0054]
3、结论
[0055]
采用实施例1的新培养方法下从真菌stachybotrys sp.m2021100lzh-1次级代谢产物中分离到的化合物1(butyrolactone
‑ⅰ
)对kb、b16-f10、hepg-2三种肿瘤细胞的增殖均有明显的抑制作用。化合物1~5对kb细胞均表现出一定的抗肿瘤活性。实验结果表明,本发明下分离到的化合物具有抗肿瘤活性。
[0056]
以上所述,仅为本发明较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
