针对egfrviii的单域抗体及其衍生蛋白和应用
技术领域
1.本发明属于免疫学领域,涉及针对egfrviii的单域抗体及其衍生蛋白和应用。
背景技术:
2.胶质母细胞瘤是最常见和致命的原发性成人脑恶性肿瘤之一,严重危害人类健康。胶质母细胞瘤的浸润性生长和异质性使得很难确定有效的治疗策略。更不乐观的是,胶质母细胞瘤发展进程很快,患者的总生存时间一般不超过15个月,5年存活率约10%(thakkar jp等cancer epidemiol biomarkersprev.2014)。通过对病人基因组分析显示egfr在超过半数的胶质母细胞瘤中发生扩增和突变。
3.egfr(epidermal growth factor receptor)是一种隶属于酪氨酸激酶受体家族的跨膜糖蛋白,其分子量为170-185kda。egfr在各胚层起源的细胞中均有一定的表达,是上皮组织来源的正常细胞生长过程的关键调节剂。在受到多种配体包括egf、tgf-α、神经调节蛋白、双调蛋白等的信号刺激下,egfr 形成二聚体并激活下游ras/raf/mapk,pi3k/akt,jak/stat等信号通路,参与调节细胞的增殖、代谢、凋亡和分化等过程(jones s等,int j biochem cell biol 2014jun;51:23-8.)。
4.egfr的异常表达在多种肿瘤病例包括胶质瘤、小细胞肺癌、乳腺癌、膀胱癌等患者中都有发现,且与癌症的放射治疗和化学治疗等治疗方案的抵抗有关(arteaga cl,oncologist.2002;7suppl 4:31-9.)。而这些肿瘤中的异常表达通常是由于egfr尤其是胞外段和酪氨酸激酶结构域的突变引起的,并进一步导致升高的或延长的异常egfr信号传导。在egfr的多种突变中,egfr突变体iii(egfrviii)是胶质母细胞瘤中最常被检测到的突变,约占病例的50%-60%(del vecchio ca等oncogene.2013may 23;32(21):2670-81),胶质瘤恶性级别与egfrviii表达水平呈正相关关系,在存活一年或更长时间的患者中,egfrviii的表达被认为是一个阴性预后指标,而与其他因素如切除范围和年龄无关(heimbergerab等人j transl med.2005oct 19;3:38.)。这一类型的突变是由egfr胞外域的外显子2-7(267个氨基酸)缺失引起的。egfrviii通过非受体依赖性的自身磷酸化及酪氨酸激酶活性,建立信号通路调控网,促进胶质母细胞瘤的恶性特征,包括细胞增殖、血管生成和侵袭。
5.非常重要的是,虽然egfrviii在肿瘤组织内部存在高度异质性,但其表达仅在肿瘤组织和肿瘤细胞中发现(moscatello dk等cancer res.1995dec 1;55(23):5536-9),因此,egfr/egfrviii被认为是胶质母细胞瘤靶向治疗的良好候选者。
6.由于血脑屏障(blood-brain barrier)的存在以及常规淋巴组织的缺失,中枢神经系统常被认为是免疫豁免区域,但近来有越来越多的数据证实白细胞可以在有血脑屏障的存在下进入中枢神经部位,恶性胶质瘤患者中的疫苗研究中也有阳性结果(aguilar等,curr treat options oncol 2012 13:437-450)。bullain 等人(j neurooncol.2009sep;94(3):373-82.)在2009年的一项实验中使用针对egfrviii的mr1鼠scfv 序列,构建egfrviii特异性第一代car,并证明了用mr1-ζ基因修饰的t细胞可以特异性识别表达
egfrviii的神经胶质瘤细胞系并抑制免疫缺陷小鼠模型中的颅内肿瘤生长。类似的在2010年,ohno 等人(cancer sci.2010dec;101(12):2518-24.)基于先前研究产生的小鼠单克隆抗体3c10,构建了针对 egfrviii的第一代car,发现car修饰的t细胞可以通过全身给药渗入颅内胶质瘤并延缓免疫缺陷小鼠的肿瘤生长。2012年,摩根等人(hum gene ther.2012oct;23(10):1043-53.)基于人的单抗构建了第三代抗egfrviii car,以cd28-41bb-cd3ζ作为t细胞信号传导结构域,在体外实验中该car可以特异性识别胶质瘤干细胞表达的egfrviii,并且不会攻击对照组或野生型egfr细胞系。在gbm模型小鼠中,egfrvⅲ靶向性car-t可以有效通过bbb到达肿瘤区,表现出抗肿瘤功效。诺华制药与宾夕法尼亚大学的o'rourke等人(sci transl med.2017jul 19;9(399):eaaa0984.,nct02209376)进行了 egfrvⅲ靶向性car-t的临床试验,在初次复发egfrvⅲ阳性的10例复发gbm患者中已证实了其安全性与可行性,研究中未观察到脱靶毒性或细胞因子释放综合征,尽管总生率没有显著改善,但进一步发现在输注car-t-egfrvⅲ后,肿瘤微环境的免疫抑制分子的表达显著上调,1例病人生存期达到18个月以上。
7.rindopepimut(也称为cdx-110)是一种针对egfrviii的肽类肿瘤疫苗,由与锁孔血蓝蛋白(klh) 偶联的egfrviii特异性肽组成。在随机、双盲的3期试验中招募了745名患者,而在最终的实验分析中rindopepimut这一肽类疫苗并没有增加新诊断的胶质母细胞瘤患者的生存率(weller m等lancetoncol.2017oct;18(10):1373-1385)。
8.双特异性t细胞桥(bite)由不同抗体的两个单链可变片段(scfv)组成;其中一个scfvs通过cd3与t细胞结合,另一个通过在肿瘤细胞表面表达的特定蛋白与肿瘤细胞结合。choi等人(proc natlacad sci u s a.2013jan 2;110(1):270-5.)发现靶向egfrviii的bite在体外展示出了使表达egfrviii 的神经胶质瘤细胞的抗原特异性裂解的特性。egfrviii靶向bite的全身给药可以提高脑内表达 egfrviii的胶质瘤小鼠的存活率,并以高达75%的比率实现持久的完全治愈。虽然临床前研究显示出有希望的结果,但目前暂时还没有将这些发现转化为人类病例上的研究。
9.利用抗体药物偶联物(adc)靶向肿瘤特异性抗原也是一种诱人的治疗策略.针对胶质瘤的 egfrviii的adc包括有abt-414,它是通过将抗微管剂单甲基auristatin f(mmaf)与针对egfr或突变型egfrviii的抗体连接起来,从而靶向癌细胞。philips ac等人(mol cancer ther.2016 apr;15(4):661-9.)的研究还表明,abt-414联合放疗和替莫唑胺显着抑制体内肿瘤生长。但在iii期研究中显示接受abt-414与标准治疗(放疗合并替莫唑胺)的患者相比使用安慰剂与标准治疗没有获得生存期方面的益处。
10.综上,市场上还没有一种对egfrviii有明显良好效果的药物,本领域仍需要能够准确靶向并高亲和力结合肿瘤细胞表面egfrviii,抑制肿瘤细胞高水平的egfr活化信号的抗体。
技术实现要素:
11.为了克服上述缺陷,本发明的目的是提供针对egfrviii的单域抗体及其衍生蛋白和应用,使用生物基因工程技术筛选出特异性针对egfrviii单域抗体,这些抗体初步亲和力明显,并且具有阻断特定细胞释放细胞因子,通过原核表达即具有良好的结合活性,具有一定的成药性。
12.本发明的第一方面,提供了针对egfrviii的单域抗体,所述的单域抗体由重链构成,重链包括重链cdr1、重链cdr2和重链cdr3;
13.所述的重链cdr1、重链cdr2和重链cdr3的氨基酸序列为下述(1)-(7)的一种:
14.(1)seqidno:40所示的cdr1,seqidno:46所示的cdr2,seqidno:52所示的cdr3;
15.(2)seqidno:40所示的cdr1,seqidno:46所示的cdr2,seqidno:53所示的cdr3;
16.(3)seqidno:41所示的cdr1,seqidno:48所示的cdr2,seqidno:54所示的cdr3;
17.(4)seqidno:43所示的cdr1,seqidno:49所示的cdr2,seqidno:51所示的cdr3;
18.(5)seqidno:40所示的cdr1,seqidno:47所示的cdr2,seqidno:52所示的cdr3;
19.(6)seqidno:40所示的cdr1,seqidno:44所示的cdr2,seqidno:52所示的cdr3;
20.(7)seqidno:42所示的cdr1,seqidno:45所示的cdr2,seqidno:50所示的cdr3。
21.以上(1)对应seqidno.1、seqidno.7-9,(2)对应seqidno.2,(3)对应seqidno.3,(4)对应seqidno.4,(5)对应seqidno.5,(6)对应seqidno.6,(7)对应seqidno.10。
22.即,所述的重链包括互补决定区cdr;所述互补决定区cdr包括重链cdr1、cdr2和cdr3的氨基酸序列。上述所有序列,可以替换为与该序列具有“至少80%同源性”的序列或仅一个或少数几个氨基酸替换的序列;优选为“至少85%同源性”,更优选为“至少90%同源性”,更优选为“至少95%同源性”,最优选为“至少98%同源性”。
23.在优选实施例中,所述的单域抗体的序列还包括框架区fr;所述框架区fr包括fr1、fr2、fr3和fr4的氨基酸序列;
24.所述的单域抗体的框架区fr的序列为下述(a)-(i)中的一种;
25.(a)seqidno:21所示的fr1,seqidno:26所示的fr2,seqidno:34所示的fr3,seqidno:39所示的fr4,或其变体,所述变体在所述fr中包含至多3个氨基酸的替换;
26.(b)seqidno:24所示的fr1,seqidno:31所示的fr2,seqidno:37所示的fr3,seqidno:38所示的fr4,或其变体,所述变体在所述fr中包含至多3个氨基酸的替换;
27.(c)seqidno:25所示的fr1,seqidno:30所示的fr2,seqidno:36所示的fr3,seqidno:39所示的fr4,或其变体,所述变体在所述fr中包含至多3个氨基酸的替换;
28.(d)seqidno:23所示的fr1,seqidno:27所示的fr2,seqidno:32所示的fr3,seqidno:39所示的fr4,或其变体,所述变体在所述fr中包含至多3个氨基酸的替换;
29.(e)seqidno:21所示的fr1,seqidno:28所示的fr2,seqidno:34所示的fr3,seqidno:39所示的fr4,或其变体,所述变体在所述fr中包含至多3个氨基酸的替换;
30.(f)seqidno:21所示的fr1,seqidno:27所示的fr2,seqidno:34所示的fr3,seqidno:39所示的fr4,或其变体,所述变体在所述fr中包含至多3个氨基酸的替换;
31.(g)seqidno:23所示的fr1,seqidno:27所示的fr2,seqidno:33所示的fr3,seqidno:39所示的fr4,或其变体,所述变体在所述fr中包含至多3个氨基酸的替换;
32.(h)seqidno:22所示的fr1,seqidno:26所示的fr2,seqidno:34所示的fr3,seqidno:39所示的fr4,或其变体,所述变体在所述fr中包含至多3个氨基酸的替换;
33.(i)seqidno:22所示的fr1,seqidno:29所示的fr2,seqidno:35所示的fr3,seqidno:38所示的fr4,或其变体,所述变体在所述fr中包含至多3个氨基酸的替换。
34.在一个实施方案中,所述针对egfrviii的单域抗体与选自seqidno:1-10的氨基酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%序列同源性,并且能够特异性结合egfrviii抗原。
35.在另一个优选实施例中,所述针对egfrviii的单域抗体与选自seqidno:1-10的氨基酸序列具有至少95%序列同源性,并且能够特异性结合egfrviii抗原。
36.本发明的第二方面是提供针对egfrviii的单域抗体,所述单域抗体分别如seqidno.1-10所示,或者所述单域抗体与seqidno.1-10的氨基酸序列具有至少95%序列同源性。
37.在一个实施方案中,编码所述针对egfrviii的单域抗体的核酸分子与选自seqidno:11-20的核苷酸序列具有至少90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、100%序列同源性,并且其编码的针对egfrviii单域抗体能够特异性结合egfrviii抗原。
38.优选的,所述单域抗体的编码序列分别如seqidno.11-20所示,或者与seqidno.11-20具有至少95%序列同源性。
39.本发明的第三方面是提供前述的针对egfrviii的单域抗体的fc融合抗体或人源化抗体。
40.本发明的第四个方面是提供编码前述的针对egfrviii单域抗体的核苷酸分子,其核苷酸序列分别如seqidno:11-20所示,或者与seqidno.11-20具有至少95%序列同源性。
41.本发明的第五个方面是提供一种表达载体,其包含编码前述的单域抗体或者前述的fc融合抗体的核苷酸分子或者前述的核苷酸分子。
42.本发明的第六个方面是提供一种宿主细胞,其可以表达出前述的针对egfrviii的单域抗体,或其包含前述的表达载体。
43.本发明还提供一种产生针对egfrviii的单域抗体或其fc融合抗体的方法,包括步骤:(a)在适合产生单域抗体或其fc融合抗体的条件下,培养前述的宿主细胞,从而获得含所述针对egfrviii单域抗体或其fc融合抗体的培养物;(b)从所述培养物中分离或回收所述的针对egfrviii单域抗体或其fc融合抗体;以及(c)任选地,纯化和/或修饰步骤(b)中获得的针对egfrviii单域抗体或其fc融合抗体。
44.本发明的第七个方面是提供一种药物组合物,所述药物组合物含有:(i)如前述的针对egfrviii的单域抗体、或前述的针对egfrviii的单域抗体的fc融合抗体;以及(ii)一种或几种药学上可接受的赋型剂。
45.本发明还提供针对egfrviii的单域抗体在制备对表面含有egfrviii蛋白的细胞进行内化的试剂中的应用,这里的试剂指针对egfrviii的单域抗体。
46.本发明还提供前述的针对egfrviii的单域抗体在制备抑制egfrviii基因表达的药物或抗肿瘤药物中的用途。抑制egfrviii基因表达的药物可适用于egfrviii基因高表达的任何病症。优选的,所述的肿瘤包括但不限于胶质瘤、小细胞肺癌、乳腺癌、膀胱癌。
47.本发明还提供前述的针对egfrviii的单域抗体、或前述的针对egfrviii的单域抗体的fc融合抗体的用途,用于制备试剂、检测板或试剂盒;其中,所述试剂、检测板或试剂盒用于:检测样品中 egfrviii蛋白的存在和/或含量。
48.所述的单域抗体为vhh,其仅包含抗体重链,不包含抗体轻链。
49.本发明使用生物基因工程技术筛选出特异性针对egfrviii的单域抗体,这些抗体初步亲和力明显,并且具有阻断特定细胞释放细胞因子,通过原核表达即具有良好的结合活性,具有一定的成药性,这些单域抗体具有以下优势:
50.(1)这些单域抗体的表达体系选择灵活,既可以再原核系统中表达也可以在酵母细胞或哺乳动物细胞的真核系统中表达,且其在原核表达系统中的表达成本低,可降低后期生产成本。
51.(2)由于单域抗体为单结构域抗体,所以其抗体的多组合形式改造更为简单,通过基因工程的方式简单的串联即可以获得多价、多特异性的抗体,并且其免疫异质性很低,在不经过人源化改造的情况下也不会产生较强的免疫反应。
52.(3)正如多篇文献报道的那样,单域抗体的亲和力范围更为宽泛,在未进行亲和力成熟之前,其亲和力范围可以从nm级别至pm级别,为后期不同用途的抗体提供多个选择。
附图说明
53.图1人源重组egfrviii蛋白sds-page分析图;
54.图2 vhh序列插入率分析;
55.图3靶向egfrviii淘选的文库富集情况;
56.图4 egfrviii靶点部分原核表达抗体sds-page;
57.图5 egfrviii靶点抗体抗原结合活性;
58.图6 egfrviii靶点抗体内化检测(流式细胞术),其中4、37分别是指4℃、37℃的实验条件。
具体实施方式
59.下面结合实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
60.单域抗体(sdab,也被研发者ablynx称为纳米抗体或vhh)是本领域技术人员公知的。单域抗体为其互补决定区是单域多肽的一部分的抗体。因此,单域抗体包含单个互补决定区(单个cdr1、单个 cdr2和单个cdr3)。单域抗体的实例为仅有重链的抗体(该抗体天然不包含轻链)、衍生自常规抗体的单域抗体和工程化抗体。
61.单域抗体可以衍生自任何物种,包括小鼠、人、骆驼、美洲驼、山羊、兔和牛。例如,天然存在的vhh分子可以衍生自骆驼科物种(例如骆驼、单峰骆驼、美洲驼和原驼)提供的抗体。像完整的抗体一样,单域抗体能够选择性地结合特定抗原。单域抗体可以仅含有免疫球蛋白链的可变结构域,该结构域具有cdr1、cdr2和cdr3以及框架区。
62.如本文所用,术语“序列同源性”表示两个(核苷酸或氨基酸)序列在比对中在相同位置处具有相同残基的程度,并且通常表示为百分数。优选地,同源性在被比较的序列的整体长度上确定。因此,具有完全相同序列的两个拷贝具有100%同源性。
63.本发明中,与本发明公开的cdr1-3的序列同源性高的序列,也可以得到针对egfrviii的纳米抗体。在一些实施例中,与(1)-(7)中的序列具有“至少80%同源性”的序列,或者“至少85%同源性”、“至少90%同源性”、“至少95%同源性”、“至少98%同源性”的序列都可以实现发明目的(即衍生蛋白)。
64.在一些实施例中,与seq id no:1-10中的序列相比仅仅替换一个或少数几个氨基酸的序列,例如,包含1、2、3、4、5、6、7、8、9或10个保守氨基酸取代,也可以实现发明目的。实际上,在确定两个氨基酸序列之间的序列同源性程度或在确定单域抗体中的cdr1、cdr2和cdr3组合时,技术人员可以考虑所谓的“保守”氨基酸取代,在取代情况下,所述取代将优选为保守氨基酸取代,所述保守氨基酸,其通常可以被描述为氨基酸残基被具有相似化学结构的另一个氨基酸残基替代的氨基酸取代,并且该取代对多肽的功能、活性或其它生物学性质几乎没有或基本上没有影响。所述保守氨基酸取代在本领域是通用的,例如保守氨基酸取代是以下(a)-(d)组内的一个或少数几个氨基酸被同一组内另一个或少数几个氨基酸所取代:(a)极性带负电残基及其不带电酰胺:asp、asn、glu、gln; (b)极性带正电残基:his、arg、lys;(c)芳香族残基:phe、trp、tyr;(d)脂肪族非极性或弱极性残基:ala、ser、thr、gly、pro、met、leu、ile、val、cys。特别优选的保守氨基酸取代如下:asp 被glu取代;asn被gln或his取代;glu被asp取代;gln被asn取代;his被asn或gln取代;arg 被lys取代;lys被arg、gln取代;phe被met、leu、tyr取代;trp被tyr取代;tyr被phe、trp取代;ala被gly或ser取代;ser被thr取代;thr被ser取代;gly被ala或pro取代;met被leu、 tyr或ile取代;leu被ile或val取代;ile被leu或val取代;val被ile或leu取代;cys被ser取代。另外,本领域技术人员知晓,单域抗体的创造性体现在cdr1-3区,而框架区序列fr1-4并非是不可改变的,fr1-4的序列可以采取本发明公开的序列的保守序列变体。
65.本发明的优选宿主细胞为细菌细胞、真菌细胞或哺乳动物细胞。
66.本专利是通过基因工程技术制备目标蛋白以及目标蛋白的截短体形式,然后将获得的抗原蛋白免疫内蒙古阿拉善双峰驼,通过多次免疫后,获得骆驼的外周血淋巴细胞或者脾细胞,通过基因工程的方式,将驼源抗体可变区编码序列重组到噬菌体展示载体中,通过噬菌体展示技术筛选出针对抗原蛋白的特异性抗体,并进一步检测其与抗原结合的能力以及在包括自身免疫疾病治疗中的应用。
67.现将上述技术方案拆分详解,以具体实施例的方式描述:
68.实施例1:人源egfrviii重组胞外结构域蛋白的制备:
69.本专利中用到的人源重组胞外结构域蛋白为公司自己表达纯化获得,人源重组egfrviii蛋白的表达载体设计方案具体如下:
70.(1)在ncbi中检索获得egfrviii的编码序列,其收录号为nm_005228.4,该序列编码产生的氨基酸序列登录号为np_001333870.1。
71.(2)分别通过tmhmm和smart网站对np_001333870.1对应的氨基酸序列进行蛋白跨膜区和胞外端的分析。
72.(3)分析结果显示egfrviii蛋白的胞外端为1-378位氨基酸,其中1-25位为该蛋白
的信号肽。
73.(4)利用基因合成的方式将编码egfrviii蛋白的1-378位氨基酸的核苷酸序列克隆到载体 pcdna3.4中。
74.(5)将构建好的载体进行sanger测序,比对原始序列,确认无误后,将该重组质粒进行批量抽提,去除内毒素,转染悬浮293f进行目的蛋白的表达、纯化,纯化后egfrviii重组蛋白的sds-page 分析结果如图1所示,纯化后的蛋白纯度高达90%,满足动物免疫的需求。
75.实施例2:针对egfrviii蛋白的单域抗体文库的构建:
76.将1mg实施例1中纯化获得的人源重组egfrviii蛋白与等体积的弗氏完全佐剂混合,免疫一只内蒙古阿拉善双峰驼,每周免疫一次,共连续免疫7次,除首次免疫外,其余六次均是用1mg egfrviii 蛋白与弗氏不完全佐剂等体积混合进行动物免疫,该免疫过程是为了集中刺激骆驼使其产生针对 egfrviii蛋白的抗体。
77.动物免疫结束后,抽取骆驼外周血淋巴细胞150ml,并提取细胞的rna。利用提取的总rna合成cdna,并通过套式pcr反应以cdna为模板扩增vhh(抗体重链可变区)。
78.然后利用限制性内切酶分别酶切pmecs载体和vhh片段,然后将酶切后的片段和载体链接。将连接后的片段电转化至感受态细胞tg1中,构建egfrviii蛋白的噬菌体展示文库并测定库容,文库的库容大小约为1
×
109,同时,通过菌落pcr鉴定检测文库在目的片段的正确插入率,结果如图2所示。
79.结果显示,从文库中随机挑选的30个菌落进行pcr扩增后,有28个克隆可以扩增出大小为 600bp(预测大小)的条带,有2个克隆扩增出条带不正确,故正确插入率为28
÷
30
×
100%≈93.3%。
80.实施例3:针对egfrviii蛋白的单域抗体筛选:
81.取200μl实施例2中的重组tg1细胞至2
×
ty培养基中培养,期间加入40μl辅助噬菌体vcsm13 侵染tg1细胞,并培养过夜以扩增噬菌体,次日利用peg/nacl沉淀噬菌体,离心收集扩增噬菌体。
82.将稀释在100mm ph8.3的nahco3中的egfrviii蛋白500μg偶联在酶标板上,4℃放置过夜,同时设立阴性对照孔;第二天加入200μl的3%的脱脂乳,室温封闭2h;封闭结束后,加入100μl扩增后噬菌体文库(大约2
×
10
11
个噬菌体颗粒),室温作用1h;作用1小时后,用pbs+0.05%tween-20洗 15遍,以洗掉未结合的噬菌体。
83.用终浓度为25mg/ml的胰蛋白酶将与egfrviii蛋白特异性结合的噬菌体解离下,并感染处于对数生长期的大肠杆菌tg1细胞,37℃培养1h,产生并收集噬菌体用于下一轮的筛选,相同筛选过程重复1轮,逐步得到富集,当富集倍数达到10倍以上时,富集效果如图3所示。
84.图3中,p/n=生物淘选中阳性孔洗脱下的噬菌体感染tg1细菌后生长的单克隆细菌数/阳性孔洗脱下的噬菌体感染tg1细菌后生长的单克隆细菌数,该参数在富集发生后会逐渐增大;i/e=生物淘选中每轮加入阳性孔的噬菌体总量/生物淘选中每轮从阳性孔洗脱出的噬菌体总量,该参数在富集发生后会逐渐趋近于1。
85.实施例4:用噬菌体的酶联免疫方法(elisa)筛选针对egfrviii的特异性阳性克隆:
86.根据上述实施例3中的筛选方法对抗egfrviii蛋白的单域抗体进行3轮筛选,抗egfrviii蛋白的噬菌体富集因子达到10以上,筛选结束后,从筛选获得的阳性克隆中挑选384个单菌落分别接种于含100μg/ml氨苄青霉素的2
×
ty培养基的96深孔板中,并设置空白对照,37℃培养至对数期后,加入终浓度为1mm的iptg,28℃培养过夜。
87.利用渗透涨破法获得粗提抗体;将egfrviii重组蛋白分别释至100mm ph8.3的nahco3中并将 100μg蛋白在酶标板(elisa板)中4℃包被过夜。将获得的抗体粗提液取100ul转移至加入抗原的elisa 板上,室温孵育1h;用pbst洗去未结合的抗体,加入100μl经1:2000稀释后的mouse anti-ha tagantibody(hrp)(鼠抗ha辣根过氧化物酶标记抗体,thermo fisher),在室温孵育1h;用pbst洗去未结合的抗体,加入辣根过氧化物酶显色液,37℃下反应15min后,加入终止液,于酶标仪上450nm 波长处,读取吸收值。
88.当样品孔od值大于对照孔5倍以上时,判定为阳性克隆孔;将阳性克隆孔的菌转摇在含有100 μg/ml氨苄青霉素的lb培养基中以便提取质粒并进行测序。
89.根据序列比对软件vectornti分析各个克隆株的基因序列,把cdr1,cdr2和cdr3序列相同的株视为同一克隆株,而序列不同的株视为不同克隆株,最终获得特异性针对egfrviii蛋白的单域抗体 (seq id no.1-10,以及未示出序列的单域抗体2g1、2c9、2f3、3e11、3c11、2c2、1a8、1c3)。
90.其抗体的氨基酸序列为fr1-cdr1-fr2-cdr2-fr3-cdr3-fr4结构,构成整个vhh。获得的单域抗体重组质粒可以在原核系统中进行表达,最终获得单域抗体蛋白。
91.10种单域抗体的cdr、fr序列如表1所示,4种单域抗体的氨基酸序列如表2所示。
92.表1 10种单域抗体的cdr、fr序列
[0093][0094][0095]
[0096][0097]
表2 10种单域抗体的氨基酸序列
[0098][0099]
实施例5:egfrviii蛋白的特异性单域抗体在宿主菌大肠杆菌中的纯化及表达
[0100]
将实施例4中测序分析所获得不同克隆株的质粒(pmecs-vhh)电转化到大肠杆菌hb2151中,并将其涂布在lb+amp+glucose即含有氨苄青霉素和葡萄糖的培养平板上,37℃培养过夜;挑选单个菌落接种在5ml含有岸边青霉素的lb培养液中,37℃摇床培养过夜。
[0101]
接种1ml的过夜培养菌种至330mltb培养液中,37℃摇床培养,培养到od600nm值达到0.6-0.9 时,加入1m iptg,28℃摇床培养过夜;离心,收集大肠杆菌,利用渗透涨破法,获得抗体粗提液;
[0102]
通过镍柱亲和层析法纯化出抗体,纯化后的单域抗体,包括vhh1~18,如图4所示。图4中, vhh1-10依次与单域抗体1b1、1e7、2c7、2c12、3a12、3b3、3b10、4a8、4b4、4f7分别对应。vhh11-18(未在图4中示出)依次对应于克隆2g1、2c 9、2f3、3e11、3c11、2c2、1a8、1c3(序列未示出,为技术效果不够好或者无需在本发明申请中予以保护的单域抗体)。
[0103]
实施例6:egfrviii蛋白的特异性单域抗体的fc融合抗体真核表达载体的构建
[0104]
(1)将实施例4中获得的目标序列亚克隆至真核表达载体中:将实施例4中筛选出来的抗体经sanger测序得到其核苷酸序列;
[0105]
(2)通过序列合成的方式将密码子优化后的上述核苷酸序列(seq id no.11-20)合成至本公司设计改造的载体rjk-v4-hfc中,该载体的改造方法如实施例10所述;
[0106]
(3)将公司构建好的重组真核表达载体转化至dh5α大肠杆菌中,培养进行质粒大提,去除内毒素;
[0107]
(4)将大提后的质粒再进行序列测序鉴定;
[0108]
(5)将确定无误后的重组载体准备后续真核细胞转染表达,后续真核细胞转染表达指:通过实施例7或8的方法将vhh的fc蛋白表达后并通过实施例9的方法纯化上述抗体。
[0109]
实施例7:egfrviii蛋白的特异性单域抗体的fc融合抗体在悬浮expicho-s细胞中表达
[0110]
(1)转染前3天以2.5
×
105/ml细胞传代和扩大培养expicho-s
tm
细胞,计算出的所需的细胞体积转移至装有新鲜的已预热的120ml(终体积)的expicho
tm
表达培养基的500ml摇瓶中;使细胞浓度达到约4
×
10
6-6
×
106活细胞/ml;
[0111]
(2)在转染前一天,将expicho-s
tm
细胞稀释浓度至3.5
×
106活细胞/ml,使细胞过夜培养;
[0112]
(3)转染当天,测定细胞密度和活细胞百分比。转染之前细胞密度应达到约7
×
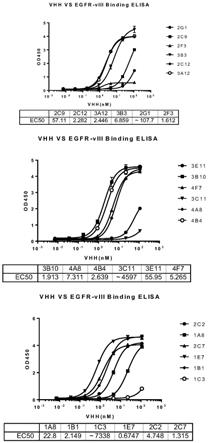
10
6-10
×
106活细胞/ml;
[0113]
(4)用预热至37℃新鲜的expicho
tm
表达培养基将细胞稀释至6
×
106个活细胞/ml。计算出的所需的细胞体积转移至装有新鲜的已预热的100ml(终体积)的expicho
tm
表达培养基的500ml 摇瓶中;
[0114]
(5)使轻轻颠倒混匀expifectamine
tm
cho试剂,用3.7ml optipro
tm
培养基稀释 expifectamine
tm
cho试剂,回荡或混匀;
[0115]
(6)用冷藏的4ml optipro
tm
培养基稀释质粒dna,回荡混匀;所述的质粒dna为实施例 6制得的egfrviii蛋白的特异性单域抗体的fc融合抗体真核表达载体;
[0116]
(7)将expifectamine cho/质粒dna复合物室温孵育1-5分钟,然后轻轻加入制备的细胞悬液中,加入过程中轻轻回荡摇瓶;
[0117]
(8)将细胞在37℃、8%co2、加湿的空气中震荡培养;
[0118]
(9)转染后第1天(18-22小时后)添加600ul expifectamine
tm
cho enhancer和24ml expichofeed。
[0119]
(10)在转染后约8天(细胞活率低于70%)收集上清。
[0120]
实施例8:egfrviii蛋白的特异性单域抗体的fc融合抗体在悬浮293f细胞中的表达
[0121]
重组单域抗体表达实验流程(以500ml摇瓶为例):
[0122]
(1)转染前3天以2.5
×
105/ml细胞传代和扩大培养293f细胞,计算出的所需的细胞体积转移至装有新鲜的已预热的120ml(终体积)的opm-293cd05 medium培养基的500ml摇瓶中。使细胞浓度达到约2
×
10
6-3
×
106活细胞/ml。
[0123]
(2)转染当天,测定细胞密度和活细胞百分比。转染之前细胞密度应达到约2
×
10
6-3
×
106活细胞/ml。
[0124]
(3)用预热的opm-293cd05 medium将细胞稀释至1
×
106个活细胞/ml。计算出所需的细胞体积转移至装有新鲜的已预热的100ml(终体积)的培养基的500ml摇瓶中。
[0125]
(4)用4ml opti-mem培养基稀释pei(1mg/ml)试剂,回荡或吹打混匀;用4ml opt-mem 培养基稀释质粒dna,回荡混匀,并用0.22um的滤头过滤。室温孵育5min。
[0126]
(5)将稀释的pei试剂加入稀释的dna中,颠倒混匀。将pei/质粒dna复合物室温孵育15-20 分钟,然后轻轻加入制备的细胞悬液中,加入过程中轻轻回荡摇瓶。
[0127]
(6)将细胞在37℃、5%co2、120rpm震荡培养。
[0128]
(7)转染后第24h、72h添加5ml opm-cho pff05补料。
[0129]
(8)在转染后约7天(细胞活率低于70%)收集上清。
[0130]
实施例9:人源fc重组单域抗体的纯化
[0131]
(1)将实施例7或8中获得蛋白表达上清用0.45μm的一次性滤头过滤除掉不可溶杂质;
[0132]
(2)将上述滤液使用蛋白纯化仪进行亲和层析纯化,利用人源fc与protein a结合的能力,使用偶联protein a的琼脂糖填料进行纯化;
[0133]
(3)将滤液通过1ml/分钟的流速流穿protein a预装柱,该步骤中滤液中的目标蛋白会与填料结合;
[0134]
(4)通过低盐和高盐缓冲液将柱上结合的杂质蛋白洗涤;
[0135]
(5)用低ph缓冲液将柱上结合的目标蛋白进行系统;
[0136]
(6)将洗脱液迅速加入ph9.0的tris-hcl溶液,进行中和;
[0137]
(7)将上述中和后的蛋白溶液透析后,进行sds-page分析,确定蛋白纯度在95%以上,且浓度在0.5mg/ml以上后,低温保存备用。
[0138]
实施例10:纳米抗体真核表达载体rjk-v4-hfc的构建
[0139]
所提及纳米抗体通用的目标载体rjk-v4-hfc,为本公司在invitrogen商业化载体pcdna3.4(载体资料链接:
[0140]
https://assets.thermofisher.com/tfs-assets/lsg/manuals/pcdna3_4_topo_ta_cloning_kit_man.pdf)的基础上融合了人源igg的重链编码序列(ncbi accession no.:ab776838.1)中的fc区段后改造而来的,即该载体包含了igg重链的铰链区(hinge)ch2和ch3区。具体改造方案如下:
[0141]
(1)选取pcdna3.4上的限制性酶切位点xbai和agei;
[0142]
(2)在fc片段编码序列的5’端和3’端通过重叠pcr的方式分别引入多克隆位点(mcs, multiple cloning site)和6
×
his标签;
[0143]
(3)使用分别带有xbai和agei酶切位点的一对引物通过pcr的方式将上述片段扩增;
[0144]
(4)使用限制性内切酶xbai和agei分别酶切pcdna3.4和(3)中的重组dna片段;
[0145]
(5)将酶切后的载体和插入片段在t4连接酶的作用下连接,然后将连接产物转化至大肠杆菌,扩增,测序核实,获得重组质粒。
[0146]
实施例11:针对egfrviii的单域抗体的人源化
[0147]
人源化方法采用本公司自主开发的基于噬菌体展示技术的纳米抗体人源化平台完成。
[0148]
人源化步骤为:
[0149]
(1)分别建立人源抗体及驼源抗体重链可变区氨基酸序列数据库;
[0150]
(2)综合比较人源抗体及驼源抗体fr区各氨基酸位点的差异性,并在各fr区的各不同氨基酸位点做氨基酸种类及比例的统计;
[0151]
(3)根据各位点氨基酸的种类及比例差异,插入该序列的cdr区进行文库的合成或者计算机模拟同源建模;
[0152]
(4)对针该序列的合成文库和同源建模数据进行筛选,挑选出人源化位点最多且亲和力和功能较优的克隆,即为最优人源化vhh。
[0153]
实施例12:egfrviii蛋白的特异性单域抗体的结合量效曲线测定
[0154]
(1)包被50μl 1μg/ml egfrviii,4℃过夜。
[0155]
(2)洗板;加入200μl5%牛奶,37℃封闭1h。
[0156]
(3)将vhh(实施例5中经原核表达制得的针对egfrviii蛋白的特异性单域抗体)稀释至 2μg/ml,然后5倍梯度稀释抗体共8个浓度梯度。
[0157]
(4)洗板;加入50μl经步骤(3)稀释的抗体,两复孔,37℃孵育1h。
[0158]
(5)洗板;加入50μl鼠抗ha标签hrp二抗,37℃孵育30min。
[0159]
(6)洗板(多洗几次);加入50μl预先恢复常温的tmb,避光常温反应15min。
[0160]
(7)加入50μl终止液(1n hcl),酶标仪读数保存。
[0161]
(8)绘制曲线,计算ec50,如图5和表3所示,可见本发明的10种单域抗体与egfrviii 蛋白的结合力佳。
[0162]
表3单域抗体的ec50值
[0163] 2c92c123a123b32g12f3ec5057.112.2822.4466.859~107.71.612
[0164] 3b104a84b43c113e114f7ec501.9137.3112.639~459755.955.265
[0165] 1a81b11c31e72c22c7ec5022.82.149~73380.67474.7481.315
[0166]
实施例13:靶向人源egfrviii的工具抗体(tool antibody,tab)的表达和纯化tab1(2173) 序列来自专利us10308717b2。
[0167]
(1)将搜索到的序列委托通用生物系统(安徽)有限公司进行哺乳动物细胞表达系统密码子优化,并克隆至pcdna3.1载体。
[0168]
(2)经过抗性筛选,选择质粒阳性菌扩增,使用质粒中提试剂盒(machereynagel, cat#740412.50)抽提质粒。
[0169]
(3)按照每100ml细胞加入100μg质粒(40μg重链+60μg轻链),使用pei在293f细胞(培养基:freestyle 293expression medium,thermo,cat#12338026+f-68,thermo,cat#24040032)中瞬转表达;
[0170]
(4)转染6~24h后加入5%体积的10%peptone(sigma,cat#p0521-100g),8%co2 130rpm培养约7~8天;
[0171]
(5)细胞活率降至50%时收取表达上清,使用proteina(ge,cat#17-5438-02)重力
柱纯化;
[0172]
(6)pbs透析后,使用nanodrop测定浓度,sec鉴定纯度,间接elisa验证结合能力;
[0173]
(7)通过本方法获得的tab1,浓度不小于2mg/ml,纯度大于94%,与egfrviii(acrocot#egi-h52h4)结合的ec50约为0.38nm。
[0174]
实施例14:特异性针对egfrviii的单域抗体在hek293-egfrviii细胞上的内化作用
[0175]
hek293-egfrviii是由慢病毒法构建的egfrviii高表达稳定细胞系
[0176]
(1)将复苏后传代3-4代的hek293-egfrviii细胞用pbs洗后分别按500000个每孔铺入96 孔板;
[0177]
(2)将phrodo标记的tab1、higg和单域抗体配制为10μg/ml的溶液;higg指同型对照,不与任何靶标结合的免疫球蛋白分子,通过商品化购买得到。tab1由实施例13制得(即图6中的tab)。这里的单域抗体为实施例8制得的egfrviii蛋白的特异性单域抗体的fc融合抗体经实施例9纯化而得;
[0178]
(3)将hek293-egfrviii细胞悬液离心后用上述配制好的抗体溶液重悬,设置冰上组和37℃组,在各自温度下孵育4h;
[0179]
(4)将上步骤中的混合液用流式细胞仪读取荧光值;
[0180]
(5)根据荧光强度分析结果,计算37℃样品/冰上样品,比值越大,内化程度越高,结果如图 6所示,可见本发明的10种单域抗体对hek293-egfrviii细胞有较强的内化作用。
[0181]
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节。
