一种来源于生菜的叶绿体转运肽lsa3084及其应用
技术领域
1.本发明属于生物技术领域,具体涉及一种来源于生菜的叶绿体转运肽lsa3084及其应用。
背景技术:
2.原始蓝藻和变形菌与真核生物的内共生产生了植物细胞中的质体和线粒体。质体是一类细胞器的统称,广泛存在于植物细胞中,根据所含有的色素不同可以分为黄色、红色和橙色的有色体,无色的白色体,绿色的叶绿体以及黄花幼苗中的黄化质体等。 在植物幼年的细胞中,尚未分化成熟的质体称为前质体,随着细胞的长大,前质体逐渐分化为成熟的质体。为了适应不同的化境,质体分别在不同的细胞中完成不同的功能。
3.质体中最引人关注的是叶绿体。叶绿体首先由ris和plau在衣藻中发现,是植物细胞和真核藻类中进行光合作用的细胞器。除了在光合作用和co2固定中发挥重要作用外,叶绿体还参与叶绿素、类胡萝卜素、脂肪酸、一些氨基酸、淀粉和蛋白质的合成。叶绿体是结构复杂的细胞器,由内外两层膜包围。叶绿体还显示出第三个内部膜,称为类囊体膜。膜系统产生三个隔间:膜间空间、基质和类囊体腔。转录和翻译过程和代谢反应,如卡尔文循环,发生在基质中。光合作用发生在类囊体腔内,伴随着nadph、atp和氧气的产生。
4.叶绿体基因组只编码大约100个蛋白质,大量在叶绿体中起作用的蛋白质在细胞质中合成,蛋白必须在翻译过程中或翻译后从细胞质导入,进入叶绿体中加工成成熟的蛋白质进而发挥作用。
5.转运肽(transit peptide),是一种12~60个氨基酸残基的前导序列,它引导在细胞溶质中合成的蛋白质输入线粒体和叶绿体。以叶绿体表达为目标的前体蛋白质包含被称作叶绿体转运肽(chloroplast transit peptides,ctps)的n-末端延伸。这些靶向肽有助于将蛋白质前体引导到叶绿体表面,在那里它们被外膜的toc进口机制的受体识别,介导前体蛋白穿过叶绿体膜并被运送至叶绿体内的各种亚级结构。叶绿体转运肽对于前体蛋白进入叶绿体中至关重要。
6.目前,越来越多的证据表明,利用转运肽通过生物工程技术可改善作物的光合作用、抗病性、抗逆性和产量等性状,对解决世界粮食问题具有重要意义。如van den broeck等人1985年通过将豌豆(pisum sativum)核酮糖-1,5-二磷酸羧化酶/加氧酶(rubisco)小亚基连接到npt-ii的n端,成功地将细菌新霉素磷酸化酶ii (npt-ii)运输到烟草叶绿体中。利用叶绿体转运肽将外源病虫r
é
sistance基因转化到叶绿体中,增强了转基因植物抗病虫能力。li等将来自水稻的rubisco ctp与β-glucuronidase(gus)融合转化为水稻,发现与不含ctp的水稻相比,含有rubisco ctp的水稻植株gus蛋白表达量增加了约4.2倍。
7.然而,转运肽的结构是高度多样化的,缺乏一致的序列基序。因此,这样的多样性如何支持精确的蛋白质输入到叶绿体以及如何确定转运肽的输入特异性仍然是亟待解决的问题。
技术实现要素:
8.本发明的一个目的是提供一种转运肽。
9.本发明提供的转运肽来源于生菜,名称为lsa3084,所述lsa3084转运肽为a1)或a2)所示的蛋白质:a1)氨基酸序列是序列2所示的蛋白质;a2)在序列2所示的蛋白质的n端或/和c端连接标签得到的融合蛋白质。
10.上述a2)所述的蛋白质中,所述标签是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪和/或纯化。所述标签可为flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
11.上述a1)或a2)所述的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
12.本发明的另一个目的是提供与lsa3084转运肽相关的生物材料。
13.本发明提供的与lsa3084转运肽相关的生物材料为下述a1)至a8)中的任一种:a1)编码lsa3084转运肽的核酸分子;a2)含有a1)所述核酸分子的表达盒;a3)含有a1)所述核酸分子的重组载体;a4)含有a2)所述表达盒的重组载体;a5)含有a1)所述核酸分子的重组微生物;a6)含有a2)所述表达盒的重组微生物;a7)含有a3)所述重组载体的重组微生物;a8)含有a4)所述重组载体的重组微生物。
14.上述生物材料中,a1)所述核酸分子为如下1)或2)所示的基因:1)其编码序列是序列1所示的dna分子;2)与1)限定的核苷酸序列具有75%或75%以上同一性,且编码lsa3084转运肽的dna分子。
15.本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码lsa3084转运肽的核苷酸序列进行突变。那些经过人工修饰的,具有编码lsa3084转运肽的核苷酸序列75%或者更高同一性的核苷酸,只要编码lsa3084转运肽且具有相同功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
16.这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码序列2所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
17.上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。
18.本发明还有一个目的是提供上述lsa3084转运肽或与其相关的生物材料的新用途。
19.本发明提供了上述lsa3084转运肽或与其相关的生物材料在将目的蛋白定位于叶绿体中的应用。
20.本发明还提供了上述lsa3084转运肽或与其相关的生物材料在将目的蛋白引导至叶绿体中的应用。
21.本发明还提供了上述lsa3084转运肽或与其相关的生物材料在叶绿体遗传转化中的应用。
22.本发明还有一个目的是提供一种将目的蛋白定位于叶绿体的方法。
23.本发明提供的将目的蛋白定位于叶绿体的方法包括如下步骤:在受体植物中将上述转运肽和目的蛋白进行融合表达,进而使所述目的蛋白定位于所述受体植物的叶绿体中。
24.上述方法中,所述lsa3084转运肽融合在所述目的蛋白的氨基端。
25.进一步的,所述在受体植物中将lsa3084转运肽和目的蛋白进行融合表达的方法为将由lsa3084转运肽和目的蛋白融合而成的融合蛋白的编码基因导入受体植物。
26.更进一步的,所述融合蛋白的编码基因通过重组表达载体导入受体植物。
27.所述重组表达载体含有依次由编码lsa3084转运肽的核酸分子和编码目的蛋白的核酸分子组成的dna片段。
28.所述融合蛋白的编码基因通过重组表达载体导入受体植物的方法包括如下步骤:将所述重组表达载体导入农杆菌中,得到重组菌;用所述重组菌侵染受体植物,实现受体植物瞬时转化。
29.所述重组菌侵染受体植物的方法可为注射法。
30.所述编码lsa3084转运肽的核酸分子为序列1所示的dna分子。
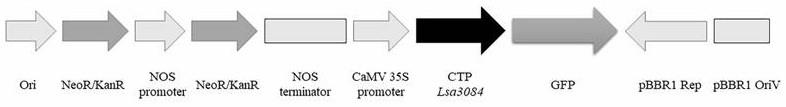
31.在本发明的具体实施例中,所述重组载体为pyba1132-lsa3084-gfp,所述重组载体pyba1132-lsa3084-gfp为将载体pyba1132(该载体包括184 bp nos promoter,795 bp neor/kanr,253 bp nos terminator和346 bp camv 35s promoter)的xbai和sali酶切位点间的dna分子替换为序列1所示的dna分子,且保持载体pyba1132的其他序列不变后得到的载体。
32.本发明最后一个目的是提供一种融合蛋白或其相关生物材料;所述融合蛋白为由lsa3084转运肽和目的蛋白融合而成的融合蛋白;所述生物材料为编码所述融合蛋白的核酸分子或含有所述核酸分子的表达盒或重组载体或重组微生物。
33.上述方法或上述融合蛋白或其相关生物材料在叶绿体遗传转化中的应用也属于本发明的保护范围。
34.上述任一所述方法或应用中,所述目的蛋白可为现有技术中任意一种蛋白质,具体为gfp荧光蛋白。
35.上述任一所述方法或应用中,所述植物为含有叶绿体的植物。在本发明的具体实施例中,所述植物为烟草(如本生烟草)。
36.本发明提供了一种来源于生菜的lsa3084转运肽,并将其编码基因与目的基因gfp进行融合,在烟草中进行瞬时表达观察叶绿体gfp荧光信号,结果发现在目的蛋白gfp氨基端连接lsa3084转运肽后,可将gfp信号定位在叶绿体。本发明为叶绿体遗传转化提供了一种新的思路。
附图说明
37.图1为pyba1132-lsa3084-gfp质粒的结构示意图。
38.图2为转基因烟草kan的pcr验证。泳道1是marker,泳道2-13是kan f/r引物验证结果。
39.图3为转基因烟草(pyba1132-gfp)的原生质体明场(a)、叶绿素荧光(b)、gfp荧光(c)、all(d)。
40.图4为转基因烟草(pyba1132-lsa3084-gfp)的原生质体明场(a)、叶绿素荧光(b)、gfp荧光(c)、all(d)。
具体实施方式
41.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
42.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
43.下述实施例中的生菜品种为美国大速生,记载于文献“薛国萍,姜伟,杜金伟,付崇毅,白红梅,杜刚强,朱春侠,皇甫九茹.不同营养液配方对生菜生长发育的影响[j].北方农业学报,2019,47(01):126-129.”中,公众可从北京市农林科学院获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。下述实施例中的2yt培养液的制备方法如下:先将胰蛋白胨16g、酵母提取物10g、nacl 5g与1l蒸馏水混匀,然后于121℃,20min灭菌后冷却至室温使用,保存于4℃冰箱。
[0044]
下述实施例中的酶解液的制备方法如下:先将如下组分混匀:1.25% celluase r10 0.1875g、0.3% macerozyme r10 0.045g、0.4m mannitol 7.5ml、20mm kcl 1.5ml、20mm mes(ph5.7)1.5ml,然后55℃水浴10min,再冷却至室温后加入10mm cacl2 0.15ml和0.1% bsa 0.015g,最后用水补足总体积至15ml。
[0045]
实施例1、lsa3084转运肽的克隆1、总rna的提取取100mg一月生生菜苗为实验材料,使用诺唯赞rna提取试剂盒(rc401)提取总rna。
[0046]
2、cdna的获得使用诺唯赞反转录试剂盒(r312)将步骤1提取的总rna反转录成cdna。
[0047]
3、pcr扩增以步骤2获得的cdna为模板,采用m-3084-f和m-3084-r引物进行pcr扩增,得到pcr产物。引物序列如下:m-3084-f:gctctagaatggcggcggcggcctcttctt(下划线所示序列为xbai酶切位点);m-3084-r:acgcgtcgacgccatcgtctttcttggtgaagcaa(下划线所示序列为sali酶切位点)。
[0048]
pcr扩增体系(总体积为50μl)如下:cdna 3μl,m-3084-f(10μm) 2μl,m-3084-r(10μm)2μl,ddh2o 18μl,kod onetm pcr master mix-blue(kmm-201)25μl。
[0049]
pcr反应条件如下:98℃预变性3min,然后98℃变性10s,55℃退火5s,68℃延伸5s,35个循环,最后68℃延伸5min,反应完后保持在8℃,使用1%琼脂糖胶进行电泳,回收相应条带(转运肽片段)。
[0050]
4、pcr产物测序对步骤3获得的pcr产物进行测序,测序结果表明:pcr产物的核苷酸序列包含序列表中序列1所示的dna分子,并将其命名为lsa3084基因,该基因编码的lsa3084蛋白质的氨基酸序列如序列表中序列2所示。
[0051]
实施例2、lsa3084转运肽在将目的蛋白定位于叶绿体中的应用一、载体的构建1、酶切使用xbai酶和sali酶分别对实施例1获得的转运肽片段以及载体pyba1132(购自上海禾午生物科技有限公司,货号为p8514)进行切割,然后将切割产物进行回收,得到酶切后各片段产物。
[0052]
酶切体系(总体积为50μl)如下:xbai酶和sali酶各1μl,cutsmart 5μl,核酸片段43μl。
[0053]
酶切反应程序为37℃ 2h,65℃ 20min。
[0054]
2、连接使用t4连接酶对步骤1获得的各酶切产物片段进行连接,得到重组载体。
[0055]
连接反应体系(总体积为10μl)如下:t4连接酶0.5μl,t4 buffer 1μl,转运肽片段7.5μl,载体片段1μl。
[0056]
连接反应条件如下:室温1h。
[0057]
3、鉴定将重组载体转化至e.coli dh5α感受态细胞,然后涂于含有卡那霉素抗性的2yt培养皿上,37℃过夜培养。挑取单克隆,提取质粒,经过测序验证,得到重组质粒,并将测序结果正确的质粒命名为pyba1132-lsa3084-gfp。
[0058]
pyba1132-lsa3084-gfp为将载体pyba1132的xbai和sali酶切位点间的dna分子替换为序列1所示的dna分子,且保持载体pyba1132的其他序列不变后得到的载体。pyba1132-lsa3084-gfp表达由lsa3084转运肽和gfp蛋白融合而成的融合蛋白。pyba1132-lsa3084-gfp质粒的结构示意图如图1所示。
[0059]
二、菌液的准备1、重组菌制备将步骤一得到的重组载体pyba1132-lsa3084-gfp转化至农杆菌eha105(购自北京博迈德基因技术有限公司,货号为bc313-01)中,得到重组菌pyba1132-lsa3084-gfp/eha105。
[0060]
2、菌液制备将步骤1制备的重组菌pyba1132-lsa3084-gfp/eha105涂布于含有卡那霉素和利福平抗性的2yt培养皿上,28℃过夜培养,然后挑取单克隆,于含有卡那霉素和利福平抗性
的2yt培养液中过夜培养至od
600nm
为1.2-1.3,再6000r室温离心5min,使用含有乙酰丁香酮的mgcl2重悬菌液至od
600nm
为0.6-0.8,得到实验组菌液,室温放置3-4小时备用。
[0061]
按照上述方法,将pyba1132-lsa3084-gfp替换为pyba1132,得到对照组菌液。
[0062]
三、烟草的瞬时转化与荧光信号的观察1、菌液注射使用不加针头的注射器将上述步骤二获得的菌液(实验组菌液或对照组菌液)注射进1月龄的本生烟草(nicotiana benthamiana)叶片中,每片叶子1ml,做好标注,先暗培养一天(培养条件:培养温度为24℃;光照条件为24小时遮光),然后光培养两天(培养条件:培养温度为24℃;光照条件为16小时光照,8小时黑暗),分别得到转基因烟草,备用。
[0063]
将注射实验组菌液的烟草记作转基因烟草(pyba1132-lsa3084-gfp)。
[0064]
将注射对照组菌液的烟草记作转基因烟草(pyba1132-gfp)。
[0065]
2、pcr验证转基因烟草以转基因烟草(pyba1132-lsa3084-gfp)和转基因烟草(pyba1132-gfp)为实验材料,使用ctab法提取总dna。以此dna为模板,采用kan-f和kan-r为引物进行pcr扩增,得到pcr产物。
[0066]
引物序列如下:kan-f:ggtggagaggctattcggctatg;kan-r:tgctcgctcgatgcgatgttt。
[0067]
pcr扩增体系(20μl)如下:dna 2μl,k-f(10μm)1μl,k-r(10μm)1μl,ddh2o 6μl,2xrapid taq master mix(p222-aa)10μl。
[0068]
pcr反应条件如下:95℃预变性3min,然后95℃变性10s,60℃退火10s,72℃延伸10s,35个循环,最后72℃延伸5min,反应完后保持在8℃,使用1%琼脂糖胶进行电泳检测(目标条带为388bp)。
[0069]
结果如图2所示,泳道2-4为对照组转基因烟草(pyba1132-gfp)结果,泳道5-7为实验组转基因烟草(pyba1132-lsa3084-gfp)结果。从图中可以看出:载体成功进入到烟草叶片组织。
[0070]
3、酶解取培养三天后注射菌液的转基因烟草(pyba1132-lsa3084-gfp)和转基因烟草(pyba1132-gfp)叶片,用锋利的刀片切成细条状(越细越好,容易酶解),加入适量酶解液,22℃弱光或黑暗60rpm摇床酶解2-3 h,得到酶解产物。
[0071]
4、收集原生质体用200目的尼龙网过滤酶解产物,将滤液收集到50ml离心管中,水平转子4℃、100g离心5min,去上清液,收集沉淀,向沉淀中轻轻加入预冷的w5溶液,将底部的原生质体轻轻悬起,于激光共聚焦显微镜下观察荧光信号。
[0072]
结果如图3和图4所示,结果表明:转基因烟草(pyba1132-gfp)的gfp信号定位于非叶绿体,而转基因烟草(pyba1132-lsa3084-gfp)的gfp信号定位于叶绿体。说明lsa3084转运肽可以将非叶绿体蛋白gfp引导至叶绿体,使其定位于叶绿体中。
[0073]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实
施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
