1.本发明涉及黑曲霉发酵产柠檬酸领域,具体涉及一种通过控制黑曲霉菌球形态来调控柠檬酸发酵的方法。
背景技术:
2.柠檬酸可用于饮料、食品、制药等工业领域。其用途取决于三种特性:酸性、滋味和形成盐。柠檬酸能形成很广泛的盐,这些盐可以在工业中作为掩蔽剂和抗凝血保护剂,也用于脂肪和油中,起到抗氧化作用;柠檬酸也可与许多醇生成酯类,如丁酯、三乙酯和乙酰基三丁酯,这些酯可用于塑料膜增塑剂。
3.黑曲霉在液体深层培养中,其随着培养条件的不同而呈现不同的形态,而黑曲霉的形态对于柠檬酸的发酵产率至关重要。目前,黑曲霉形态主要呈现两种形态:丝状菌体、平滑致密菌球。丝状菌体其主要缺点是:丝状黑曲霉使发酵液粘度增大,随之而来的影响是是搅拌和质量传递难度加大;而平滑致密菌球的缺陷是:细胞的生长及产酸只能发生在致密菌丝球的表面,在表面能够接触到足够的营养成分及氧气,而生长在菌丝球内部的细胞由于营养物质和氧气等的传递限制使得柠檬酸生产受到限制。因此培养一种既有利于营养物质、氧气的传递,同时又降低发酵液的粘度的黑曲霉形态,从而加快产酸速度、缩短发酵周期、降低电耗,显得至关重要。
技术实现要素:
4.本发明针对现有黑曲霉培养方法的诸多缺陷,提供了一种控制黑曲霉形态来调控柠檬酸发酵的方法。主要技术方案为,在黑曲霉种子培养或发酵过程中,通过合理控制碳源或氮源的流加速度以及限制培养基中磷元素和锰元素浓度的方法,使种子培养或发酵过程的黑曲霉形成一种菌球紧凑、规则且直径较小,菌丝短而粗壮且呈多分枝的形态。该黑曲霉形态有利于营养物质、氧及代谢目的产物柠檬酸的传递,加快了发酵产酸,缩短了发酵周期;同时菌丝缩短有利于降低发酵液粘度,降低搅拌电耗;有利于发酵液过滤形成搭桥效应,提高过滤效果,提取收率和滤液质量大大提高,降低滤渣水分,提高了企业的综合经济效益。
5.本发明提供一种通过控制黑曲霉菌球形态来调控柠檬酸发酵的方法,包括1)黑曲霉种子培养,2)柠檬酸发酵过程。
6.其中,步骤1)黑曲霉种子培养过程中:
7.种子基础培养基中磷元素浓度为:2.5-3.5g/l,锰元素浓度为:0.06-0.10mg/l;
8.黑曲霉种子培养阶段控制碳源及氮源的流加速度来调控黑曲霉形态,具体为:0h-8h:碳源流加速度控制在0.5-0.7g糖/(l
·
h),氮源流加速度控制在55-66mg/(l
·
h),其中无机氮与有机氮的比例为0.5:1-0.8:1,c/n为3.0:1-5.2:1;9h-16h:碳源流加速度控制在1.1-1.3g糖/(l
·
h),氮源流加速度控制在100-120mg/(l
·
h),其中无机氮与有机氮的比例为0.4:1-0.65:1,c/n为3.6:1-5.2:1;17h-24h:碳源流加速度控制在1.8-2.0g糖/(l
·
h),
氮源流加速度控制在100-120mg/(l
·
h),其中氮源皆为有机氮源,c/n为6.0:1-7.8:1。
9.具体工艺过程为:将黑曲霉孢子悬浮液无菌接入灭菌后的种子基础培养基,控制种子培养条件进行黑曲霉种子培养,所述的种子培养条件为:罐压0.06-0.12mpa、罐温32-40℃、通风比0.15-0.23vvm,搅拌转速250-350rpm。
10.优选的,步骤1)黑曲霉种子培养阶段,黑曲霉孢子接种浓度为25-50万个/ml。
11.优选的,步骤1)黑曲霉种子培养过程中,种子基础培养基组成为:
12.(1)营养盐:kcl 4-6g/l、含磷营养盐(磷元素浓度为:2.5-3.5g/l)、mgso4·
7h2o 0.25-0.4g/l、na2so
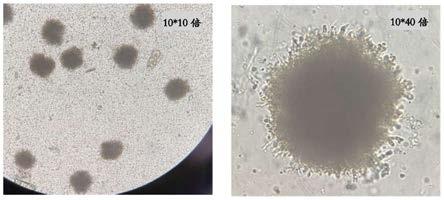
4 2g/l、无水cacl
2 4-6g/l;
13.(2)微量元素:feso4·
7h2o 1.5-2.5mg/l、znso4·
7h2o 0.4-0.6mg/l、含锰营养盐(控制锰元素浓度为:0.06-0.10mg/l)、cuso4·
5h2o 0.15-0.25mg/l、cocl2·
6h2o 0.10-0.20mg/l;灭菌待用。
14.2)柠檬酸发酵过程中:
15.发酵基础培养基中,磷元素浓度为:0.55-0.80g/l,锰元素浓度为:0.04-0.06mg/l;
16.根据不同发酵阶段控制氮源的流加速度来调控黑曲霉形态:0h-20h:氮源流加速度控制15-17mg/(l
·
h),所述氮源为有机氮源;21h-发酵结束:氮源流加速度控制13-15mg/(l
·
h),所述氮源为有机氮源。
17.具体工艺过程为:黑曲霉种子液培养好后,将种子液转入灭菌降温后的发酵基础培养基中,控制发酵条件开始发酵;发酵培养条件为:罐压0.06-0.12mpa、罐温35-40℃、通风比0.18-0.25vvm,搅拌转速300-400rpm。
18.优选的,发酵阶段,菌球接种浓度控制在2.5-5.0万个/ml。
19.优选的,发酵基础培养基组成为:
20.(1)碳源:总糖(175-185)g/l;
21.(2)营养盐:kcl 2.5-4.0g/l、含磷营养盐(控制磷元素浓度为:0.55-0.80g/l)、mgso4·
7h2o 0.15-0.35g/l、na2so
4 0.40-0.55g/l、无水cacl
2 6.0-8.0g/l;
22.(3)微量元素:feso4·
7h2o 4.0-6.0mg/l、znso4·
7h2o 2.0-3.0mg/l、含锰营养盐(控制锰元素浓度为:0.04-0.06mg/l)、cuso4·
5h2o 0.08-0.12mg/l、cocl2·
6h2o 0.07-0.11mg/l、生物素2.5-4.0mg/l、vb1 1.8-2.5mg/l;
23.1)黑曲霉种子培养及2)柠檬酸发酵过程中,所述的碳源指淀粉(玉米、马铃薯、木薯)、葡萄糖等中的一种或若干种;无机氮指氨水、铵盐或硝酸盐(硫酸铵、硝酸铵、硝酸钠等)、尿素等中的一种或若干种,有机氮指玉米浆、豆饼粉、花生粉、酵母浸出膏等中的一种或若干种;含磷营养盐指磷酸二氢钾、磷酸氢二钾等中的一种或若干种;含锰营养盐指硫酸锰、氯化锰等中的一种或若干种。
24.本技术中,在黑曲霉种子培养阶段通过控制培养基中碳源及氮源浓度(计量浓度单位:糖/(l
·
h)中的“糖”指葡萄糖,指碳源浓度按照葡萄糖计),限制黑曲霉的生长,使黑曲霉比生长速率维持在一个合适的范围,从而降低菌丝分支频率使黑曲霉形成一种菌球紧凑、规则且较小,菌丝短而粗壮且分支度多的形态。但是氮源缺失也不行,会影响黑曲霉的生长,提高氮源浓度又会导致形成更大更结实的菌球,不利于营养物质、氧气的传递,同时也消耗了额外的碳源,影响糖酸转化率。
25.黑曲霉种子培养阶段,控制磷元素初始浓度为:2.5-3.5g/l,控制锰元素初始浓度为:0.06-0.10mg/l。即使在培养过程中流加氮源和碳源,磷和锰元素的浓度仍在适量范围内,这两种元素的浓度对菌丝形态起到重要作用。在较高磷元素含量下,菌丝体松散,从而导致粘度增加,溶氧降低,产率下降,而磷含量较低时影响菌体生长。锰离子参与细胞壁的合成与孢子的形成等过程,锰离子缺乏,会使黑曲霉形态异常,孢子膨胀,形成球根状菌丝,抑制糖蛋白周转,使得菌丝的极性生长减少。锰离子过高会使黑曲霉的形态改变,菌丝体不结团,菌丝直径减小。
26.在上述黑曲霉种子培养使黑曲霉获得相应形态的基础上,继续在柠檬酸发酵过程中,控制磷元素初始浓度为:0.55-0.80g/l,锰元素初始浓度为:0.04-0.06mg/l,并采取流加氮源和碳源的方式,进一步控制黑曲霉的发酵状态。
27.与现有技术相比,本发明的最主要特征在黑曲霉种子培养阶段控制葡萄糖及氮源的流加速度、限制磷元素及锰元素浓度等方法,使黑曲霉形成一种菌球紧凑、规则且较小,菌丝短而粗壮且分支度多的形态,该黑曲霉形态有利于发酵产柠檬酸及后续提取工艺。综上所述,本发明培养的黑曲霉菌体形态加快了产酸速度,提高了糖酸转化率,缩短了发酵周期;同时降低了搅拌电耗。
附图说明
28.图1实施例1黑曲霉菌球分别在100倍和400倍显微镜下视野图;
29.图2实施例2黑曲霉菌球分别在100倍和400倍显微镜下视野图;
30.图3实施例3黑曲霉菌球分别在100倍和400倍显微镜下视野图;
31.图4实施例4黑曲霉菌球分别在100倍和400倍显微镜下视野图;
32.图5实施例5黑曲霉菌球分别在100倍和400倍显微镜下视野图;
33.图6对比例1黑曲霉菌球分别在100倍和400倍显微镜下视野图;
34.图7对比例2黑曲霉菌球分别在100倍和400倍显微镜下视野图;
35.图1-图7均为各实施例及对比例中柠檬酸发酵32h时的黑曲霉菌球形态。
具体实施方式
36.以下通过实施例形式的具体实施方式,对本发明的上述内容做进一步的详细说明,但不以任何方式限制本发明。凡基于本发明上述内容所实现的技术均属于本发明的范围,除特殊说明外,下述实施例中均采用常规现有技术完成。
37.以下实施例中所采用的玉米浆中氮元素含量为3.7%。
38.实施例1
39.1)黑曲霉种子培养:
40.将培养好的黑曲霉孢子用无菌水配置成黑曲霉孢子悬浮,待用;
41.配置黑曲霉种子基础培养基:(1)营养盐:kcl 5.5g/l、kh2po
4 12g/l、mgso4·
7h2o 0.35g/l、na2so
4 2g/l、无水cacl
2 5g/l;(2)微量元素:feso4·
7h2o 2mg/l、znso4·
7h2o 0.5mg/l、mnso4·
h2o 0.2mg/l、cuso4·
5h2o 0.2mg/l、cocl2·
6h2o 0.15mg/l;灭菌待用;
42.同时分别配置葡萄糖、玉米浆、硫酸铵流加液,灭菌待用;
43.将黑曲霉孢子悬浮液无菌接入灭菌后的种子基础培养基(接种量为35万个/ml),
2.5g/l、mgso4·
7h2o 0.25g/l、na2so
4 0.5g/l、无水cacl
2 7.5g/l;(3)微量元素:feso4·
7h2o 5mg/l、znso4·
7h2o 2.5mg/l、mnso4·
h2o 0.17mg/l、cuso4·
5h2o 0.1mg/l、cocl2·
6h2o 0.1mg/l、生物素3.0mg/l、vb1 2.2mg/l;高温灭菌待用;同时配置玉米浆流加液,灭菌待用;
60.黑曲霉种子液培养24h好后,将黑曲霉种子液无菌转入灭菌降温后的发酵培养基(接种量为3.5万个/ml),控制发酵条件开始发酵。发酵培养条件为:罐压0.09mpa、罐温37.5℃、通风比0.25vvm,搅拌转速350rpm;
61.期间根据不同发酵阶段控制氮源的流加速度(同时限制磷元素及锰元素的浓度)来调控黑曲霉形态:柠檬酸发酵过程,0h-20h:玉米浆流加速度控制0.42g/(l
·
h),所述氮源为有机氮源;21h-发酵结束:氮源流加速度控制0.37/(l
·
h);
62.发酵结束条件标准为产柠檬酸速度小于0.1g/(100ml
·
h)。
63.在此条件下,培养出的黑曲霉种子形态为:菌球紧凑、规则且较小,菌丝短而粗壮且分支度多,菌球直径145-160μm;发酵参数:18.4%,发酵周期54h,菌体量15.5g/l,产酸18.95%,转化率102.99%,发酵指数为3.51g/(l
·
h),搅拌电耗118kwh/t酸。
64.实施例3
65.1)黑曲霉种子培养:
66.将培养好的黑曲霉孢子用无菌水配置成黑曲霉孢子悬浮,待用;
67.配置黑曲霉种子基础培养基:(1)营养盐:kcl 5.5g/l、kh2po
4 14g/l、mgso4·
7h2o 0.35g/l、na2so
4 2g/l、无水cacl
2 5g/l;(2)微量元素:feso4·
7h2o 2mg/l、znso4·
7h2o 0.5mg/l、mnso4·
h2o 0.30mg/l、cuso4·
5h2o 0.2mg/l、cocl2·
6h2o 0.15mg/l;灭菌待用;
68.同时分别配置葡萄糖、玉米浆、硫酸铵流加液,灭菌待用;
69.将黑曲霉孢子悬浮液无菌接入灭菌后的种子基础培养基(接种量为35万个/ml),控制种子培养条件进行黑曲霉种子培养,培养条件为:罐压0.1mpa、罐温37.2℃、通风比0.20vvm,搅拌转速300rpm;
70.培养过程中在不同培养阶段控制葡萄糖及玉米浆的流加速度:黑曲霉种子培养阶段,0h-8h:葡萄糖流加速度控制在0.7g/(l
·
h),玉米浆流加速度控制在1.1g/(l
·
h),硫酸铵流加速度控制在0.12g/(l
·
h);9h-16h:葡萄糖流加速度控制在1.3g/(l
·
h),玉米浆流加速度控制在2.0g/(l
·
h),硫酸铵流加速度控制在0.20g/(l
·
h);17h-24h:葡萄糖流加速度控制在2.0g/(l
·
h),玉米浆流加速度控制在3.1g/(l
·
h)。
71.2)柠檬酸发酵过程:
72.配置发酵基础培养基:(1)碳源:葡萄糖185g/l;(2)营养盐:kcl 3.5g/l、kh2po
4 2.7g/l、mgso4·
7h2o 0.25g/l、na2so
4 0.5g/l、无水cacl
2 7.5g/l;(3)微量元素:feso4·
7h2o 5mg/l、znso4·
7h2o 2.5mg/l、mnso4·
h2o 0.15mg/l、cuso4·
5h2o 0.1mg/l、cocl2·
6h2o 0.1mg/l、生物素2.8mg/l、vb1 2.3mg/l;高温灭菌待用;同时配置玉米浆流加液,灭菌待用;
73.黑曲霉种子液培养24h好后,将黑曲霉种子液无菌转入灭菌降温后的发酵培养基(接种量为3.5万个/ml),控制发酵条件开始发酵。发酵培养条件为:罐压0.09mpa、罐温37.5℃、通风比0.25vvm,搅拌转速350rpm;
74.期间根据不同发酵阶段控制氮源的流加速度(同时限制磷元素及锰元素的浓度)
来调控黑曲霉形态:柠檬酸发酵过程,0h-20h:玉米浆流加速度控制0.43g/(l
·
h),所述氮源为有机氮源;21h-发酵结束:氮源流加速度控制0.38/(l
·
h);
75.发酵结束条件标准为产柠檬酸速度小于0.1g/(100ml
·
h)。
76.在此条件下,培养出的黑曲霉种子形态为:菌球紧凑、规则且较小,菌丝短而粗壮且分支度多,菌球直径145-165μm;发酵参数:18.5%,发酵周期54h,菌体量15.8g/l,产酸19.00%,转化率102.70%,发酵指数为3.52g/(l
·
h),搅拌电耗118kwh/t酸。
77.实施例4
78.1)黑曲霉种子培养:
79.将培养好的黑曲霉孢子用无菌水配置成黑曲霉孢子悬浮,待用;
80.配置黑曲霉种子基础培养基:(1)营养盐:kcl 5.5g/l、kh2po
4 12.5g/l、mgso4·
7h2o 0.35g/l、na2so
4 2g/l、无水cacl
2 5g/l;(2)微量元素:feso4·
7h2o 2mg/l、znso4·
7h2o 0.5mg/l、mnso4·
h2o 0.25mg/l、cuso4·
5h2o 0.2mg/l、cocl2·
6h2o 0.15mg/l;灭菌待用;
81.同时分别配置葡萄糖、玉米浆、硫酸铵流加液,灭菌待用;
82.将黑曲霉孢子悬浮液无菌接入灭菌后的种子基础培养基(接种量为35万个/ml),控制种子培养条件进行黑曲霉种子培养,培养条件为:罐压0.1mpa、罐温37.2℃、通风比0.20vvm,搅拌转速300rpm;
83.培养过程中在不同培养阶段控制葡萄糖及玉米浆的流加速度:黑曲霉种子培养阶段,0h-8h:葡萄糖流加速度控制在0.55g/(l
·
h),玉米浆流加速度控制在0.95g/(l
·
h),硫酸铵流加速度控制在0.11g/(l
·
h);9h-16h:葡萄糖流加速度控制在1.15g/(l
·
h),玉米浆流加速度控制在1.9g/(l
·
h),硫酸铵流加速度控制在0.17g/(l
·
h);17h-24h:葡萄糖流加速度控制在1.9g/(l
·
h),玉米浆流加速度控制在2.9g/(l
·
h)。
84.2)柠檬酸发酵过程:
85.配置发酵基础培养基:(1)碳源:葡萄糖185g/l;(2)营养盐:kcl 3.5g/l、kh2po
4 3.1g/l、mgso4·
7h2o 0.25g/l、na2so
4 0.5g/l、无水cacl
2 7.5g/l;(3)微量元素:feso4·
7h2o 5mg/l、znso4·
7h2o 2.5mg/l、mnso4·
h2o 0.16mg/l、cuso4·
5h2o 0.1mg/l、cocl2·
6h2o 0.1mg/l、生物素3.2mg/l、vb1 1.9mg/l;高温灭菌待用;同时配置玉米浆流加液,灭菌待用;
86.黑曲霉种子液培养24h好后,将黑曲霉种子液无菌转入灭菌降温后的发酵培养基(接种量为3.5万个/ml),控制发酵条件开始发酵。发酵培养条件为:罐压0.09mpa、罐温37.5℃、通风比0.25vvm,搅拌转速350rpm;
87.期间根据不同发酵阶段控制氮源的流加速度(同时限制磷元素及锰元素的浓度)来调控黑曲霉形态:柠檬酸发酵过程,0h-20h:玉米浆流加速度控制0.44g/(l
·
h),所述氮源为有机氮源;21h-发酵结束:氮源流加速度控制0.39/(l
·
h);
88.发酵结束条件标准为产柠檬酸速度小于0.1g/(100ml
·
h)。
89.在此条件下,培养出的黑曲霉种子形态为:菌球紧凑、规则且较小,菌丝短而粗壮且分支度多,菌球直径140-155μm;发酵参数:18.5%,发酵周期55h,菌体量15.3g/l,产酸19.10%,转化率103.24%,发酵指数为3.47g/(l
·
h),搅拌电耗121kwh/t酸。
90.实施例5
91.1)黑曲霉种子培养:
92.将培养好的黑曲霉孢子用无菌水配置成黑曲霉孢子悬浮,待用;
93.配置黑曲霉种子基础培养基:(1)营养盐:kcl 5.5g/l、kh2po
4 13.0g/l、mgso4·
7h2o 0.35g/l、na2so
4 2g/l、无水cacl
2 5g/l;(2)微量元素:feso4·
7h2o 2mg/l、znso4·
7h2o 0.5mg/l、mnso4·
h2o 0.27mg/l、cuso4·
5h2o 0.2mg/l、cocl2·
6h2o 0.15mg/l;灭菌待用;
94.同时分别配置葡萄糖、玉米浆、硫酸铵流加液,灭菌待用;
95.将黑曲霉孢子悬浮液无菌接入灭菌后的种子基础培养基(接种量为35万个/ml),控制种子培养条件进行黑曲霉种子培养,培养条件为:罐压0.1mpa、罐温37.2℃、通风比0.20vvm,搅拌转速300rpm;
96.培养过程中在不同培养阶段控制葡萄糖及玉米浆的流加速度:黑曲霉种子培养阶段,0h-8h:葡萄糖流加速度控制在0.65g/(l
·
h),玉米浆流加速度控制在1.05g/(l
·
h),硫酸铵流加速度控制在0.11g/(l
·
h);9h-16h:葡萄糖流加速度控制在1.25g/(l
·
h),玉米浆流加速度控制在1.95g/(l
·
h),硫酸铵流加速度控制在0.18g/(l
·
h);17h-24h:葡萄糖流加速度控制在1.90g/(l
·
h),玉米浆流加速度控制在3.0g/(l
·
h);
97.2)柠檬酸发酵过程:
98.配置发酵基础培养基:(1)碳源:葡萄糖185g/l;(2)营养盐:kcl 3.5g/l、kh2po
4 3.2g/l、mgso4·
7h2o 0.25g/l、na2so
4 0.5g/l、无水cacl
2 7.5g/l;(3)微量元素:feso4·
7h2o 5mg/l、znso4·
7h2o 2.5mg/l、mnso4·
h2o 0.14mg/l、cuso4·
5h2o 0.1mg/l、cocl2·
6h2o 0.1mg/l、生物素3.7mg/l、vb1 2.1mg/l;高温灭菌待用;同时配置玉米浆流加液,灭菌待用;
99.黑曲霉种子液培养24h好后,将黑曲霉种子液无菌转入灭菌降温后的发酵培养基(接种量为3.5万个/ml),控制发酵条件开始发酵。发酵培养条件为:罐压0.09mpa、罐温37.5℃、通风比0.25vvm,搅拌转速350rpm;
100.期间根据不同发酵阶段控制氮源的流加速度(同时限制磷元素及锰元素的浓度)来调控黑曲霉形态:柠檬酸发酵过程,0h-20h:玉米浆流加速度控制0.45g/(l
·
h),所述氮源为有机氮源;21h-发酵结束:氮源流加速度控制0.40g/(l
·
h);
101.发酵结束条件标准为产柠檬酸速度小于0.1g/(100ml
·
h)。
102.在此条件下,培养出的黑曲霉种子形态为:菌球紧凑、规则且较小,菌丝短而粗壮且分支度多,菌球直径140-160μm;发酵参数:18.5%,发酵周期54h,菌体量15.2g/l,产酸19.05%,转化率102.97%,发酵指数为3.53g/(l
·
h),搅拌电耗118kwh/t酸。
103.比较例1
104.1)黑曲霉种子培养:
105.将培养好的黑曲霉孢子用无菌水配置成黑曲霉孢子悬浮,待用;
106.配置黑曲霉种子培养基:(1)碳源:葡萄糖27.2g/l,氮源:玉米浆44g/l、硫酸铵2.08g/l;(2)营养盐:kcl 5.5g/l、kh2po
4 11g/l、mgso4·
7h2o 0.35g/l、na2so
4 2g/l、无水cacl
2 5g/l;(3)微量元素:feso4·
7h2o 2mg/l、znso4·
7h2o 0.5mg/l、mnso4·
h2o 0.15mg/l、cuso4·
5h2o 0.2mg/l、cocl2·
6h2o 0.15mg/l;灭菌待用;
107.将黑曲霉孢子悬浮液无菌接入灭菌后的种子培养基(接种量为35万个/ml),控制
种子培养条件进行黑曲霉种子培养,培养条件为:罐压0.1mpa、罐温37.2℃、通风比0.20vvm,搅拌转速300rpm。
108.2)柠檬酸发酵过程:
109.配置发酵培养基:(1)碳源:葡萄糖185g/l,氮源:玉米浆23g/l;(2)营养盐:kcl 3.5g/l、kh2po
4 2g/l、mgso4·
7h2o 0.25g/l、na2so
4 0.5g/l、无水cacl
2 7.5g/l;(3)微量元素:feso4·
7h2o 5mg/l、znso4·
7h2o 2.5mg/l、mnso4·
h2o 0.11mg/l、cuso4·
5h2o 0.1mg/l、cocl2·
6h2o 0.1mg/l、生物素3.5mg/l、vb1 2mg/l;高温灭菌待用。
110.黑曲霉种子液培养24h好后,将黑曲霉种子液无菌转入灭菌降温后的发酵培养基(接种量为3.5万个/ml),控制发酵条件开始发酵。发酵培养条件为:罐压0.09mpa、罐温37.5℃、通风比0.25vvm,搅拌转速350rpm;发酵结束条件标准为产柠檬酸速度小于0.1g/(100ml
·
h)。
111.在此条件下,培养出的黑曲霉种子形态为:菌球松散、不规则且较大,菌丝细长且分支度少,菌球直径180-220μm;发酵参数:总糖18.5%,发酵周期63h,菌体量18.6g/l,产酸18.70%,转化率101.08%,发酵指数为2.97g/(l
·
h),搅拌电耗154kwh/t酸。
112.比较例2
113.1)黑曲霉种子培养:
114.将培养好的黑曲霉孢子用无菌水配置成黑曲霉孢子悬浮,待用;
115.配置黑曲霉种子培养基:(1)碳源:葡萄糖29.2g/l,氮源:玉米浆47.2g/l、硫酸铵2.32g/l;(2)营养盐:kcl 5.5g/l、kh2po
4 15g/l、mgso4·
7h2o 0.35g/l、na2so
4 2g/l、无水cacl
2 5g/l;(3)微量元素:feso4·
7h2o 2mg/l、znso4·
7h2o 0.5mg/l、mnso4·
h2o 0.35mg/l、cuso4·
5h2o 0.2mg/l、cocl2·
6h2o 0.15mg/l;灭菌待用;
116.将黑曲霉孢子悬浮液无菌接入灭菌后的种子培养基(接种量为35万个/ml),控制种子培养条件进行黑曲霉种子培养,培养条件为:罐压0.1mpa、罐温37.2℃、通风比0.20vvm,搅拌转速300rpm。
117.2)柠檬酸发酵过程:
118.配置发酵培养基:(1)碳源:葡萄糖175g/l,氮源:玉米浆24g/l;(2)营养盐:kcl 3.5g/l、kh2po
4 4g/l、mgso4·
7h2o 0.25g/l、na2so
4 0.5g/l、无水cacl
2 7.5g/l;(3)微量元素:feso4·
7h2o 5mg/l、znso4·
7h2o 2.5mg/l、mnso4·
h2o 0.19mg/l、cuso4·
5h2o 0.1mg/l、cocl2·
6h2o 0.1mg/l、生物素3.5mg/l、vb1 2mg/l;高温灭菌待用。
119.黑曲霉种子液培养24h好后,将黑曲霉种子液无菌转入灭菌降温后的发酵培养基(接种量为3.5万个/ml),控制发酵条件开始发酵。发酵培养条件为:罐压0.09mpa、罐温37.5℃、通风比0.25vvm,搅拌转速350rpm;发酵结束条件标准为产柠檬酸速度小于0.1g/(100ml
·
h)。
120.在此条件下,培养出的黑曲霉种子形态为:菌球松散、不规则且较大,菌丝细长且分支度少,菌球直径190-230μm;发酵参数:总糖17.5%,发酵周期58h,菌体量19.1g/l,产酸17.80%,转化率101.71%,发酵指数为3.07g/(l
·
h),搅拌电耗135kwh/t酸。
121.对各实施例及对比例中的步骤2)柠檬酸发酵32h的黑曲霉形态(发酵培养32h时,菌球形态大小已经稳定)及发酵过程各发酵参数进行对比,详见表1和表2:
122.表1:本发明与现有技术黑曲霉形态对比
[0123][0124]
表2:本发明与现有技术柠檬酸发酵参数对比
[0125][0126]
通过上述对比,本发明所述的黑曲霉培养发酵柠檬酸新工艺与原有工艺相比较:(1)发酵周期缩短,糖酸转化率提高,发酵指数提高;(2)黑曲霉菌球形态较小,菌丝较短,搅拌电耗降低;(3)菌体量低,柠檬酸酸收率相应提高。因此,综合提升了柠檬酸的行业竞争力。
