(squalene synthase,ss),催化2,3-氧化角鲨烯生成的角鲨烯环氧酶(squalene epoxidase, se),催化达玛烯二醇生成的达玛烯二醇合成酶(ds),还有负责羟基化的细胞色素p450酶等,但三七皂苷r1的合成途径尚未完全挖掘。
技术实现要素:
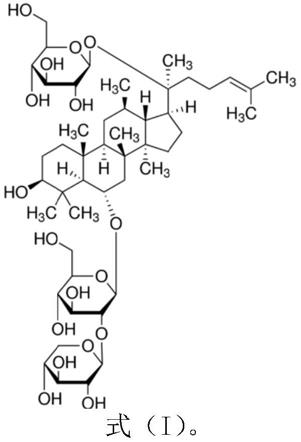
7.本发明的目的是生产人参皂苷rg1。
8.本发明提供了一种蛋白质,来源于三七,命名为pn3-32-i5蛋白,可为如下a1)或a2) 或a3)或a4):
9.a1)氨基酸序列是seq id no:5所示的蛋白质;
10.a2)在seq id no:5所示的蛋白质的n端或/和c端连接标签得到的融合蛋白质;
11.a3)将a1)或a2)所示的蛋白质经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的具有三七皂苷r1合成酶活性的蛋白质;
12.a4)与a1)或a2)所示的蛋白质具有80%或80%以上同一性,来源于三七且具有三七皂苷r1合成酶活性的蛋白质。
13.其中,seq id no:5由446个氨基酸残基组成。
14.为了使蛋白质便于纯化和检测,可在由seq id no:5所示的氨基酸序列组成的 pn3-32-i5蛋白的氨基末端或羧基末端连接上如表5所示的标签。
15.表5.标签的序列
16.标签残基序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhhflag8dykddddkstrep-tag ii8wshpqfekc-myc10eqkliseedl
17.上述a3)中的蛋白质,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超过 10个氨基酸残基的取代和/或缺失和/或添加。
18.上述a3)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
19.上述a3)中的蛋白质的编码基因可通过将seq id no:1所示的dna序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5
′
端和/ 或3
′
端连上表5所示的标签的编码序列得到。
20.编码所述pn3-32-i5蛋白的核酸分子也属于本发明的保护范围。
21.编码所述pn3-32-i5蛋白的核酸分子可为如下b1)或b2)或b3)或b4)所示的dna分子:
22.b1)编码区是seq id no:1所示的dna分子;
23.b2)核苷酸序列是seq id no:1所示的dna分子;
24.b3)与b1)或b2)限定的核苷酸序列具有75%或75%以上同一性,来源于三七且编码所述pn3-32-i5蛋白的dna分子;
25.b4)在严格条件下与b1)或b2)限定的核苷酸序列杂交,来源于三七且编码所述pn3-32-i5 蛋白的dna分子。
26.其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
27.其中,seq id no:1由1341个核苷酸组成,seq id no:1所示的核苷酸编码seq id no: 5所示的氨基酸序列。
28.本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码所述pn3-32-i5蛋白的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的所述pn3-32-i5蛋白的核苷酸序列80%或者更高同一性的核苷酸,只要编码所述pn3-32-i5蛋白,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
29.这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码seq id no:5所示的氨基酸序列组成的pn3-32-i5蛋白的核苷酸序列具有80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
30.编码所述pn3-32-i5蛋白的核酸分子具体可为编码所述pn3-32-i5蛋白的基因,命名为 pn3-32-i5基因。
31.含有上述任一所述核酸分子的表达盒、重组载体、重组微生物或转基因细胞系也属于本发明的保护范围。
32.所述含有上述任一所述核酸分子的重组载体可为在载体的多克隆位点插入seq id no:1 所示的dna分子得到的重组质粒。
33.所述载体可为质粒载体、黏粒载体、噬菌体载体或病毒载体。
34.所述载体可为表达载体或克隆载体。
35.所述表达载体可为质粒prs425-leu2-p
tef1-stpgmas-t
cyc1
。
36.所述含有上述任一所述核酸分子的重组载体具体可为重组质粒 prs425-leu2-p
tef1-pn3-32-i5-t
cyc1
。所述重组质粒prs425-leu2-p
tef1-pn3-32-i5-t
cyc1
可为将质粒prs425-leu2-p
tef1-stpgmas-t
cyc1
的限制性内切酶sexaⅰ和ascⅰ之间的dna小片段替换为 seq id no:1所示的dna分子。
37.所述含有上述任一所述核酸分子的重组微生物可为将含有上述任一所述核酸分子的重组载体导入出发微生物得到的重组菌。
38.所述出发微生物可为酵母、细菌、藻或真菌。所述酵母可为酿酒酵母(saccharomycescerevisiae)、解脂耶氏酵母(yarrowia lipolytica)、毕赤酵母(pichia pastoris)、红发夫酵母(phaffia rhodozyma)或隐球酵母(cryptococcus aerius)。
39.所述含有上述任一所述核酸分子的重组微生物具体可为重组酵母菌rg1-xm+pn3-32-i5。所述重组酵母菌rg1-xm+pn3-32-i5可为将重组质粒prs425-leu2-p
tef1-pn3-32-i5-t
cyc1
导入重组酵母菌rg1-xm,得到的重组菌。
40.所述转基因细胞系可为转基因植物细胞系或转基因动物细胞系。
41.所述转基因细胞系不包括繁殖材料。
42.本发明还保护上述任一所述pn3-32-i5蛋白的应用,可为如下c1)或c2)或c3)或c4) 或c5)或c6):
43.c1)生产三七皂苷r1;
44.c2)制备用于生产三七皂苷r1的产品;
45.c3)生产人参皂苷rg1;
46.c4)制备用于生产人参皂苷rg1的产品;
47.c5)作为三七皂苷r1合成酶;
48.c6)制备具有三七皂苷r1合成酶的功能的产品。
49.本发明还保护上述任一所述核酸分子的应用,可为如下c1)或c2)或c3)或c4)或c5) 或c6):
50.c1)生产三七皂苷r1;
51.c2)制备用于生产三七皂苷r1的产品;
52.c3)生产人参皂苷rg1;
53.c4)制备用于生产人参皂苷rg1的产品;
54.c5)作为三七皂苷r1合成酶;
55.c6)制备具有三七皂苷r1合成酶的功能的产品。
56.本发明还保护制备用于生产三七皂苷r1和/或人参皂苷rg1的工程菌(以下称为工程菌一)的方法,可包括如下步骤:提高受体酵母菌中磷酸葡萄糖变位酶1(geneid为853732)、α-磷酸葡萄糖变位酶(geneid为855131)、尿苷二磷酸葡萄糖焦磷酸化酶(geneid为 853830)、拟南芥udp-葡萄糖脱氢酶1、拟南芥udp-葡萄糖醛酸脱羧酶3、人参udp-糖基转移酶101和上述任一所述pn3-32-i5蛋白的表达量和/或活性,从而获得所述用于生产三七皂苷r1和/或人参皂苷rg1的工程菌;
57.所述受体酵母菌是通过提高酿酒酵母中羟甲戊二酰辅酶a还原酶1(将目标蛋白n端第 2至528位的氨基酸残基去除获得;目标蛋白的geneid为854900)、法尼基焦磷酸合酶(geneid 为853272)、鲨烯合酶(geneid为856597)、鲨烯环氧酶(geneid为853086)、达玛烯二醇
ꢀ‑
ii合酶、原人参二醇合酶、原人参三醇合酶和细胞色素p450还原酶(geneid为826869) 的表达量和/或活性获得的。
58.上述方法中,所述“提高受体酵母菌中磷酸葡萄糖变位酶1、α-磷酸葡萄糖变位酶、尿苷二磷酸葡萄糖焦磷酸化酶、拟南芥udp-葡萄糖脱氢酶1、拟南芥udp-葡萄糖醛酸脱羧酶3、人参udp-糖基转移酶101和上述任一所述pn3-32-i5蛋白的表达量和/或活性”是通过向所述受体酵母菌中导入磷酸葡萄糖变位酶1的编码基因(即pgm1基因,genebank号为z28127.1)、α-磷酸葡萄糖变位酶的编码基因(即pgm2基因,genebank号为ay723853.1)、尿苷二磷酸葡萄糖焦磷酸化酶的编码基因(即ugp1基因,genebank号为nm_001179601.3)、拟南芥udp-葡萄糖脱氢酶1的编码基因(即synatugd1基因)、拟南芥udp-葡萄糖醛酸脱羧酶3的编码基因(即synatuxs3基因)、人参udp-糖基转移酶101的编码基因(即 ugtpg101基因)和上述任一所述pn3-32-i5蛋白的编码基因(即pn3-32-i5基因)来实现的。
59.本发明还保护制备用于生产人参皂苷rg1的工程菌(以下称为工程菌二)的方法,可包括如下步骤:提高受体酵母菌中磷酸葡萄糖变位酶1、α-磷酸葡萄糖变位酶、尿苷二磷酸葡萄糖焦磷酸化酶、拟南芥udp-葡萄糖脱氢酶1、拟南芥udp-葡萄糖醛酸脱羧酶3和人参 udp-糖基转移酶101的表达量和/或活性,从而获得所述用于生产人参皂苷rg1的工程菌;
60.所述受体酵母菌是通过提高酿酒酵母中羟甲戊二酰辅酶a还原酶1、法尼基焦磷酸合酶、鲨烯合酶、鲨烯环氧酶、达玛烯二醇-ii合酶、原人参二醇合酶、原人参三醇合酶、细胞
色素p450还原酶的表达量和/或活性获得的。
61.上述方法中,所述“提高受体酵母菌中磷酸葡萄糖变位酶1、α-磷酸葡萄糖变位酶、尿苷二磷酸葡萄糖焦磷酸化酶、拟南芥udp-葡萄糖脱氢酶1、拟南芥udp-葡萄糖醛酸脱羧酶3和人参udp-糖基转移酶101的表达量和/或活性”是通过向所述受体酵母菌中导入磷酸葡萄糖变位酶1的编码基因、α-磷酸葡萄糖变位酶的编码基因、尿苷二磷酸葡萄糖焦磷酸化酶的编码基因、拟南芥udp-葡萄糖脱氢酶1的编码基因(即synatugd1基因)、拟南芥udp-葡萄糖醛酸脱羧酶3的编码基因(即synatuxs3基因)和人参udp-糖基转移酶101 的编码基因(即ugtpg101基因)来实现的。
62.上述任一所述“受体酵母菌是通过提高酿酒酵母中羟甲戊二酰辅酶a还原酶1、法尼基焦磷酸合酶、鲨烯合酶、鲨烯环氧酶、达玛烯二醇-ii合酶、原人参二醇合酶、原人参三醇合酶、细胞色素p450还原酶的表达量和/或活性获得的”是通过向所述酿酒酵母中导入羟甲戊二酰辅酶a还原酶1的编码基因(将目标基因5’末端起第4-1584位去除获得;目标基因的genebank号为nm_001182434.1)、法尼基焦磷酸合酶的编码基因(genebank号为 nm_001181600.1)、鲨烯合酶的编码基因(genebank号为nm_001179321.1)、鲨烯环氧酶的编码基因(genebank号为nm_001181304.1)、达玛烯二醇-ii合酶的编码基因(即synpgdds 基因)、原人参二醇合酶的编码基因(即synpgppds基因)、原人参三醇合酶的编码基因(即 synpgppts基因)和细胞色素p450还原酶的编码基因(genebank号为nm_001084908.2)来实现的。
63.上述任一所述synatuxs3基因的核苷酸序列可如seq id no:2所示。
64.上述任一所述synatugd1基因的核苷酸序列可如seq id no:3所示。
65.上述任一所述ugtpg101基因的核苷酸序列可如seq id no:4所示。
66.上述任一所述synpgdds基因的核苷酸序列可如seq id no:6所示。
67.上述任一所述synpgppds基因的核苷酸序列可如seq id no:7所示。
68.上述任一所述synpgppts基因的核苷酸序列可如seq id no:8所示。
69.上述任一所述拟南芥udp-葡萄糖醛酸脱羧酶3的氨基酸序列可如seq id no:9所示。
70.上述任一所述拟南芥udp-葡萄糖脱氢酶1的氨基酸序列可如seq id no:10所示。
71.上述任一所述人参udp-糖基转移酶101的氨基酸序列可如seq id no:11所示。
72.上述任一所述达玛烯二醇-ii合酶的氨基酸序列可如seq id no:12所示。
73.上述任一所述原人参二醇合酶的氨基酸序列可如seq id no:13所示。
74.上述任一所述原人参三醇合酶的氨基酸序列可如seq id no:14所示。
75.上述任一所述酿酒酵母可为酿酒酵母by4742。
76.上述任一所述的方法中,所述受体酵母菌可为酵母菌by-ppd-ppt。
77.所述工程菌一具体可为本发明实施例提及的重组酵母菌rg1-xm+pn3-32-i5。
78.所述工程菌二具体可为本发明实施例提及的重组酵母菌rg1-xm。
79.本发明还保护采用上述任一所述方法制备得到的用于生产三七皂苷r1和/或人参皂苷 rg1的工程菌一。
80.本发明还保护采用上述任一所述方法制备得到的用于生产人参皂苷rg1的工程菌二。
81.本发明还保护上述任一所述工程菌一在生产三七皂苷r1和/或人参皂苷rg1中的应用。
82.本发明还保护上述任一所述工程菌二在生产人参皂苷rg1中的应用。
83.本发明还保护一种生产三七皂苷r1和/或人参皂苷rg1的方法,包括如下步骤:发酵培养上述任一所述工程菌一,收集发酵产物,从中获得三七皂苷r1和/或人参皂苷rg1。
84.上述方法中,所述发酵培养的培养基可为含0.6-1.0%(如0.6-0.8%、0.8-1.0%、0.6%、 0.8%或1.0%)酵母选择培养基sd-trp-leu-his-ura、1-3%(如1-2%、2-3%、1%、2%或3%)葡萄糖和0.005-0.015%(如0.005-0.010%、0.010-0.015%、0.005%、0.010%或0.015%)leu的水溶液。
85.上述方法中,所述发酵培养的条件可为28-32℃(如28-30℃、30-32℃、28℃、30℃或 32℃)、200-300rpm(如200-250rpm、250-300rpm、200rpm、250rpm或300rpm)振荡培养。
86.上述方法中,所述从发酵产物中获得三七皂苷r1和/或人参皂苷rg1的步骤可为:
87.(1)收集发酵产物中沉淀;
88.(2)破碎,收集上清液。
89.本发明还保护一种生产人参皂苷rg1的方法,包括如下步骤:发酵培养上述任一所述工程菌二,收集发酵产物,从中获得人参皂苷rg1。
90.上述方法中,所述发酵培养的培养基可为含0.6-1.0%(如0.6-0.8%、0.8-1.0%、0.6%、 0.8%或1.0%)酵母选择培养基sd-trp-leu-his-ura和1-3%(如1-2%、2-3%、1%、2%或3%)葡萄糖的水溶液。
91.上述方法中,所述发酵培养的条件可为28-32℃(如28-30℃、30-32℃、28℃、30℃或 32℃)、200-300rpm(如200-250rpm、250-300rpm、200rpm、250rpm或300rpm)振荡培养。
92.上述方法中,所述从发酵产物中获得人参皂苷rg1的步骤可为:
93.(1)收集发酵产物中沉淀;
94.(2)破碎,收集上清液。
95.上文中,完成步骤(1)后、进行步骤(2)之前,还包括步骤(a):清洗沉淀。所述清洗采用ddh2o。
96.上文中,所述步骤(2)中,所述破碎方法可为加入萃取液,震荡破碎,之后超声破碎。加入萃取液的同时还可以加入玻璃珠。所述萃取液具体可由1体积份甲醇和1体积份丙酮混合而成。所述震荡破碎的时间可为8-12min(如8-10min、10-12min、8min、10min或12min)。所述超声破碎的时间可为25-35min(如25-30min、30-35min、25min、30min或35min)。
97.上文中,完成步骤(2)后,还包括步骤(b):对所述上清液进行过滤除菌。
98.本发明通过将磷酸葡萄糖变位酶1的编码基因、α-磷酸葡萄糖变位酶的编码基因、尿苷二磷酸葡萄糖焦磷酸化酶的编码基因、拟南芥udp-葡萄糖脱氢酶1的编码基因、拟南芥 udp-葡萄糖醛酸脱羧酶3的编码基因、人参udp-糖基转移酶101的编码基因导入生产ppt 的菌株by-ppd-ppt,得到重组酵母菌rg1-xm;重组酵母菌rg1-xm可以生产人参皂苷rg1。将三七皂苷r1合成酶的编码基因(即pn3-32-i5基因)导入重组酵母菌rg1-xm,得到重组酵母菌rg1-xm+pn3-32-i5。重组酵母菌rg1-xm+pn3-3-i5可以同时生产三七皂苷r1和人参皂苷rg1,具有较好的工业化应用前景。本发明提供了生产人参皂苷rg1的方法,具有重要的应用
价值。
附图说明
99.图1为标准品、rg1-xm溶液和rg1-xm+pn3-32-i5溶液的lc-ms分析结果。
具体实施方式
100.以下的实施例便于更好地理解本发明,但并不限定本发明。
101.下述实施例中的实验方法,如无特殊说明,均为常规方法。
102.下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
103.以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
104.酿酒酵母by4742(saccharomyces cerevisiae by4742)记载于如下文献中:carriebaker brachmann et al.,1998,yeast,14:115-132.,公众可从中国科学院天津工业生物技术研究所(即申请人处)获得。在下文中,酿酒酵母by4742简称酿酒酵母。
105.酵母选择培养基sd-trp-leu-his-ura为北京泛基诺科技有限公司的产品。puc57载体为金斯瑞生物科技有限公司的产品。peasy-blunt simple质粒为北京全式金生物技术有限公司产品。pcr supermix(+dye)为北京全式金生物技术有限公司的产品。 pcr产物纯化试剂盒为上海生工生物工程有限公司的产品。
106.hs dna聚合酶为takara公司的产品。5
×
ps buffer为hs dna聚合酶中的组件。
107.反转录试剂盒为thermo公司的产品。oligo(dt)
18
引物、5
×
rt buffer和maxima h minusenzyme mix均为反转录试剂盒中的组件。
108.质粒pm3-erg9已在中国发明专利文献cn 103484389 b中公开。
109.质粒pm9-pn1-31、质粒pm16-pn3-31、质粒pm2-pgm1、质粒pm8-pgm2、质粒pm11-ugp1 和质粒trp1-pgk均已在中国发明专利文献cn 110438099 a中公开。
110.质粒prs425-leu2-p
tef1-stpgmas-t
cyc1
已在中国发明专利文献cn 108060092 a中公开。
111.下述实施例中涉及的质粒信息如表1所示。
112.表1.质粒信息
113.114.下述实施例中涉及的菌株信息如表2所示。
115.表2.菌株信息
[0116][0117][0118]
磷酸葡萄糖变位酶1的geneid为853732。编码磷酸葡萄糖变位酶1的基因(即pgm1基因)的genebank号为z28127.1。
[0119]
α-磷酸葡萄糖变位酶的geneid为855131。编码α-磷酸葡萄糖变位酶的基因(即pgm2 基因)的genebank号为ay723853.1。
[0120]
尿苷二磷酸葡萄糖焦磷酸化酶的geneid为853830。编码尿苷二磷酸葡萄糖焦磷酸化酶的基因(即ugp1基因)的genebank号为nm_001179601.3。
[0121]
拟南芥udp-葡萄糖醛酸脱羧酶3的编码基因(即synatuxs3基因)的核苷酸序列如 seq id no:2所示。
[0122]
拟南芥udp-葡萄糖脱氢酶1的编码基因(即synatugd1基因)的核苷酸序列如seq idno:3所示。
[0123]
人参udp-糖基转移酶101的编码基因(即ugtpg101基因)的核苷酸序列如seq id no: 4所示。
[0124]
实施例1、pn3-32-i5基因的克隆
[0125]
1、采用qiagen植物rna提取试剂盒提取三七叶片的总rna。
[0126]
2、完成步骤1后,取三七叶片的总rna,采用反转录试剂盒进行反转录,得到三七的 cdna。
[0127]
反应体系为15μl,包括3μl三七的cdna、1μl oligo(dt)
18
引物(浓度为10μm)、 1μl dntp mix(datp、dttp、dgtp和dctp的浓度均为10mm)、4μl 5
×
rt buffer、1μl maximah minus enzyme mix和10μl rnase-free水。
[0128]
反应程序:50℃50min,85℃5min,4℃保温。
[0129]
3、以三七的cdna为模板,采用引物sexa1-pn3-32-i5:5
’ꢀ‑
gcgacctggtatggataaccaagaagctagaatcag-3’(下划线为限制性内切酶sexaⅰ的识别位点) 和引物pn3-32-i5-asc1:5
’‑
gcggcgcgccctattgtgcatctttcttcttcttac-3’(下划线为限制性内切酶ascⅰ的识别位点)组成的引物对进行pcr扩增,回收约1360bp的pcr扩增产物,然后用pcr产物纯化试剂盒纯化。
[0130]
反应体系为50μl,包括10μl 5
×
ps buffer、4μl dntp mix、引物各1μl、0.5μl 三七的cdna和0.5μlhs聚合酶(浓度为2.5u/μl)和蒸馏水。
[0131]
反应程序:98℃预变性3min;98℃变性10s,55℃退火15s,72℃延伸2min,30个循环; 72℃延伸8min。
[0132]
4、将步骤3纯化的pcr扩增产物和peasy-blunt simple质粒进行连接,得到重组质粒 p-pn3-32-i5。
[0133]
将重组质粒p-pn3-32-i5进行测序。测序结果表明,重组质粒p-pn3-32-i5中含有核苷酸序列如seq id no:1所示的pn3-32-i5基因。
[0134]
pn3-32-i5基因编码pn3-32-i5蛋白,pn3-32-i5蛋白的氨基酸序列如seq id no:5 所示。
[0135]
实施例2、pn3-32-i5蛋白在制备三七皂苷r1中的应用
[0136]
一、重组质粒pm3-synatugd1、重组质粒pm9-synatuxs3、重组质粒pm16-ugtpg101和重组质粒prs425-leu2-p
tef1-pn3-32-i5-t
cyc1
的构建
[0137]
1、重组质粒p-synatuxs3、重组质粒p-synatugd1和重组质粒p-ugtpg101的构建
[0138]
由金斯瑞生物科技有限公司分别合成seq id no:2所示的synatuxs3基因、seq id no: 3所示的synatugd1基因和seq id no:4所示的ugtpg101基因。
[0139]
将synatuxs3基因插入puc57载体的多克隆位点,得到重组质粒p-synatuxs3。
[0140]
将synatugd1基因插入puc57载体的多克隆位点,得到重组质粒p-synatugd1。
[0141]
将ugtpg101基因插入puc57载体的多克隆位点,得到重组质粒p-ugtpg101。
[0142]
2、重组质粒pm3-synatugd1的构建
[0143]
(1)用限制性内切酶sexaⅰ和ascⅰ酶切重组质粒p-synatugd1,回收约1460bp的酶切产物。
[0144]
(2)用限制性内切酶sexaⅰ和ascⅰ酶切质粒pm3-erg9,回收约4598bp的载体骨架。
[0145]
(3)将步骤(1)回收的酶切产物和步骤(2)回收的载体骨架进行连接,得到重组质粒pm3-synatugd1。
[0146]
将重组质粒pm3-synatugd1进行测序。测序结果表明,重组质粒pm3-synatugd1为将质粒 pm3-erg9的限制性内切酶sexaⅰ和ascⅰ之间的dna小片段替换为dna分子甲,得到的重组质粒;dna分子甲中含有seq id no:3所示的synatugd1基因。重组质粒pm3-synatugd1 表达拟南芥udp-葡萄糖脱氢酶1。
[0147]
3、重组质粒pm9-synatuxs3的构建
[0148]
(1)用限制性内切酶sexaⅰ和ascⅰ酶切重组质粒p-synatuxs3,回收约1043bp的酶切产物。
[0149]
(2)用限制性内切酶sexaⅰ和ascⅰ酶切质粒pm9-pn1-31,回收约5136bp的载体骨架。
[0150]
(3)将步骤(1)回收的酶切产物和步骤(2)回收的载体骨架进行连接,得到重组质粒pm9-synatuxs3。
[0151]
将重组质粒pm9-synatuxs3进行测序。测序结果表明,重组质粒pm9-synatuxs3为将质粒 pm9-pn1-31的限制性内切酶sexaⅰ和ascⅰ之间的dna小片段替换为dna分子乙,得到的重组质粒;dna分子乙中含有seq id no:2所示的synatuxs3基因。重组质粒pm9-synatuxs3 表达拟南芥udp-葡萄糖醛酸脱羧酶3。
[0152]
4、重组质粒pm16-ugtpg101的构建
[0153]
(1)用限制性内切酶sexaⅰ和ascⅰ酶切重组质粒p-ugtpg101,回收约1442bp的酶切产物。
[0154]
(2)用限制性内切酶sexaⅰ和ascⅰ酶切质粒pm16-pn3-31,回收约5136bp的载体骨架。
[0155]
(3)将步骤(1)回收的酶切产物和步骤(2)回收的载体骨架进行连接,得到重组质粒pm16-ugtpg101。
[0156]
将重组质粒pm16-ugtpg101进行测序。测序结果表明,重组质粒pm16-ugtpg101为将质粒 pm16-pn3-31的限制性内切酶sexaⅰ和ascⅰ之间的dna小片段替换为dna分子丙,得到的重组质粒;dna分子丙中含有no:4所示的ugtpg101基因。重组质粒pm16-ugtpg101表达人参udp-糖基转移酶101。
[0157]
5、重组质粒prs425-leu2-p
tef1-pn3-32-i5-t
cyc1
[0158]
(1)用限制性内切酶sexaⅰ和ascⅰ酶切重组质粒p-pn3-32-i5,回收约1355bp的酶切产物。
[0159]
(2)用限制性内切酶sexaⅰ和ascⅰ酶切质粒prs425-leu2-p
tef1-stpgmas-t
cyc1
,回收约 7602bp的载体骨架。
[0160]
(3)将步骤(1)回收的酶切产物和步骤(2)回收的载体骨架进行连接,得到重组质粒prs425-leu2-p
tef1-pn3-32-i5-t
cyc1
。
[0161]
将重组质粒prs425-leu2-p
tef1-pn3-32-i5-t
cyc1
进行测序。测序结果表明,重组质粒 prs425-leu2-p
tef1-pn3-32-i5-t
cyc1
为将质粒prs425-leu2-p
tef1-stpgmas-t
cyc1
的限制性内切酶 sexaⅰ和ascⅰ之间的dna小片段替换为seq id no:1所示的dna分子。重组质粒 prs425-leu2-p
tef1-pn3-32-i5-t
cyc1
表达pn3-32-i5蛋白。
[0162]
二、重组酵母菌rg1-xm和重组酵母菌rg1-xm+pn3-32-i5的构建
[0163]
1、重组酵母菌rg1-xm的构建
[0164]
(1)分别以表3中第2列所示的质粒或酵母基因组dna为模板,采用表3中第3列和第4列所示的引物进行pcr扩增,回收相应的pcr扩增产物,即获得模块m1
′
、m2
′
、 m3
′
、m4
′
、m5
′
、m6
′
、m7
′
、m8
′
和m9
′
。
[0165]
反应体系为50μl,包括5
×
psbuffer 10μl、dntp mix 4μl、引物各1μl、模板0.5μl、hs聚合酶(2.5u/μl)0.5μl和蒸馏水。
[0166]
反应条件为:98℃预变性3min;98℃变性10s,58℃退火15s,72℃延伸3min,30个循环;72℃延伸10min。
[0167]
表3.引物序列
[0168][0169][0170]
(2)采用中国发明专利文献cn 102925376 b中实施例2中感受态细胞的制备方法,制备by-ppd-ppt(已在中国发明专利文献cn 110438099 a中公开)感受态细胞。
[0171]
(3)向by-ppd-ppt感受态细胞中加入0.1μg模块m1
′
、0.1μg模块m2
′
、0.1μg 模块m3
′
、0.1μg模块m4
′
、0.1μg模块m5
′
、0.1μg模块m6
′
、0.1μg模块m7
′
、 0.1μg模块m8
′
和0.1μg模块m9
′
,2.7kv电击后,加入1ml1mol/l山梨醇水溶液, 30℃复苏1h,涂布到筛选培养基1上,得到若干单克隆。
[0172]
筛选培养基1:含0.8%(m/m)酵母选择培养基sd-trp-leu-his-ura、2%(m/m) 葡萄糖、0.01%(m/m)leu和2%(m/m)琼脂粉的固体培养基。
[0173]
筛选培养条件为:30℃培养36h以上。
[0174]
(4)pcr鉴定
[0175]
每个步骤(3)获得的单克隆进行如下鉴定:
[0176]
(1-1)提取单克隆的基因组dna并以其为模板,分别采用引物对1、引物对2、引物对3、引物对4、引物对5、引物对6、引物对7、引物对8、引物对9、引物对10、引物对 11、引物对12和引物对13进行pcr扩增,得到相应的pcr扩增产物。
[0177]
反应体系均为10μl,由5μlpcr supermix(+dye)、引物各0.5μl、模板1μl和蒸馏水组成。
[0178]
反应条件为:94℃预变性5min;94℃变性30s,53℃退火30s,72℃延伸3min,30个循环;72℃延伸10min。
[0179]
组成各个引物对的引物名称和引物的核苷酸序列见表4。
[0180]
表4
[0181][0182][0183]
(1-2)分别将步骤(1-1)得到的pcr扩增产物进行1%(m/m)琼脂糖凝胶电泳,然后进行如下判断:如果某单克隆采用引物对1扩增获得的pcr扩增产物中含有大小为1098bp 的dna片段、采用引物对2扩增获得的pcr扩增产物中含有大小为2492bp的dna片段、采用引物对3扩增获得的pcr扩增产物中含有大小为2870bp的dna片段、采用引物对4扩增获得的pcr扩增产物中含有大小为1860bp的dna片段、采用引物对5扩增获得的pcr扩增产物中含有大小为2459bp的dna片段、采用引物对6扩增获得的pcr扩增产物中含有大小为2459bp的dna片段、采用引物对7扩增获得的pcr扩增产物中含有大小为2678bp的dna 片段、采用引物对8扩增获得的pcr扩增产物中含有大小为2561bp的dna片段、采用引物对9扩增获得的pcr扩增产物中含有大小为2940bp的dna片段、采用引物对10扩增获得的 pcr扩增产物中含有大小为2332bp的dna片段、采用引物对11扩增获得的pcr扩增产物中含有大小为2343bp的dna片
段、采用引物对12扩增获得的pcr扩增产物中含有大小为1887bp 的dna片段、采用引物对13扩增获得的pcr扩增产物中含有大小为2298bp的dna片段,则该单克隆为阳性克隆。
[0184]
将其中一个阳性克隆命名为重组酵母菌rg1-xm。
[0185]
重组酵母菌rg1-xm为将pgm1基因、pgm2基因、ugp1基因、synatugd1基因、synatuxs3 基因和ugtpg101基因导入by-ppd-ppt,得到的重组菌。
[0186]
2、重组酵母菌rg1-xm+pn3-32-i5的构建
[0187]
(1)采用中国发明专利文献cn 102925376 b中实施例2中感受态细胞的制备方法,制备rg1-xm感受态细胞。
[0188]
(2)向rg1-xm感受态细胞中加入1μg重组质粒prs425-leu2-p
tef1-pn3-32-i5-t
cyc1
, 2.7kv电击后,加入1ml 1mol/l山梨醇水溶液,30℃复苏1h,涂布到筛选培养基2上,得到若干单克隆。
[0189]
筛选培养基2:含0.8%(m/m)酵母选择培养基sd-trp-leu-his-ura、2%(m/m) 葡萄糖和2%(m/m)琼脂粉的固体培养基。
[0190]
筛选培养条件为:30℃培养36h以上。
[0191]
(3)pcr鉴定
[0192]
每个步骤(2)获得的单克隆进行如下鉴定:
[0193]
(1-1)提取单克隆的基因组dna并以其为模板,采用引物sacii-ptef1: 5
’‑
gcgccgcggagtgatcccccacacaccatagctt-3’和引物pn3-32-i5-asc: 5
’‑
gcggcgcgccctattgtgcatctttcttcttcttac-3’组成的引物对进行pcr扩增,得到pcr扩增产物。
[0194]
反应体系均为10μl,由5μlpcr supermix(+dye)、引物各0.5μl、模板1μl和蒸馏水组成。
[0195]
反应条件为:94℃预变性5min;94℃变性30s,53℃退火30s,72℃延伸2min,30个循环;72℃延伸10min。
[0196]
(1-2)将步骤(1-1)得到的pcr扩增产物进行1%(m/m)琼脂糖凝胶电泳,然后进行如下判断:如果某单克隆的pcr扩增产物中含有大小为1782bp的dna片段,则该单克隆为阳性克隆。
[0197]
将其中一个阳性克隆命名为重组酵母菌rg1-xm+pn3-32-i5。
[0198]
重组酵母菌rg1-xm+pn3-32-i5为将pn3-32-i5基因导入重组酵母菌rg1-xm,得到的重组菌。
[0199]
三、摇瓶发酵和lc-ms检测
[0200]
1、摇瓶发酵
[0201]
固体选择培养基1的溶质及其质量百分比浓度为:0.8%酵母选择培养基 sd-trp-leu-his-ura、2%葡萄糖、0.01%trp、0.01%leu和2%琼脂粉;溶剂为水。
[0202]
液体选择培养基1的溶质及其质量百分比浓度为:0.8%酵母选择培养基sd-trp-leu-his-ura、2%葡萄糖、0.01%trp和0.01%leu;溶剂为水。
[0203]
固体选择培养基2的溶质及其质量百分比浓度为:0.8%酵母选择培养基 sd-trp-leu-his-ura、2%葡萄糖、0.01%leu和2%琼脂粉;溶剂为水。
[0204]
液体选择培养基2的溶质及其质量百分比浓度为:0.8%酵母选择培养基 sd-trp-leu-his-ura、2%葡萄糖和0.01%leu;溶剂为水。
[0205]
固体选择培养基3的溶质及其质量百分比浓度为:0.8%酵母选择培养基 sd-trp-leu-his-ura、2%葡萄糖和2%琼脂粉;溶剂为水。
[0206]
液体选择培养基3的溶质及其质量百分比浓度为:0.8%酵母选择培养基 sd-trp-leu-his-ura和2%葡萄糖;溶剂为水。
[0207]
(1)在固体选择培养基1上活化by-ppd-ppt,然后将单克隆接种于4ml液体选择培养基1,30℃、250rpm培养16h,得到种子液;将150μl种子液接种于装有15ml液体选择培养基1的三角瓶(规格为100ml)中,30℃、250rpm振荡培养6天,得到by-ppd-ppt发酵液。
[0208]
(2)在固体选择培养基2上活化重组酵母菌rg1-xm,然后将单克隆接种于4ml液体选择培养基2,30℃、250rpm培养16h,得到种子液;将150μl种子液接种于装有15ml液体选择培养基2的三角瓶(规格为100ml)中,30℃、250rpm振荡培养6天,得到rg1-xm 发酵液。
[0209]
(3)在固体选择培养基3上活化重组酵母菌rg1-xm+pn3-32-i5,然后将单克隆接种于4ml液体选择培养基3,30℃、250rpm培养16h,得到种子液;将150μl种子液接种于装有15ml液体选择培养基3的三角瓶(规格为100ml)中,30℃、250rpm振荡培养6天,得到rg1-xm+pn3-32-i5发酵液。
[0210]
2、提取发酵液中的化合物
[0211]
(1)取by-ppd-ppt发酵液,5000rpm离心5min,收集沉淀;
[0212]
(2)完成步骤(1)后,取所述沉淀,用ddh2o清洗后转移至破碎管中,12000rpm离心2min,弃上清;
[0213]
(3)完成步骤(2)后,取所述破碎管,加入玻璃珠(直径为0.5mm)和1ml萃取液(由 1体积份甲醇和1体积份丙酮混合而成),震荡破碎10min,超声破碎30min;
[0214]
(4)完成步骤(3)后,13000rpm离心2min,收集上清液。
[0215]
(5)完成步骤(4)后,将所述上清液用有机滤膜(孔径为0.22μm)过滤,收集滤液;该滤液即为by-ppd-ppt溶液。
[0216]
按照上述方法,将by-ppd-ppt发酵液替换为rg1-xm发酵液,其它步骤均不变,得到rg1-xm溶液。
[0217]
按照上述方法,将by-ppd-ppt发酵液替换为rg1-xm+pn3-32-i5发酵液,其它步骤均不变,得到rg1-xm+pn3-32-i5溶液。
[0218]
3、lc-ms定性分析
[0219]
lc-ms分别检测标准品、by-ppd-ppt溶液、rg1-xm溶液和rg1-xm+pn3-32-i5溶液。标准品由三七皂苷r1和人参皂苷rg1等质量混合而成。三七皂苷r1和人参皂苷rg1均为上海源叶生物科技有限公司的产品。
[0220]
仪器:液相色谱-串联质谱(lc-ms)仪,由安捷伦1200高效液相色谱仪和 bruker-microtof-ii质谱仪组成;microotof control version 3.0/data anaysisversion 4.0数据采集和处理系统。
[0221]
质谱条件:电喷雾电离源正离子模式(esi
+
),喷雾电压(4.5kv),雾化气流量 (6l/h),雾化器温度(180℃),碰撞气为氮气,压力为1.0bar,数据采集频率1.0hz:碰撞能量为8.0ev。
[0222]
lc条件:dad检测器,检测波长203nm,pg-c18色谱柱(250mm
×
4.6mm,5μm),流动相a(甲酸:水=1:999);流动相b(甲酸:乙腈=1:999);梯度洗脱,流速1ml/min;柱
温25℃;进样体积(20μl)。洗脱方式如下:0~12min(包括12min)流动相a的体积百分比浓度保持81%,流动相b的体积百分比浓度保持19%;12~32min(包括32min)流动相a 的体积百分比浓度为81%~74%,流动相b的体积百分比浓度为19%~26%;32~34min(包括 34min)流动相a的体积百分比浓度为74%~10%,流动相b的体积百分比浓度为26%~90%;34~ 44min(包括44min)流动相a的体积百分比浓度保持10%,流动相b的体积百分比浓度保持90%; 44~46min(包括46min)流动相a的体积百分比浓度为10%~81%,流动相b的体积百分比浓度为90%~19%;46~50min(包括50min)流动相a的体积百分比浓度为保持81%,流动相b的体积百分比浓度保持19%。
[0223]
部分检测结果见图1(a为标准品、rg1-xm溶液和rg1-xm+pn3-32-i5溶液的lc-ms离子图,b为对应峰的高分辨质谱分子量,c为三七来源的pn3-32-i5蛋白参与三七皂苷r1 的合成)。结果表明,rg1-xm溶液中含有和标准品同时出现相同的高分辨率人参皂苷rg1 质谱离子峰图。rg1-xm+pn3-32-i5溶液含有和标准品同时出现相同的高分辨率三七皂苷r1 和人参皂苷rg1质谱离子峰图。
[0224]
上述结果表明,将编码磷酸葡萄糖变位酶1的基因(即pgm1基因)、编码α-磷酸葡萄糖变位酶的基因(即pgm2基因)、编码尿苷二磷酸葡萄糖焦磷酸化酶的基因(即ugp1基因)、编码拟南芥udp-葡萄糖脱氢酶1的基因(即synatugd1基因)、编码拟南芥udp-葡萄糖醛酸脱羧酶3基因(即synatuxs3基因)、编码人参udp-糖基转移酶101的基因(即ugtpg101 基因)导入by-ppd-ppt,得到重组酵母菌rg1-xm。重组酵母菌rg1-xm可以生产人参皂苷rg1。将编码pn3-32-i5蛋白的基因(即pn3-32-i5基因)导入重组酵母菌rg1-xm,得到重组酵母菌rg1-xm+pn3-32-i5。重组酵母菌rg1-xm+pn3-32-i5可以同时生产三七皂苷 r1和人参皂苷rg1。
