靶向敲降sirt2基因的shrna及烟酰胺腺嘌呤二核苷酸的前体在制备治疗神经退行性疾病的药物中的应用
技术领域
1.本公开涉及基因工程技术领域,尤其涉及靶向敲降sirt2基因的shrna及烟酰胺腺嘌呤二核苷酸的前体在制备治疗神经退行性疾病的药物中的应用。
背景技术:
2.脱髓鞘是神经系统衰老和神经变性疾病比如阿尔兹海默症和亨廷顿舞蹈症等的早期事件之一,是神经系统脱髓鞘疾病比如多发性硬化症的特征性病理基础。中枢神经系统脱髓鞘疾病发病10年到20年后,许多患者的临床病程逐渐发展,最终导致行动能力和认知能力受损,严重影响患者的生活质量甚至导致死亡。
3.对于中枢神经系统脱髓鞘疾病,临床上尚无有效促进髓鞘修复的药物,目前主要的治疗方法是给予免疫调节剂,虽然免疫调节剂能够减缓疾病进程,但对修复髓鞘没有作用,不能完全阻止疾病发展,治标不治本;另外免疫调节剂价格昂贵,增加了患者经济困难,患者依从性降低。
技术实现要素:
4.有鉴于此,本公开的目的在于提出一种靶向敲降sirt2基因的shrna及烟酰胺腺嘌呤二核苷酸的前体在制备治疗神经退行性疾病的药物中的应用。
5.基于上述目的,本公开第一方面提供了一种靶向敲降sirt2基因的shrna,其特征在于,所述shrna的核苷酸序列包括:
6.shrna-f:5'—gatccggatgaaagagaagatcttctttcaagagaagaagatcttctctttcatcctttttg—3',(seq id no:1)
7.shrna-r:5'—aattcaaaaaggatgaaagagaagatcttcttctcttgaaagaagatcttctctttcatccg—3'。(seq id no:2)
8.基于相同目的,本公开第二方面还提供了烟酰胺腺嘌呤二核苷酸的前体在制备治疗神经退行性疾病的药物中的应用。
9.可选地,所述烟酰胺腺嘌呤二核苷酸的前体包括β-烟酰胺单核苷酸、烟酰胺和烟酰胺核糖中的至少一种。
10.可选地,所述治疗神经退行性疾病的药物包括治疗脱髓鞘疾病的药物。
11.可选地,所述治疗脱髓鞘疾病的药物包括促进髓鞘修复的药物。
12.可选地,所述促进髓鞘修复的药物包括促进少突胶质细胞前体细胞分化为成熟的少突胶质细胞的药物。
13.可选地,所述促进少突胶质细胞前体细胞分化为成熟的少突胶质细胞的药物包括促进sirt2进入少突胶质细胞前体细胞的细胞核的药物。
14.可选地,所述神经退行性疾病包括多发性硬化症、阿尔兹海默症、帕金森综合征、脊髓侧索硬化症和亨廷顿舞蹈症。
15.可选地,所述治疗神经退行性疾病的药物是以烟酰胺腺嘌呤二核苷酸的前体作为唯一活性成分或者是包含烟酰胺腺嘌呤二核苷酸的前体的药物组合物。
16.可选地,所述治疗神经退行性疾病的药物包括采用药学上可接受的辅料制成药学上可接受的任意剂型;优选地,所述治疗神经退行性疾病的药物包括汤剂、散剂、丸剂、酒剂、锭剂、胶剂、茶剂、曲剂、糕剂、露剂、棒剂、线剂、条剂、钉剂,灸熨剂,膏剂、丹剂、脂质体制剂、气雾剂、注射剂、合剂、口服安瓿剂、片剂、胶囊剂、滴丸剂、乳剂、膜剂和海绵剂中的至少一种。
17.从上面所述可以看出,本公开提供的靶向敲降sirt2基因的shrna及烟酰胺腺嘌呤二核苷酸的前体在制备治疗神经退行性疾病的药物中的应用,烟酰胺腺嘌呤二核苷酸的前体能够促进sirt2进入少突胶质细胞前体细胞的细胞核内,从而促进少突胶质细胞前体细胞分化为成熟的少突胶质细胞,修复髓鞘进而实现脱髓鞘疾病的治疗,从根本上起到治疗脱髓鞘疾病的作用;并且服用安全性好,成本降低,患者依从性高。
附图说明
18.为了更清楚地说明本公开或相关技术中的技术方案,下面将对实施例或相关技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本公开的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
19.图1为小鼠胼胝体区局部脱髓鞘模型结构示意图;
20.图2a为g3 terc-/-小鼠注射pbs或β-nmn后,lpc诱导脱髓鞘后21天取材示意图;
21.图2b为g3 terc-/-小鼠注射pbs或β-nmn后胼胝体损伤区髓鞘的代表性透射电镜图片;
22.图2c为g3 terc-/-小鼠注射pbs或β-nmn后复髓鞘的病理分级统计;
23.图2d为g3 terc-/-小鼠注射pbs或β-nmn后复髓鞘轴突比例的统计图;
24.图2e为g3 terc-/-小鼠注射pbs或β-nmn后复髓鞘的g-ratio的统计结果示意图;
25.图2f为g3 terc-/-小鼠注射pbs或β-nmn后复髓鞘层间距的统计图;
26.图3a为脱髓鞘21d后大脑的冠状切片以及电极放置示意图;
27.图3b为各组的代表性胼胝体复合动作电位波形图;
28.图3c为各组有效记录脑片的比例统计图;
29.图3d为快传导幅值与慢传导幅值比例的统计图;
30.图4a为g3 terc-/-小鼠在lpc注射前半小时腹腔注射pbs或β-nmn,或者lpc诱导脱髓鞘后3天腹腔注射β-nmn,21dpl取材,过程示意图;
31.图4b为β-nmn处理组和pbs对照组小鼠胼胝体损伤区髓鞘的代表性透射电镜图片;
32.图4c为β-nmn处理组和pbs对照组小鼠复髓鞘的病理分级统计;
33.图4d为β-nmn处理组和pbs对照组小鼠复髓鞘轴突比例的统计图;
34.图4e为β-nmn处理组和pbs对照组小鼠复髓鞘的g-ratio的统计结果示意图;
35.图4f为β-nmn处理组和pbs对照组小鼠复髓鞘层间距的统计图;
36.图5a为g3 terc-/-小鼠和wt小鼠少突胶质细胞前体细胞用dmso或者β-nmn处理后分化的代表性荧光图;
37.图5b为图5a各代表性荧光图的统计图;
38.图6a为原代少突胶质细胞前体细胞在dmso或β-nmn处理之后sirt2细胞定位的荧光图;
39.图6b为sirt2入核的细胞比例的统计图;
40.图6c为细胞核中sirt2的荧光信号与整个胞体荧光信号比值的统计图;
41.图6d为western blot检测sirt2过表达或者敲降之后的sirt2蛋白表达量以及其去乙酰化底物的乙酰化水平;
42.图6e为野生型小鼠少突胶质细胞前体细胞和g3 terc-/-小鼠少突胶质细胞前体细胞以及β-nmn处理之后的g3 terc-/-小鼠少突胶质细胞前体细胞中id4的mrna水平;
43.图6f为野生型小鼠和sirt2-/-小鼠脑组织中id4的mrna水平;
44.图6g为chip-qpcr检测dmso对照组以及β-nmn处理组中sirt2在id4启动子区的富集;
45.图7a为sirt2-/-小鼠和野生型小鼠脑组织中的sirt2蛋白含量;
46.图7b为sirt2-/-小鼠和野生型小鼠注射lpc诱导脱髓鞘后21天取材过程示意图;
47.图7c为sirt2-/-小鼠和野生型小鼠胼胝体损伤区复髓鞘的代表性透射电镜图片;
48.图7d为sirt2-/-小鼠和野生型小鼠复髓鞘的病理分级统计;
49.图7e为sirt2-/-小鼠和野生型小鼠复髓鞘轴突比例的统计图;
50.图7f为sirt2-/-小鼠和野生型小鼠的g-ratio的统计结果示意图;
51.图7g为sirt2-/-小鼠和野生型小鼠复髓鞘层间距的统计图。
具体实施方式
52.为使本公开的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本公开进一步详细说明。
53.需要说明的是,除非另外定义,本公开实施例使用的技术术语或者科学术语应当为本公开所属领域内具有一般技能的人士所理解的通常意义。本公开实施例中使用的“第一”、“第二”以及类似的词语并不表示任何顺序、数量或者重要性,而只是用来区分不同的组成部分。
54.髓鞘是由少突胶质细胞形成的节段样结构,髓鞘包裹轴突为其提供营养支持和保护作用,也是神经信号跳跃式传导的结构基础。少突胶质细胞受损引起的髓鞘变性称为脱髓鞘。少突胶质细胞前体细胞可以分化为成熟的少突胶质细胞,形成新的髓鞘包裹轴突,这一过程称为髓鞘修复。髓鞘修复可以贯穿从发育、成年到衰老的生命全过程,是中枢神经系统中唯一可完整发生的再生过程。
55.中枢神经系统脱髓鞘疾病包括:髓鞘和少突胶质细胞的炎症性损害引发的脱髓鞘比如多发性硬化症;影响少突胶质细胞的遗传因素引发的髓鞘形成受损比如脑白质营养不良。另外,衰老、自身免疫疾病、缺血或缺氧、病毒感染和遗传性因素等多种原因都可以引起髓鞘退行性改变。脱髓鞘也是神经系统衰老和神经变性疾病比如阿尔兹海默症和亨廷顿舞蹈症等的早期事件之一,是神经系统脱髓鞘疾病的特征性病理基础。中枢神经系统脱髓鞘疾病由于脱髓鞘病变累及脑区、病灶大小和数目不同而呈现多种多样的临床表现,包括但不限于视神经炎引起的单眼视力丧失,横贯性脊髓炎引起的肢体无力或感觉丧失,脑干功
能障碍引起的复视或小脑病变引起的共济失调。通常在10年到20年后,许多患者的临床病程逐渐发展,最终导致行动能力和认知能力受损,严重影响患者的生活质量甚至导致死亡。因此,探索促进中枢神经系统髓鞘修复的药物具有重要的意义。
56.对于中枢神经系统脱髓鞘疾病,临床上尚无有效促进髓鞘修复的药物,目前主要的治疗方法是给予免疫调节剂,虽然免疫调节剂能够减缓疾病进程,但对修复髓鞘没有作用,不能完全阻止疾病发展,治标不治本;另外免疫调节剂价格昂贵,增加了患者经济困难,患者依从性降低。
57.β-烟酰胺单核苷酸、烟酰胺和烟酰胺核糖是烟酰胺腺嘌呤二核苷酸的前体,烟酰胺腺嘌呤二核苷酸是细胞能量代谢的重要中间产物,在很多生物过程的调节中发挥关键作用。为了探究烟酰胺腺嘌呤二核苷酸的前体是否在脱髓鞘修复的分化过程中发挥作用,本公开以β-烟酰胺单核苷酸为例,对β-烟酰胺单核苷酸促进sirt2进入少突胶质细胞前体细胞的细胞核、β-烟酰胺单核苷酸促进少突胶质细胞前体细胞的分化和β-烟酰胺单核苷酸促进髓鞘修复均进行了研究。下述结合具体实验例进行详细说明。
58.实验例
59.下述实验中采用的野生型小鼠为c57bl/6p0-p2小鼠和c57bl/6成年小鼠,购于上海斯莱克;采用的g3 terc-/-早衰小鼠,即第三代端粒酶rna组分敲除小鼠,由杂合子小鼠交配得到第一代纯合子小鼠,再由第一代纯合子小鼠交配得到第二代纯合子,最后由第二代纯合子小鼠交配得到第三代纯合子;采用的sirt2-/-小鼠购于jackson lab。
60.采用的β-烟酰胺单核苷酸(以下简称β-nmn)购于邦泰生物工程有限公司,货号1094-61-7;溶血卵磷脂(以下简称lpc),购于sigma,货号l4129;兔抗olig2,购于millipore,货号ab9610;大鼠抗mbp,购于bio-rad,货号mca409s;兔抗sirt2,购于sigma,货号s8447;驴抗兔-488,购于jackson immunoresearch,货号711-545-152;驴抗大鼠-cy3,购于jackson immunoresearch,货号712-165-153;驴抗兔-cy3,购于jackson immunoresearch,货号711-165-152;兔抗h3k18ac,购于active motif,货号39693;兔抗h3,购于abcam,货号ab1791;小鼠抗β-actin,购于sigma,货号a5441;驴抗兔-hrp,购于jackson immunoresearch,货号711-035-152;驴抗小鼠-hrp,购于jackson immunoresearch,货号715-035-151;鼠抗flag,购于mbl,货号m185-3l;鼠igg,购于beyotime,货号a7028。
61.1.实验方法
62.1.1原代少突胶质细胞前体细胞的培养
63.培养过程中采用的培养基有两种:培养基一:dmem/f12+10%胎牛血清+1%青霉素/链霉素;培养基二:neurobasal+b27+n2+1%青霉素/链霉素。以上培养基成分均购于gbico,货号分别为:dmem/f12(11320082),胎牛血清(10099141),青霉素/链霉素(15140163),neurobasal(21103049),b27(17504044),n2(17502001)。
64.培养过程如下:小鼠全身喷酒精,剪断颈;再用手术剪剪开皮,再沿颅骨中缝剪开,左右各开一小口,用弯镊剥离脑壳,捞出全脑,放入预冷的hbss(gbico,14025092)中;去掉脑干部分,大脑左右半球夹开,剥离脑膜,腹侧朝上,去除海马和核团,只留皮层,去除明显可见的出血点;放入预热的培养基一中,用镊子将组织夹成碎片,然后用1ml的枪头慢慢吹散至无肉眼可见的组织块;加入到多聚赖氨酸预包被的75cm2培养瓶中,培养基一补足至10ml,开始培养;第三天晚上换液,之后每两天换一次液,到第十天晚上收细胞;培养瓶拧
紧,封口膜封好,摇床上37℃下100rpm摇1h;吸出培养基,换培养基一,继续摇床上37℃250rpm摇12-18小时;第二天上午,吸出培养基至10cm的培养皿(不需要包被),37℃静置30分钟;将培养基转移到15ml离心管,1000rpm离心3-4分钟弃上清;培养基一重悬(具体体积依细胞量而定)加到多聚赖氨酸预包被的六孔板或小玻片上,37℃培养3-4小时后换成培养基二,第二天可以进行后续实验。
65.1.2脱髓鞘模型小鼠的构建
66.将lpc注射到小鼠胼胝体区构建局部脱髓鞘模型,具体操作方法如下:
67.将10mg lpc溶于1ml pbs中,超声至完全溶解,溶液澄清。
68.将小鼠腹腔注射戊巴比妥钠(30mg/kg)麻醉;将小鼠头部固定在脑立体定位仪上,前后作用水平,轻按头部保证其不晃动;在小鼠眼部涂抹青霉素眼膏,防止光照射眼部受伤;头部用碘酒消毒,剃毛;剪开头部皮肤,露出颅骨,用10%双氧水擦拭,暴露前囟;定位至前囟前0.5mm处,用钻头钻孔,孔不宜太大;微量注射针吸入3μl lpc,缓缓向下,至脑表处,记下刻度,再慢慢向下旋至脑表下2.0mm处;以2μl/10分钟的速度注射lpc,每只小鼠注射2μl;注射结束后,留针10min后再开始缓慢拔针,5min后拔出;缝合头部皮肤,将小鼠从定位仪上取下来放到热垫上,待麻药退去后放回鼠笼。21天后灌流,灌流方法为:首先将小鼠腹腔注射戊巴比妥钠(30mg/kg)进行麻醉,用4℃预冷的pbs心脏灌流去血,再用4℃预冷的4%戊二醛心脏灌流固定5-8分钟,然后取小鼠脑组织,在4%戊二醛中4℃后固定至少一周。
69.灌流后制作透射电镜样品,制作过程如下:首先剖离目标组织块,约1mm3,在4%戊二醛中4℃固定过夜;再用0.1m的二甲砷酸钠缓冲液漂洗3次,每次10min,冰上操作(0.1m的二甲砷酸钠缓冲液配置:a液:4.28g二甲砷酸钠溶于100ml ddh2o中;b液:0.88ml hcl加入到50ml ddh2o中。100ml a液,5.4ml b液加入到80ml ddh2o中,用蔗糖调渗透压至300,ddh2o定容至200ml);之后用2%的锇酸冰上固定1h,再用ddh2o漂洗4次,每次5min;接下来用2%醋酸双氧铀室温固定1h,再用ddh2o漂洗4次,每次5min;之后用梯度浓度(50%,70%,90%,95%)的丙酮对样品进行脱水处理,每次10min,再用100%丙酮脱水3次,每次20min;之后用包埋剂与丙酮的混合液(v/v=1/3,1/1,3/1)分别处理2h,再在纯包埋剂中包埋过夜,第二天更换一次纯包埋剂,包埋2h;接下来将样品转移至有纯包埋剂的样品台上45℃聚合12h,然后65℃聚合48-72h,待样品聚合好后在leica em uc7超薄切片机进行切片,获得60-90nm切片;将切片在柠檬酸铅和醋酸双氧铀饱和溶液中染色5min,并在tecnai g2 spirit 120kv电镜下进行观察拍照。
70.电镜下观察髓鞘,结果如附图1所示:正常髓鞘化轴突外紧密包裹髓鞘,脱髓鞘后轴突裸露,复髓鞘后轴突重新包裹髓鞘,只是髓鞘会变薄。
71.1.3sirt2过表达稳转株和sirt2敲降稳转株的构建
72.1.3.1sirt2过表达载体和sirt2敲降载体的构建
73.构建sirt2过表达载体时使用的质粒为pcdh-cmv-ef1α-mcs-flag-p2a-copgfp,将sirt2基因插入多克隆位点,由cmv和ef1α启动子共同启动sirt2的表达。
74.具体过程为:采用高保真酶pcr得到sirt2全长产物;然后进行dna电泳,在凝胶成像仪中将目标条带切下;使用通用型dna纯化回收试剂盒进行胶回收;使用限制性内切酶xbaⅰ和bsiwⅰ对2μg质粒和胶回收得到的sirt2 dna于37℃下进行双酶切30min;dna电泳切胶后,使用通用型dna纯化回收试剂盒进行胶回收;回收得到的线性化质粒和sirt2片段按
摩尔质量1:1的比例用连接酶于室温下进行连接2h;连接产物与50μl大肠杆菌感受态混合,冰上放置30min,42℃热激90s,冰上放置3min;加入1ml lb培养基,37℃下250rpm的摇床上复苏1h;菌液离心后,200μl培养基重悬,取100μl菌液涂布到含有氨苄抗性的细菌培养板上培养过夜;第二天挑取单菌落,进行测序;测序正确的细菌部分保种,部分扩大培养摇过夜;过夜培养的菌液4℃下3000rpm离心10min后采用无内毒素质粒提取试剂盒提取质粒,得到sirt2过表达载体。
75.构建sirt2敲降载体时使用的质粒为pgreenpuro,将shrna正反向引物序列退火形成双链后插入到pgreenpuro质粒中。其中,针对sirt2基因设计shrna序列,通过thermo fisher网站(https://rnaidesigner.thermofisher.com/rnaiexpress/)设计shrna。shrna的核苷酸序列包括:
76.shrna-f:5'—gatccggatgaaagagaagatcttctttcaagagaagaagatcttctctttcatcctttttg—3'(如seq id no:1所示),
77.shrna-r:5'—aattcaaaaaggatgaaagagaagatcttcttctcttgaaagaagatcttctctttcatccg—3'(如seq id no:2所示)。
78.sirt2敲降载体的构建具体过程为:取20μm的shrna正反向引物各1μl加入到18μl的ddh2o中,放入pcr仪中98℃下反应2min,然后关掉pcr仪,缓慢降温退火,约2h后拿出。用限制性内切酶bamhⅰ和ecorⅰ对2μg pgreenpuro质粒于37℃下进行双酶切30min;电泳后切胶,使用通用型dna纯化回收试剂盒进行胶回收;取1μl退火产物和线性化质粒于室温下连接2h;后续连接产物转化、测序、质粒提取过程同sirt2过表达载体的构建过程,得到sirt2敲降载体。
79.1.3.2稳转株构建
80.采用hek293t细胞作为宿主细胞包被慢病毒;具体过程为:用含有10%胎牛血清的dmem培养基培养hek293t细胞,细胞汇合度达到80%时,将培养基换成无血清的dmem培养基,2小时后转染;将sirt2过表达载体或者sirt2敲降载体与pspax2和pmd2.g按4:3:1的比例且总量为8μg混合,加入到1ml opti-mem中,混匀后加入16μl 1mg/ml的pei,轻轻混匀,室温静置5min后慢慢滴加到细胞中,混匀放入细胞培养箱中;转染8h后换成含有10%胎牛血清的dmem培养基,继续培养36-48h;荧光显微镜下观察细胞,此时90%以上的细胞带有荧光,将细胞培养基经过0.22μm滤器过滤后收集滤液,滤液中含有慢病毒。在实际应用中,若在一周内使用该滤液,则将其存放在4℃,如果在一周后使用该滤液,则将其存放在-80℃。
81.以每孔5*10^5个细胞的密度将oln93细胞种到6孔板中,培养12h后,待细胞汇合度达到80%左右,将培养基换成收集到的含有慢病毒的滤液;慢病毒感染36-48h后,在荧光显微镜下观察感染效率;将细胞用胰酶消化,梯度稀释成10个/ml,加到96孔板中,每孔100μl;待细胞贴壁后,显微镜下观察并标记出有单细胞且带荧光的孔;培养14天后,将被标记孔中形成单克隆的细胞消化下来扩大培养,即得到sirt2过表达稳转细胞株和sirt2敲降稳转细胞株。
82.1.4长期补充β-nmn对脱髓鞘小鼠髓鞘修复的影响
83.将3月龄的g3 terc-/-小鼠腹腔注射β-nmn作为β-nmn处理组,给药方式为:β-nmn溶于水,每天腹腔注射,持续3个月,剂量为10mg/kg体重;将3月龄的g3 terc-/-小鼠腹腔注射pbs作为pbs对照组,给药方式为:每天腹腔注射,持续3个月,剂量为10mg/kg体重。
84.持续3个月后注射lpc脱髓鞘,脱髓鞘方法同1.2,21天后,灌流、制作透射电镜样品,方法与1.2中相同,电镜观察损伤区的髓鞘恢复效率,结果如图2a~2e所示,图中结果显示,补充β-nmn后g3 terc-/-小鼠胼胝体区裸露轴突减少(图2b),统计结果也显示复髓鞘轴突的比例增加了一倍(图2d);新形成的髓鞘中,正常髓鞘的比例明显增加,2级髓鞘比例下降(图2c);g-ratio的统计结果显示新形成髓鞘的厚度也明显增加(图2e);新生髓鞘的层间距明显下降(图2f)。图2b~2f结果表明,体内长期补充β-nmn可以提高早衰小鼠髓鞘损伤后的修复效率。
85.1.5长期补充β-nmn对胼胝体损伤区的电信号传导功能的影响
86.将野生型年轻小鼠和野生型老年小鼠作为空白对照组,将3月龄的g3 terc-/-小鼠腹腔注射β-nmn作为β-nmn处理组,给药方式为:β-nmn溶于水,每天腹腔注射,持续3个月,剂量为10mg/kg体重;将3月龄的g3 terc-/-小鼠腹腔注射pbs作为pbs对照组,给药方式为:每天腹腔注射,持续3个月,剂量为10mg/kg体重。
87.持续3个月后注射lpc脱髓鞘,脱髓鞘方法同1.2,21天后,小鼠腹腔注射戊巴比妥钠(30mg/kg)麻醉,取脑组织;将脑组织转移到预冷的切片缓冲液中,并保持通95%o2和5%co2气体;在震荡切片机上进行冠状切片,厚度为250μm;取脱髓鞘位置(bregma-1.0mm)前后共4张脑片,在人工脑脊液中34.5℃孵育1h;接着将脑片转移至室温,放置到记录槽中,平衡半小时后开始记录;将室温调至21.5℃;刺激电极使用钨电极,记录电极使用玻璃电极(1
–
3mω),刺激脉冲为0.1ms,电流强度为1ma;诱发复合动作电位记录后由spike2软件进行线下分析。数据分析时,每次记录平均100个重复用于波形分析,传导速度由两次刺激位点和记录电极间的距离差除以时间差进行估计,振幅为两个去极化相的峰值到正极前后相切点的垂直距离。
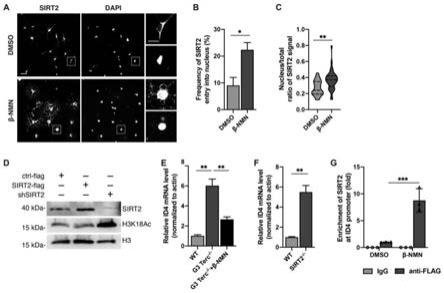
88.其中,切片缓冲液包括:2.5mm kcl、1.25mm nah2po4、26mm nahco3、10mm dextrose、213mm sucrose、2mm mgso4和2mm cacl2;人工脑脊液包括:126mm nacl、2.5mm kcl、1.25mm nah2po4、26mm nahco3、25mm dextrose、2mm mgso4和2mm cacl2,315
–
325mosm,且人工脑脊液ph为7.2
–
7.3。
89.图3a为脱髓鞘21d后大脑的冠状切片以及电极放置示意图,图中左侧为钨刺激电极,右侧为玻璃记录电极,冠状切片厚度为250μm。
90.各组小鼠的胼胝体复合动作电位结果如图3b~图3d所示,图中结果显示,各组小鼠的胼胝体复合动作电位的波形图有两相,第一相为有髓鞘包裹的快传导轴突,第二相为无髓鞘包裹的慢传导裸露轴突(图3b);野生型年轻小鼠和β-nmn处理的g3 terc-/-小鼠有90%以上的脑片都可以记录到电信号,而野生型老年小鼠和pbs处理的g3 terc-/-小鼠可记录到电信号的脑片数目不足50%(附图3c);pbs处理的g3 terc-/-小鼠的快传导相与慢传导相幅值之比与野生型年轻小鼠相比显著下降,而补充β-nmn之后明显上调,甚至超过了野生型年轻小鼠(附图3d);其中,快传导相与慢传导相幅值之比即为有髓鞘轴突与无髓鞘轴突数目之比。图3b~3d结果表明,体内长期补充β-nmn可以在功能上促进胼胝体的信号传导。
91.1.6损伤时或损伤后补充β-nmn对脱髓鞘小鼠髓鞘修复的影响
92.如图4a所示,在对g3 terc-/-小鼠腹腔注射lpc前半小时或者注射lpc后3天,分别腹腔注射β-nmn作为β-nmn处理组,在对g3 terc-/-小鼠腹腔注射lpc前半小时腹腔注射pbs作为pbs对照组;对β-nmn处理组和pbs对照组小鼠分别进行灌流、制作透射电镜样品,方法
与1.2中相同,电镜观察损伤区的髓鞘恢复效率,结果如图4b~4f所示,且图4b中上牌图片标尺为2μm,下排图片标尺为200nm;图中结果可知,无论是损伤当时还是损伤完成后补充β-nmn,胼胝体区裸露轴突数目均明显减少且髓鞘结构明显变好(图4b);补充β-nmn后,新形成的髓鞘比例增加(图4d);新生髓鞘中正常髓鞘的比例明显增加,1级髓鞘比例下降(图4c);g-ratio的统计结果显示新形成髓鞘的厚度也明显增加(图4e);新生髓鞘的层间距明显下降(图4f)。图4b~4f结果表明,髓鞘损伤时或损伤后补充β-nmn均可以提高髓鞘损伤后的修复效率。
93.1.7β-nmn对少突胶质细胞前体细胞分化的影响
94.分别培养野生型小鼠和g3 terc-/-小鼠的少突胶质细胞前体细胞,培养方法同1.1;对于培养后的野生型小鼠和g3 terc-/-小鼠的少突胶质细胞前体细胞分别采用β-nmn处理作为β-nmn处理组,β-nmn的给药浓度为1mm,处理时间为48小时;对于培养后的野生型小鼠和g3 terc-/-小鼠的少突胶质血包前体细胞分别采用dmso处理作为dmso处理组,dmso的给药体积与β-nmn相同,处理时间为48小时。
95.处理结束后,将各组小鼠的少突胶质细胞前体细胞分别采用免疫荧光染色法进行显示,免疫荧光检测方法过程如下:将培养野生型小鼠和g3 terc-/-小鼠的少突胶质细胞前体细胞分别在4%的多聚甲醛中固定10min,用pbs洗3次,之后在含0.3%triton x-100的5%驴血清中封闭1h;将兔抗olig2和大鼠抗mbp与2.5%的驴血清分别按照1:200的比例和1:500的比例稀释后室温孵育4小时,用pbs洗3次;再滴加驴抗兔-488和驴抗大鼠-cy3室温孵育1h,其中驴抗兔-488和驴抗大鼠-cy3分别与2.5%的驴血清按照1:400的比例稀释,孵育后用pbs洗3次;之后用dapi染细胞核10min,pbs洗3次;封片观察。
96.结果如图5a~5b所示,图中结果显示,补充β-nmn后,野生型小鼠和g3 terc-/-小鼠分化成熟的少突胶质细胞数目都有增加(图5a),统计结果也显示野生型和g3 terc-/-小鼠少突胶质细胞前体细胞的分化效率都明显增加(图5b)。
97.1.8少突胶质细胞前体细胞中sirt2定位检测
98.培养野生型小鼠的原代少突胶质细胞前体细胞,培养方法同1.1,采用β-nmn处理野生型小鼠的原代少突胶质细胞前体细胞作为β-nmn处理组,β-nmn的给药浓度为1mm,处理时间为48小时;采用dmso处理野生型小鼠的原代少突胶质细胞前体细胞作为dmso对照组,dmso的给药体积与β-nmn相同,处理时间为48小时;然后采用免疫荧光检测实验组和对照组中原代少突胶质细胞前体细胞中sirt2定位;免疫荧光检测方法过程如下:将原代少突胶质细胞前体细胞在4%的多聚甲醛中固定10min,用pbs洗3次,之后在含0.3%triton x-100的5%驴血清中封闭1h;将兔抗sirt2与2.5%的驴血清按照1:200的比例稀释后室温孵育4小时,用pbs洗3次;再滴加驴抗兔-cy3室温孵育1h,其中将驴抗兔-cy3与2.5%的驴血清按照1:400的比例稀释,孵育后用pbs洗3次;之后用dapi染细胞核10min,pbs洗3次;封片观察。
99.β-nmn处理组和dmso对照组免疫荧光检测结果如图6a所示,图6a显示了在采用dmso或β-nmn处理原代少突胶质细胞前体细胞后,细胞内的sirt2定位图,图中最右侧为左侧图中方框标识部分的放大图。sirt2入核的细胞比例的统计图如图6b所示,由图中结果可知,dmso处理的对照组中sirt2进入原代少突胶质细胞前体细胞的细胞核的比例为9%,而β-nmn处理的实验组中sirt2进入原代少突胶质细胞前体细胞的细胞核的比例为22%。细胞核中sirt2的荧光信号与整个胞体荧光信号比值的统计结果如图2c所示,由图中结果可知,
β-nmn处理的实验组中原代少突胶质细胞前体细胞的细胞核中sirt2的荧光信号与整个胞体荧光信号的比值也明显增加。
100.图6a、图6b和图6c的结果表明,β-nmn能够促进sirt2进入少突胶质细胞前体细胞的细胞核。
101.构建质粒pcdh-cmv-ef1α-mcs-flag-p2a-copgfp的稳转细胞株作为对照空载体,构建方法同sirt2过表达稳转株或sirt2敲降稳转株的构建方法。然后将sirt2过表达稳转株、sirt2敲降稳转株和对照空载体稳转株进行western blot实验,实验过程如下:将各稳转株中加入裂解液,匀浆后冰上放置30min至细胞完全裂解,然后4度1000g离心5min,取蛋白上清;蛋白样品中加入5x loading buffer,95度金属浴5min变性。电泳上样量为20μg,200v电泳60min;将pvdf膜在甲醇中浸泡30s后转膜,蛋白胶放负极,pvdf膜放正极,组装好后开始转膜,300ma,75min;转膜结束后将膜取出,在5%脱脂牛奶中封闭2h,之后分别在兔抗sirt2、兔抗h3k18ac和兔抗h3中4度孵育过夜,其中,兔抗sirt2、兔抗h3k18ac和兔抗h3分别与tbst按照1:1000的比例稀释,孵育后用tbst洗3次,每次5min;接着在驴抗兔-hrp中4度孵育2h,其中,驴抗兔-hrp与tbst按照1:10000的比例稀释,孵育后用tbst洗3次,每次5min;膜上滴加ecl显影液,在化学发光成像仪中显影。
102.western blot实验结果如图6d所示,其中ctrl-flag表示对照空载体稳转株组,sirt2-flag表示sirt2过表达稳转株组,shsirt2表示sirt2敲降稳转株组;图中结果显示,与对照空载体稳转株组相比,h3k18的乙酰化水平在sirt2过表达后下调,而在sirt2敲降之后明显上调,由此可以确定,少突胶质细胞前体细胞中sirt2的组蛋白去乙酰化位点为h3k18。
103.培养g3 terc-/-小鼠和野生型小鼠的少突胶质细胞前体细胞,培养方法同1.1,用β-nmn处理g3 terc-/-小鼠的少突胶质细胞前体细胞,β-nmn的给药浓度为1mm,处理时间为48小时,然后采用rt-pcr检测β-nmn处理g3 terc-/-小鼠的少突胶质细胞前体细胞、未处理g3 terc-/-小鼠的少突胶质细胞前体细胞和野生型小鼠的少突胶质细胞前体细胞分化抑制因子id4的mrna水平;其中rt-pcr检测采用的引物名称分别为id4-f:5'—gctggagactcaccctgctttg—3'(如seq id no:3所示),和id4-r:5'—tgctgtcaccctgcttgttcac—3'(如seq id no:4所示);rt-pcr的检测过程为:首先用rna提取试剂盒提取rna,接着取1μg rna反转录成cdna,pcr体系如下:
[0104][0105]
pcr程序为:95度,30秒;95度,5秒,60度,30秒,40个循环。
[0106]
野生型小鼠少突胶质细胞前体细胞和g3 terc-/-小鼠少突胶质细胞前体细胞以及β-nmn处理之后的g3 terc-/-小鼠少突胶质细胞前体细胞中id4的mrna水平检测结果如图6e所示,图中结果显示,在未经处理的g3 terc-/-小鼠少突胶质细胞前体细胞中少突胶质细胞
前体细胞分化抑制因子id4的转录,明显高于野生型小鼠,而β-nmn处理之后的g3 terc-/-小鼠少突胶质细胞前体细胞中少突胶质细胞前体细胞分化抑制因子id4的转录显著下调。
[0107]
采用rt-pcr检测sirt2-/-小鼠脑组织和野生型小鼠脑组织中id4的mrna水平,结果如图6f所示,图中结果显示,sirt2-/-小鼠脑组织中id4的mrna水平与野生型小鼠脑组织中id4的mrna水平相比显著上调。
[0108]
采用β-nmn处理sirt2过表达稳转株作为β-nmn处理组,β-nmn的给药浓度为1mm,处理时间为48小时,采用dmso处理sirt2过表达稳转株作为dmso对照组,dmso的给药体积与β-nmn相同,处理时间为48小时,然后采用染色质免疫共沉淀结合定量pcr(chip-qpcr)检测β-nmn处理组和dmso对照组中sirt2在id4启动子区的富集;其中chip-qpcr检测采用的引物名称分别为chip-id4-f:5'—tggcactgtcctcctgattg—3'(如seq id no:5所示),和chip-id4-r:5'—ccctcaaagtaacgacttccaa—3'(如seq id no:6所示)
[0109]
chip-qpcr的检测过程为:将β-nmn处理组细胞和dmso对照组细胞分别铺到3个10cm的细胞培养皿中,培养细胞至80%-90%汇合度,换液为10ml新鲜培养基;每个培养皿中滴加270μl 37%甲醛至终浓度为1%,室温低速摇10min进行交联;每个培养皿中滴加500μl 2.5m甘氨酸,室温低速摇5min终止交联;弃培养基,并用2ml预冷的pbs洗3次;每个培养皿中加入1ml胰酶,37度消化5min,用含有血清的培养基终止消化;消化下来的细胞4度3000rpm离心5min,弃上清;用1ml预冷的pbs洗1次,4℃3000rpm离心5min;弃上清,用500μl细胞裂解液(ph7.5的50mm tris-hcl+0.5%sds+5mm edta,使用前加入蛋白酶抑制剂)裂解,4℃转5min后短暂离心;超声使dna断裂,超声条件为:10%功率,超声0.5s,停0.5s,共超声25min(超声条件需要前期预实验摸索,最终得到的dna片段为100bp-300bp);4度12000rpm离心10min取上清;加入5μg鼠抗flag或鼠igg,4度转过夜;第二天,取50μl琼脂糖珠子,加入1ml封闭液(ph 8.0的10mm tris-hcl+1mm edta+1%bsa),4℃转10min,4℃3000rpm离心2min,弃上清;再次加入1ml封闭液,4℃转10min,4℃3000rpm离心2min,弃上清,用50μl细胞裂解液重悬;取出转过夜的样品,取1%作为input存放在-20℃,其余样品4℃12000rpm离心10min,取上清加入到封闭好的珠子中,4℃转2h;4℃3000rpm离心2min,弃上清;分别用洗涤液ⅰ(ph8.0的20mm tris-hcl+150mm nacl+2mm edta+1%triton x-100+1%sds)、洗涤液ⅱ(ph8.0的20mm tris-hcl+500mm nacl+2mm edta+1%triton x-100+0.1%sds)、洗涤液ⅲ(ph8.0的10mm tris-hcl+0.25m licl+1mm edta+1%np-40)、te缓冲液(ph 8.0的10mm tris-hcl+1mm edta)、te缓冲液洗涤珠子。每次洗涤都是4℃转15min,4℃3000rpm离心2min,弃上清;用100μl含有蛋白酶k的洗脱液(0.1m nahco3+0.1%sds)重悬珠子,室温转10min,室温3000rpm离心2min,收集上清;再用100μl含有蛋白酶k的洗脱液重悬珠子,室温转10min,室温3000rpm离心2min,收集上清与上一管合并;取出input样品室温解冻后加入200μl含有蛋白酶k的洗脱液;所有样品65度水浴过夜解交联;室温12000rpm离心10min,取上清;用dna纯化试剂盒进行纯化。纯化后采用定量pcr方法进行检测,pcr体系如下:
[0110][0111]
pcr程序为:95度,30秒;95度,5秒,60度,30秒,40个循环。
[0112]
chip-qpcr的检测结果如图6g所示,图中结果显示,与dmso对照组相比,β-nmn处理组的sirt2过表达稳转株细胞中sirt2与id4的启动子区dna结合明显增加。
[0113]
由图6a-图6g可以确定,β-nmn可以促进少突胶质细胞前体细胞中sirt2的入核,sirt2入核去乙酰化h3k18,进而抑制id4的转录,最后促进少突胶质细胞前体细胞分化。
[0114]
1.9sirt2对髓鞘修复的作用
[0115]
采用western blot检测sirt2-/-小鼠和野生型小鼠脑组织中的sirt2蛋白含量,western blot检测方法与1.4中的方法基本相同,其区别仅在于,采用的一抗为兔抗sirt2和小鼠抗β-actin,且兔抗sirt2与tbst按照1:1000的比例稀释,小鼠抗β-actin与tbst按照1:10000的比例稀释,采用的二抗为驴抗兔-hrp和驴抗小鼠-hrp,且驴抗兔-hrp和驴抗小鼠-hrp分别与tbst按照1:10000的比例稀释;western blot检测结果如图7a所示,图中结果显示,sirt2-/-小鼠脑组织中未检测到sirt2蛋白,则表明sirt2-/-小鼠中的sirt2基因被敲除。
[0116]
将野生型小鼠和sirt2-/-小鼠分别注射lpc诱导脱髓鞘后21天,图7b所示,灌流、制作透射电镜样品,方法与1.2中相同,电镜观察透射电镜样品,结果如图7c~7g所示,图中结果显示,sirt2敲除之后,新生髓鞘的比例明显下降,结构变差(附图7c);sirt2敲除小鼠胼胝体中新生髓鞘的比例明显下降(图7e);新生髓鞘中正常髓鞘的比例明显下降,1、2级松散髓鞘比例显著上调(图7d);g-ratio的统计结果显示新形成髓鞘的厚度也明显变薄(图7f);新生髓鞘的层间距明显增加(图7g)。图7c~7g中结果证明sirt2敲除之后髓鞘修复效率明显下降,sirt2对髓鞘修复是必不可少的。
[0117]
本公开提供的靶向敲降sirt2基因的shrna及β-烟酰胺单核苷酸在制备治疗神经退行性疾病的药物中的应用,β-烟酰胺单核苷酸能够促进sirt2进入少突胶质细胞前体细胞的细胞核内,从而促进少突胶质细胞前体细胞分化为成熟的少突胶质细胞,修复髓鞘进而实现脱髓鞘疾病的治疗,从根本上起到治疗脱髓鞘疾病的作用;并且服用安全性,成本降低,患者依从性高。
[0118]
需要说明的是,本公开的实施例还可以以下方式进一步描述:
[0119]
靶向敲降sirt2基因的shrna,其特征在于,所述shrna的核苷酸序列包括:
[0120]
shrna-f:5'—gatccggatgaaagagaagatcttctttcaagagaagaagatcttctctttcatcctttttg—3',
[0121]
shrna-r:5'—aattcaaaaaggatgaaagagaagatcttcttctcttgaaagaagatcttctctttcatccg—3'。
[0122]
烟酰胺腺嘌呤二核苷酸的前体在制备治疗神经退行性疾病的药物中的应用。
[0123]
可选地,所述烟酰胺腺嘌呤二核苷酸的前体包括β-烟酰胺单核苷酸、烟酰胺和烟酰胺核糖中的至少一种。
[0124]
可选地,所述治疗神经退行性疾病的药物包括治疗脱髓鞘疾病的药物。
[0125]
可选地,所述治疗脱髓鞘疾病的药物包括促进髓鞘修复的药物。
[0126]
可选地,所述促进髓鞘修复的药物包括促进少突胶质细胞前体细胞分化为成熟的少突胶质细胞的药物。
[0127]
可选地,所述促进少突胶质细胞前体细胞分化为成熟的少突胶质细胞的药物包括促进sirt2进入少突胶质细胞前体细胞的细胞核的药物。
[0128]
可选地,所述神经退行性疾病包括多发性硬化症、阿尔兹海默症、帕金森综合征、脊髓侧索硬化症和亨廷顿舞蹈症。
[0129]
可选地,所述治疗神经退行性疾病的药物是以烟酰胺腺嘌呤二核苷酸的前体作为唯一活性成分或者是包含烟酰胺腺嘌呤二核苷酸的前体的药物组合物。
[0130]
可选地,所述治疗神经退行性疾病的药物包括采用药学上可接受的辅料制成药学上可接受的任意剂型;优选地,所述治疗神经退行性疾病的药物包括汤剂、散剂、丸剂、酒剂、锭剂、胶剂、茶剂、曲剂、糕剂、露剂、棒剂、线剂、条剂、钉剂,灸熨剂,膏剂、丹剂、脂质体制剂、气雾剂、注射剂、合剂、口服安瓿剂、片剂、胶囊剂、滴丸剂、乳剂、膜剂和海绵剂中的至少一种。
[0131]
所属领域的普通技术人员应当理解:以上任何实施例的讨论仅为示例性的,并非旨在暗示本公开的范围(包括权利要求)被限于这些例子;在本公开的思路下,以上实施例或者不同实施例中的技术特征之间也可以进行组合,步骤可以以任意顺序实现,并存在如上所述的本公开实施例的不同方面的许多其它变化,为了简明它们没有在细节中提供。
[0132]
本公开实施例旨在涵盖落入所附权利要求的宽泛范围之内的所有这样的替换、修改和变型。因此,凡在本公开实施例的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本公开的保护范围之内。
