1.本发明属于细胞培养技术领域,具体提供一种间充质干细胞培养用无血清培养基及用途。
背景技术:
2.间充质干细胞(mscs)被认为是源自具有自我更新能力的中胚层的多能基质细胞。弗里登斯坦等人首次发表了关于解释源自人骨髓的贴壁和纺锤形细胞扩增的报告。这些间充质干细胞能够分化成各种细胞,包括骨细胞、软骨细胞、肌细胞和脂肪细胞。间充质干细胞通常的功能作用是通过分化组织特定细胞类型、增殖以及释放生长因子和免疫调节物质来维持组织平衡。最近的一些证据表明,间充质干细胞通过阻碍或抑制不需要的免疫反应来帮助组织再生,并赋予其生长因子,而不是直接恢复受损细胞。
3.通常情况下,动物细胞培养依赖于动物血清,动物血清可以为细胞生长提供激素、生长因子、贴壁因子、结合蛋白和其它营养物质等,动物血清虽然具有良好的促细胞生长的作用,但仍存在很多风险及弊端:(1)血清的价格十分昂贵,占成本的一半以上,使成本大幅度提高;(2)地域的差异、季节转换以及个体差异导致动物血清各个批次成分不稳定,最终致使细胞生长情况不同,影响实验及生产进度;(3)成分不确定,动物血清中含有多种成分,其中一大部分为蛋白质,给后续的实验及生产带来了很大的干扰;(4)动物血清中可能含有真菌、细菌、病毒、支原体等污染物。
4.awrk6(swvgkhgkkfglkkhkkh)是根据东北林蛙皮肤抗菌肽dybowskin-2cdya,由辽宁大学实验室优化改造得到的新型抗菌肽,分子量为2130.5,是具有α-螺旋的阳离子抗菌肽。前期研究表明,awrk6具有良好的抑菌细菌活性,并且awrk6在体内外能显著中和内毒素,并能抑制由lps所诱导的炎症因子tnf-α与il-8的释放,awrk6对小鼠腹腔巨噬细胞无毒性作用。
技术实现要素:
5.针对上述技术问题,本发明提供一种间充质干细胞培养用无血清培养基及用途。
6.本发明是这样实现的,提供一种间充质干细胞培养用无血清培养基,包括基础培养基和添加组分,所述添加组分包括以下成分:人血清白蛋白、人转铁蛋白、egf、fgf、人重组胰岛素、igf-1、氢化可的松、过氧化氢酶、超氧化物歧化酶、谷氨酰胺、酵母水解物、awrk6。
7.优选地,以所述添加组分的体积计,添加组分中各成分的含量为,人血清白蛋白:1-3g/l、人转铁蛋白:7-10mg/l、egf:7-10μg/l、fgf:5-10μg/l、人重组胰岛素:300-500μg/l、igf-1:60-100μg/l、氢化可的松:1-5mg/l、过氧化氢酶:170-250μg/l、超氧化物歧化酶:1
×
10
6-5
×
106u/l、谷氨酰胺:200-500mg/l、酵母水解物:250-750mg/l、awrk:6 200-250mg/l。
8.进一步优选,以所述添加组分的体积计,添加组分中各成分的含量为,人血清白蛋
白:3g/l、人转铁蛋白:7mg/l、egf:10μg/l、fgf:10μg/l、人重组胰岛素:300μg/l、igf-1:60μg/l、氢化可的松:1mg/l、过氧化氢酶:250μg/l、超氧化物歧化酶:5
×
106u/l、谷氨酰胺:400mg/l、酵母水解物:500mg/l、awrk6:220mg/l。
9.进一步优选,所述基础培养基与所述添加组分的体积比为100:0.5-4.0。
10.进一步优选,所述基础培养基与所述添加组分的体积比为50:1。
11.进一步优选,所述基础培养基为dmem/f12。
12.本发明还提供一种上述的间充质干细胞培养用无血清培养基的用途,用于脐带间充质干细胞的培养。
13.与现有技术相比,本发明的优点在于:
14.本发明通过在基础培养基中添加人血清白蛋白、人转铁蛋白、egf、fgf、人重组胰岛素、igf-1、氢化可的松、过氧化氢酶、超氧化物歧化酶、谷氨酰胺、酵母水解物、awrk6替代血清功能,成分明确、稳定,排除了血清培养的不稳定性,同时各成分之间协同作用,能够高效的扩增脐带间充质干细胞,缩短细胞周期,增殖迅速,且能够延缓细胞的衰老,细胞一致性好,能够高效的维持其生物学特性及分化潜能。
15.利用本发明提供的培养基培养的间充质干细胞,细胞免疫表型分析阳性标志物cd90和cd105表达率达99%以上;阴性标志物cd45表达率1%以下。此培养基培养的脐带间充质干细胞能够有效地维持其分化能,能够向软骨细胞、脂肪细胞、成骨细胞分化。因此使用此培养基培养的脐带间充质干细胞能够更好地应用在临床应用和科研上。
16.本发明的培养基不含动物来源血清及动物来源蛋白成分,排除了动物源蛋白污染,排除异源蛋白可能引起的免疫反应,同时排除动物来源的细菌、病毒感染等风险。
17.本发明的培养基在细胞培养效果上能够接近或超过含胎牛血清培养基的水平,适用于无血清培养体系,更安全可控,同时成本低廉,打破进口培养基价格高昂,供应不及时,价格垄断等状况。
附图说明
18.图1为人脐带间充质干细胞在实施例1提供的无血清培养基(a)、其他无血清培养基(b)和胎牛血清培养基(c)中培养后细胞形态图;
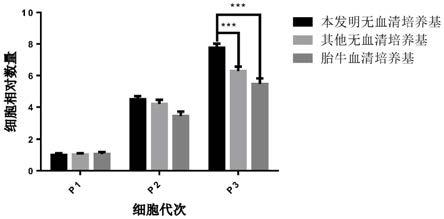
19.图2为人脐带间充质干细胞在实施例1提供的无血清培养基、其他无血清培养基和胎牛血清培养基培养条件下连续传代3次的细胞总数对比示意图;
20.图3为通过β-半乳糖苷酶染色检测细胞衰老情况示意图。
具体实施方式
21.为了使本发明的目的、技术方案及优点更加清楚明白,下面结合附图和实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用于解释本发明,并不用于限定本发明。
22.鉴于间充质干细胞的重要作用,如何获得高活性、高一致性、更安全的脐带间充质干细胞,是间充质干细胞研究应用的重要课题。为了提高间充质干细胞体外培养质量,降低风险,需要研发高效的间充质干细胞无血清培养基,本发明通过在基础培养基中添加多种细胞生长因子,多种重组蛋白等成分,替代血清功能,以期实现无动物源成分,同时还能够
高效的扩增间充质干细胞,获得的细胞一致性好,能有效维持其生物学特性及分化潜能,还减少血清培养带来的不稳定性,排除异源血清、人源提取成分等带来的生物安全风险等。
23.实施例1、
24.本实施例提供的间充质干细胞无血清培养基由以下成分组成:基础培养基和添加组分,基础培养基为dmem/f12,添加组分记为max组分,max组分和dmem/f12的具体物质组成如下:
25.(1)max组分中含有的组分及各组分的含量为(以max组分的体积计):
26.表1
[0027][0028][0029]
(2)dmem/f12组分中含有的组分及各组分含量为(以dmem/f12组分的体积计):
[0030]
表2
[0031]
[0032][0033]
本例中,基础培养基dmem/f12,也可以直接从试剂公司购买。
[0034]
本例中,基础培养基dmem/f12,由dmem/f12粉剂加水和1.2g碳酸氢钠,溶解后以0.22微米滤膜过滤而成。
[0035]
本例中,间充质干细胞无血清培养基以dmem/f12与max1按体积比1000ml:20ml配制而成。
[0036]
实施例2、
[0037]
本实施例提供实施例1的间充质干细胞无血清培养基的效果验证。
[0038]
本实施例的实验中采用人脐带间充质干细胞,该细胞来源于本实验室,此细胞用于下述所有实验。
[0039]
一、实验方法
[0040]
1、细胞培养
[0041]
人脐带间充质干细胞,以8000/cm2密度接种于培养瓶中。
[0042]
添加培养基进行连续培养,添加量约为15ml,每48-72h更换一次培养基,脐带间充质干细胞生长至约85%密度时进行传代培养,同时记录细胞数。继代培养仍以8000/cm2密度接种于6孔细胞培养板,连续传代培养3次,每样本设置3个重复实验组。
[0043]
二、细胞鉴定
[0044]
1、检测脐带间充质干细胞细胞形态及增殖效率
[0045]
按上述细胞培养的实验方法连续传代三次,同时追踪各代次细胞形态,如图1所示,结果显示,采用本发明无血清培养基的培养条件,连续传代三次,细胞同胎牛血清培养基培养相同形态均一,符合脐带间充质干细胞梭形;而采用其他无血清培养基的培养条件,
连续传代三次,细胞呈现非梭形,且状态一般。
[0046]
按上述细胞培养的实验方法连续传代三次,同时追踪各代次细胞总数,如图2所示,结果显示,采用实施例1的本发明无血清培养基的培养条件,脐带间充质干细胞在无血清条件下产率更高,传代三次(图2中p3),其细胞收获量高于胎牛血清培养基组和其他无血清培养基组细胞收获量。
[0047]
2、脐带间充质干细胞细胞表面标志物检测
[0048]
脐带间充质干细胞在实施例1的无血清培养基和胎牛血清培养基的培养条件下连续培养传代3次,以常规方法进行细胞免疫染色,通过细胞流式术进行标志物分析。细胞染色:阳性染色以apc/cy7anti-human cd90和pe anti-human cd105抗体染色;阴性以percp anti-human cd45进行染色;同时分别以对应的同型对照作为参照。
[0049]
使用bd facscanto ii进行细胞流式术分析。
[0050]
检测结果参见表4,结果显示,采用本实施例1的无血清培养基培养的脐带间充质干细胞能够很好的保证脐带间充质干细胞的生物特性不改变,且无血清培养条件下阳性标志物cd90和cd105表达率达99%以上;阴性标志物cd45表达率1%以下。
[0051]
3、脐带间充质干细胞细胞衰老测试脐带间充质干细胞在实施例1的无血清培养基培养条件下连续培养,然后观察检测细胞状态及细胞代次。
[0052]
结果如表5所示,结果显示,无血清培养条件下,加了awrk6时脐带间充质干细胞能够较好的延缓细胞的衰老。
[0053]
β-半乳糖苷酶染色
[0054]
脐带间充质干细胞连续培养,然后通过β-半乳糖苷酶染色法检测细胞衰老情况,如图3。
[0055]
实施例3、
[0056]
本实施例提供多种培养基的效果验证。本实施例的实验中采用人脐带间充质干细胞,该细胞来源于本实验室,此细胞用于下述所有实验。
[0057]
一、实验方法
[0058]
1、培养基的配制:
[0059]
根据实施例1的技术方法配制以下培养基:
[0060]
表3
[0061]
编号awrk6的浓度mg/lm10m2200m3210m4220m5230m6240m7250
[0062]
一、实验方法和结果
[0063]
1、细胞培养
[0064]
人脐带间充质干细胞,以8000/cm2密度接种于100mm细胞培养皿,实验所用细胞培
养皿皆经包被预处理。实验设置9组,分别采用m1,m2,m3,m4,m5,m6,m7,胎牛血清组和其他无血清组。
[0065]
添加以上培养基,进行连续培养,添加量约为15ml,每48-72h更换一次培养基,脐带间充质干细胞生长至约85%密度时进行传代培养,同时记录细胞数。继代培养仍以8000/cm2密度接种于6孔细胞培养板,连续传代培养3次,每样本设置3个重复实验组。
[0066]
2、细胞鉴定
[0067]
(1)、检测脐带间充质干细胞细胞形态及增殖效率,参见实施例2。
[0068]
按上述细胞培养的实验方法连续传代三次,同时追踪各代次细胞产率。脐带间充质干细胞在本发明无血清条件下产率更高,传代三次。
[0069]
(2)、脐带间充质干细胞细胞表面标志物检测,参见实施例2。
[0070]
细胞染色:阳性染色以apc/cy7anti-human cd90和pe anti-human cd105抗体染色;阴性以percp anti-human cd45进行染色;同时分别以对应的同型对照作为参照。使用bd facscanto ii进行细胞流式术分析。
[0071]
检测结果见下表,m1,m2,m3,m4,m5组,胎牛血清组和其他无血清组对照组条件下阳性标志物cd90和cd105表达率达95%以上;阴性标志物cd45表达率2%以下。m4配制方案优于m1、m2、m3、m5、m6配制方案。m7方案awrk6浓度过高时未能收获细胞。
[0072]
表4
[0073][0074][0075]
(3)、检测脐带间充质干细胞衰老代次,参见实施例2。
[0076]
按上述细胞培养的实验方法连续培养,同时追踪各代次细胞状态。
[0077]
检测结果见下表,显示没有加入awrk6的无血清培养基、胎牛血清培养基和其他无血清培养基最高能培养p8代次的细胞,加入awrk6后的无血清培养基能够培养p9代次以上的细胞。
[0078]
表5
[0079][0080]
(4)、β-半乳糖苷酶染色
[0081]
按上述细胞培养的实验方法连续培养,同时追踪各代次细胞状态。检测结果见图3,显示本发明无血清培养基能够延缓细胞的衰老。
[0082]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。
