1.本发明属于细胞提取技术领域,具体涉及肾小管上皮细胞分离与培养方法。
背景技术:
2.肾脏是一个复杂的器官,主要由肾小球、肾小管、系膜细胞、内皮细胞和足细胞组成。将这些组织和细胞从器官内分离纯化,接着体外培养这些原代细胞,可真实反映细胞在体内的状态,功能蛋白及标记物的表达较为完全,为基础研究中不可或缺的部分。另外,随着多种肾脏疾病相关治疗药物的兴起,应考虑开发体外培养细胞体系作为最直接简便的药品安全性检测平台。目前已有几种分离上述细胞的方案,其中分离得最多的是近端肾小管上皮细胞。它们在水平衡、酸碱的控制、化学分子的重吸收、异物和内源性代谢物的分泌等方面发挥着重要作用。
3.在过去,涉及到药品的肾毒性研究与安全评价都是在动物身上进行的,很难将相关的体外研究结果直接套用到人类身上。与人类相关的实验不但受到成本的限制,更多的是伦理问题。解决这些问题的其中一种方法是2d肾细胞培养。针对不同的测试对象和药物靶点等,可以分离出如肾小球,肾小管等组织和系膜细胞,足细胞等特定的细胞类型,对上述细胞类型进行针对性的研究。考虑到细胞永生化和长期细胞传代技术可能导致的基因组和表观遗传的变化,从肾组织分离出原代细胞仍是目前体外测试模型的金标准。
4.发明申请专利cn109402041a中公开了一种人肾小管上皮细胞分离及培养方法,包括步骤:(a)含双抗预冷pbs清洗组织标本;(b)剪碎并研磨组织,收集研磨后的组织块;(c)混合酶(胰蛋白酶、iv胶原酶和i型胶原酶)消化,筛网过滤,收集滤液离心;(d)percoll分离;(e)完全培养基重悬细胞沉淀,接种于培养瓶中;(f)培养数天后更换混合完全培养基继续培养。
5.酶消化法是从组织分离单个细胞常用的方法,常用的酶有胰蛋白酶、胶原酶、透明质酸酶和中性蛋白酶(分散酶)等等。由于每种组织的结构和成分不一样,同一组织不同种属间也存在差异,因此,不同的酶对不同的组织消化效能不同。胰酶等消化能力较强的酶很容易损伤细胞(消化不均匀)。在胰酶的消化过程中,部分细胞还没被消化,就有少部分细胞被过度消化,但当胰酶浓度达不到有效浓度,不能有效消化组织细胞。胰酶消化组织细胞从消化完全到消化过度的这一阶段的时间很短,难以把控消化时间,消化不完全产量就少,消化过度就导致细胞受伤,细胞活力下降,导致不能稳定地获得状态相同的细胞。
技术实现要素:
6.本发明的目的在于缩短酶消化肾皮质组织时间的同时,尽可能延长从消化完全到刚消化过度这一阶段的时间,提高消化肾皮质组织分离细胞的可控性,避免过度消化。一种简单、高效的肾小管上皮细胞分离与培养方法,该方法包括两次消化步骤。该方法适用于从人、猴和猪的肾皮质组织中分离和培养得到肾小管上皮细胞。第一次初步消化不仅缩短第二次消化的时间,而且延长了可控时间(从消化完全到刚消化过度的时间长)。另外,该方法
条件温和对细胞伤害小,提取细胞数量多,活力高,获得的肾小管上皮细胞增值速度快,可传代次数高。
7.本发明的目的是提供一种肾小管上皮细胞分离与培养方法。
8.本发明的目的是通过以下技术方案予以实现的:
9.一种肾小管上皮细胞分离与培养方法,包含以下步骤:
10.s1:组织机械分离:将肾皮质组织分割成组织碎块;
11.s2:酶解:第一消化酶消化组织碎块,离心去上清,再用第二消化酶消化获得细胞;
12.s3:细胞培养:将获得的细胞接种培养基培养;
13.所述第一消化酶包括分散酶和胶原酶;
14.所述第二消化酶为胶原酶。
15.在本发明的一些实施方式中,所述第一消化酶和第二消化酶所述的胶原酶为ii型胶原酶或iv型胶原酶。
16.在本发明的一些实施方式中,所述第一消化酶中分散酶的浓度为0.75~1.5mg/ml,胶原酶的浓度为1~2.5mg/ml。
17.在本发明的一些实施方式中,所述第二消化酶的浓度为1~2.5mg/ml。
18.在本发明的一些实施方式中,所述第一消化酶所述的分散酶和胶原酶的体积比为1:0.5~2。
19.在本发明的一些实施方式中,所述的第一消化酶的消化组织的时间为45~75min,第二消化酶的消化时间为40~60min。
20.在本发明的一些实施方式中,所述步骤s2每克组织碎块加入第一消化酶2~3ml,每克组织碎块加入第二消化酶0.5~0.1ml。
21.在本发明的一些实施方式中,步骤s1中所述的组织碎块为1~3mm3。
22.在本发明的一些实施方式中,所述步骤s3中细胞接种密度为0.5~1.5
×
106个/75m2。
23.在本发明的一些实施方式中,所述步骤s2中的离心条件为:800~1200rpm离心4~10min。
24.在本发明的一些实施方式中,所述步骤s2中的离心条件为:1000rpm离心5min。
25.在本发明的一些实施方式中,为了更好的保持细胞活性,所述离心最好发生在低温环境中,优选为3~10℃,更优选为4℃。
26.本发明的有益效果是:
27.(1)消化时间相对短,组织细胞从消化完全到消化过度这阶段的时间长,方便把控消化时间,不容易造成消化过度;
28.(2)机械分离和酶解分离的方法比较温和,获得的细胞存活率高(>50%),状态好(高增殖性);
29.(3)获得的肾小管上皮细胞无需基质层铺板培养,增殖速度快(1
×
106初代细胞接种在t25瓶中,72小时内可达到完全汇合),可传代次数高。
30.(4)操作简单,无需配套不锈钢网筛、研磨设备、percoll梯度离心分离等设备。
附图说明
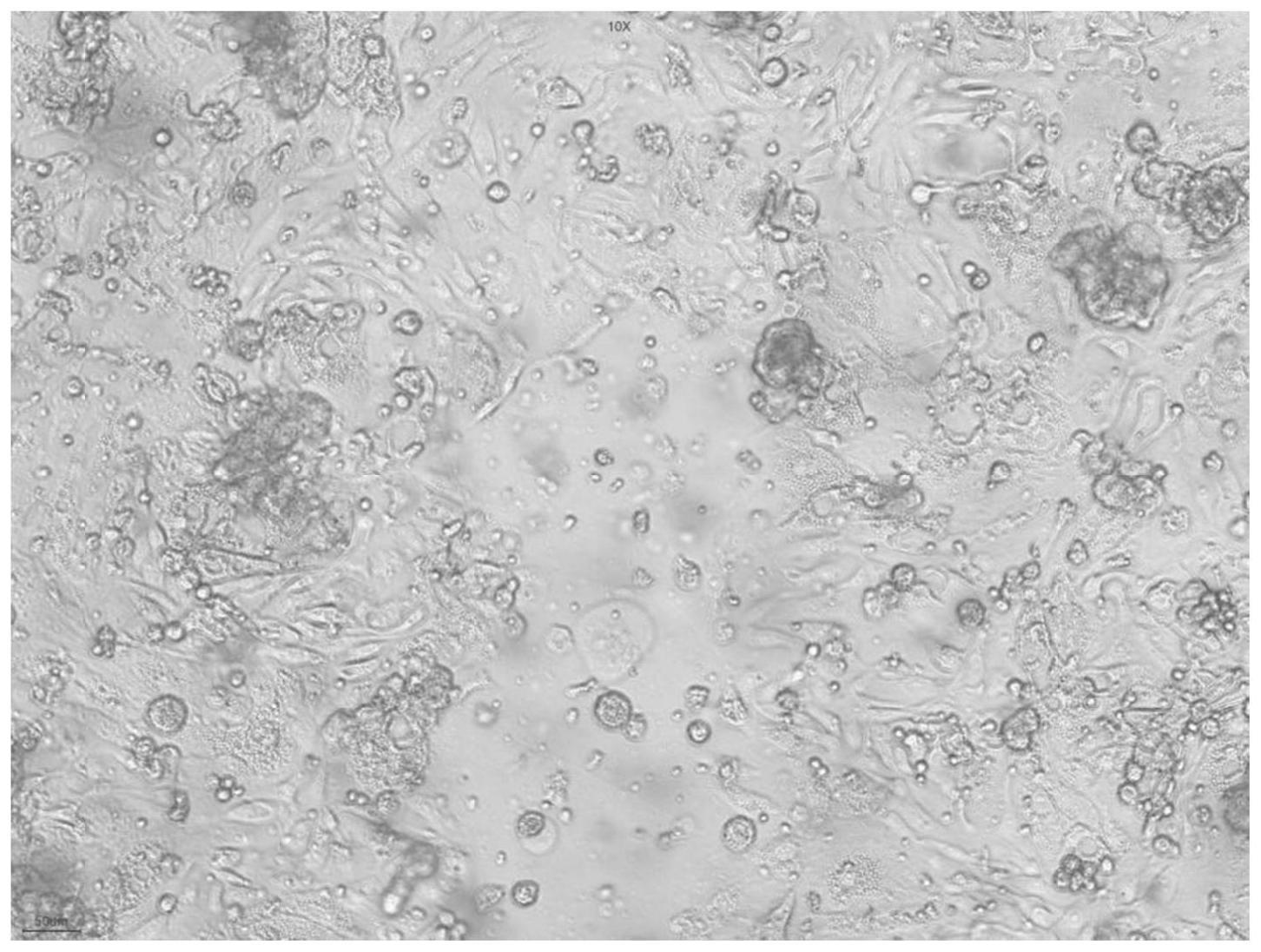
31.图1为p0细胞在72h内可达到100%汇合度。
32.图2为实施例1分离培养的肾小管上皮细胞长满汇合状态,其中p1为细胞第一代,p4为细胞第四代和p6为细胞第六代。
33.图3为实施例1的p6代肾小管上皮细胞状态。
34.图4为实施例2分散酶和ii型胶原酶消化60min,再用iv型胶原酶消化45min得到的细胞。其中图4a为细胞生长状况;图4b为细胞活力。
35.图5为实施例2的p0代肾小管上皮细胞长满汇合状态。
36.图6为实施例3分散酶和iv型胶原酶消化70min,再用ii型胶原酶消化45min得到的细胞。其中图6a为细胞生长状况;图6b为细胞活力。
37.图7为对比例1的胰酶消化10min得到的细胞。
38.图8为对比例2的ii型胶原酶消化4h得到的细胞。
39.图9为对比例4的木瓜蛋白酶消化30min所得的细胞活力。
40.图10为对比例5的ii型胶原酶和分散酶消化3h得到的细胞。
41.图11为对比例6的ii型胶原酶和分散酶消化105min得到的细胞。
42.图12为对比例6的ii型胶原酶和分散酶消化105min得到的细胞,离心取1*106个细胞接种于培养基,p0代肾小管上皮细胞长满汇合的状态。
43.图13为对比例7的iv型胶原酶和分散酶消化105min得到的细胞。
44.图14为对比例7的iv型胶原酶和分散酶消化105min得到的细胞,离心取1*106个细胞接种于培养基,p0代肾小管上皮细胞长满汇合的状态。
45.图15为对比例8的ii型胶原酶和木瓜蛋白酶消化30min得到的细胞。
46.图16为对比例9的分散酶和木瓜蛋白酶消化30min得到的细胞。
47.图17为对比例10的分散酶和ii型胶原酶消化1h,再用胰酶消化5min得到的细胞。
48.图18为对比例11的分散酶和ii型胶原酶消化1h,再用胰酶消化10min得到的细胞。其中图18a为细胞生长状态;图18b为细胞活力。
49.图19为对比例12的分散酶和ii型胶原酶消化3h,再用木瓜蛋白酶消化30min得到的细胞。
50.图20为对比例13的ii型胶原酶和分散酶消化4小时,再用木瓜蛋白酶消化30min得到的细胞。
51.图21为对比例14的ii型胶原酶,木瓜蛋白酶和分散酶消化30min得到的细胞。
52.图22为对比例18的iv型胶原酶消化1h,再用分散酶和iv型胶原消化30min所得细胞的细胞活力。
53.图23为对比例23的过筛+percoll细胞分离液的梯度密度离心法所得的细胞状态,其中图23a为过筛,图23b为过筛后活力检测,图23c为梯度密度离心后状态。
54.图24为对比例23的过筛+percoll细胞分离液的梯度密度离心法所提取的p0细胞状态。
具体实施方式
55.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以
充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
56.实施例1肾原代小管上皮细胞的分离与培养的方法
57.(1)肾皮质预处理:冲洗干净的人肾脏组织放入装有4℃pbs的不锈钢托盘中,用组织剪和镊子去除包膜和脂肪等,用手术刀把肾脏从中间割开,沿皮质和髓质的颜色分界线,把皮质割开,完全分离皮质部分,分离下来的皮质放入装有4℃pbs的50ml离心管中,彻底清洗,移液枪吸去上清,重复多次至溶液中没有血迹(若为皮质组织则只需进行皮质剪碎)。剩余的组织块称重记录后,将剩余的肾皮质用手术剪刀剪成1~3mm3,尽可能剪得最小块。浸泡于放着4℃的pbs的培养皿中,培养皿底部垫着冰袋,分离下来的皮质放入装有4℃pbs的离心管中,彻底清洗,移液枪吸去上清,重复多次至溶液中没有血迹。
58.(2)酶解消化:
59.在装有肾皮质组织碎块的离心管中放入消化酶进行消化:分散酶(1mg/ml)和ii型胶原酶(2mg/ml)按体积比1:1混合,取1g肾皮质组织碎块加入2ml上述酶混合液,消化组织50min后离心去上清,加入0.75ml iv型胶原酶(2mg/ml)再消化45min。所述离心条件:1000rpm 4℃离心5min。
60.(3)肾小管上皮细胞种板和培养方案:
61.2d纯肾小管细胞的体外培养无需细胞外基质成分铺板。培养基成分方案:dmem-f12+10%胎牛血清+1%青霉素/链霉素。
62.在酶解作用结束之后,通过离心程序清除上清中的胶原酶。然后将细胞重悬在上述的培养基中,滤过100μm的细胞筛,取筛下液细胞种板和检测细胞存活率(台盼蓝法),种板密度在t75瓶内是1*106左右。2天内不要移动培养瓶,等待细胞适应体外培养状态,逐渐粘附到瓶壁。
63.结果:细胞在72h内可达到100%汇合度(图1),期间每2天可换一次培养基(dmem-f12+10%胎牛血清+1%青霉素/链霉素),可进行传代。p1到p2的时候稀释比例为1:3的情况下,仍能3天长满。p3-p4代约需4~5天长满。p5代之后进入衰老期,增殖速度减缓,进入衰老期,需要7天以上才能长满,结果见图2。最高可达到p7(d9),传6代之后细胞仍保持较好的形态和生长速度(图3),15天长满。
64.本方案获得的细胞具有高细胞活性,分离方法最大化减少机械破坏和温和酶解作用,使得获取的细胞的存活率能达到55
±
5%,从组织中提取的细胞数量至少达到1
×
106/g(肾皮质组织)。高起始接种密度,使得细胞的增殖环境压力较少,加上富含营养且简便的营养基,无需基质层铺板,也能使得肾小管上皮细胞细胞增殖速度比较快。如1
×
106细胞接种在t75瓶中,72小时内便可达到完全汇合。
65.实施例2
66.实施例2中的肾原代小管上皮细胞的分离与培养的方法,除酶解消化操作外,其他操作如同实施例1。
67.酶解消化操作:第一次消化采用分散酶(1mg/ml)和ii型胶原酶(2mg/ml)消化肾皮质组织碎块60min后离心去上清,第二次消化加入iv型胶原酶(1mg/ml)消化45min;不包含dna去除步骤,其他操作如同实施例1。
68.结果:组织碎块消化后见图4,能有效完整分离出单个细胞,而且细胞数量多。所得的肾小管上皮细胞在完全培养基上存活率高,细胞活性能达到60%,提取细胞数量至少达到3
×
106/g;1
×
106个细胞接种在t75瓶中,2-3天便可达到完全汇合(如图5,质地较为均匀,较少大细胞团出现),传6代之后细胞仍保持较好的形态和生长速度。经过实验摸索,第二次消化加入iv型胶原酶消化40min-60min之间,其分离效果仍然很好,所得的肾小管上皮细胞在完全培养基上存活率保持在55-65%之间,约20分钟消化可控时间,方便稳定生产肾小管上皮细胞。
69.实施例3
70.实施例3中的肾原代小管上皮细胞的分离与培养的方法除酶解消化操作外,其他操作如同实施例1。
71.酶解消化操作:第一次消化采用分散酶(1mg/ml)和iv型胶原酶(1mg/ml)混合液消化70min后离心去上清,第二次消化加入ii型胶原酶(2mg/ml)消化45min;不包含dna去除步骤,其他操作如同实施例1。
72.结果:结果如图6所示,可以看出能有效完整分离出单个细胞,而且细胞数量多。所得的细胞在完全培养基上存活率高,细胞活性能达到57%,细胞数量至少达到2
×
106个/g;1
×
106个细胞接种在t75瓶中,72小时内便可达到完全汇合,传6代之后细胞仍保持较好的形态和生长速度。经过实验摸索,第二次消化加入ii型胶原酶消化40min-60min之间,其分离效果仍然很好,所得的肾小管上皮细胞存活率保持在50-60%之间,约20分钟消化可控时间,方便稳定生产肾小管上皮细胞。
73.实施例4消化酶优化
74.本实施例实验的目的提高效消化肾皮质组织效率的同时,获得较长的消化可控时间,提高产量和细胞活力。肾原代小管上皮细胞的分离与培养的方法和实施例1的基本一样,除了酶消化的条件。
75.对比例1:酶解条件为:用0.25%胰酶消化肾皮质组织碎块10min,其它操作同实施例1。
76.结果:如图7,可以看出酶解作用过于强劲,消化液粘稠。经过摸索得出0.25%胰酶消化10min前后,细胞消化完全就马上进入了消化过度阶段。消化可控制的时间很短,不利于实验人员把控消化的时间点,导致细胞的获得率和活性不稳定。
77.对比例2:酶解条件为:ii型胶原酶(2mg/ml)消化肾皮质组织碎块4h。其它操作同实施例1。
78.结果:如图8,长时间消化仍然不能将组织完全消化分离成单个细胞。
79.对比例3:酶解条件为:分散酶(1mg/ml)消化肾皮质组织碎块4h。其它操作同实施例1。
80.结果:长时间消化仍然不能将组织完全消化分离成单个细胞。
81.对比例4:酶解条件为:木瓜蛋白酶(2mg/ml)消化肾皮质组织碎块30min,其它操作同实施例1。
82.结果:30分钟前后能完全消化细胞,但测定细胞活力为15%(图9);1
×
106个细胞接种在t75瓶中,4-5天才达到完全汇合。另外,经过摸索从消化完全到消化过度的时间很短,只有2~3分钟,不利于实验人员把控消化的时间点,导致每批次细胞之间的获得率和活
性不高。
83.对比例5:酶解条件为:ii型胶原酶(2mg/ml)和分散酶(1m/ml)按体积1:1混合消化肾皮质组织碎块3h。其它操作同实施例1。
84.结果:见图10,悬液中仍存在大量组织团块,显微镜下看不到太多细胞,消化不完全。
85.对比例6:酶解条件为:ii型胶原酶(2mg/ml)和分散酶(1mg/ml)按体积1:1混合消化肾皮质组织碎块105min,其它操作同实施例1。
86.结果:如图11,消化不完全。仍存在数量较多的细胞团块,并没有全部变成单细胞状态。分离后种板的细胞生长到100%汇合度时的状态如图12,p0代有许多的杂质,质地大小不均匀。
87.对比例7:酶解条件为:分散酶(1mg/ml)和iv型胶原酶(1mg/ml)按体积1:1混合消化肾皮质组织碎块105min其它操作同实施例1。
88.结果:如图13,消化尚未完全,仍存在细胞团块,并没有全部变成单细胞状态,且细胞团块成糊状边界并不清晰,细胞疑似有部分消融。分离后种板的细胞生长到100%汇合度时的状态如图14,p0代仍存有细胞团块,质地大小不均匀。
89.对比例8:酶解条件为:ii型胶原酶(1mg/ml)和木瓜蛋白酶(0.1mg/ml)按体积比1:1混合消化肾皮质组织碎块30min,其它操作同实施例1。
90.结果:细胞消化不完全,见图15。
91.对比例9:酶解条件为:分散酶(1mg/ml)和木瓜蛋白酶(0.1mg/ml)消化30min。其它操作同实施例1。
92.结果:如图16,可以看出消化不完全,仍然有许多细胞团块。
93.对比例10:酶解条件为:第一次消化采用分散酶(1mg/ml)和ii型胶原酶(2mg/ml)按体积比1:1混合消化肾皮质组织碎块1h后,离心弃上清,加入再用0.25%胰酶进行第二次消化5min。其它操作同实施例1。
94.结果:见图17,可以看出消化未完全。
95.对比例11:酶解条件为:第一次消化采用消化酶(1mg/ml)和ii型胶原酶(2mg/ml)混合液消化肾皮质组织碎块1h后,离心弃上清,第二次用0.25%胰酶消化10min。其它操作同实施例1。
96.结果:如图18,在镜下可以看出消化完全,但是所提取的细胞总数不高,存活率为60%。当1
×
106个初代细胞(p0)接种在t75瓶中,需要3-4天才可以达到完全汇合。根据多个对比例数据可知,采用胰酶消化肾皮质其时间难以控制,从消化完全到消化过度之间的时间太短,时间把控不好就可能对细胞造成损伤。
97.对比例12:酶解条件为:第一次消化用ii型胶原酶消化(2mg/ml)和分散酶(1mg/ml)按体积1:1混合,磁力搅拌消化肾皮质组织碎块3h后,离心弃上清,第二消化加入木瓜蛋白酶(0.1mg/ml)继续消化30min。其它操作同实施例1。
98.结果:见图19,可以看出消化时间久,也未能完全分离成单个细胞,仍可见细胞团。
99.对比例13:酶解条件为:第一次消化用ii型胶原酶(2mg/ml)和分散酶(1mg/ml)按体积1:1混合消化(磁力搅拌)4h后,离心弃上清,第二消化用木瓜蛋白酶(0.1mg/ml)继续消化30min。其它操作同实施例1。
100.结果:见图20,可以看出细胞膜消融,死细胞增多。
101.对比例14:酶解条件为:分散酶(1mg/ml),ii型胶原酶(2mg/ml)和木瓜蛋白酶(0.1mg/ml)按体积比1:1:1混合消化肾皮质组织碎块30min,其它操作同实施例1。
102.结果:见图21,可以看出消化不均匀,一部分组织还未消化,消化液变粘稠,另一部分出现消化过度,已经出现细胞膜消融。
103.对比例15:酶解条件为:第一次消化用ii型胶原酶(2mg/ml)和分散酶(1mg/ml),按体积1:1混合消化肾皮质组织碎块1h,离心弃上清,第二消化用分散酶(1mg/ml)消化45min。其它操作同实施例1。
104.结果:能完全消化得到细胞。但经过实验摸索,经过摸索分散酶二次消化的适宜为45~50min,只有5分钟的可控时间,50min后就消化过度。
105.对比例16:酶解条件为:第一次消化用ii型胶原酶(2mg/ml)消化肾皮质组织碎块1h,离心弃上清,第二消化用ii型胶原酶(2mg/ml)消化3h。
106.结果:消化不完全,仍有大量细胞团。
107.对比例17:酶解条件为:第一次消化用ii型胶原酶(2mg/ml)消化肾皮质组织碎块1h,离心弃上清,第二次消化用分散酶(1mg/ml)消化2h。
108.结果:消化不完全,仍有大量细胞团。
109.对比例18:酶解条件为:第一次消化用iv型胶原酶(2mg/ml)消化肾皮质组织碎块1h,第二次消化用分散酶(1mg/ml)和iv型胶原酶按体积1:1混合消化肾皮质组织碎块30min。
110.结果:能完全消化得到细胞。但经过实验摸索,分散酶二次消化的适宜为30~35min,只有5分钟左右的可控时间,35min后消化过度,细胞活力低,约33%(图22)。
111.对比例19:酶解条件为:第一次消化采用分散酶(1mg/ml)和ii型胶原酶(2mg/ml)按体积比1:1混合消化肾皮质组织碎块1h后,不离心直接再加入iv型胶原酶(2mg/ml)酶继续消化2h。其它操作同实施例1。
112.结果:消化不完全。
113.实施例5酶时间优化
114.本实施例实验对分散酶和胶原酶第一次时间进行优化。调整了酶的消化时间,肾原代小管上皮细胞的分离与培养的方法和实施例2的基本一样。
115.对比例20:酶解条件为:第一次消化采用分散酶(1mg/ml)和ii型胶原酶(2mg/ml)消化肾皮质组织碎块30min后离心去上清,第二次消化加入iv型胶原酶(1mg/ml)消化120min;不包含dna去除步骤,其他操作如同实施例2。
116.结果:消化不完全。
117.实施例6酶浓度的优化
118.本实施例的目的是优化酶的浓度条件,肾原代小管上皮细胞的分离与培养的方法和实施例2的基本一样,只是在酶的种类和浓度做出了改变。
119.对比例21:酶解条件为:第一次消化采用ii型胶原酶(2mg/ml)和分散酶(0.5mg/ml)按体积1:1消化肾皮质组织碎块1h,离心弃去上清,第二次采用ii型胶原酶(2mg/ml)消化90min。
120.结果:90分钟完全消化细胞,但测定细胞活力为25%;1
×
106个细胞接种在t25瓶
中,4-5天可达到完全汇合。另外,经过摸索从消化完全到消化过度的时间为85-110min,但细胞存活率较差,在20~30%之间。
121.对比例22:酶解条件为:第一次消化采用iv型胶原酶(2mg/ml)和分散酶(2mg/ml)按体积1:1消化肾皮质组织碎块1h,离心弃去上清,第二次采用iv型胶原酶(2mg/ml)消化30min。
122.结果:90分钟完全消化细胞,但测定细胞活力为40%;1
×
106个细胞接种在t25瓶中,4-5天可达到完全汇合。另外,经过摸索从消化完全到消化过度的时间为30-40min,而且细胞存活率较差,在35~45%之间。
123.实施例7机械分离条件的优化
124.本实施例进行了不同的分离方法将肾皮质分离成单细胞,同时对不同分离方法下的获得的细胞,进行了细胞状态的检测:
125.对比例23:分离条件为:过筛+percoll细胞分离液的梯度密度离心法:将肾皮质组织先通过不锈钢筛子(40目)上,用玻璃制的研磨棒将筛上的肾组织朝一个方向轻轻转圈研磨,使其顺利通过不锈钢筛子,期间用4℃的hbss冲洗筛子使其冲洗干净。用同样的办法使肾皮质组织依次通过200μm的不锈钢细胞筛和100μm细胞筛。收集筛下液,筛上物用载玻片轻轻刮起,转移到50ml离心管中。梯度密度离心程序如下:配制50ml的浓度为45%的percoll工作液,50ml的percoll工作液平均分成两管,重悬细胞沉淀,4℃定角20000xg离心30min,离心结束后可见液体分两层,小心抽取下层悬浮混合液,放入15ml离心管中,加入hbss,760xg离心5min加入hbss再次离心,重复两次,洗净percoll。获得的细胞按实施例1的(3)肾小管上皮细胞种板和培养方案培养细胞。
126.结果:细胞过筛后,死细胞数目占了绝大部分,过筛前的研磨使细胞破损严重,细胞液与核酸析出呈粘稠状(图23a),活力低(图23b)。
127.从离心程序结束后的状态来看,有一层灰色的分层,应是死细胞的残骸和碎屑(图23c)。可以看出经过percoll离心分离程序后,细胞总数较多,活性尚可,但其后种板,3天后的细胞量见图24,可以看出后续接板培养状态不佳。
128.综上所述,使用本发明中的肾小管上皮细胞分离与培养方法能够获得细胞活性高、增殖速度快。
129.上述具体实施方式对本发明作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下做出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
