一种大面积电偶腐蚀结构的生物医用可降解金属骨架增强zn基复合材料的制备方法
技术领域
1.本发明涉及生物医用金属技术领域,特别涉及一种大面积电偶腐蚀结构的生物医用可降解金属骨架增强zn基复合材料的制备方法。
背景技术:
2.随着交通事故频发及社会人口老龄化现象的日趋严重,患者诱发骨折的几率逐年递增,已被世界卫生组织列为第二大危害人类健康的疾病。针对骨折修复和固定治疗,临床上常用骨钉、骨板、骨锚等植入物进行辅助愈合。目前,骨组织修复与替换的金属植入材料主要由医用不锈钢、钛、钽及其合金等永久植入材料构成。需要指出的是,骨折愈合对金属植入材料的功能需求只是暂时的,在完全愈合后往往需要进行二次手术取出。此外,金属植入物长期植入骨骼会产生应力遮挡效应,影响骨骼生长发育,甚至会造成骨萎缩和感染等严重并发症。目前大部分的骨折固定物仍采用二次手术取出,因此对于骨折患者的术后愈合和经济负担都不友好。针对这一问题,可降解金属材料的研发受到了许多研究者的关注,并形成了镁、铁、锌等合金体系。然而,镁合金在人体内的降解速率过快及不均匀降解导致力学稳定性无法保障,难以满足植入材料力学和耐腐蚀性能要求。同时生成大量气体并引起局部区域ph值升高,阻碍骨细胞间的正常连接,干扰皮质骨的愈合过程,导致结缔组织形成和骨皮质缺陷,从而严重影响骨折内固定的愈后效果。铁及其铁合金则降解速率太过缓慢,且腐蚀产物在体内难以被降解,失去了可降解金属材料的优势,此外,铁基材料对磁共振成像(mri)也不友好;锌及锌合金在生物体内也可以降解,和可降解镁合金的体内降解机理类似,但锌比镁更耐腐蚀,比铁更易腐蚀。锌及锌合金如果作为生物可降解材料,就可避免出现如生物镁合金降解速度过快或如生物铁基合金降解速度过慢而引发的一系列问题。同时,锌也是人体必须的微量元素之一,在人体的生理机能,细胞代谢以及基因表达方面有十分重要的作用。此外,锌还能促进骨组织发育,对骨组织具有骨诱导作用。因此,锌及锌合金适合用作骨植入物材料。
3.然而,铸态纯锌较少的滑移系和较低的再结晶温度,导致力学性能和抗老化能力较差,难以满足力学性能要求。目前,通过合金化和变形工艺均能够显著提升锌合金的力学性能。合金化添加的金属元素包括镁、钙、锶、锰、铜、锂、铁、锗、锆和银。变形工艺包括轧制、挤压。锻压、等径角挤压、拉拔等。但是经过力学性能优化后纯锌和大部分锌合金的体外降解速率小于0.1毫米/年,介于心血管植入材料和骨科植入材料之间且更接近心血管植入材料的降解速率。因此,这将会导致锌合金在被用于骨科植入物时,完全降解周期远长于骨愈合周期12~24周,仍可能会出现永久植入材料存在的骨萎缩和难以忍受的宿主反应。
4.众所周知,在导电介质中两种或两种以上具有不同电极电位的金属会构成腐蚀原电池,从而形成电偶腐蚀而加速腐蚀过程。电偶腐蚀能够诱发和加速应力腐蚀、点蚀、缝隙腐蚀等其他类型的局部腐蚀,从而加速设备或工件的破坏。但是,考虑到锌合金较慢的腐蚀速率,可以通过电偶腐蚀加速阳极腐蚀的特性,能够提高可降解锌合金植入件的降解速率,
从而满足骨植入物的降解速率要求。泡沫金属由于具有三维网状结构、孔隙率高、比表面积大、质量均匀、活性好,常被用于电极、催化剂、过滤网、导热、吸声等器件上。
5.目前国内外文献还未见有报道可降解金属骨架/zn生物医用材料的制备及相应性能的研究,故提出将可降解金属骨架/zn生物医用材料用作下一阶段的可降解生物医用材料的使用。
技术实现要素:
6.针对现有技术存在的不足,本发明的目的在于提供一种大面积电偶腐蚀结构的生物医用可降解金属骨架增强zn基复合材料的制备方法,以解决上述技术问题。
7.本发明的技术方案是这样实现的:一种大面积电偶腐蚀结构的生物医用可降解金属骨架增强zn基复合材料的制备方法,包括金属骨架及zn-x合金,所述金属骨架为泡沫纯cu、fe、mg金属中的一种,包括如下步骤:
8.s1、高纯金属zn和x作为原料,并按照zn-x合金成分中单质的质量比进行称量;
9.s2、将原料置于真空渗流装置中升温加热至500~700℃,同时将泡沫纯cu、fe、mg金属中的一种使用10~40g/l的naoh溶液在超声波下除油2~30min后水平放入浇铸模具中预抽真空,使内部真空度保持在80~100pa直至浇铸结束;
10.s3、当锌合金完全融化后,调节渗流温度至420~720℃﹐打开加压阀门进行渗流铸造,渗流压力的0.2~0.8mpa,将zn熔体浇铸到装有泡沫金属并预热至200~300℃模具中,得到金属骨架增强zn复合材料金属方块;
11.s4、用线切割切取长度为40~80mm、宽度为5~30mm、高度为3~13mm的金属方块;
12.s5、将切割后的金属方块放入马弗炉中进行均匀化处理,均匀化温度为200~350℃,均匀化时间为2~20h,均匀后进行空冷或水冷;
13.s6、对复合材料进行轧制,首次轧制前试样保温时间为5~60min,之后每道次轧制前保温时间为5~10min。
14.通过采用上述技术方案,通过该方法制得的复合材料未出现明显的裂纹,具有良好的结合性能,采用zn合金进一步的提升力学性能,具有较好的塑性变形能力,这种材料的降解周期与骨愈合的周期接近,也具有良好的细胞相容性。
15.本发明进一步设置为:所述x为人体必须元素cu、mg、sr、ca、ge、ti、li、fe、sn、ag、mn、re中的一种或多种组合。
16.通过采用上述技术方案,采用不同的元素对人体的作用不同,可以根据需要使用不同的元素,且通过合金的方式进行制备能够提升纯zn本身的力学性能。
17.本发明进一步设置为:所述金属zn的纯度为99.5wt.%,所述x的纯度为99.9wt.%。
18.通过采用上述技术方案,该合金元素的力学性能高。
19.本发明进一步设置为:所述金属骨架通过电沉积法或渗流铸造法或粉末烧结法或增材制造法制备而成。
20.通过采用上述技术方案,方便金属骨架的制备,制备的效率高且方便实施。
21.本发明进一步设置为:所述金属骨架的孔隙率为10~80ppi,厚度为5~15mm。
22.通过采用上述技术方案,采用这种能够方便zn的浇铸入,且稳定性高,力学性能
高。
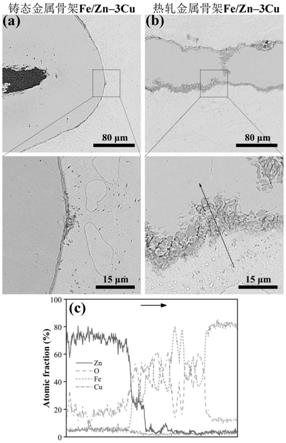
23.本发明进一步设置为:所述步骤s6中轧制的总压下量为30~95%,每道次压下量为1~10%,轧制温度为180~320℃,轧制速度为1~10m/min。
24.通过采用上述技术方案,防止轧制速度过慢导致由于温度的下降而使得末端的轧制温度过低而出现开裂,有利于轧制变形的稳定,也能够实现高效率。
25.本发明进一步设置为:所述zn-x合金通过渗流装置浇铸至金属骨架内。
26.通过采用上述技术方案,能够实现复合材料的高效制备。
附图说明
27.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
28.图1为本发明具体实施方式铸态和热轧态金属骨架fe/zn生物医用材料的sem图和eds线扫描分析图;
29.图2为本发明具体实施方式热轧态金属骨架fe/zn生物医用材料的拉伸断口sem图;
30.图3为本发明具体实施方式热轧态金属骨架fe/zn生物医用材料在hanks’溶液中的极化曲线图;
31.图4为本发明具体实施方式拉伸试验后热轧态金属骨架fe/zn生物医用材料的力学性能和硬度结果;
32.图5为本发明具体实施方式极化试验后拟合的热轧态金属骨架fe/zn生物医用材料电化学性能参数;
33.图6为本发明具体实施方式渗流装置结构示意图;
34.图7为本发明具体实施方式降温机构结构示意图。
35.附图标记:1、金属熔化室;2、渗流室;3、导流机构;4、增压装置;400、增压器;401、增压管;402、第一调节阀;403、压力表;5、泄压装置;500、泄压管;501、第二调节阀;6、隔热层;7、通风室;700、第一导流片;701、第二导流片;8、降温机构;800、底板;801、安装罩;802、第一进风口;803、第二进风口;804、细管;805、第一水管;806、第二水管;807、水泵;808、水箱。
具体实施方式
36.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
37.如图1至图7所示;
38.实施例1:
39.首先以高纯金属zn和cu作为原料,并按照zn-3cu合金成分中单质的质量比进行称
量。接着将原料置于真空渗流装置中升温加热至620℃。同时将孔隙率为40ppi和厚度为10mm的泡沫纯fe使用30g/l的naoh溶液在超声波下除油10min后水平放入浇铸模具中预抽真空,使内部真空度保持在80pa直至浇铸结束。当锌合金完全融化后,调节渗流温度至650℃﹐打开加压阀门进行渗流铸造,渗流压力为0.6mpa,将zn熔体浇铸到装有泡沫金属并预热至250℃模具中,得到金属骨架fe/zn生物医用材料;
40.用线切割切取60mm(长)
×
20mm(宽)
×
10mm(高),金属方块的高度方向为金属骨架高度方向,且保证高度方向上下两个平面均含有均匀分布的金属骨架。将金属方块放入马弗炉中进行均匀化处理,均匀化温度为340℃,均匀化时间为10h,空冷,使得金属骨架与锌基体的界面处发生充分扩散。轧制的总压下量为90%,每道次压下量为5%。轧制温度为300℃,首次轧制前试样保温时间为30min,之后每道次轧制前保温时间为5min。轧制速度为5m/min,防止轧制速度过慢导致由于温度的下降而使得末端的轧制温度过低而出现开裂,有利于轧制变形的稳定,也能够实现高效率和高密度成形。
41.包括如下实施效果:
42.铸态金属骨架fe/zn生物医用材料中存在金属骨架纯fe和zn-3cu合金。金属骨架纯fe具有光滑的边缘,zn-3cu中存在椭圆状的cuzn5相和α-zn基体。金属骨架纯fe和zn-3cu合金之间具有1.5μm的过渡层,未出现明显的裂纹,具有良好的结合性能。经过热轧处理后,金属骨架纯fe和cuzn5相沿着水平方向均匀分布,过渡层之间zn、fe和o元素呈现梯度变化,形成均匀分布的层片状异种金属结构。在hanks’溶液中由于fe和zn合金之间的腐蚀电位差,层片状结构极易形成电偶腐蚀结构从而加速腐蚀过程;
43.力学性能和硬度数据,金属骨架fe/zn生物医用材料的抗拉强度为269.1mpa,屈服强度为210.3mpa,延伸率为26.7%,fe金属骨架维氏硬度为154.3hv,zn基体为83.7hv;
44.热轧态金属骨架fe/zn生物医用材料的断口中zn-3cu端存在较多大小不一的韧窝,表现出较好的塑性变形能力。金属骨架fe相对于zn-3cu合金具有更高的强度和较低的延伸率。由于在金属骨架fe与zn-3cu之间还存在紧密的界面结合,能够协同变形,因此高强低塑性的金属骨架fe与低强高塑性的zn-3cu合金良好匹配,能够提升生物医用材料的力学性能;
45.在hanks’溶液中进行极化试验所得的金属骨架fe/zn生物医用材料的腐蚀电位,腐蚀电流密度和腐蚀速率为-0.775v,187.3μa/cm2,2651μm/y。在hanks’溶液中浸泡90天后金属骨架fe/zn生物医用材料的降解速率为252μm/y,与骨愈合周期接近;
46.金属骨架fe/zn生物医用材料的浸提液在小鼠血液中的溶血率为2.91%,浸提液的溶血率低于5%的临床医用材料的溶血率要求,表现出良好的血液相容性。mg-63骨肉瘤细胞在100%、50%和25%浓度的金属骨架fe/zn生物医用材料的浸提液中培养72h后细胞存活率分别为51.4%、82.9%和94.6%,稀释后的浸提液表现出良好的细胞相容性。金属骨架fe/zn生物医用材料与金黄色葡萄球菌共同培养24h后的抑菌圈尺寸为6.84mm。
47.实施例2:
48.首先以高纯金属zn和cu作为原料,并按照zn-3cu合金成分中单质的质量比进行称量。接着将原料置于真空渗流装置中升温加热至600℃。同时将孔隙率为30ppi和厚度为10mm的泡沫纯cu使用20g/l的naoh溶液在超声波下除油15min后水平放入浇铸模具中预抽真空,使内部真空度保持在90pa直至浇铸结束。当锌合金完全融化后,调节渗流温度至650
℃﹐打开加压阀门进行渗流铸造,渗流压力为0.9mpa,将zn熔体浇铸到装有泡沫金属并预热至200℃模具中,得到金属骨架cu/zn生物医用材料。
49.用线切割切取60mm(长)
×
15mm(宽)
×
10mm(高),金属方块的高度方向为金属骨架高度方向,且保证高度方向上下两个平面均含有均匀分布的金属骨架。将金属方块放入马弗炉中进行均匀化处理,均匀化温度为350℃,均匀化时间为15h,水冷,使得金属骨架与锌基体的界面处发生充分扩散。轧制的总压下量为95%,每道次压下量为5%。轧制温度为280℃,首次轧制前试样保温时间为30min,之后每道次轧制前保温时间为5min。轧制速度为2m/min,防止轧制速度过慢导致由于温度的下降而使得末端的轧制温度过低而出现开裂,有利于轧制变形的稳定,也能够实现高效率和高密度成形。
50.包括如下实施效果:
51.本实施例制备的金属骨架cu/zn生物医用材料的抗拉强度为288.7mpa,屈服强度为197.2mpa,延伸率为17.5%,cu金属骨架维氏硬度为99.2hv,zn基体为82.9hv。在hanks’溶液中进行极化试验所得的金属骨架cu/zn生物医用材料的腐蚀电位,腐蚀电流密度和腐蚀速率为-0.842v,511.3μa/cm2,7147μm/y。在hanks’溶液中浸泡90天后金属骨架cu/zn生物医用材料的降解速率为316μm/y,与骨愈合周期接近。金属骨架cu/zn生物医用材料的浸提液在小鼠血液中的溶血率为3.67%,浸提液的溶血率低于5%的临床医用材料的溶血率要求,表现出良好的血液相容性。mg-63骨肉瘤细胞在100%、50%和25%浓度的金属骨架cu/zn生物医用材料的浸提液中培养72h后细胞存活率分别为42.8%、86.2%和97.9%,稀释后的浸提液表现出良好的细胞相容性。金属骨架cu/zn生物医用材料与金黄色葡萄球菌共同培养24h后的抑菌圈尺寸为8.48mm。
52.实施例3:
53.所述的渗流装置包括金属熔化室1、渗流室2以及导流机构3,所述渗流室2设置在金属熔化室1的上方,所述导流机构3位于渗流室2与金属熔化室1之间,所述金属熔化室1的一侧设有增压装置4,另一侧设有泄压装置5,所述增压装置4包括增压器400、增压管401、第一调节阀402以及压力表403,所述增压管401的一端与增压器400相连接,另一端与金属熔化室1相连接,所述第一调节阀402以及压力表403均设置在增压管401上,所述泄压装置5包括泄压管500以及第二调节阀501,所述泄压管500的一端与金属熔化室1相连接,另一端与外界连通,所述第二调节阀501设置在泄压管500上,所述导流机构3呈漏斗型,所述导流机构3开口大的一端与渗流室2连通,开口小的一端与金属熔化室1连通,所述导流机构3开口大的一端外侧设有安装部,所述安装部设置于金属熔化室1与渗流室2之间,所述安装部的两侧设有耐火耐热密封件,所述金属熔化室1及渗流室2的壁中分别开设有隔热室,所述隔热室内填充有隔热层6,所述金属熔化室1及渗流室2的壁中还开设有通风室7,所述通风室7与隔热室相邻设置,且位于隔热室的外侧,所述通风室7的两侧设有上下交错设置的第一导流片700和第二导流片701,所述金属熔化室1与渗流室2的通风室7通过通风管连通,所述通风管的入口端设置有降温机构8,所述降温机构8包括底板800、安装罩801、出水结构、风管组、进风结构以及出风结构,所述安装罩801罩设在底板800的外侧,所述出水结构设置在安装罩801的顶部,所述进风结构包括第一进风口802、第二进风口803,所述第一进风口802设置在安装罩801的右侧,所述第二进风口803设有两个均设置在安装罩801的后侧,所述第一进风口802和第二进风口803处均设置有风机,所述出风结构包括第一出风口和第二出风
口,所述第一出风口设置在安装罩801的右侧且与第一进风口802相邻设置,所述第二出风口设置在安装罩801的前侧,所述风管组包括安装头以及若干细管804,所述安装头分别设置在第一进风口802和第一出风口处,所述若干细管804的一端与第一进风口802处的安装头相连接,另一端与第一出风口处的安装头相连接,所述若干细管804的中部形成弧形,所述细管804的外侧设有蒸发片,所述出水结构用于将水喷淋至细管804和蒸发片上,所述出水结构包括第一水管805、第二水管806、水泵807以及水箱808,所述第一水管805设置在安装罩801内部的顶部,所述第二水管806的一端贯穿安装罩801与第一水管805相连接,另一端与水箱808连接,所述水泵807设置在第二水管806上,所述第一出风口和第二出风口的出口端连接有比例调配阀,所述比例调配阀设置有连个出口,其中一个出口与通风管连接,用于将冷气注入通风室7;通过隔热层6将金属熔化室1以及渗流室2的高温进行阻隔,通过降温机构8对通风室7通入冷气,使得外壁能够进一步的降温从而使得安全性提升,出水结构将水淋在蒸发片和细管804外侧,细管804内通气,第二进风口803能够加速蒸发片和细管804表面水分的蒸发,从而降低细管804内空气的温度,且细管804的中部呈弧形形成回转,能够形成两次降温,进一步的降低温度,第一出风口排出干冷的空气,第二出风口排出湿冷的空气,通过比例调配阀进行调节通入到通风室7内,进一步的降低通风室7的温度,通过交错设置的导流片来提升冷气在通风室7内停留的时间,提升降温的充分性。
54.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
