高肝硬度背景sd大鼠原位肝癌模型的构建方法及其应用
技术领域
1.本发明涉及动物模型技术领域,具体涉及高肝硬度背景sd大鼠原位肝癌模型的构建方法及其应用。
背景技术:
2.基质硬化主要由胞外基质蛋白过度沉积和交联所致,该机械硬度改变往往会破坏细胞表面力的平衡,促进整合素聚集和粘着斑形成,使外源硬度力学信号传递到胞内转变为生化信号,从而影响、改变细胞生物学表型和特征。基质硬化为实体瘤典型的生物力学表型,常伴随肿瘤发生与进展,目前临床上已将基质硬度评估(弹性超声成像)作为乳腺癌、肝细胞癌等实体瘤发展、预后预测的方法,研究显示肿瘤微环境中基质硬度增加作为始动因素能够参与肿瘤侵袭转移的调控,基质硬度作为细胞微环境的重要生物力学参数,可影响并参与体内多种病理生理过程如组织发育、纤维化、肿瘤转移等。然而理想基质硬度相关体内外实验平台的缺乏,特别是硬度关联理想肿瘤动物模型的缺乏,依然严重制约着基质硬度调控肿瘤发生进展相关分子机制研究的开展。
3.中国发明专利zl201410025039.9将聚丙烯酰胺凝胶硬度可调性与基质蛋白包被有机结合,制成既有生物界面又有硬度变化的不同硬度基底体外细胞培养平台,较好地模拟正常肝组织至肝硬化硬度变化状态;同时中国发明专利zl201310127532.7建立不同肝基质硬度背景buffalo大鼠肝癌模型,实现硬度背景与肝癌的联合造模,较好地模拟显示肝基质硬度影响下的肝癌恶性病理特征包括组织病理、肝功能、肿瘤增殖、肺远端转移及侵袭转移关联基因等。上述体外、体内研究体系建立,较好地解决了肝基质硬度背景变化参与肝癌发生进展研究缺少理想实验体系以及缺少理想动物模型等问题,有助于获得基质硬度改变影响肝癌细胞恶性生物学特征的系列证据,阐明该物理力学特征参与肝癌发生发展分子机制。然而,受制于buffalo大鼠购买成本及来源限制,能否创造性地构建实用又新型的替代动物模型成为急需探索和解决的基础问题。
4.肝细胞癌(hcc)发生不同于其他肿瘤的特点,其通常会经历慢性或急性肝损伤(肝炎)
→
肝脏自我修复
→
肝纤维化
→
肝硬化
→
肝癌的过程,肝癌患者常伴有肝脏的明显坏死性炎症、异常血管生成和广泛纤维化及肝硬化,可见肝炎到肝硬化的过程中微环境的改变在肝癌发生发展中起重要作用,且肝炎至肝硬化过程中微环境改变导致的肝脏灌注改变、代谢变化等同样会影响药物治疗的效果。临床数据显示超过80%的肝癌患者具有肝纤维化或肝硬化背景,具有高肝硬化背景的肝癌患者一般预后较差。然而,肝纤维化和硬化产生的力学信号调控肝癌进展的机制目前仍然知之甚少,缺乏理想的肝硬化背景肝癌动物模型是一个重要原因。目前常见健康肝脏原位移植瘤或皮下瘤动物模型,无法模拟基质硬度背景改变对肝癌恶性特征的影响以及基质硬度微环境对药物反应性的影响。因此,能否构建更为实用、高效可模拟肝基质硬度微环境的肝癌动物模型对解决微环境中生物力学信号作用机制研究至关重要。
5.目前,常用的肝癌动物模型及其优缺点如下:
6.1)诱发性肝癌模型:指用特定化学诱导剂诱发肝癌发生,包括二乙基亚硝胺(den)、黄曲霉素(af)、二甲基氨基偶氮苯(dab),通过化学诱导剂诱导小鼠/大鼠肝脏纤维化/肝硬化进而导致肝癌发生,可实现在免疫功能正常小鼠/大鼠中诱导hcc。该类模型多用于肝癌病因学、发生学、发病机制、遗传学方面的研究以及候选药物的癌症风险及化疗检测。然而,小鼠/大鼠品系的不同,肿瘤诱导形成的时间和肿瘤大小存在明显差异,且该模型常会发生多发性肿瘤病变,诱导模型很难标准化。此外,这种模型动物成瘤率低、死亡率高,成瘤后动物一般状况较差、生存时间短,难以耐受后续研究的进行。
7.2)异种移植模型:该模型是在免疫缺陷小鼠如无胸腺裸鼠或重度联合免疫缺陷(scid)小鼠中皮下注射人hcc细胞系。这种模型由于肿瘤易于获得且可连续监测肿瘤生长,有助于研究治疗反应,对肿瘤进展过程中癌细胞恶性行为的某些研究也较有益。此外,将患者肿瘤组织直接移植到免疫缺陷鼠而建立的人源异种移植模型(pdx),在组织病理学、分子生物学和基因水平上保留了原代肿瘤大部分特点、具有较好的临床疗效预测性,目前该类模型广泛应用于新药开发,尤其是靶点药物的临床试验病人筛选和预测性生物标志物的研究中。然而,异种移植模型肿瘤除在原位生长外,偶见远处转移,无法研究远处或局部(肝内)转移的自发发展,也较难模拟重现肿瘤-基质硬度环境间的相互作用,同时还受到免疫反应功能障碍或缺失的极大限制。
8.3)转基因或基因工程肝癌模型(gems):
9.转基因肝癌模型指利用转基因技术使动物接受外源基因,此基因在其染色体基因组内稳定整合并能遗传给后代。目前常见的有乙型肝炎病毒转基因肝癌模型、猴病毒40(sv40)转基因动物肝癌模型、tgf转基因小鼠模型等,主要用于研究特殊基因的功能和不同基因在肝细胞癌发展过程中的相互作用(如癌基因和抑癌基因),也可用于研究特殊基因与肝特异性致癌物之间的关系。但转基因表达在所有肝脏细胞,包括肿瘤微环境细胞,且这种基因突变在胚胎形成时已存在,可能会导致一些代偿的分子通路激活。此外,转基因动物肝癌模型技术要求高,价格昂贵,限制了该模型的应用,该模型同样无法模拟肝硬化过程,较难用于研究肿瘤-基质硬度间的相互作用。
10.基因工程肝癌模型包括c-myc和mtdh肝细胞特异性模型等,在mtdh和myc双重过表达的gems中,小鼠发生侵袭性hcc以及肺转移,gem模型诱导特定突变以重现hcc的表达,这类肝癌模型多用于研究肝癌发生,但该模型同样无法模拟肝硬化基础上的肝癌发生过程。
11.crispr-cas模型也属基因工程肝癌模型,该模型通过rna注射的方式将crispr-cas系统导入小鼠受精卵使其在胚胎中产生定点突变,即用crispr-cas技术靶向肿瘤抑制基因(如pten、p53或ctnnb1癌基因)。该技术能够直接突变肿瘤抑制因子或癌基因,以便其在hcc的功能基因组学研究,此外,该方法没有小鼠遗传品系限制,能够对大片段基因组dna进行删除,也可以通过同时注射针对不同基因rna序列达到在同一只小鼠或大鼠中产生多个基因突变的效果。该方法构建的基因突变动物具有显著高于传统方法的生殖系转移能力,是一种可靠、高效、快速的构建敲除动物模型的新方法。但因造模过程无肝炎
→
肝硬化
→
肝癌的过程,无法进行肿瘤-基质背景环境间相互作用的研究,且模型费用成本较高。
12.4)兔肝癌动物模型:属于肝同种移植的肝癌模型,采用的瘤源为vx2肿瘤细胞株,接种到兔的肝脏制成原位肝癌模型。该模型为目前最大的动物可接种肝肿瘤模型;为富血管肿瘤,其供血动脉主要为肝动脉;病理上肿瘤为巨块型实体瘤,浸润性生长,血供丰富,类
似于人巨块型肝癌;模型制作简单,价格相对低廉,接种成功率高,实验周期短。适用于插管等局部治疗、肝肿瘤影像学诊断及介入放射治疗的实验研究。但兔发生的是移植性肝癌,缺乏肝硬化背景,无法进行肿瘤-基质背景环境间相互作用研究,且vx2肿瘤极易转移和播散。
13.综上,尽管肝癌研究领域已成功建立了不同类型的小鼠/大鼠肝癌模型,但具有不同肝硬度背景的理想肝癌模型目前依然缺乏。在现有技术中,虽然不同肝硬化背景buffalo大鼠原位肝癌模型为基质硬度调控肝癌恶性特征研究提供可靠的动物模型,但受buffalo大鼠成本高、获取困难,以及造模周期长、相对复杂特点等限制。因此,进一步发展更为实用、高效的新型动物模型已以解决硬度相关研究急需探索和解决的关键问题。鉴于小鼠耐受性差,肝硬化小鼠常因腹水、肝功能衰竭等原因死亡或无法耐受后续肝脏原位肿瘤移植,造模成功率低。本发明选择常用易获sd大鼠,采用联合造模方式,通过四氯化碳先诱导形成高肝硬度sd大鼠,然后在高肝硬度sd大鼠肝包膜下注射matrigel混合的buffalo大鼠肝癌细胞mca-rh7777,并结合免疫抑制剂短暂使用,成功获得高肝硬度背景sd大鼠肝癌模型。与其它鼠肝癌模型相比,该模型所用sd大鼠及buffalo大鼠肝癌细胞mca-rh7777均易获取且成本较低,具有成瘤率高、肿瘤数量及位置可控、成瘤时间短、高转移等优点,检测显示可较好模拟高肝硬度背景肝癌的恶性病理特征,同时能分析硬度微环境下基因功能、放疗抵抗及免疫抑制等机制解析,为基质硬度力学信号调控肝癌侵袭转移研究提供了一种实用、高效的肝癌动物模型。
技术实现要素:
14.本发明的第一目的是提供高肝硬度背景sd大鼠原位肝癌模型的构建方法,较好地模拟再现肝硬化肝癌患者临床病理及生化特征,解决buffalo大鼠成本高、获取困难以及造模周期长、相对复杂特点等问题,形成更为实用、高效的新型替代动物模型。为此,本发明选择常用易获的sd大鼠,采用联合造模方式,通过四氯化碳先诱导形成高肝硬度sd大鼠,然后在高肝硬度sd大鼠肝包膜下注射matrigel混合的buffalo大鼠肝癌细胞mca-rh7777,并结合小剂量糖皮质激素短暂使用,得到高肝硬度背景sd大鼠原位肝癌模型。
15.本发明的第二目的是提供上述高肝硬度背景sd大鼠原位肝癌模型的应用,通过该模型在大鼠体内模拟临床肝硬化背景的肝癌患者病理特征用于基质硬度调控肝癌侵袭转移相关机制研究。
16.为实现上述第一目的,本发明采用的技术方案是:
17.本发明提供的高肝硬度背景sd大鼠原位肝癌模型的构建方法,包括以下步骤:
18.(1)sd大鼠腹部皮下注射四氯化碳诱导形成高肝硬度sd大鼠;
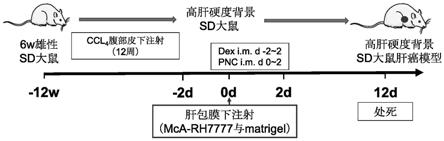
19.(2)步骤(1)中所述高肝硬度sd大鼠肝包膜下注射低生长因子matrigel混合的大鼠肝癌细胞,同时结合注射小剂量的糖皮质激素,12
–
14天后形成块状肝癌,得到高肝硬度背景sd大鼠原位肝癌模型。
20.作为优选的技术方案,步骤(1)中,所述sd大鼠为4~6周龄雄性sd大鼠。
21.作为优选的技术方案,步骤(1)中,所述sd大鼠腹部皮下注射四氯化碳,首次按照3ml/kg剂量注射纯四氯化碳,之后按照2ml/kg剂量注射体积比为1:1的四氯化碳-橄榄油溶液,每周2次,共12周,诱导形成高肝硬度sd大鼠。
22.作为优选的技术方案,步骤(2)中,所述大鼠肝癌细胞为buffalo大鼠肝癌细胞
mca-rh7777,采用1.6
×
106个大鼠肝癌细胞/100ulpbs悬液与低生长因子matrigel按照体积比1:1轻轻混匀后进行注射。
23.作为优选的技术方案,步骤(2)中,所述糖皮质激素为地塞米松,按照5mg/kg剂量肌肉注射,由所述高肝硬度sd大鼠注射大鼠肝癌细胞前两天开始直至术后第2天(d-2
–
d2),共5天。
24.作为优选的技术方案,步骤(2)中建立高肝硬度背景sd大鼠原位肝癌模型的步骤为:
25.(2-1)按照5mg/kg剂量肌肉注射地塞米松,由所述高肝硬度sd大鼠注射大鼠肝癌细胞前两天开始直至术后第2天(d-2~d2),共5天;
26.(2-2)上述高肝硬度sd大鼠手术当天用2%戊巴比妥钠按照3ml/kg剂量进行麻醉,剃去腹部手术区毛发;
27.(2-3)在无菌超净台下取上述高肝硬度sd大鼠腹部正中切口开腹,充分暴露肝脏,1.6
×
106个大鼠肝癌细胞/100ulpbs悬液与低生长因子matrigel按照体积比1:1轻轻混匀得到混悬液,用胰岛素针吸取上述混悬液缓慢注入肝包膜下,进针方向从肝叶下部斜向上方向,沿肝脏表面包膜进针,进针深度为0.5~1cm,注射完毕后可见肝包膜下出现一透明近圆形凸起,随后撤针,用干燥棉球按压注射点数秒,防止细胞从穿刺点流出,观察肝脏无出血后逐层关腹;
28.(2-4)术后按照8万u/只剂量肌肉注射青霉素,手术当天开始至术后第二天(d0~2),12~14天后形成块状肝癌。
29.本发明通过前期预实验,从众多候选动物(包括sd大鼠、wistar大鼠等)中确定易于获取且耐受性良好的sd大鼠,同时参考前期造模经验(中国发明专利zl201410025039.9和zl201310127532.7),采用联合造模方式将sd大鼠肝硬化诱导与sd大鼠肝肿瘤原位移植相结合,同时短暂使用小剂量糖皮质激素将buffalo大鼠肝癌细胞mca-rh7777在sd大鼠原位形成移植瘤,采用细胞与matrigel混合肝包膜下注射方式加速肝内成瘤,同时避免因操作因素导致的肝癌细胞肝内扩散,成功构建高肝硬度背景sd大鼠原位肝癌模型,可较好地模拟再现肝硬化肝癌患者临床病理及生化特征,通过该模型发现硬度力学感应分子(integrinβ1或piezo1)下调的高肝硬度sd大鼠肝癌模型成瘤及肺转移能力均明显低于高肝硬度sd大鼠肝癌模型。此外,发现与正常肝硬度sd大鼠肝癌模型相比,高肝硬度背景sd大鼠原位肝癌模型对放疗存在明显抵抗,上述应用均证实基质硬度增加可显著增强肝癌细胞恶性特征,为探讨基质硬度调控肝癌发生发展的相关病理机制提供一种新型动物模型。
30.本发明还提供上述高肝硬度背景sd大鼠原位肝癌模型在模拟高肝硬度背景肝癌患者的恶性病理特征、及硬度力学微环境下基因功能、放疗抵抗和免疫抑制的机制解析研究中的应用。
31.与现有技术相比,本发明的有益效果在于:
32.(1)与现有的鼠肝癌模型相比,本发明中高肝硬度背景sd大鼠原位肝癌模型采用的sd大鼠及buffalo大鼠肝癌细胞mca-rh7777均易获取且成本较低,具有成瘤率高、肿瘤数量及位置可控、成瘤时间短、高转移等优点,检测显示可以较好模拟高肝硬度背景肝癌患者的恶性病理特征以及用于硬度力学微环境下基因功能、放疗抵抗及免疫抑制等机制解析,极大地解决了困扰硬度背景肝癌动物模型建立的技术难度与成本,为基质硬度力学信号调
控肝癌侵袭转移研究提供一种实用、高效的新型肝癌动物模型。
33.(2)本发明采用的瘤源为buffalo大鼠肝癌细胞mca-rh7777,通过短时小剂量糖皮质激素在sd大鼠原位形成同种异型移植瘤,且可发生肝内及肺转移,能较好地用于肝癌局部或远处转移的相关机制及药物治疗反应等研究。
34.(3)本发明构建的高肝硬度背景sd大鼠原位肝癌模型具有成瘤率高、肿瘤数量及位置可控、成瘤时间短、高转移,成本较低,易操作等优点,可广泛应用于基质硬度调控肝癌转移的相关研究,具有较好的经济效益与应用价值。
附图说明
35.图1是实施例中构建高肝硬度背景sd大鼠原位肝癌模型的流程示意图。
36.图2是实施例中构建的高肝硬度背景sd大鼠原位肝癌模型;其中:(a)肝硬化sd大鼠肝脏大体观;(b)高肝硬度sd大鼠肝包膜下注射肝癌细胞后形成的透明凸起;(c)高肝硬度背景sd大鼠原位肝癌模型肝脏原位瘤大体观。
37.图3是实施例中构建的高肝硬度背景sd大鼠原位肝癌模型验证;其中:(a)高肝硬度sd大鼠肝癌组织he染色;(b)高肝硬度背景sd大鼠原位肝癌模型肝功能情况;(c
–
d)免疫组化检测正常肝硬度sd大鼠及高肝硬度sd大鼠肝脏lox、col1表达情况;(e
–
f)高肝硬度背景sd大鼠原位肝癌模型肺转移情况(*p《0.05,**p《0.01,***p《0.005,****p《0.001)。
38.图4是实施例中硬度力学感应分子integrinβ1及piezo1对高肝硬度背景sd大鼠原位肝癌模型肝癌侵袭转移的影响;其中:(a)integrinβ1敲减(右)及piezo1敲减(左)的大鼠肝癌细胞系;(b)integrinβ1或piezo1表达量对高肝硬度背景sd大鼠肿瘤增殖的影响,肿瘤大体形态;(c)各组高肝硬度大鼠肿瘤体积差异;(d)integrinβ1或piezo1表达量对高肝硬度背景sd大鼠肿瘤肺转移的影响;(e)integrinβ1或piezo1表达量对正常肝硬度背景sd大鼠肿瘤增殖的影响,肿瘤大体形态;(f)各组正常肝硬度大鼠肿瘤体积差异;(g)各组正常肝硬度大鼠肿瘤重量差异;(h)integrinβ1或piezo1表达量对正常肝硬度背景sd大鼠肿瘤肺转移的影响(*p《0.05,**p《0.01,***p《0.005,****p《0.001)。
39.图5是实施例中基质硬度促进肝细胞肝癌增殖和放疗抵抗;其中:(a)基质硬度及放疗对肿瘤增殖的影响,肿瘤大体形态;(b)各组大鼠肿瘤重量差异;(c)各组大鼠肿瘤的肿瘤体积差异;(d)不同肝硬度背景sd大鼠在放疗刺激下肿瘤重量的变化情况;(e)不同肝硬度背景sd大鼠在放疗刺激下肿瘤体积的变化情况(*p《0.05,**p《0.01,***p《0.005,****p《0.001)。
具体实施方式
40.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例的附图,对本发明实施例的技术方案进行清楚、完整地描述。显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于所描述的本发明的实施例,本领域普通技术人员在无需创造性劳动的前提下所获得的所有其它实施例,都属于本发明保护的范围。
41.实施例1
42.按照如图1所示的方法构建高肝硬度背景sd大鼠原位肝癌模型,步骤如下:
43.第一步、诱导高肝硬度sd大鼠:
44.选取4~6周龄雄性sd大鼠,sd大鼠腹部皮下注射四氯化碳,剂量:首次注射纯四氯化碳(3ml/kg),后注射四氯化碳-橄榄油溶液(1:1),2ml/kg,每周2次,共12周,诱导后大鼠肝脏情况如图2a所示。
45.第二步、建立高肝硬度背景sd大鼠原位肝癌模型:
46.细胞:大鼠肝癌细胞mca-rh7777扩增;
47.糖皮质激素预处理:肌肉注射地塞米松,剂量为5mg/kg,共5天,大鼠原位肝癌种植前2天开始直至术后第2天(d-2~d2);
48.术前准备:手术当天用2%戊巴比妥钠进行麻醉,剂量:3ml/kg。剃去腹部手术区毛发;
49.肝包膜下注射:手术在无菌超净台下进行,取腹部正中切口开腹,充分暴露肝脏,1.6
×
106个前述细胞(0.1mlpbs混悬)与低生长因子matrigel混合(1:1,轻轻混匀),用胰岛素针吸取上述混悬液缓慢注入肝包膜下,注意进针方向从肝叶下部斜向上方向,沿肝脏表面包膜进针,进针深度约0.5~1cm,注射完毕后可见肝包膜下出现一透明近圆形凸起(图2b)。随后撤针,用干燥棉球按压注射点数秒,防止细胞从穿刺点流出,观察肝脏无出血后逐层关腹;术后青霉素肌肉注射,剂量为8万u/只,手术当天开始至术后第二天(d0~2),12~14天后可形成结节状肝癌(图2c)。
50.实施例2
51.验证实施例1中高肝硬度背景sd大鼠原位肝癌模型,步骤如下:对先期形成的高肝硬度sd大鼠肝脏硬度进行评估,随机选取6只高肝硬度sd大鼠进行肝脏弹性超声检测肝脏硬度,结果提示高肝硬度sd大鼠的平均肝硬度值为17.03kpa(表1),可较好的模拟人肝硬化的肝脏硬度值。
52.表1:高肝硬度背景sd大鼠原位肝癌模型肝脏弹性超声硬度值
53.case123456meanstiffness value(kpa)15.4519.6815.0217.6717.8516.5417.03
54.对高肝硬度背景sd大鼠原位肝癌模型血清肝功能指标进行检测,发现高肝硬度组sd大鼠的肝酶(alt、ast)升高,白蛋白水平降低,白蛋白/球蛋白比例倒置(图3b),与临床肝硬化患者血清表型相似,提示存在肝纤维化/肝硬化表现。
55.对高肝硬度sd大鼠和正常肝硬度sd大鼠肝脏组织行免疫组化染色,选择lox和col1两指标作为判定标准,观察两组大鼠肝基质硬度情况(图3c
–
d),发现高肝硬度组sd大鼠肝脏组织lox和col1染色强度显著强于正常对照组肝脏组织,说明高肝硬度组sd大鼠肝脏组织lox和col1表达明显增加,提示基质硬度增加。
56.取前述高肝硬度sd大鼠的原位肝癌组织进行he染色,观察肿瘤形态,提示本模型构建的肝癌均为肝细胞癌(图3a)。
57.取前述高肝硬度sd大鼠原位肝癌模型的肺组织进行连续切片和he染色,观察肺转移情况,发现本大鼠模型可出现肺转移(图3e
–
f)。
58.实施例3
59.本实施例中高肝硬度背景sd大鼠原位肝癌模型进行基质微环境对肝癌影响的相关体内外研究实验,步骤如下:
60.利用上述方法构建大鼠肝硬化模型,准备肝硬化大鼠,分成四组:
①
肝硬化大鼠,
wt;
②
肝硬化大鼠,nc;
③
肝硬化大鼠,shitgb1;
④
肝硬化大鼠,shpiezo1。
61.在培养瓶中培养大鼠肝癌细胞mca-rh777,在对数增殖期收集细胞,pbs清洗,计数板计数,制成1.6
×
106个大鼠肝癌细胞/100ul细胞悬液,加入100ul marigel吹打混匀,避免产生气泡。
62.按照上述方法对各组大鼠实施肝包膜下细胞种植手术,2周后处死大鼠,观察测量并记录肿瘤大小、重量、肺转移等情况。评估硬度力学感应分子integrinβ1及piezo1对肝癌侵袭转移的影响,发现integrinβ1或piezo1下调的高肝硬度sd大鼠肝癌模型的成瘤及肺转移能力均明显低于对照组高肝硬度sd大鼠肝癌模型(图4a~d)。
63.同时准备正常肝硬度大鼠(不予四氯化碳诱导肝硬化),分成四组:
①
正常肝硬度大鼠,wt;
②
正常肝硬度大鼠,nc;
③
正常肝硬度大鼠,shitgb1;
④
正常肝硬度大鼠,shpiezo1。按照上述方法重复前述步骤,构建正常肝硬度sdintegrinβ1及piezo1表达量不同的大鼠肝癌模型,观察测量并记录肿瘤大小、重量、肺转移等情况。评估integrinβ1及piezo1在正常肝硬度sd大鼠中对肝癌侵袭转移的影响,发现integrinβ1或piezo1下调的正常肝硬度sd大鼠肝癌模型的成瘤及肺转移能力均明显低于对照组正常肝硬度sd大鼠肝癌模型。此外,正常肝硬度sd大鼠肝癌模型均未发生肺转移,提示正常肝硬度sd大鼠肝癌模型肺转移能力低于高肝硬度sd大鼠肝癌模型(图4e~h)。
64.实施例4
65.通过实施例1中高肝硬度背景sd大鼠原位肝癌模型进行肝脏基质硬度对肝细胞肝癌放疗抵抗影响的相关体内外研究实验,步骤如下:
66.采用实施例1中的方法构建sd大鼠肝硬化模型,准备肝硬化大鼠和对照正常大鼠。分成四组:
①
正常大鼠,不照射(n);
②
正常大鼠,照射(n+ir);
③
肝硬化大鼠,不照射(h);
④
肝硬化大鼠,照射(h+ir)。在培养瓶中培养mca-rh777,在对数增殖期将细胞随记分成两组:对照组、照射组。培养瓶密封,将细胞水平转移至加速器机房;照射方法:6mv-x,剂量率300mv/min,机架角180
°
,下方垫1.5cm补偿膜,一次照射4gy,收集上清,pbs清洗后加入胰酶,用收集的培液终止反应,收集细胞,1000rpm离心3min,加入pbs重悬,计数板计数,制成1.6
×
106个细胞/100ul细胞悬液,加入100ul marigel吹打混匀,避免产生气泡。
67.按照上述方法对各组大鼠实施肝包膜下细胞种植手术,2周后处死大鼠,观察测量并记录肿瘤大小、重量、肺转移等情况,评估肝脏基质硬度对肝细胞肝癌放疗抵抗的影响程度(图5),发现与正常肝硬度sd大鼠肝癌模型比,高肝硬度背景sd大鼠原位肝癌模型对放疗存在明显抵抗。
68.应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
