1.本发明涉及一种用于缓解化疗骨髓抑制的红枣发酵制品及其制备方法,属于功能食品技术领域。
背景技术:
2.化疗是肿瘤的治疗主要手段之一;2018年全球最佳化疗利用率达到57.7%,且呈上升趋势;中国化疗的利用率在60%以上。化疗引起的骨髓抑制(myelosuppression after chemotherapy,mac)是化疗的主要副作用,严重影响化疗的进程和效果。骨髓抑制临床表现为外周血中红细胞、白细胞、血小板等降低,出现贫血、出血、免疫弱化、炎症性反应等现象,其中又以白细胞的减少最为显著,使人体免疫力显著下降,面临感染风险显著提高。
3.目前缓解和治疗化疗引起的骨髓抑制,主要以造血细胞集落刺激因子、成分输血和造血干细胞移植为主,费用高,效果有限,而且具有较多的毒副反应。中药及天然产物的有效成分,在缓解化疗引起的骨髓抑制方面有重要的应用价值。例如,黄芪可改善化疗治疗乳腺癌(中国医药指南,2018,16(2):173-174)、食管癌(中国中药杂志,2015,40(18):3674-3681)、肺癌(curr oncol,2016,23:188-195.)过程中骨髓抑制分级的发生率,缓解骨髓抑制,提高化疗的完成率及其疗效。中国发明专利cn113332326a公开了一种以黄芪、当归、白术等为主要成分的中药组合物及其煎制方法。中国发明专利cn112244298a公开了一种辅助肺部肿瘤化疗的红参铁叶酸组合物及其制法,该组合物为含有红参、菟丝子、黄精、银耳以及叶酸等无机物的口服液,具有缓解骨髓移植的作用。上述技术及其制品,配方复杂,有效成分含量低,使用量大,常以液体等方式使用,使用不方便等问题。且部分中药及天然产物的药理作用不明确,存在潜在的副作用及安全性问题。
4.红枣是“药食同源”的经典代表,红枣在中医临床中具有补血、益气等功效;常被用作化疗病人的肿瘤化疗病人的饮食调养品。现代医学证实红枣中多酚、多糖、有机酸等有效成分,具有免疫刺激和免疫强化的作用。然而,红枣所含大量为还原性糖分及水份,通过直接食用红枣所需的食用量大,且被人体和肠道微生物吸收利用的程度低,因而限制了其使用效果。而提取红枣中多糖等有效成分,提取率低,提取过程造成的其他活性成分(如多酚)损失明显,并且已有文献证明红枣单一组分(如多糖)不如红枣所含多组分混合物的效果明显。
5.发酵是红枣加工的一种重要方式。现有技术主要通过发酵来降低红枣中的还原糖含量,同时获得一些风味物质和有益的发酵组分(如有机酸、脂肪酸、氨基酸),同时在发酵过程中使用乳酸菌等益生菌,提升其改善肠道微生物的作用。发酵制品通常以红枣酒和醋的形式使用。如中国发明专利cn111227149a公开了一种富含多酚的低糖发酵红枣浆饮品及其制备方法,利用乳酸菌发酵,降低总糖及还原糖并提高产品的总酚含量。中国发明专利cn110973426a公开了一种益生菌发酵红枣液及其制备方法,制备的发酵型红枣液,还原糖含量大幅降低且增加γ-氨基丁酸(gaba)功能成分。这些发酵产品通常没有针对特定的使用对象以及特定的功能进行发酵组分优化和发酵产品制剂加工。特别是,缺乏针对肿瘤患
者和化疗引起的缓解骨髓抑制的红枣发酵制剂技术和产品。
技术实现要素:
6.本发明的目的是提供一种针对肿瘤患者和化疗引起的缓解骨髓抑制的红枣发酵产品,通过特定的发酵工艺条件,富集对缓解骨髓抑制有益的组分,降低糖含量,改善肠道微生物对红枣中有益组分的吸收和利用,提升红枣缓解骨髓抑制的作用,改善化疗病人的肠道微生物,增加肠道微生物的短链脂肪酸代谢,缓解化疗病人的骨髓抑制,特别是白细胞抑制,提升化疗效果。
7.本发明所提供的红枣发酵制品的制备方法,包括如下步骤:
8.s1、采用水提取红枣组分干粉,过滤得到红枣水提物滤液;
9.s2、采用果酒酵母对所述红枣水提物滤液进行发酵;
10.所述发酵的条件如下:
11.发酵温度为20~40℃,具体可为25~30℃,发酵时间为3~8h,具体可为4~6h;
12.发酵液中溶解氧含量为30%~50%,如40%~45%或40%~50%;
13.发酵终点时发酵液ph控制为3.0~3.5,如3.1~3.2;
14.s3、所述发酵结束后,经减压浓缩脱除乙醇,即得所述红枣发酵制品。
15.上述的制备方法中,步骤s1中,所述红枣组分干粉的粒径为10~100μm;
16.以干物质计,所述红枣组分干粉中还原性糖的含量不高于60%。
17.上述的制备方法中,步骤s1中,所述水与所述红枣全组分干粉的质量比为4~7:1,如5:1;
18.所述提取的温度为30~50℃,时间为0.5~2h,如在30℃的条件下提取0.5h;
19.所述红枣水提物滤液中,以葡萄糖计,总糖含量不低于80g总糖/kg红枣水提物滤液。
20.上述的制备方法中,步骤s2中,所述果酒酵母的用量为:按所述红枣水提物滤液中总糖计,每2~5g总糖接种1g所述果酒酵母,如4g总糖接种1g所述果酒酵母。
21.上述的制备方法中,步骤s3中,所述减压浓缩得到的浓缩液中溶质含量为15%~25%,如20%;
22.所述方法还包括对所述浓缩液进行冻干得到红枣发酵物冻干粉的步骤;
23.所述红枣发酵物冻干粉的含水率小于5%。
24.本发明方法制备的红枣发酵制品中,总糖的质量分数不低于90%,其中,多糖的质量分数为40%~60%;总酚的质量分数为0.5%~1.5%;短链脂肪酸的质量分数为0.3%~0.8%;
25.本发明具体实施方式制备的红枣发酵制品中,总糖的质量分数为95%~96(95.7%~96.4%),其中,多糖的质量分数为42%~46%(42.3%~46%));总酚的质量分数为0.8%~0.9%;短链脂肪酸的质量分数为0.4%~0.6%。
26.本发明方法制备的红枣发酵制品能够增强环磷酰胺抗肿瘤疗效、增强环磷酰胺与其他抗肿瘤药物联用的抗肿瘤疗效、减轻环磷酰胺所致骨髓抑制以及改善化疗患者的肠道微生物丰度和结构。
27.具体可按照下述方式服用所述红枣发酵制品:
28.在不晚于首次使用化疗药物的3天内,连续口服所述红枣发酵制品,每天的口服用量为0.1~0.6g/kg体重,具体可为0.25~0.5g/kg体重;分一次服用或分次服用;连续服用至少12天。
29.本发明提供的红枣发酵冻干粉能够显著改善化疗病人的肠道微生物丰度和结构,减化疗药物的所致骨髓抑;本发明的红枣发酵冻干粉与化疗药物配合使用时,可增强化疗药物的治疗效果。
附图说明
30.图1为本发明制备红枣发酵制品的工艺流程图。
31.图2为本发明红枣发酵制品对肠道微生物的多样性的影响(实施例3)。
32.图3为基因水平上毛螺菌科(lachnospiraceae)的差异(左图)以及盲肠内容物中丁酸盐含量的差异(右图)(实施例3)。
33.图4为本发明红枣发酵制品对肠道微生物的多样性的影响(实施例4)。
34.图5为kegg功能预测的丁酸盐代谢功能丰度(左图)以及盲肠内容物中丁酸盐含量的差异(右图)(实施例5)。
35.图6为mc38结肠癌小鼠模型肿瘤体积的变化。
具体实施方式
36.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
37.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
38.本发明红枣发酵制品用于减轻化疗药物所致的骨髓抑制以及增强化疗药物的抗肿瘤疗效的应用中。
39.下面实施例的红枣全组分干粉为产自新疆阿克苏的灰枣经干燥、脱核后以及低温粉碎后得到的全组分干粉,该红枣全组分干粉的主要活性物质含量如表1所示,粒径为38~53μm(筛分粒径)。
40.表1红枣全组分干粉原料主要活性物质含量(以干物质计)
41.组分还原糖多糖总酚蛋白短链脂肪酸水不溶物质量分数(%)58.214.11.11.50.213
42.下述实施例采用的mc38结肠癌细胞株购于国家实验细胞资源共享平台,下述实施例所用mc38结肠癌小鼠模型可按照如下文献记载的步骤获得:探讨pd-1抑制剂在不同小鼠肿瘤模型中的应答差异,解放军医学院学报,2019,40(4)。
43.实施例1、制备红枣发酵冻干粉
44.将1kg红枣全组分干粉(表1所示)和5kg水混匀后在搅拌釜中30℃提取30分钟,而后过滤两次去除固体物质,共收集滤液5.58kg,滤渣烘干后称重为0.28kg,即红枣粉中72%的物质溶解在水中。采用苯酚-硫酸法测定滤液中的总糖含量(以葡萄糖计)为116g总糖/kg提取液。
45.将上述提取液中加入8l发酵釜中。根据总糖量,加入安琪果酒酵母sy 175g(相当于每4kg总糖加入1kg酵母)。而后通入微量过滤空气,调整通气量使发酵液的溶解氧do值保持为40%~45%;发酵过程中以水浴夹套控制发酵温度为30℃。在此条件下发酵4h,发酵终
点时发酵液ph值为3.2。
46.将发酵液(包括其中的固体)取出,在旋转蒸发器中,在40℃和真空度50kpa下,蒸发乙醇和水分,至溶质含量为20%,而后将浓缩液预冷,并在冻干机中冻干24h,得到冻干粉,其中水含量为3%,发酵制品的收率为19.1%(发酵制品溶质总量/红枣全组分干粉的固体总量)。测定冻干粉中各组分含量列于表2中。
47.实施例2、制备红枣发酵冻干粉
48.红枣水提取物发酵液的制备过程同实施例1,得到的水提滤液中的总糖含量(以葡萄糖计)为121g总糖/kg提取液。
49.将水提滤液6kg发酵装8l发酵釜中。根据总糖量,加入安琪果酒酵母sy 180g(相当于每4kg总糖加入1kg酵母)。而后通入微量过滤空气,调整通气量使发酵液的溶解氧do值保持为40%~50%;发酵过程中以水浴夹套控制发酵温度为25℃。在此条件下发酵6h,发酵终点时发酵液ph值为3.1。
50.将发酵液(包括其中的固体)取出,在旋转蒸发器中,在40℃和真空度50kpa下,蒸发乙醇和水分,至溶质含量为20%,而后将浓缩液预冷,并在冻干机中冻干24h,得到冻干粉,其中水含量为3%,发酵制品的收率为18.3%(发酵制品溶质总量/红枣全组分干粉的固体总量)。测定冻干粉中各组分含量列于表2中。
51.表2实施例1和2制备的发酵冻干粉的各组分含量(质量分数)
[0052] 总糖还原糖多糖蛋白短链脂肪酸总酚实施例196.4%54.1%42.3%2.2%0.4%0.8%实施例295.7%49.7%46.0%2.7%0.6%0.9%
[0053]
实施例3、采用实施例1制备的红枣发酵制品改善肠道微生物及缓解免疫抑制的效果
[0054]
采用mc38结肠癌小鼠模型,采用的化疗药物为环磷酰胺,设阴性对照组(ctr)、模型对照组(ctx)、使用本发明产品恢复组(ctx+jf)。
[0055]
适应性喂养7天,对模型对照组、三组恢复组腹腔注射环磷酰胺,剂量为80mg/kg体重,持续3天,阴性对照组腹腔注射等体积的生理盐水。腹腔注射3天后开始用红枣组分与红枣发酵产品对恢复组小鼠灌胃,剂量为0.4g/kg体重,每天1次,持续13天,阴性对照组(ctr)与模型对照组(ctx)灌胃等体积的无菌蒸馏水。灌胃结束后将小鼠禁食12h,记录其体重。使用眼眶动脉取血法每只小鼠取1ml外周血,使用动物血液体液分析仪对外周血进行血常规检测。使用流式细胞法检测血液中cd4
+
t细胞与cd8
+
t细胞在白细胞中的比例,使用flowjo10.6.2进行流式数据分析。随后即用颈椎脱臼法处死小鼠,取出小鼠粪便,对小鼠解剖取出盲肠内容物、脾脏并对脾脏称重记录。将0.1g盲肠内容物用0.4ml水、0.1ml50%硫酸溶解酸化,离心取上清液,加入0.5ml乙醚,震荡5min,萃取其中短链脂肪酸,离心后取乙醚层,使用气相色谱对其中短链脂肪酸组分进行定分析。
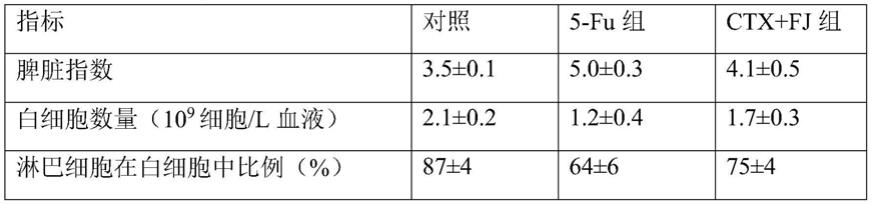
[0056]
使用16s rrna基因扩增子测序对粪便样本中的细菌群落组成进行表征。以粪便基因组dna小量提取试剂盒(qiagen,hilden,德国)提取小鼠粪便中的dna。采用pcr对16s rrna基因的v3-v4区进行扩增,而后采用标准程序进行测序。微生物的α-多样性采用在线majorbio i-sanger云平台(www.i-sanger.com)进行分析;主成分分析以及样品差异分析采用mixomics r语言包完成;lefse用于描述不用实验组微生物群落成分的差异。微生物群
落的潜在功能采用picrust预测工具完成,并进一步利用deseq2 r语言包进行差异基因表达分析。
[0057]
图2展示了不同组的肠道微生物的多样性和生物群落成分的结果。使用化疗药物环磷酰胺使表征小鼠肠道微生物α-多样性的chao-1指数下降,辛普森指数增大;而配和使用本发明的红枣发酵制品后,chao-1指数得到恢复(chao-1指数对稀有物种敏感,特别表明稀有的微生物得到了恢复),辛普森指数降低对照组的水平以下。以上结果表明本发明的红枣发酵制品可使化疗药物造成的肠道微生物的丰度等到恢复或者提高。
[0058]
图3展示了为本发明的红枣发酵制品对微生物群落的潜在功能的影响。使用本发明的红枣发酵制品后,与短链脂肪酸代谢特别是丁酸盐代谢相关的毛螺菌科(lachnospiraceae)微生物的比例提高。使用化疗药物环磷酰胺使丁酸盐的代谢水平降低,而配和使用本发明的红枣发酵制品后,丁酸盐的代谢水平得到恢复。
[0059]
表3列出本发明的红枣发酵制品对免疫细胞和免疫系统恢复作用的数据。可见,使用化疗药物ctx造成免疫细胞数量显著的降低,脾脏指数增加;而联合使用本发明的红枣发酵制品后,外周血白细胞数量均得到恢复,cd8
+
t细胞和cd4
+
t细胞的比例提高。
[0060]
表3本发明的红枣发酵制品对免疫细胞和免疫系统的恢复作用
[0061]
指标对照ctx组ctx+fj组脾脏指数(mg/g)3.7
±
0.014.8
±
0.24.0
±
0.9白细胞数量(109细胞/l血液)2.0
±
0.30.9
±
0.21.5
±
0.2淋巴细胞在白细胞中比例(%)87
±
361
±
871
±
5cd8
+
t占cd45
+
细胞比例(%)14.2
±
0.411.9
±
0.515.6
±
0.2cd4
+
t占cd45
+
细胞比例(%)32
±
523
±
426
±2[0062]
实施例4、采用实施例2制备的红枣发酵制品改善肠道微生物及缓解免疫抑制的效果
[0063]
采用mc38结肠癌小鼠模型,采用的化疗药物为5-氟尿嘧啶(5-fu),设阴性对照组(ctr)、模型对照组(5-fu)、使用本发明产品恢复组(5-fu+jf)。
[0064]
适应性喂养7天,对模型对照组、三组恢复组腹腔隔日注射5-氟尿嘧啶注射液,剂量为25mg/kg体重,持续12天,阴性对照组腹腔注射等体积的生理盐水。腹腔注射5-氟尿嘧啶2次后(即第3天)开始用红枣组分与红枣发酵产品对恢复组小鼠灌胃,剂量为0.32mg/kg体重,每天1次,持续13天,阴性对照组(ctr)与模型对照组(ctx)灌胃等体积的无菌蒸馏水。灌胃结束后将小鼠禁食12h,记录其体重。使用眼眶动脉取血法每只小鼠取1ml外周血,使用动物血液体液分析仪对外周血进行血常规检测。使用流式细胞法检测血液中cd4
+
t细胞与cd8
+
t细胞在白细胞中的比例,使用flowjo10.6.2进行流式数据分析。随后即用颈椎脱臼法处死小鼠,取出小鼠粪便,对小鼠解剖取出盲肠内容物、脾脏并对脾脏称重记录。将0.1g盲肠内容物用0.4ml水、0.1ml 50%硫酸溶解酸化,离心取上清液,加入0.5ml乙醚,震荡5min,萃取其中短链脂肪酸,离心后取乙醚层,使用气相色谱对其中短链脂肪酸组分进行定分析。
[0065]
使用16s rrna基因扩增子测序对粪便中的细菌群落组成进行表征。以粪便基因组dna小量提取试剂盒(qiagen,hilden,德国)提取小鼠粪便中的dna。采用pcr对16s rrna基因的v3-v4区进行扩增,而后采用标准程序进行测序。微生物的α-多样性采用在线majorbio i-sanger云平台(www.i-sanger.com)进行分析;主成分分析以及样品差异分析采用
mixomics r语言包完成;lefse用于描述不用实验组微生物群落成分的差异。微生物群落的潜在功能采用picrust预测工具完成,并进一步利用deseq2 r语言包进行差异基因表达分析。
[0066]
图4展示了不同组的肠道微生物的多样性和生物群落成分的结果。使用化疗药物5-fu使表征小鼠肠道微生物α-多样性的chao-1指数下降,辛普森指数增大;而配和使用本发明的红枣发酵制品后,chao-1指数得到恢复(chao-1指数对稀有物种敏感,特别表明稀有的微生物得到了恢复),辛普森指数降低对照组的水平以下。以上结果表明本发明红枣发酵制品可使化疗药物5-fu造成的肠道微生物的丰度等到恢复或者提高。
[0067]
图5展示了为本发明的红枣发酵制品对微生物群落的潜在功能的影响。使用本发明的红枣发酵制品后,与短链脂肪酸代谢特别是丁酸盐代谢相关的微生物的比例提高。使用化疗药物环磷酰胺使丁酸盐的代谢水平降低,而配和使用本发明红枣发酵制品后,丁酸盐的代谢水平得到恢复。
[0068]
表4列出了本发明的红枣发酵制品对免疫细胞和免疫系统恢复作用的数据。可见,使用化疗药物5-fu造成免疫细胞数量显著的降低,脾脏指数增加;而联合使用本发明的红枣发酵制品后,外周血中白细胞的数量和淋巴细胞在白细胞中的占比均得到恢复,cd8
+
t细胞比例提高,cd4
+
t细胞比例得到一定程度恢复。
[0069]
表4本发明的红枣发酵制品对免疫细胞和免疫系统的恢复作用
[0070][0071][0072]
实施例5、采用实施例1制备的红枣发酵制品增强肿瘤治疗的效果
[0073]
采用mc38结肠癌小鼠模型,采用的化疗药物为环磷酰胺(ctx),设阴性对照组(ctr)、模型对照组(ctx)、使用本发明产品恢复组(ctx+jf)。
[0074]
适应性喂养7天,而后(计为第0天)对模型对照组、恢复组腹腔注射环磷酰胺,剂量为80mg/kg体重,持续3天,阴性对照组腹腔注射等体积的生理盐水。腹腔注射3天后开始用红枣组分与红枣发酵产品对恢复组小鼠灌胃,剂量为0.5mg/kg体重,每天1次,持续13天,阴性对照组(ctr)与模型对照组(ctx)灌胃等体积的无菌蒸馏水。分别在第0天、第5天、第7天和第13天,测量记录其肿瘤体积其体重。
[0075]
图6为小鼠肿瘤的体积变化,可以看出,采用本发明红枣发酵制品和环磷酰胺联合使用,可使肿瘤体积较单独使用环磷酰胺降低82%。
