1.本技术涉及生物制药技术领域,更具体而言,其涉及一种奶牛乳房炎多联灭活疫苗及其制备方法和应用。
背景技术:
2.奶牛乳房炎(bovine mastitis)是由致病性或条件致病性病原微生物感染或理化刺激所引起的奶牛乳腺的一种炎性病变。因其病因复杂,反复发作,是影响全球奶牛业持续发展的三大疾病之一,也是导致奶牛养殖业经济损失最惨重的一种疾病,特别是我国表现更为严重。因此,科学防控奶牛乳房炎已成为关系到国计民生的重大现实问题。
3.奶牛乳房炎的致病因素多且复杂,如饲养方式、卫生条件、遗传因素、病原微生物感染等,其中病原微生物感染是最主要的致病因素。引起奶牛乳房炎的病原微生物高达150多种,主要为大肠杆菌、金黄色葡萄球菌和链球菌,这三种细菌占感染引起奶牛乳房炎的比例超过90%,其中大肠杆菌占30%,金黄色葡萄球菌占46%,链球菌占40%,多以临床型或亚临床型出现,易于分娩或临近分娩时爆发,导致产奶量降低,发病严重淘汰。目前,采用抗生素治疗奶牛乳房炎是最有效的手段,但抗生素易产生耐药性,抗生素残留对畜牧业、人类健康及食品安全与公共卫生安全的危害已引起国际社会高度关注。因此,在当下严格控制抗生素使用的前提下,如何科学防治由病原感染导致的奶牛乳房炎,确保乳制品食品安全是我们面临的严峻挑战。
4.疫苗是通过增强机体免疫系统的功能从而使机体获得天然的抗病能力,并且疫苗具有安全、稳定、有效等特点,目前疫苗仍是防控传染病最有效的手段之一。对于细菌感染致奶牛乳房炎疫苗而言,国际上结合优势流行菌株与奶牛自身感染特征开展了深入研究并取得了重要成果。一是美国在上世80年代研发及批准上市针对大肠杆菌的j5灭活疫苗,已在美国和欧洲对控制大肠杆菌感染致奶牛乳房炎中发挥重要作用;二是美国勃林格上世纪90年代研发及批准上市针对金黄色葡萄球菌的lysigin多价裂解疫苗,能够抵抗金黄色葡萄球菌感染且具有一定的保护力;三是西班牙本世纪初研发及批准上市针对大肠杆菌、金黄色葡萄球菌的 startvac灭活疫苗,能安全、有效抵抗大肠杆菌、金黄色葡萄球菌感染致奶牛乳房炎;四是西班牙研发及批准上市针对大肠杆菌、金黄色葡萄球菌、化脓性放线杆菌、无乳链球菌、化脓性链球菌等的多联疫苗mastivac能够有效防控细菌引起的奶牛乳房炎;五是在巴西批准上市的多联疫苗mastiplus-br中含有无乳链球菌,停乳链球菌,乳房链球菌,金黄色葡萄球菌,大肠杆菌,化脓性链球菌,鼠伤寒沙门氏菌、肺炎克雷伯菌,产气肠杆菌和多杀性巴氏杆菌等细菌。分析这些已批准上市商业化产品安全有效。因此,研发适宜中国流行代表菌株和环境的疫苗势在必行。国内研究的奶牛乳腺炎疫苗均处于实验室研究阶段,但由于乳腺炎病原菌复杂,乳腺免疫具有独特性质,研究不深入,细菌苗制造过程中存在技术难题,使得国内尚无高效、商业化运作成熟、广泛使用的奶牛乳腺炎疫苗。奶牛乳房炎多联多价疫苗研发既要集成传统疫苗策略,又要有创新思维,这将是科学防控细菌感染致乳房炎疫苗创新发展的关键所在。
技术实现要素:
5.为了安全、高效、全面有效预防奶牛乳房炎,延长免疫持续期,本技术提供一种奶牛乳房炎多联灭活疫苗及其制备方法和应用。
6.第一方面,本技术提供一种奶牛乳房炎多联灭活疫苗,采用如下技术方案:一种奶牛乳房炎多联灭活疫苗,其活性成分包括灭活后的大肠埃希氏菌、灭活后的5型金黄色葡萄球菌、灭活后的8型金黄色葡萄球菌、灭活后的336型金黄色葡萄球菌、灭活后的ⅰa 型无乳链球菌、灭活后的ⅱ型无乳链球菌、灭活后的停乳链球菌、灭活后的乳房链球菌、灭活后的肺炎克雷伯氏菌、灭活后的化脓链球菌;所述大肠埃希氏菌命名为大肠埃希氏菌ebm09菌株,于2013年12月09日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.8532;所述5型金黄色葡萄球菌命名为5型金黄色葡萄球菌sacp5菌株,于2018年6月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.15908;所述8型金黄色葡萄球菌命名为8型金黄色葡萄球菌sacp8菌株,于2018年6月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.15907;所述336型金黄色葡萄球菌命名为336型金黄色葡萄球菌sa336菌株,于2018年6月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.15909;所述ⅰa型无乳链球菌命名为无乳链球菌sawr-6菌株,于2013年12月09日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.8533;所述ⅱ型无乳链球菌命名为无乳链球菌sawr-9菌株,于2021年5月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.22629;所述停乳链球菌命名为停乳链球菌sdtr-9菌株,于2013年12月09日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.8534;所述乳房链球菌命名为乳房链球菌surf-5菌株,于2013年12月09日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.8535;所述肺炎克雷伯氏菌命名为肺炎克雷伯氏菌kp-2菌株,于2021年5月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.22627;所述化脓链球菌命名为化脓链球菌sphn-4菌株,于2021年5月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.22628。
7.可选的,所述灭活后的大肠埃希氏菌、灭活后的5型金黄色葡萄球菌、灭活后的8型金黄色葡萄球菌、灭活后的336型金黄色葡萄球菌、灭活后的ⅰa型无乳链球菌、灭活后的ⅱ型无乳链球菌、灭活后的停乳链球菌、灭活后的乳房链球菌、灭活后的肺炎克雷伯氏菌、灭活后的化脓链球菌的浓度各自独立地为10
8-10
10
个菌/ml。
8.可选的,还包括佐剂。
9.可选的,所述佐剂选自sp01-cpg佐剂、sp01佐剂、白油佐剂、铝盐佐剂中的至少一种。优选的,所述佐剂为sp01-cpg佐剂、sp01佐剂中的至少一种。进一步优选的,所述佐剂为sp01-cpg佐剂。
10.其中,所述cpg为牛cpg序列5
’‑
tccatgacgttcctgacgtt-3’。
11.所述sp01佐剂的制备方法如下:用pbs(0.01m,ph值7.2)按重量体积比配制5%角鲨烯(购于sigma公司,货号为
442785)、 2.5%聚氧乙烯蓖麻油(购于sigma公司,货号为c5135,密度1.05g/ml,粘度850cp)和 2.5%聚醚(购于sigma公司,货号为435449,密度1.05g/ml,粘度850cp)的原料;将原料用高速分散机混匀30min以上,速度为10000rpm以上,当油状原料均匀分散后,再加pbs 缓冲液混匀,转速6000rpm或以上,时间3min或以上,当油状原料均匀分散后,初乳制备完毕,用纳米粒径仪检测其粒径及均一度,平均粒径约为2000-3000nm,该初乳静置后分层。
12.所述sp01-cpg佐剂的制备方法如下:用pbs(0.01m,ph值7.2)按重量体积比配制5%角鲨烯(购于sigma公司,货号为442785)、 2.5%聚氧乙烯蓖麻油(购于sigma公司,货号为c5135,密度1.05g/ml,粘度850cp)和 2.5%聚醚(购于sigma公司,货号为435449,密度1.05g/ml,粘度850cp)的原料;将原料用高速分散机混匀30min以上,速度为10000rpm以上,当油状原料均匀分散后,再加pbs 缓冲液、终浓度5%的牛cpg序列5
’‑
tccatgacgttcctgacgtt-3’混匀,转速6000rpm 或以上,时间3min或以上,当油状原料均匀分散后,初乳制备完毕,用纳米粒径仪检测其粒径及均一度,平均粒径约为2000-3000nm,该初乳静置后分层。
13.可选的,还包括等渗缓冲溶液。
14.可选的,所述等渗缓冲溶液选自pbs溶液、生理盐水中的一种。
15.可选的,还包括mf59、免疫刺激复合物、脂质体、免疫细胞因子中的至少一种。
16.第二方面,本技术提供一种奶牛乳房炎多联灭活疫苗的制备方法,采用如下技术方案:一种奶牛乳房炎多联灭活疫苗的制备方法,包括如下步骤:(1)抗原原液的制备大肠埃希氏菌、5型金黄色葡萄球菌、8型金黄色葡萄球菌、336型金黄色葡萄球菌、ⅰa型无乳链球菌、ⅱ型无乳链球菌、停乳链球菌、乳房链球菌、肺炎克雷伯氏菌、化脓链球菌各自独立地经过发酵培养、灭活、离心、重悬得相应的抗原原液;(2)疫苗的制备将大肠埃希氏菌抗原原液、5型金黄色葡萄球菌抗原原液、8型金黄色葡萄球菌抗原原液、336 型金黄色葡萄球菌抗原原液、ⅰa型无乳链球菌抗原原液、ⅱ型无乳链球菌抗原原液、停乳链球菌抗原原液、乳房链球菌抗原原液、肺炎克雷伯氏菌抗原原液、化脓链球菌抗原原液混合均匀得混合液,所述混合液与佐剂混合乳化得所述奶牛乳房炎多联灭活疫苗。
17.可选的,所述混合液和佐剂的体积比为(1-2):1。
18.可选的,步骤(1)中所述灭活时采用甲醛灭活。
19.可选的,步骤(1)中所述重悬时采用pbs溶液或生理盐水。
20.可选的,步骤(2)中所述混合液在与佐剂混合乳化之前采用pbs溶液或生理盐水调节混合液中的细菌浓度。
21.第三方面,本技术提供一种大肠埃希氏菌、5型金黄色葡萄球菌、8型金黄色葡萄球菌、336型金黄色葡萄球菌、ⅰa型无乳链球菌、ⅱ型无乳链球菌、停乳链球菌、乳房链球菌、肺炎克雷伯氏菌、化脓链球菌在预防奶牛乳房炎、制备预防奶牛乳房炎产品、制备奶牛乳房炎疫苗中的应用;所述大肠埃希氏菌命名为大肠埃希氏菌ebm09菌株,于2013年12月09日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.8532;
所述5型金黄色葡萄球菌为5型金黄色葡萄球菌sacp5菌株,于2018年6月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.15908;所述8型金黄色葡萄球菌为8型金黄色葡萄球菌sacp8菌株,于2018年6月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.15907;所述336型金黄色葡萄球菌为336型金黄色葡萄球菌sa336菌株,于2018年6月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.15909;所述ⅰa型无乳链球菌为无乳链球菌sawr-6菌株,于2013年12月09日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.8533;所述ⅱ型无乳链球菌为无乳链球菌sawr-9菌株,于2021年5月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.22629;所述停乳链球菌为停乳链球菌sdtr-9菌株,于2013年12月09日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.8534;所述乳房链球菌为乳房链球菌surf-5菌株,于2013年12月09日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.8535;所述肺炎克雷伯氏菌为肺炎克雷伯氏菌kp-2菌株,于2021年5月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.22627;所述化脓链球菌为化脓链球菌sphn-4菌株,于2021年5月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.22628。
22.第四方面,本技术提供一种无乳链球菌sawr-9菌株于2021年5月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.22629。
23.第五方面,本技术提供一种无乳链球菌sawr-9菌株在预防奶牛乳房炎、制备预防奶牛乳房炎产品、制备奶牛乳房炎疫苗中的应用。
24.第六方面,本技术提供一种肺炎克雷伯氏菌kp-2菌株于2021年5月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.22627。
25.第七方面,本技术提供一种肺炎克雷伯氏菌kp-2菌株在预防奶牛乳房炎、制备预防奶牛乳房炎产品、制备奶牛乳房炎疫苗中的应用。
26.第八方面,本技术提供一种化脓链球菌sphn-4菌株于2021年5月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.22628。
27.第九方面,本技术提供一种化脓链球菌sphn-4菌株在预防奶牛乳房炎、制备预防奶牛乳房炎产品、制备奶牛乳房炎疫苗中的应用。
28.综上所述,本技术具有以下有益效果:第一、所用疫苗菌种是通过大规模筛选获得的临床流行株,免疫原性好;所用检验菌种也是通过毒力筛选获得的强毒株。
29.第二、奶牛乳房炎成因复杂,本多联灭活疫苗基本覆盖常见的流行致病菌和环境致病菌,能有效预防奶牛乳房炎。
30.第三、在佐剂中增加牛cpg序列5
’‑
tccatgacgttcctgacgtt-3’,可以增强免疫反应。
具体实施方式
31.以下结合实施例对本技术作进一步详细说明。
32.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
33.下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
34.下述实施例中的定量试验,均设置三次重复实验,结果取平均值。
35.下述实施例中的结果评判期中,只要满足如下(1)、(2)中的一项,则判断为乳房炎发病个体:(1)临床评分不低于2分;临床评分标准:0分:乳房外观和乳汁正常;1分:乳汁中无结块;2分:乳汁中有结块;3分:乳房有炎性反应,硬块,乳汁中有淡黄色组织分泌物;4分:乳房有重度炎性反应,硬块,乳汁中有淡黄色或血性组织分泌物,奶牛存在战栗、出血、厌食精神萎靡等症状。
36.⑵
乳汁中体细胞数高于30万个/ml。
37.下述实施例中的脑心浸液肉汤琼脂平板的溶剂为水,溶质及其浓度分别如下:蛋白胨 lo.og/l、牛脑浸粉12.5g/l、牛心浸粉5.og/l、氯化钠5.og/l、葡萄糖2.og/l、磷酸氢二钠 2.5g/l、琼脂15.0g/l,ph为7.4
±
0.1。
38.下述实施例中的麦康凯琼脂培养基的溶剂为水,溶质及其浓度分别如下:明胶胰酶水解物17.0g/l、蛋白胨3.og/l、乳糖10.og/l、脱氧胆酸钠1.5g/l、氯化钠5.og/l、中性红0.030g/l、琼脂13.5g/l,结晶紫0.001g/l、ph为7.1
±
0.2。
39.下述实施例中的新鲜脱纤维绵羊血平板的溶剂为水,溶质及其浓度分别如下:胰蛋白胨15.0g/l、大豆蛋白胨5.0g/l、氯化钠5.0g/l、琼脂15.0g/l、新鲜脱纤维绵羊血100ml/l, ph为7.3+0.1。
40.一、疫苗株及检验用菌株的筛选及保藏(一)感染奶牛乳房炎流行优势菌株的筛选并确定从覆盖我国内蒙古、甘肃、新疆、黑龙江、河北、山东等东西南北中12个省市100余个中大型奶牛场、近3万头奶牛乳腺炎乳汁样品,分离、鉴定、确定我国奶牛乳房炎流行优势株。经过形态、生化、纯粹性、基因特征、传代稳定性等方面全面鉴定,从中分别挑选流行株。这些菌株不仅是流行株,且具有产量高、稳定性好、诱导免疫保护能力强、交叉保护谱广等优点。具体步骤如下:s1奶牛乳样的采集选取出现乳房炎临床症状(或者怀疑为亚临床型乳房炎)奶牛,先用温水,再用体积百分比浓度为0.2%新洁尔灭擦洗乳房,最后用体积百分比浓度为75%的酒精擦拭乳头。采样者同时进行手指擦拭消毒。每个乳室先挤去头2-3把奶,以排除污染的杂菌,每头奶牛取乳样至少 15ml于无菌乳样杯中,2-8℃保存待检。
41.s2大肠杆菌菌株的获得和保藏s2.1菌株的筛选——从乳样中分离纯化大肠杆菌菌株大肠杆菌的菌落形态特征(37℃,培养24-72h):(1)tsa培养基:可见光滑、湿润、表面有光泽、隆起的圆形乳白色菌落,挑取典型菌落涂片、革兰氏染色并镜检,染色阴性,呈长杆状,单个或成对;(2)营养肉汤:呈浑浊生长;(3)麦康凯培养基:菌落呈圆形、粉红色、光滑、湿润、表面有光泽;(4)血琼脂平板(新鲜脱纤维绵羊血):生长并形成灰白色菌落,无溶
血现象。
42.大肠杆菌的生理生化特征:(1)氧化酶试验:阴性;(2)糖发酵试验:能分解葡萄糖、乳糖、甘露醇、阿拉伯糖、麦芽糖、木糖、棉子糖产酸,不能利用丙二酸盐、枸橼酸盐、山梨醇;(3)甲基红阳性;(4)苯丙氨酸脱氢酶试验:阴性;(5)硫化氢试验:阴性;(6)脲酶试验:阴性;(7)硝酸盐还原反应:阳性;(8)明胶液化反应:阴性;(9)凝固酶反应:阴性;(10)dna 酶试验:阴性;(11)接触酶反应:阳性。
43.将分离得到的大肠杆菌的分别进行全基因组测序与genbank数据库进行比对。
44.s2.2构建重组菌通过构建自杀致死质粒pcvd442-gale,运用同源重组的方法敲除参与脂多糖合成的gale基因,得到1株重组菌(定义为p0代)。
45.将重组菌(定义为p0代),划线接种至tsa培养基平板,37℃静置培养20小时,然后用5g/100ml的脱脂奶粉水溶液冲洗并收集平板上的菌落,分装于冻存管(定义为p1代),
ꢀ‑
70℃以下保存。
46.取p1冻存管,室温水浴解冻,接种至tsb培养基,37℃、160rpm振荡培养20小时,每100毫升加入5g脱脂奶粉,分装于冻存管(定义为p2代),-70℃以下保存。
47.取p2冻存管,室温解冻,接种至tsb培养基,37℃、160rpm振荡培养20小时,加入等体积的体积百分比浓度为60%甘油的纯化水溶液,分装于冻存管(定义为p3代),-70℃以下保存。
48.将该株重组菌分类命名为大肠埃希氏菌(escherichia coli)ebm09,简称菌株ebm09。 p3代菌株ebm09于2013年12月09日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为cgmcc no.8532。
49.s3金黄色葡萄球菌菌株的的获得和保藏s3.1菌株的筛选——从乳样中分离纯化金黄色葡萄球菌菌株金黄色葡萄球菌的菌落形态特征(37℃,培养24-72h):(1)tsa培养基平板:可见到湿润、光滑、隆起的圆形金黄色菌落,挑取典型菌落涂片、染色并镜检,革兰氏染色阳性且呈葡萄状排列;(2)营养肉汤:呈浑浊生长,管底有少量灰白色沉淀;(3)麦康凯培养基:不生长;(4) 血琼脂平板(新鲜脱纤维绵羊血):菌落较大,呈金黄色、圆形,菌落周围出现明显的溶血。
50.金黄色葡萄球菌的生理生化特征:(1)触酶试验:阳性;(2)血浆凝固酶反应:阳性;(3) 糖发酵试验:能分解葡萄糖、乳糖、甘露醇、麦芽糖、蔗糖发酵,不能利用阿拉伯糖、丙二酸盐;(4)氧化酶试验:阴性;(5)v-p试验:阳性;(6)dna酶试验:阳性;(7)硝酸盐还原反应:阳性;(8)吲哚试验:阳性;(9)明胶液化反应:阴性。
51.将分离得到的金黄色葡萄球菌分别进行全基因组测序,与genbank数据库进行比对。
52.s3.2菌株的扩大培养将菌株分别划线接种至bhi培养基平板,37℃静置培养20小时,然后用质量百分比浓度为 5%脱脂奶粉水溶液冲洗并收集平板上的菌落,分装于冻存管(定义为p1代),-70℃以下保存。
53.取p1冻存管,室温解冻,然后接种至液体bhi培养基,37℃、160rpm振荡培养20 小时,每100毫升加入5g脱脂奶粉,分装于冻存管(定义为p2代),-70℃以下保存。
54.取p2冻存管,室温解冻,然后接种至液体bhi培养基,37℃、160rpm振荡培养20 小时,加入等体积的体积百分比浓度为60%甘油的纯化水溶液,分装于冻存管(定义为p3 代),-70℃以下保存。
55.s3.3菌株的血清型鉴定和致病性鉴定将p3代菌株分别进行玻片凝集试验(5型金黄色葡萄球菌atcc49521;8型金黄色葡萄球菌 atcc49525;336型金黄色葡萄球菌atcc55804;制备血清的方法为:将金黄色葡萄球菌灭活后免疫balb/c小鼠,然后收获血清)。从5型金黄色葡萄球菌中挑选一株命名为菌株sacp5,从8型金黄色葡萄球菌中挑选一株命名为菌株sacp8,从336型金黄色葡萄球菌中挑选一株命名为菌株sa336。
56.将p3代菌株sacp5分别注射给6-8周龄balb/c小鼠(每只通过腹腔注射3
×ꢀ
108cfu)、l.5-2岁家兔(每只通过腹腔注射1
×
1o9cfu)和3-4岁奶牛(每只通过乳头管注射200cfu)。发现菌株sacp5可使balb/c小鼠和家兔发病,可引起奶牛发生乳房炎。分别取发病小鼠的肝脏、发病家兔的肝脏、发病奶牛的乳房,进行病原菌重分离,将重分离得到的菌株进行全基因组测序,均与注射菌株的测序结果一致。
57.将p3代菌株sacp6分别注射给6-8周龄balb/c小鼠(每只通过腹腔注射3
×ꢀ
108cfu)、l.5-2岁家兔(每只通过腹腔注射1
×
1o9cfu)和3-4岁奶牛(每只通过乳头管注射200cfu)。发现菌株sacp6可使balb/c小鼠和家兔发病,可引起奶牛发生乳房炎。分别取发病小鼠的肝脏、发病家兔的肝脏、发病奶牛的乳房,进行病原菌重分离,将重分离得到的菌株进行全基因组测序,均与注射菌株的测序结果一致。
58.将p3代菌株sa336分别注射给6-8周龄balb/c小鼠(每只通过腹腔注射3
×
108cfu)、 l.5-2岁家兔(每只通过腹腔注射1
×
1o9cfu)和3-4岁奶牛(每只通过乳头管注射200cfu)。发现菌株sa336均可使balb/c小鼠和家兔发病,可引起奶牛发生乳房炎。分别取发病小鼠的肝脏、发病家兔的肝脏、发病奶牛的乳房,进行病原菌重分离,将重分离得到的菌株进行全基因组测序,均与注射菌株的测序结果一致。
59.s3.4菌株的保藏菌株sacp5的分类命名为金黄色葡萄球菌(staphylococcus aureus)sacp5,p3代菌株sacp5 于2018年6月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),保藏编号为cgmcc no.15908。
60.菌株sacp8分类命名为金黄色葡萄球菌(staphylococcus aureus)sacp8,p3代菌株 sacp8于2018年6月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称 cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),保藏编号为cgmcc no.15907。
61.菌株sa336的分类命名为金黄色葡萄球菌(staphylococcus aureus)sa336,p3代菌株sa336于2018年6月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称 cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),保藏编号为cgmcc no.15909。
62.s4链球菌菌株的的获得和保藏s4.1菌种的筛选。
63.链球菌的菌落形态特征(37℃,培养24-72h):(1)普通琼脂平板,未见到菌落;(2)鲜血琼脂平板上长有灰白色、半透明表面光滑圆形隆起的小菌落,出现溶血现象,如果是β溶血则疑为无乳链球菌,如果为α溶血疑为停乳链球菌或乳房链球菌,如为γ溶血疑为乳房链球菌;(3)血清肉汤中生长初呈均匀浑浊,管底出现絮状沉淀,上清变得透明;(4)挑取典型菌落涂片、染色、镜检,如呈球状、短链状或者长链状排列,无芽胞,革兰氏染色阳性则疑为链球菌。
64.链球菌的生理生化特征:(1)触酶试验阴性;(2)细菌camp试验阳性,水解七叶苷和马尿酸钠,能够利用葡萄糖、乳糖、棉子糖、水杨甘,不能利用山梨醇、海藻糖和甘露醇,胆汁七叶苷实验为阴性,高盐肉汤实验为阴性,即鉴定为无乳链球菌;(3)若细菌camp试验阴性,不水解七叶苷和马尿酸钠,能够利用葡萄糖、乳糖、棉子糖、海藻糖,不能利用山梨醇、水杨甘和甘露醇,胆汁七叶苷实验为阴性,高盐肉汤实验为阴性,即鉴定为停乳链球菌; (4)若细菌camp试验阴性,水解七叶苷和马尿酸钠,能够利用葡萄糖、乳糖、棉子糖,不能利用山梨醇和甘露醇,胆汁七叶苷实验为阴性,高盐肉汤实验为阴性,即鉴定为乳房链球菌; (5)若细菌camp试验阴性,不水解七叶苷和马尿酸钠,能够利用葡萄糖、乳糖、海藻糖,不能利用山梨醇和甘露醇,高盐肉汤实验为阴性,即鉴定为化脓链球菌。
65.链球菌的16s rrna的编码基因分别进行基因组测序,与genbank数据库进行比对。
66.s4.2菌株的扩大培养将菌株划线接种至bhi培养基平板,37℃静置培养20-24小时,然后用5g/100ml的脱脂奶粉水溶液冲洗并收集平板上的菌落,分装于冻存管(定义为p1代),-70℃以下保存。
67.取p1冻存管,室温解冻,然后接种至液体bhi培养基,37℃、160rpm振荡培养20-24 小时,每100毫升加入5g脱脂奶粉,分装于冻存管(定义为p2代),-70℃以下保存。
68.取p2冻存管,室温解冻,然后接种至液体bhi培养基,37℃、160rpm振荡培养20-24 小时,加入等体积的体积百分比浓度为60%甘油的纯化水溶液,分装于冻存管(定义为p3 代),-70℃以下保存。
69.s4.3菌株的血清型鉴定和致病性鉴定将p3代菌株进行玻片凝集试验(无乳链球菌atcc51487,停乳链球菌atcc43078,乳房链球菌atcc19436,化脓链球菌atcc19615;制备血清的方法为:将链球菌灭活后免疫balb/c 小鼠,然后收获血清),得到无乳链球菌(命名为菌株sawr-6),停乳链球菌(命名为菌株 sdtr-9),乳房链球菌(命名为菌株surf-5),化脓链球菌(命名为菌株sphn-4)。
70.将p3代菌株sawr-6分别注射给6-8周龄balb/c小鼠(每只通过腹腔注射2
×ꢀ
108cfu),l.5-2岁家兔(每只通过腹腔注射8
×
108cfu)和2-3岁奶牛(每只通过乳导管注射1000cfu)。观察表征发现菌株sawr-6可使balb/c小鼠和家兔发病,有些动物甚至在1 周内死亡;菌株sawr-6可引起奶牛发生乳房炎。分别取发病小鼠的肝脏、发病家兔的肝脏、发病奶牛的乳房,进行病原菌重分离,将重分离得到的菌株进行全基因组测序,均与菌株 sawr-6的测序结果一致。
71.将p3代菌株sdtr-9分别注射给6-8周龄balb/c小鼠(每只通过腹腔注射2
×ꢀ
108cfu),1.5-2岁家兔(每只通过腹腔注射8
×
108cfu)和2-3岁奶牛(每只通过乳导管注射
1000cfu)。观察表征发现菌株sdtr-9可使balb/c小鼠和家兔发病,有些动物甚至在1 周内死亡;菌株sdtr-9可引起奶牛发生乳房炎。分别取发病小鼠的肝脏、发病家兔的肝脏、发病奶牛的乳房,进行病原菌重分离,将重分离得到的菌株进行全基因组测序,均与菌株 sdtr-9的测序结果一致。
72.将p3代菌株surf-5分别注射给6-8周龄balb/c小鼠(每只通过腹腔注射2
×ꢀ
108cfu),l.5-2岁家兔(每只通过腹腔注射8
×
108cfu)和2-3岁奶牛(每只通过乳导管注射1000cfu)。观察表征发现菌株surf-5可使balb/c小鼠和家兔发病,有些动物甚至在1 周内死亡;菌株surf-5可引起奶牛发生乳房炎。分别取发病小鼠的肝脏、发病家兔的肝脏、发病奶牛的乳房,进行病原菌重分离,将重分离得到的菌株进行全基因组测序,均与菌株 surf-5的测序结果一致。
73.s4.4菌株的保藏菌株sawr-6分类命名为无乳链球菌(streptococcus agalactiae)sawr-6,p3代菌株sawr-6 于2013年12月09日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为cgmcc no.8533。
74.菌株sawr-9分类命名为无乳链球菌(streptococcus agalactiae)sawr-9,p3代菌株 sawr-9于2021年5月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称 cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为cgmcc no.22629。
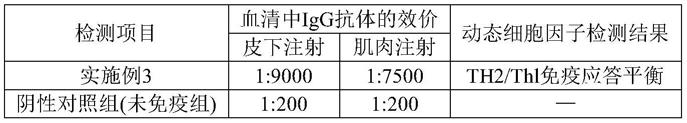
75.菌株sdtr-9分类命名为停乳链球菌(streptococcus dysgalactiae)sdtr-9,p3代菌株 sdtr-9于2013年12月09日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称 cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为cgmcc no.8534。
76.菌株surf-5全称为乳房链球菌(streptococcus uberis)surf-5,p3代菌株surf-5 于2013年12月09日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为cgmcc no.8535。
77.菌株sphn-4分类命名为化脓链球菌(streptococcus pyogenes)sphn-4,p3代菌株 sphn-4于2021年5月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称 cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为cgmcc no.22628。
78.s5肺炎克雷伯氏菌菌株的的获得和保藏s5.1菌种的筛选。
79.肺炎克雷伯氏菌的菌落形态特征(37℃,培养24-72h):(1)普通琼脂平板,生大量荚膜物质而呈灰白色、浓厚、圆凸、闪光、丰盛而黏稠的黏液状大菌落,菌落间常相互融合; (2)血液琼脂培养基上生长不溶血。斜面上可长成灰白色半流动状黏液性培养物,斜面底部凝集水常呈黏液状;(3)肉汤内生长数天后可形成黏稠液体。在肠道菌鉴别培养基上培养后可见特征性隆起的黏液状菌落,菌落可因发酵乳糖而成红色或粉红色;(4)挑取典型菌落涂片、染色、镜检,革兰氏阴性粗短杆菌,呈单个、成双或短链状排列,则疑为肺炎克雷伯氏菌。
80.肺炎克雷伯氏菌的生理生化特征:(1)触酶试验阳性;(2)发酵葡萄糖、蔗糖、麦芽糖、甘露糖、阿拉伯糖、棉籽糖、鼠李糖、木糖、海藻糖、甘露醇、水杨苷、肌醇、山梨醇,产酸产气;(3)不产生吲哚、不液化明胶,不产生硫化氢,但分解尿素;(4)甲基红试验阴性,v-p 试验阳性,能分解利用枸橼酸盐和丙二酸盐。赖氨酸脱羧酶试验阳性、鸟氨酸脱羧酶试验阴性。即鉴定为肺炎克雷伯氏菌。
81.肺炎克雷伯氏菌的16srrna的编码基因分别进行基因组测序,与genbank数据库进行比对。
82.s5.2菌株的扩大培养将菌株划线接种至bhi培养基平板,37℃静置培养20-24小时,然后用5g/100ml的脱脂奶粉水溶液冲洗并收集平板上的菌落,分装于冻存管(定义为p1代),-70℃以下保存。
83.取p1冻存管,室温解冻,然后接种至液体bhi培养基,37℃、160rpm振荡培养20-24 小时,每100毫升加入5g脱脂奶粉,分装于冻存管(定义为p2代),-70℃以下保存。
84.取p2冻存管,室温解冻,然后接种至液体bhi培养基,37℃、160rpm振荡培养20-24 小时,加入等体积的体积百分比浓度为60%甘油的纯化水溶液,分装于冻存管(定义为p3 代),-70℃以下保存。
85.s5.3菌株的血清型鉴定和致病性鉴定将p3代菌株进行玻片凝集试验(肺炎克雷伯氏菌atcc13883;制备血清的方法为:将肺炎克雷伯氏菌灭活后免疫balb/c小鼠,然后收获血清)。得到肺炎克雷伯氏,命名为菌株kp-2。
86.将p3代菌株kp-2分别注射给6-8周龄balb/c小鼠(每只通过腹腔注射2
×
108cfu), l.5-2岁家兔(每只通过腹腔注射8
×
108cfu)和2-3岁奶牛(每只通过乳导管注射1000cfu)。观察表征发现菌株kp-2可使balb/c小鼠和家兔发病,有些动物甚至在1周内死亡;菌株 kp-2可引起奶牛发生乳房炎。分别取发病小鼠的肝脏、发病家兔的肝脏、发病奶牛的乳房,进行病原菌重分离,将重分离得到的菌株进行全基因组测序,均与菌株ap-10的测序结果一致。
87.s5.4菌株的保藏菌株kp-2分类命名为肺炎克雷伯氏菌(klebsiella pneumoniae)kp-2,p3代菌株kp-2于2021年5月28日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏号为cgmcc no.22627。
88.s6菌株的特性将上述获得的p3冻存管,室温解冻,然后将上述p3代菌株(大肠埃希氏菌ebm09菌株、5 型金黄色葡萄球菌sacp5菌株、8型金黄色葡萄球菌sacp8菌株、336型金黄色葡萄球菌 sa336菌株、ⅰa型无乳链球菌sawr-6菌株、ⅱ型无乳链球菌sawr-9菌株、停乳链球菌 sdtr-9菌株、乳房链球菌surf-5菌株、肺炎克雷伯氏菌kp-2菌株、化脓链球菌sphn-4 菌株)各自独立地进行如下步骤:s6.1菌株的免疫原性将上述p3代菌株分别进行家兔免疫(单次免疫,通过皮下注射(5-10)
×
107cfu/ml,每只注射1毫升),21天后心脏取血,分离血清。通过elisa检测血清的igg抗体效价(用pbst 缓冲液梯度稀释,得到血清稀释液;将p3代菌株作为包被原,包被浓度为1
×
109个菌/ml;采用羊抗兔igg酶标二抗;设置阴性对照,即用pbst缓冲液代替血清稀释液;检测450nm 的吸光值;吸光值为阴性对照的2.1倍以上判断为阳性)。上述p3代菌株的效价均大于1:6400。
89.s6.2菌株的稳定性取p3代菌株(大肠埃希氏菌ebm09菌株、5型金黄色葡萄球菌sacp5菌株、8型金黄色葡萄球菌sacp8菌株、336型金黄色葡萄球菌sa336菌株、ⅰa型无乳链球菌sawr-6菌株、ⅱ型无乳链球菌sawr-9菌株、停乳链球菌sdtr-9菌株、乳房链球菌surf-5
菌株、肺炎克雷伯氏菌kp-2菌株、化脓链球菌sphn-4菌株)分别接种至tsb或改良马丁肉汤培养基, 37℃、160rpm振荡培养18-24小时,得到p4代菌。采用上述方法进行连续传代,传至p30 代。分别将p3代、p5代、p10代、p15代、p20代、p25代和p30代菌进行全基因组测序,测序结果均一致,表明本技术提供的菌株非常稳定。
90.奶牛乳房炎多联灭活疫苗的实施例实施例1(1)抗原原液的制备s1灭活菌体抗原原液的规模化制备及检定大肠埃希氏菌ebm09菌株、5型金黄色葡萄球菌sacp5菌株、8型金黄色葡萄球菌sacp8 菌株、336型金黄色葡萄球菌sa336菌株、ⅰa型无乳链球菌sawr-6菌株、ⅱ型无乳链球菌sawr-9菌株、停乳链球菌sdtr-9菌株、乳房链球菌surf-5菌株、肺炎克雷伯氏菌kp-2 菌株、化脓链球菌sphn-4菌株各自独立地进行如下步骤:s1.1生产种子的制备方法如下:一级种子制备:取工作种子菌种(冻干菌用0.5ml的tsb或bhi肉汤或改良马丁肉汤液体培养基溶解),划线接种于平板,37℃培养16h,挑选5个以上的典型菌落,接种tsb或bhi 肉汤或改良马丁肉汤液体培养基,37℃培养16h,作为一级种子。在2-8℃保存,应不超过7 日。在培养基上继代不超过5代。
91.二级种子制备:用tsb或bhi肉汤或改良马丁肉汤液体培养基洗下平板上的一级种子菌落,接种于tsb或bhi肉汤或改良马丁肉汤培养基,37℃培养16h,取样经纯粹检验合格后作为二级种子,在2-8℃保存,应不超过7日。
92.s1.2菌液发酵培养按发酵罐容积的50-60%加入tsb或bhi肉汤或改良马丁肉汤培养基,121℃高压灭菌。待温度降至37-38℃时,将生产种子按培养基总重量的2%接种于培养基中进行发酵培养。发酵条件为:温度37℃,初始转速200rpm/min,罐压保持在0.05mpa,重量百分比浓度为10%氨水或者重量百分比浓度为8%氢氧化钠自动调节ph值为7.0,调节转速和通气量。随着菌体生长,溶氧量不断下降,通过调整转速和通气量调节溶氧量。溶氧或ph值出现上升趋势时进行补料,培养9h后终止发酵,得到发酵液。
93.s1.3发酵液灭活按发酵液体积0.4-0.6%加入体积百分比浓度为40%的甲醛水溶液进行灭活,37℃灭活85小时,得到灭活后的发酵液。
94.s1.4发酵液浓缩将灭活后的发酵液5000-6000r/min离心20min收集菌体,用pbs(0.01mol/l,ph值7.2)悬浮,悬浮后体积不高于原体积的1/10,得到抗原原液,置2-8℃保存备用,保存期不超过6 个月。
95.s1.5抗原原液无菌检验将制备的抗原原液接种两支tg小管和tsb小管,分别置于37℃和25℃培养7天,观察有无细菌生长。结果显示制备的灭活菌抗原原液均无菌生长。
96.s1.6抗原原液抗原含量检测采用比浊计数法测定抗原原液细菌含量,每毫升抗原原液中所含的细菌数应不低
于2.0
×
10
11
个。
97.(2)疫苗的制备大肠埃希氏菌抗原原液、5型金黄色葡萄球菌抗原原液、8型金黄色葡萄球菌抗原原液、336 型金黄色葡萄球菌抗原原液、ⅰa型无乳链球菌抗原原液、ⅱ型无乳链球菌抗原原液、停乳链球菌抗原原液、乳房链球菌抗原原液、肺炎克雷伯氏菌抗原原液、化脓链球菌抗原原液与pbs溶液混合均匀,得到灭活疫苗抗原混合液。
98.(3)疫苗抗原混合原液与佐剂混合乳化将灭活疫苗抗原混合液与白油佐剂(购自法国esso公司)按体积比为1:1比例混合乳化,得奶牛乳房炎多联灭活疫苗,适量分装,2-8℃保存。
99.(4)半成品制备取制备的初乳,用高压均质机在5000-8000psi压力条件下均质5-8个循环,测量其平均粒径约为250nm。用高压均质机在10000-15000psi压力条件下再次均质5-8个循环,从第6次开始用纳米粒径仪检测其粒径,当平均粒径在145-185nm区间,粒径均一度大于95%时,停止均质;(5)成品制备取制备的半成品,用0.22um高压滤膜过滤除菌。分装,2-8℃保存。
100.实施例2实施例2与实施例1的区别在于,在步骤(3)疫苗抗原混合原液与佐剂混合乳化中,佐剂为氢氧化铝佐剂(购自北京来福赛思科技有限公司)。
101.实施例3实施例3与实施例1的区别在于,在步骤(3)疫苗抗原混合原液与佐剂混合乳化中,佐剂为sp01 佐剂。
102.其中,sp01佐剂采用下述方法的制备而得:用pbs(0.01m,ph值7.2)按重量体积比配制5%角鲨烯(购于sigma公司,货号为442785)、 2.5%聚氧乙烯蓖麻油(购于sigma公司,货号为c5135,密度1.05g/ml,粘度850cp)和 2.5%聚醚(购于sigma公司,货号为435449,密度1.05g/ml,粘度850cp)的原料;将原料用高速分散机混匀30min以上,速度为10000rpm以上,当油状原料均匀分散后,再加pbs 缓冲液混匀,转速6000rpm或以上,时间3min或以上,当油状原料均匀分散后,初乳制备完毕,用纳米粒径仪检测其粒径及均一度,平均粒径约为2000-3000nm,该初乳静置后分层。
103.实施例4实施例4与实施例1的区别:在步骤(3)疫苗抗原混合原液与佐剂混合乳化中,佐剂为sp01-cpg 佐剂。
104.sp01-cpg佐剂的制备方法如下:用pbs(0.01m,ph值7.2)按重量体积比配制5%角鲨烯(购于sigma公司,货号为442785)、 2.5%聚氧乙烯蓖麻油(购于sigma公司,货号为c5135,密度1.05g/ml,粘度850cp)和 2.5%聚醚(购于sigma公司,货号为435449,密度1.05g/ml,粘度850cp)的原料;将原料用高速分散机混匀30min以上,速度为10000rpm以上,当油状原料均匀分散后,再加pbs 缓冲液、终浓度5%的牛cpg序列5
’‑
tccatgacgttcctgacgtt-3’混匀,转速6000rpm 或以上,时间3min或以上,当油状原料均匀分散后,初乳制备完毕,用纳米粒径仪检测其粒径
及均一度,平均粒径约为2000-3000nm,该初乳静置后分层。
105.以上注射疫苗剂型可为皮下注射剂型、肌肉注射剂型、无针透皮注射剂型或乳导管注射剂型。
106.奶牛乳房炎多联灭活疫苗的对比例对比例1:与实施例3的区别在于,未加入ⅱ型无乳链球菌抗原原液。
107.对比例2:与实施例3的区别在于,未加入肺炎克雷伯氏菌抗原原液。
108.对比例3:与实施例3的区别在于,未加入化脓链球菌抗原原液。
109.实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗的评价一、安全性实验1、溶血性实验实验方法:选取体重为350g左右的豚鼠,采集新鲜豚鼠血1ml,用pbs缓冲液洗涤3次,再将血细胞体积恢复并稀释10倍。奶牛乳房炎多联灭活疫苗采用pbs缓冲液稀释(2倍、4 倍、8倍),将豚鼠血细胞加入到稀释的待检疫苗中,8小时后,观察是否出现溶血现象。
110.实验结果:经观察实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗中的成分均不能使红细胞裂解,未出现溶血现象。因此,实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗无溶血反应。
111.2、毒性实验(1)体重为18-22g balb/c小鼠体内的毒性实验实验方法:奶牛乳房炎多联灭活疫苗腹腔注射体重为18-22g balb/c小鼠,每只注射剂量为 0.5ml,每组10只,同时设pbs缓冲液阴性对照组,连续2周观察小鼠的活动状态、体重变化和存活率。
112.实验结果:分别注射实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗进行毒性实验的小鼠全部存活,没有出现竖毛、精神萎靡、行动迟缓等不良症状,而体重呈现增加。由此证明,实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗在试验的浓度下对小鼠均是安全的,14天后小鼠处死进行解剖检查,未见脏器有病理改变。
113.(2)2-6岁健康易感奶牛体内的毒性实验实验方法:奶牛乳房炎多联灭活疫苗进行双侧颈部皮下注射免疫2-6岁健康易感奶牛(荷斯坦奶牛,购自土默特左旗与芳牧场),每头注射剂量为10ml,每组5头,同时设pbs缓冲液阴性对照组,连续2周观察注射部位、全身状态。
114.实验结果:分别注射实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗进行毒性实验的奶牛精神状态均良好,且无明显局部或全身不良反应。由此证明,实施例1-4和对比例 1-3的奶牛乳房炎多联灭活疫苗无急性毒性反应,使用是安全的。
115.3、过敏实验实验方法:奶牛乳房炎多联灭活疫苗分别进行皮下接种体重为250-350g hartley豚鼠,每个样品腹腔注射接种豚鼠5只,每只接种0.5ml,隔日一次,共3次。第3次注射后21天,腹腔注射给予相同灭活疫苗1ml,并用人血白蛋白和生理盐水以同样的方法分别接种3只豚鼠作为阳性、阴性对照。
116.实验结果:分别注射实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗进行过敏实验的hartley豚鼠,分别在注射后30分钟及3天观察,阳性、阴性对照均成立;实施例1-4 和对比例1-3中的灭活疫苗组豚鼠无死亡,且无鼻痒、喷嚏、烦躁不安、呼吸困难、休克、痉挛
等过敏症状。由此证明,实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗在动物体内无过敏反应。
117.4、兔热源质实验实验方法:体重为2-3kg家兔:测量2次体温,间隔30分钟,要求2次温差不大于0.2℃,家兔2次平均温度38.6-39.5℃。第2次测温后15分钟内,将奶牛乳房炎多联灭活疫苗耳边静脉注入,注射后每隔30分钟测量体温1次,连续测量6次,观测家兔体温升温情况。
118.实验结果:分别注射实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗进行兔热源质实验的家兔体温升温均没有超过0.2℃。
119.5、疫苗的稳定性实验实验方法:将奶牛乳房炎多联灭活疫苗先在2-8℃下放置24个月、后在37℃下放置1个月。观察奶牛乳房炎多联灭活疫苗是否变色、是否分层,检测奶牛乳房炎多联灭活疫苗的ph值,以及电镜观察奶牛乳房炎多联灭活疫苗的粒径情况。
120.实验结果:实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗均无无变色分层等现象,实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗的ph值均在7.0-7.2之间,电镜观察实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗的粒径大小均保持一致。由此证明,实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗的稳定性好。
121.二、动物的免疫效力评价1、对小鼠的免疫效力评价(1)效价检测检测方法:将奶牛乳房炎多联灭活疫苗分别以皮下注射和肌肉注射两种途径免疫18-22gbalb/c小鼠,每只小鼠免疫0.25ml,间隔14日以同等剂量及途径加强免疫1次,2免后7日,静脉采血,分离血清,并采用间接elisa法测定血清中igg抗体的效价、采用elispot仪检测免疫细胞中重要细胞因子、炎性分子、趋化因子等动态变化。
122.表1实施例3的奶牛乳房炎多联灭活疫苗的效价检测结果从表1可以看出,实施例3的奶牛乳房炎多联灭活疫苗均能产生满意的双重免疫应答,而阴性对照组没有产生双重免疫应答;实施例3的奶牛乳房炎多联灭活疫苗不管是皮下注射还是肌肉注射均能产生良好的双重免疫应答,且皮下注射血清抗体效价高于肌肉注射。
123.(2)攻毒毒攻方法:奶牛乳房炎多联灭活疫苗分别以皮下注射免疫18-22g balb/c小鼠,每只小鼠免疫 0.25ml,间隔14日以同等剂量及途径加强免疫1次,将二免后14日的各组小鼠,分别腹腔静脉注射ⅱ型无乳链球菌、肺炎克雷伯氏菌、化脓链球菌强毒株菌液进行攻毒,每株攻毒株每个疫苗组注射10只小鼠,攻毒后连续观察14日。
124.表2实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗的攻毒测定结果
从表2可以看出,注射实施例1-4的奶牛乳房炎多联灭活疫苗的小鼠均达到80%以上的保护率,尤其是实施例4的奶牛乳房炎多联灭活疫苗的小鼠达到90%以上的保护率。
125.2、对奶牛的免疫效力评价(1)抗体效价检测检测方法:将奶牛乳房炎多联灭活疫苗皮下注射免疫健康易感奶牛(荷斯坦奶牛,购自土默特左旗与芳牧场)10头,每头奶牛免疫5.0ml,间隔28日以同等剂量及途径加强免疫两次,三次免疫后14日,静脉采血并分离血清,采用elisa法测定血清中igg抗体的效价。
126.表3实施例1-4奶牛乳房炎多联灭活疫苗的抗体效价检测结果项目血清中igg抗体效价实施例1≥1:9400实施例2≥1:9240实施例3≥1:10150实施例4≥1:10220从表3可以看出,注射实施例1-4奶牛乳房炎多联灭活疫苗的奶牛血清中igg抗体效价均大于1:6400,并且采用不同佐剂的奶牛乳房炎多联灭活疫苗产生的效价依次是sp01-cpg佐剂>sp01佐剂>白油佐剂>氢氧化铝佐剂。由此说明佐剂中加入cpg序列能够显著增加免疫力。
127.(2)攻毒将三免后14日的各组奶牛,分别通过乳导管注射强毒400-1000cfu进行攻毒,每株攻毒株在每个疫苗组中注射5头奶牛,攻毒后连续观察21日,记录奶牛产奶量、临床评分、乳样中体细胞数及细菌检出数。
128.表4实施例1-4奶牛乳房炎多联灭活疫苗的攻毒测定结果
从表4可以看出,攻毒后,实施例1-4的15头奶牛中有17头奶牛未出现奶牛乳房炎症状,产奶量、乳汁中体细胞数、临床评分与攻毒前差异不明显,均在正常范围内。另外3头奶牛体乳房轻微红肿,乳汁中有攻毒菌检出,表现出发病症状。由此说明,不同佐剂的奶牛乳房炎多联灭活疫苗均能对奶牛产生有效的免疫保护效果。
129.鉴于结果说明,不同佐剂的奶牛乳房炎多联灭活疫苗能诱导试验动物小鼠和靶动物奶牛产生有效的抗体效价和免疫保护效果。
130.三、长效免疫保护评价评价方法:将奶牛乳房炎多联灭活疫苗颈部皮下注射2-3岁即将进入泌乳期(即产前25d,怀孕8个月)健康易感奶牛(荷斯坦奶牛,购自土默特左旗与芳牧场)20头;免疫程序是第0天、第28天、第56天各免疫1次(即产前25天、产后第3天、产后第31天),在第二年后的同一天每头奶牛加强免疫1次,每次每头免疫5ml。以加强免疫为第0天起算,之后观察1083 天,在观察期间定期采血,并测定血清中igg抗体的效价;以及记录奶牛产奶量。
131.表5实施例1-4和对比例1-3的奶牛乳房炎多联灭活疫苗的长效免疫保护评价结果从表5可以看出,奶牛乳房炎多联灭活疫苗均具有长效免疫应答和免疫保护,第一年免疫3 次后,以后每年加强免疫一次,产奶量高于未免疫奶牛,血清中igg抗体效价可维持在较高水平。
132.应该理解的是,本技术实施例所述制备方法仅仅是用于说明本技术,而不是对本
申请的限制,在本技术的构思前提下对本技术制备方法的简单改进都属于本技术要求保护的范围。
