1.本技术涉及医药制剂的技术领域,更具体地说,它涉及一种稳定的干扰素多剂量注射液及其制备方法。
背景技术:
2.干扰素具有广泛的抗病毒、抗肿瘤及免疫调节功能,其作用机理是通过诱生多种抗病毒蛋白,抑制病毒在细胞内复制,增强nk细胞活性及其他免疫调节作用,有效地遏制病毒侵袭和感染的发生,并有抑制肿瘤细胞生长、清除早期病变细胞等多方面的作用。根据其产生部位与作用机理的不同可以分为α、β、γ、λ等大的类型,而每种大的类型又可分为若干小的亚型,同一大的类型中不同的亚型间在一级结构上差异很小,在二级以上高级结构上非常接近。在几种大的类型中,α型是应用最广的一种,目前临床应用的α型干扰素主要包括干扰素α2a、干扰素α2b、干扰素α1b、复合干扰素等。
3.目前市售的干扰素注射液产品分为普通干扰素和peg修饰长效干扰素两种。普通干扰素常见为西林瓶包装,包装形式存在着抽取注射步骤繁琐、规格固定、剂量调整不便的缺点。同时频繁去医院注射,不仅占用有限医疗资源,增加患者经济负担,还可能因患者担心隐私暴露,导致不规律用药、中断用药,影响治疗效果。已批准上市的peg修饰长效干扰素品种,虽然可显著延长药物半衰期,提高患者的依从性,但价格高昂,同时不良反应发生率和严重程度也高于普通干扰素。
4.注射液(笔芯)多剂量产品是替代传统单剂量产品的新包装形式,已被国内外多种注射剂产品采用。其形式为卡式瓶,内包材为笔式注射器用中硼硅玻璃套筒,瓶顶部用胶塞铝盖密封,接触药液面为带有自封性的胶塞(垫片),瓶底部用橡胶活塞密封。瓶中预先灌注了药液的笔芯置入注射笔中,使用时无需开启瓶盖和抽取药液,将双面专用注射针固定在笔杆穿刺铝盖端胶塞,依靠笔中推杆将药液推注出去。利用注射笔中的微量体积调节及刻度显示装置,可实现按需定量、多次注射。
5.与传统的药品注射液产品相比,药品的多剂量笔注射液产品的优势有:使用时无需对贮存注射液的药瓶进行破坏性开口处理,从而可以防止破碎产生的玻璃粉末进入药液中,随同药液进入人体而对人体造成伤害;使用时不必进行药液转移(由包装容器到注射器的转移),避免了微粒、微生物对药液的污染;多剂量注射笔使用方便,简化了注射过程,可以在家进行自主注射,更易于患者自我治疗。注射笔普遍采用超细针头,针尖较之于传统的注射器针头摩擦力更小,注射疼痛感较轻。简单易学的操作方式可适于腹部、大腿、上臂等多部位的轮换注射,减少了患者的心理恐惧感。
6.《中国药典》2020年版中抑菌效果的判定标准与2010年版对比,增加了6h和24h的时间点,提高对产品短时抑菌效果的要求,对于抑菌剂的用量筛选更加严谨,具有更加科学的指导意义。
7.针对上述相关技术中的内容,发明人认为,注射液(笔芯)多剂量产品,普遍存在的问题是干扰素注射液短时间内不能达到完全抑菌的作用效果;同时,在干扰素注射液打开
使用的过程中,干扰素注射液的稳定性较差,活性降低或产生杂质,影响产品的有效性和安全性,需要在20-30天的时间内使用,否则将会失效,无法继续使用。
技术实现要素:
8.为了提高干扰素注射液短时间内的抑菌效果,同时提高干扰素注射液使用过程中的稳定性,本技术提供一种稳定的干扰素多剂量注射液及其制备方法。
9.第一方面,本技术提供的一种稳定的干扰素多剂量注射液,采用如下的技术方案:一种稳定的干扰素多剂量注射液,所述注射液包括以下重量份的组分,以1000重量份计,干扰素0.05-0.1份;磷酸氢二钠1.0-1.5份;枸橼酸0.1-0.5份;氯化钠6.5-7.5份;人血白蛋白8.0-12.0份;苯酚1.0-2.5份;间甲酚2.0-3.0份;余量为溶剂。
10.通过采用上述技术方案,本技术在以人血白蛋白为稳定剂的干扰素注射液处方组成的基础上,通过苯酚和间甲酚的配合使用,在保证注射液长期抑菌效果的同时,能够有效提高干扰素多剂量注射液在短时间内的抑菌效果。使用本技术提供的干扰素多剂量注射液,6h内的抑菌效果能够满足《中国药典》中注射液的a类要求,24h内的抑菌效果能够实现对细菌组及真菌组的完全杀灭。
11.干扰素多剂量注射液在使用过程中必然会暴露在空气中,因而容易受到空气中微生物的污染,故为了保证干扰素多剂量注射液的抑菌效果和稳定性,需要向干扰素多剂量注射液中加入抑菌剂。本技术提供的干扰素多剂量注射液中,以苯酚和间甲酚作为抑菌剂。
12.苯酚是无色或微红色的针状结晶或结晶性块状,具有腐蚀性,且易潮解,及易溶于乙醇、甘油、氯仿、乙醚、植物油和二硫化碳,在液体石蜡中略溶。苯酚的水溶液显微酸性,遇光或在空气中颜色逐渐变深;在碱性条件下,上述颜色变化会加速。在20℃的条件下,苯酚在水中的溶解度为1g苯酚可溶于15ml水中。苯酚具有光谱抗菌效果,能够对抗多种微生物,如革兰氏阴性细菌、革兰氏阳性细菌、分枝杆菌以及某些真菌、病毒。苯酚对孢子的抑制效果非常缓慢。另外,苯酚在酸性溶液中的抑菌效果较强,同时,升高温度也会增加苯酚的抑菌效果。
13.间甲酚是几乎无色、淡紫红色或淡棕黄色的澄清液体,长时间贮存或在日光下颜色会逐渐变深。间甲酚的饱和水溶液显中性或弱酸性,能够与乙醇、氯仿、乙醚、甘油、脂肪油或挥发油任意混合。间甲酚在水中略溶会生成带浑浊的溶液,并且间甲酚也能够在碱性溶液中溶解。在20℃的条件下,间甲酚在水中的溶解度为1g苯酚可溶于50ml水中。间甲酚的抑菌活性与苯酚相似,且略强于苯酚,能够对抗革兰氏阳性菌,而对革兰氏阴性菌、酵母菌和霉菌的抑菌效果较低。间甲酚在ph值为9以下时具有较高活性,同时,在酸性条件下,间甲酚的活性也较高。
14.经过试验验证,人血白蛋白与苯酚和间甲酚之间会产生相互作用,从而影响抑菌剂对干扰素注射液的抑菌效果。当苯酚和间甲酚配合使用时,将苯酚的添加量控制在1.0-2.5份、间甲酚的添加量控制在2.0-3.0份的范围内,本技术提供的干扰素多剂量注射剂在短时间内具有较好的抑菌效果。
15.优选的,所述注射液包括以下重量份的组分,以1000重量份计,干扰素0.05-0.1份;磷酸氢二钠1.0-1.5份;枸橼酸0.1-0.5份;氯化钠6.5-7.5份;人血白蛋白8.0-12.0份;苯酚1.5-2.5份;间甲酚2.5-3.0份;余量为溶剂。
16.在一个具体的实施方式中,所述苯酚添加的重量份可以是1.0份、1.5份、2.0份、2.5份。
17.在一个具体的实施方式中,所述苯酚添加的重量份可以是1.0-1.5份、1.0-2.0份、1.5-2.0份、2.0-2.5份。
18.在一个具体的实施方式中,所述间甲酚添加的重量份可以是2.0份、2.5份、3.0份。
19.在一个具体的实施方式中,所述间甲酚添加的重量份可以是2.0-2.5份。
20.通过采用上述技术方案,经过试验分析,将注射液中苯酚的添加量控制在1.5-2.5份、间甲酚的添加量控制在2.5-3.0份的范围内时,能够进一步提高干扰素多剂量注射剂在短时间内具有较好的抑菌效果。
21.优选的,所述苯酚和间甲酚总体添加重量份为3.5-5.0份。
22.优选的,所述苯酚和间甲酚总体添加重量份为4.0-5.0份。
23.在一个具体的实施方案中,所述苯酚和间甲酚的总体添加重量份可以是3.0份、3.5份、4.0份、4.5份、5.0份、5.5份。
24.在一个具体的实施方案中,所述苯酚和间甲酚的总体添加重量份可以是3.0-3.5份、3.0-4.0份、3.0-4.5份、3.0-5.0份、3.0-5.5份、3.5-4.0份、3.5-4.5份、3.5-5.0份、3.5-5.5份、4.0-4.5份、4.0-5.5份、4.5-5.0份、4.5-5.5份、5.0-5.5份。
25.通过采用上述技术方案,经过试验分析,苯酚和间甲酚的添加量之和选择控制在3.5-5.0份的范围内时,能够在保证本技术提供的干扰素多剂量注射液在6h内的抑菌效果的时候,还能够进一步保证干扰素多剂量注射液在24h内具有显著的抑菌效果,在满足《中国药典》中注射液a类标准的基础上,进一步对干扰素多剂量注射液的质量提供了保障。
26.优选的,所述干扰素包括干扰素α、干扰素β、干扰素γ亚型。
27.优选的,所述溶剂为注射用水。
28.优选的,所述注射液的ph值在6.5-7.5的范围内。
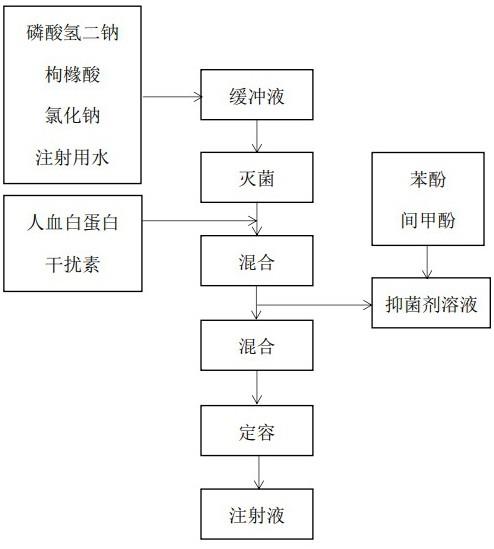
29.第二方面,本技术提供的一种稳定的干扰素多剂量注射液的制备方法,采用如下的技术方案:一种稳定的干扰素多剂量注射液的制备方法,具体包括以下步骤:(1)按照各组分的添加比例,利用磷酸氢二钠、枸橼酸和氯化钠配置缓冲液,并进行灭菌处理;利用苯酚和间甲酚配置抑菌剂溶液;(2)向溶剂中加入步骤(1)制得的缓冲液、干扰素以及人血白蛋白,混匀,制得预制液;(3)向步骤(2)制得的预制液中加入步骤(1)制得的抑菌剂溶液,用溶剂补足体积,过滤除菌,制得注射液。
30.综上所述,本技术具有以下有益效果:本技术通过探究干扰素多剂量注射液中苯酚和间甲酚的配合处方,使得提供的干扰素多剂量注射液在保证注射液长期抑菌效果的同时,能够有效提高干扰素多剂量注射液在短时间内的抑菌效果,满足《中国药典》2020年版中抑菌效力检查中的注射剂a类要求。
31.另外,本技术提供的干扰素多剂量注射液,还能够保证产品的安全、稳定,且制备方法简单,易于实现工业化生产。与干扰素单剂量注射液相比,本技术提供的干扰素多剂量注射液更加有利于患者长期使用,从而减少患者往返医院的次数,且有利于患者按时用药。
附图说明
32.图1是本技术提供的干扰素多剂量注射液的制备方法的流程图。
具体实施方式
33.本技术提供了一种稳定的干扰素多剂量注射液,所述注射液包括以下重量份的组分,以1000重量份计,干扰素0.05-0.1份;磷酸氢二钠1.0-1.5份;枸橼酸0.1-0.5份;氯化钠6.5-7.5份;人血白蛋白8.0-12.0份;苯酚1.0-2.5份;间甲酚2.0-3.0份;余量为溶剂。
34.进一步地,所述所述注射液包括以下重量份的组分,以1000重量份计,干扰素0.05-0.1份;磷酸氢二钠1.0-1.5份;枸橼酸0.1-0.5份;氯化钠6.5-7.5份;人血白蛋白8.0-12.0份;苯酚1.5-2.5份;间甲酚2.5-3.0份;余量为溶剂。
35.进一步地,所述所述苯酚和间甲酚总体添加重量份为3.5-5.0份。再进一步地,所述苯酚和间甲酚总体添加重量份为4.0-5.0份。
36.其中,所述干扰素包括干扰素α、干扰素β、干扰素γ亚型。所述溶剂为注射用水。所述注射液的ph值在6.5-7.5的范围内。
37.本技术还提供了上述稳定的干扰素多剂量注射液的制备方法,具体包括以下步骤:(1)按照各组分的添加比例,利用磷酸氢二钠、枸橼酸和氯化钠配置缓冲液,并进行灭菌处理;利用苯酚和间甲酚配置抑菌剂溶液;(2)向溶剂中加入步骤(1)制得的缓冲液、干扰素以及人血白蛋白,混匀,制得预制液;(3)向步骤(2)制得的预制液中加入步骤(1)制得的抑菌剂溶液,用溶剂补足体积,过滤除菌,制得注射液。
38.以下结合实施例1-9、对比例1-8性能检测试验对本技术作进一步详细说明。
实施例
39.实施例1-9实施例1-9分别提供了一种稳定的干扰素多剂量注射液。其中,实施例1-9的区别之处在于制备的注射液中各组分的添加量,具体如表1所示。
40.上述稳定的干扰素多剂量注射液的制备方法,具体包括以下步骤:(1)按照表1中磷酸氢二钠、枸橼酸、氯化钠的添加量,将三者加入300ml注射用水中充分溶解,制得缓冲液,并于121℃条件下灭菌,冷却备用。
41.按照表1中苯酚和间甲酚的添加量,将苯酚、间甲酚加入300ml注射用水中,制得抑菌剂溶液。
42.(2)向100ml注射用水中依次加入步骤(1)制得的缓冲液、干扰素和注射用人血白蛋白,搅拌混匀,制得预制液。其中,干扰素类型为干扰素α1b。
43.(3)向步骤(2)制得的预制液中加入步骤(1)制得的抑菌剂溶液,用注射用水补足体积,搅拌混匀,过滤除菌后,制得注射液。
44.(4)将步骤(3)制得的注射液进行灌装、轧盖,制成待包装成品。
45.(5)将步骤(4)制得的待包装成品置于2-8℃条件下避光保存,检测确定合格后,进
行外包装。
46.对比例对比例1-6对比例1-6分别提供了一种稳定的干扰素多剂量注射液。其中,对比例1-6与实施例1的区别之处在于制备的注射液中各组分的添加量,具体如表1所示。
47.表1 实施例1-9、对比例1-6制备的注射液中各组分的添加量对比例7本对比例提供了一种稳定的干扰素多剂量注射液。其与实施例5的区别之处在于:利用聚山梨酸酯作为稳定剂,代替人血白蛋白。
48.对比例8本对比例提供了一种稳定的干扰素多剂量注射液。其与实施例5的区别之处在于:利用5g多乙氧基醚80作为稳定剂,5g乙二胺四乙酸二钠盐作为螯合剂,代替人血白蛋白。
49.性能检测试验检测试验(一)—抑菌效力按照《中国药典》2020年版四部通则《1121》抑菌效力检查法,分别对实施例1-9、对比例1-8制备的注射液进行抑菌效果的检测。
50.一、试验菌株(1)细菌——金黄色葡萄球菌、铜绿假单胞菌金黄色葡萄球菌:利用0.9%无菌氯化钠溶液制成的菌悬液,菌悬液的浓度约为108cfu/ml。
51.铜绿假单胞菌:利用0.9%无菌氯化钠溶液制成的菌悬液,菌悬液的浓度约为108cfu/ml。
52.(2)真菌——黑曲霉、白色念珠菌黑曲霉:利用含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液制成的孢子悬液,孢子悬液的浓度约为108cfu/ml。
53.白色念珠菌:利用0.9%无菌氯化钠溶液制成的菌悬液,菌悬液的浓度约为108cfu/ml。
54.试验菌株的保存和使用条件:保存在室温条件下,应在2h内使用;保存在2-8℃条件下,可在24h内使用。黑曲霉的孢子悬液保存在2-8℃条件下,可在7d内使用。
55.二、检测方法(1)接种细菌的培养基:胰酪大豆胨琼脂培养基。
56.(2)接种真菌的培养基:沙氏葡萄糖琼脂培养基。
57.(3)分别利用实施例1-9、对比例1-8制备的注射液,接种金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌、黑曲霉四种菌。1ml注射液中接菌量为105~106cfu,接种菌液的体积不得超过注射液体积的1%,充分混合,使注射液中的试验菌均匀分布,置于20-25℃的条件下避光保存。按照表3所示的时间间隔,分别测定注射液中所含的菌数。
58.三、检测标准检测标准如表2所示。
59.表2 注射液抑菌效力的检测标准-《中国药典》2020年版本技术提供的注射液在各个时间间隔的细菌及真菌数的lg值,与0h的值相比,下降值均应符合a类标准。
60.四、检测结果检测结果如表3-表6所示。
61.表3抑菌效果检查结果(一)—金黄色葡萄球菌(lg)
结合表3,通过对比实施例1-9与对比例1-8提供的干扰素多剂量注射液对金黄色葡萄球菌的抑菌检测结果,可知本技术提供的干扰素多剂量注射液在短时间内具有较好的抑菌效果,在6h内和24h内的抑菌效果能够满足《中国药典》中注射液的a类标准。
62.通过对比实施例1-3、对比例1的检测结果可知,将间甲酚的添加量控制在2.0-3.0g的范围内时,本技术提供的干扰素多剂量注射液在6h内对金黄色葡萄球菌的抑制效果中,减少的lg值达到了2.14-2.52.,减少的lg值大于2,满足《中国药典》中注射液a类标准。而当将间甲酚的添加量为1.5g时,即对比例1提供的干扰素多剂量注射液在6h内对金黄色葡萄球菌的抑制效果中,减少的lg值为1.65.,减少的lg值小于2,不满足《中国药典》中注射液a类标准。另外,根据《中国药典》的规定,注射液中间甲酚的添加量不能大于0.3%,因此,在本技术提供的实施例中,不考虑间甲酚的添加量大于3.0g的情况。基于上述,本技术中,将间甲酚的添加量控制在2.0-3.0份的范围内时,提供的干扰素多剂量注射剂在短时间内具有较好的抑菌效果。
63.进一步地,将间甲酚的添加量控制在2.5-3.0g的范围内时,本技术提供的干扰素多剂量注射液在6h内对金黄色葡萄球菌的抑制效果中减少的lg值,大于当将间甲酚的添加量为2.0g时干扰素多剂量注射液在6h内对金黄色葡萄球菌的抑制效果中减少的lg值,故间甲酚的添加量进一步选择控制在2.5-3.0份的范围内。
64.通过对比实施例2、实施例4-6、实施例9以及对比例2的检测结果可知,将苯酚的添加量控制在1.0-2.5g的范围内时,本技术提供的干扰素多剂量注射液在6h内对金黄色葡萄球菌的抑制效果中,减少的lg值达到了2.41-3.15.,减少的lg值大于2,满足《中国药典》中注射液a类标准。而当将间甲酚的添加量为0.5g时,即对比例2提供的干扰素多剂量注射液在6h内对金黄色葡萄球菌的抑制效果中,减少的lg值为1.73,减少的lg值小于2,不满足《中国药典》中注射液a类标准的要求。另外,当将间甲酚的添加量为3.0g时,即实施例9提供的干扰素多剂量注射液在6h内对金黄色葡萄球菌的抑制效果中,减少的lg值为3.07,虽然减少的lg值小于2,但与实施例6相比,减少了的lg值基本无明显变化。基于上述,本技术中,将苯酚的添加量控制在1.0-2.5份的范围内时,提供的干扰素多剂量注射剂在短时间内具有较好的抑菌效果。
65.进一步地,将苯酚的添加量控制在2.0-2.5g的范围内时,本技术提供的干扰素多剂量注射液在6h内对金黄色葡萄球菌的抑制效果中减少的lg值,大于当将间甲酚的添加量为1.0g时干扰素多剂量注射液在6h内对金黄色葡萄球菌的抑制效果中减少的lg值,故间甲酚的添加量进一步选择控制在1.5-2.5份的范围内。
66.此外,通过对比实施例1-6、实施例9的检测结果可知,控制苯酚和间甲酚的添加量之和在3.5-5.0g时,本技术提供的干扰素多剂量注射液在24h内对金黄色葡萄球菌具有显著的抑制效果。而当苯酚和间甲酚的添加量之和为3.0g时,即实施例1提供的干扰素多剂量注射液虽然在24h内对金黄色葡萄球菌的抑制效果能够满足《中国药典》中注射液a类标准的要求。但控制苯酚和间甲酚的添加量之和在3.5-5.0g时的抑菌效果明显优于控制苯酚和间甲酚的添加量之和为3.0g时的抑菌效果。另外,当苯酚和间甲苯的添加量之和大于5.5时,即实施例9提供的干扰素多剂量注射液,与实施例6相比,实施例9提供的干扰素多剂量注射液在6h内对金黄色葡萄球菌的抑制效果中,减少的lg值基本无明显变化。基于上述,本技术提供的干扰素多剂量注射液中,苯酚和间甲酚的添加量之和进一步选择控制在3.5-5.0份的范围内。
67.通过对比实施例5、实施例7-8的检测结果可知,可知本技术提供的干扰素多剂量注射液中人血白蛋白的添加量控制在8.0-12.0份的范围内时,提供的干扰素多剂量注射剂在短时间内具有较好的抑菌效果。
68.另外,通过对比例3-6的检测结果可知,对比例3-6提供的干扰素多剂量注射液在6h内对金黄色葡萄球菌的抑制效果中,减少的lg值均小于2,不满足《中国药典》中注射液a类标准的要求。
69.通过对比实施例1-9以及对比例7-8的检测结果可知,虽然对比例7-8提供的干扰素多剂量注射液在6h内对金黄色葡萄球菌的抑制效果中,减少的lg值均小于2。由此可知,相关技术中提供的干扰素多剂量注射液不满足《中国药典》中注射液a类标准的要求。而本技术提供的干扰素多剂量注射液在在6h内对金黄色葡萄球菌的抑制效果均能够满足《中国药典》中注射液a类标准的要求。
70.表4抑菌效果检查结果(二)—铜绿假单胞菌(lg)
结合表4,通过对比实施例1-9与对比例1-8提供的干扰素多剂量注射液对铜绿假单胞菌的抑菌检测结果,可知本技术提供的干扰素多剂量注射液在短时间内具有较好的抑菌效果,在6h内和24h内的抑菌效果能够满足《中国药典》中注射液的a类标准。
71.表5抑菌效果检查结果(三)—白色念珠菌(lg)
表6抑菌效果检查结果(四)—黑曲霉(lg)
结合表5和表6,通过对比实施例1-9与对比例1-8提供的干扰素多剂量注射液对白色念珠菌和黑曲霉的抑菌检测结果,可知本技术提供的干扰素多剂量注射液在短时间内具有较好的抑菌效果,在7d内的抑菌效果均能够满足《中国药典》中注射液的a类标准。
72.检测试验(二)-稳定性检测以实施例1-9、对比例1-8制备的干扰素注射液为检测对象,分别对检测对象进行稳定性的检测。
73.一、检测标准干扰素注射液的质量属性的限度要求如表7所示。
74.表7干扰素注射液限度要求
二、检测方法及检测结果(一)影响因素考察1、高温条件将检测对象置于高温条件(37
±
2℃)下10d,分别在0、5、10d时检测其质量属性,检测结果如表8所示。
75.表8影响因素高温条件——检测结果结合表8的检测结果可知,将实施例2和实施例5提供的干扰素多剂量注射液放置于高温37℃环境下10天,外观、可见异物、ph值、渗透压均未见显著变化。虽然生物学活性有所降低,但变化不大,在合格范围内。但干扰素含量下降,不符合要求。同时,苯酚和间甲酚含量未见显著变化。由此可知,高温对干扰素多剂量注射液的稳定性有一定的影响,生产、贮存、运输过程中应避免将干扰素多剂量注射液长时间置于高温环境下。
76.2、光照条件将检测对象置于光照条件(4500lux
±
500lux/25
±
2℃)下10d,分别在0、5、10d时检测其质量属性,检测结果如表9所示。
77.表9影响因素光照条件——检测结果结合表9的检测结果可知,将实施例2和实施例5提供的干扰素多剂量注射液放置于光照环境下10天,外观出现变化,由无色透明变为浅粉色透明液体、可见异物、ph值、渗透压均未见显著变化。虽然生物学活性有所降低,但变化不大,在合格范围内。苯酚和间甲酚含量未见显著变化。由此可知,光照对干扰素多剂量注射液的稳定性有一定的影响。苯酚被空气中的氧气、或高锰酸钾、重铬酸钾(酸性)甚至二氧化锰、氯酸钠(酸性)都会氧化成黄红色的苯醌,间甲酚氧化生产对二苯醌和邻二苯醌,显粉红色。因此,生产、贮存、运输过程中应避免将干扰素多剂量注射液长时间置于光照环境下。
78.3、氧化条件将检测对象置于空气暴露条件(5
±
3℃)下10d,分别在0、5、10d时检测其质量属性,检测结果如表10所示。
79.表10影响因素氧化条件——检测结果
结合表10的检测结果可知,将实施例2和实施例5提供的干扰素多剂量注射液放置于空气暴露环境下10天,外观、可见异物、ph值、渗透压均未见显著变化。虽然生物学活性有所降低,但变化不大,在合格范围内。苯酚和间甲酚含量未见显著变化。由此可知,空气暴露对干扰素多剂量注射液的稳定性影响较小。
80.(二)加速试验将检测对象置于加速条件(25
±
2℃)下6个月,分别在0、1、3、6月时检测其质量属性,检测结果如表11所示。
81.表11加速试验——检测结果
结合表11的检测结果可知,将实施例2和实施例5提供的干扰素多剂量注射液放置于(加速条件25℃)下6个月,外观、可见异物、ph值、渗透压均未见显著变化。虽然生物学活性有所降低,但变化不大,在合格范围内。苯酚和间甲酚含量未见显著变化。由此可知,本技术提供的干扰素多剂量注射液在加速条件下贮存6个月,稳定性良好。
82.(三)长期试验将检测对象置于长期条件(5
±
2℃)下24个月,分别在0、3、6、9、12、24月时检测其质量属性,检测结果如表12、表13所示。
83.表12长期试验——检测结果一
表13长期试验——检测结果二结合表12、表13的检测结果可知,将实施例2和实施例5提供的干扰素多剂量注射液放置于长期试验条件下24个月,外观、可见异物、ph值、渗透压均未见显著变化。虽然生物学活性有所降低,但变化不大,在合格范围内。苯酚和间甲酚含量未见显著变化。由此可知,本技术提供的干扰素多剂量注射液在长期条件下贮存24个月,稳定性良好。
84.(四)使用过程中的稳定性试验考察在最长注射使用周期中的微生物侵入风险,以及多次短暂温度变化和注射回血对产品质量产生的影响,本试验选择与人类皮肤、粘膜等反应较相近的新西兰兔(体重
1.8-2.3kg,5-7月龄)作为实验动物,在相应的动物饲养条件下设计开展试验。试验方法模拟临床给药方式对动物进行注射,考察在模拟使用过程中药液各项质量指标和无菌的变化情况。将检测对象按照100μl/只对新西兰兔的大腿外侧皮下模拟注射,注射是按常规局部消毒。隔日再次注射,共注射15次,总计周期为30d。分别在0、10、30d时检测干扰素注射液质量属性,检测结果如表14所示。
85.表14 使用过程中的稳定性试验——检测结果结合表14的检测结果可知,将实施例2和实施例5提供的干扰素多剂量注射液分别隔日注射,使用30天,外观、可见异物、ph值、渗透压均未见显著变化,生物学活性和干扰素含量均在合格范围内。苯酚和间甲酚含量未见显著变化。由此可知,本技术提供的干扰素多剂量注射液在开封后使用的30天内,稳定性良好。
86.(五)运输过程中的稳定性试验检测对象拟采用的运输保存条件为2-8℃避光保存。运输条件可能涉及汽车、火车、飞机等不同交通运输工具,耗时最长为4d,中间周转次数最多为3次。
87.本试验选择恶劣的环境条件进行模拟试验,将检测对象采用不同的放置方向置于模拟运输振动台上,调节振动台旋转频率为200rpm,振幅为25.4mm
±
10%,模拟交通工具的振动、运输距离、运输时间等条件,考察在运输中检测对象的各项质量指标的变化情况,分别在0、2、4d时检测其质量属性,同时考察包装的完整性。检测结果如表15所示。
88.表15 运输过程中的稳定性试验——检测结果
结合表15的检测结果可知,将实施例2和实施例5提供的干扰素多剂量注射液进行模拟运输过程的试验,试验期间外观、可见异物、ph值、渗透压均未见显著变化,生物学活性和干扰素含量均在合格范围内。苯酚和间甲酚含量未见显著变化。由此可知,本技术提供的干扰素多剂量注射液在运输过程中稳定性良好。
89.本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
