1.本发明涉及中医药技术领域,尤其是涉及一种含蜂胶治疗老年慢性疾病的中药组合物及制备方法及应用。
背景技术:
2.我国是世界上人口老龄化速度较快的国家之一,随着人口老龄化程进程的加快,慢性病已经成为影响人们健康的主要负担。慢性病的发病是多病因、多阶段作用的复杂过程,其病程长、医疗费用高且难以治愈,给家庭带来了沉重的负担。老年慢性病主要有糖尿病及并发症、高血脂、高血压、高血粘、心脏病、前列腺炎、肥大、阳痿、胃炎、胃溃疡、十二指肠球溃疡、女性内分泌失调以及更年期综合征等。
3.老年慢性病主要以预防为主,如果有患病的人们,会根据患病不同基于不同的药物或者手术,这样虽然可以抑制病症以防止进一步恶化,但这样往往只是研究了最表观的病症,对于人体机能的综合调节并没有很深入地改善。中医讲究阴阳五行,脏腑五行属性相对应,将人体看做一个生命、一个整体用药,最后阴阳得以平衡,宏观来看便是身体健康。
4.中医中有很多方剂属于秘密传承,由于中医专利保护的意识还不够强,导致传统的药方被注册,这些中医药人士痛心不已的事实让我们明白专利保护迫在眉睫。因此,对于现代病之一的老年慢性病,将研究出的中药组合物进一步改进,对研究老年慢性病的中医药研究者打开新的思路。
技术实现要素:
5.为了有效地治疗各类老年慢性病,本技术提供一种含蜂胶治疗老年慢性疾病的中药组合物及其制备方法。
6.第一方面,本技术提供一种含蜂胶治疗老年慢性疾病的中药组合物,包括以下质量份数的组分:
7.蜂胶粉10-30份;
8.蜂王浆10-16份;
9.蜂花粉25-65份;
10.蜂蜜5-20份;
11.蜂王胚胎粉5-20份;
12.雄蜂蛹粉5-20份;
13.蜂巢提取物5-10份;
14.蚓激酶0.5-1份;
15.有机微量元素1.6-3.2份。
16.优选的,所述中药组合物包括以下质量份数的组分:
17.蜂胶10-20份;
18.蜂王浆15-20份;
19.蜂花粉26-48份;
20.蜂蜜6-12份;
21.蜂王胚胎粉6-11份;
22.雄蜂蛹粉6-11份;
23.蜂巢提取物6-9份;
24.蚓激酶0.6-0.8份;
25.有机微量元素1.6-3.2份。
26.从中医的角度,中医不是“分而析之”,不是建立在物质层面的分析基础上,而是是建立在阴阳二气、五行属性上来总结归纳,用药时与人体阴阳二气、脏腑五行属性相对应,进行“同类互补”,依据阴阳五行的哲学:阴阳五行的意义在于生命特征的分类和互补,用药时对人体起作用的,把人看作一个整体,生病看做一种状态,以一种生命状态去调节人体的生命状态,最后阴阳平衡,身体健康。而非分子层面直接杀灭细菌,两者属于不同的辩证体系,有各自的用药体系,没有对比性。
27.通过上述中药组合物,以蜂胶为君,蜂王浆为臣,辅佐以蜂花粉、蜂蜜、蜂巢提取物、蜂王胚胎粉、雄蜂粉和蚓激酶,配合蜂蛰疗法消炎通经络、驱邪通气血。其中,蜂胶是经过一系列特殊纯化工艺:冷冻粉碎、常温搅拌提取、微孔过滤以及特定的洗脱剂洗脱纯化,真空低温浓缩、低温干燥生产的以蜂胶多酚和蜂胶萜烯类为的水溶性蜂胶液,药效成分进入体内后迅速透过血管壁而进入血液循环起到消炎、抗病毒、软化血管和抗癌的作用,食用量规定50—100克/天,连续服用90—180天能够有效地治疗糖尿病及并发症、高血脂、高血压、高血粘、心脏病、前列腺炎、肥大、阳痿、胃炎、胃溃疡、十二指肠球溃疡、女性内分泌失调以及更年期综合征等老年慢性疾病。
28.优选的,所述蜂王胚胎粉是生产鲜蜂王浆时取出的鲜蜂王胚胎,经过匀浆、过滤、真空冷冻干燥成冻干粉并粉碎而成的;
29.所述雄蜂蛹粉是生产雄蜂蛹时取出的鲜雄蜂蛹,经过匀浆、过滤、真空冷冻干燥成冻干粉并粉碎而成;
30.所述蜂蜜是刚从蜂箱中直接取出的全封盖天然成熟蜂蜜;
31.所述蜂花粉是从蜂箱直接取得的鲜蜂花粉,经过真空冷冻干燥后粉碎成粒径不小于100目的粉末。
32.通过对原料来源的限定,规范了蜂王浆、蜂王胚胎、雄蜂蛹、蜂蜜以及蜂花粉的属性,使药物的活性得到了规范,从而进一步增强了中药组合物对老年慢性疾病的治疗效果。
33.优选的,所述中药组合物还包括5份灵芝孢子粉、5-10份灵芝、5-10份三七、1-6份冬虫夏草和0.5-2份铁皮石斛。
34.以上制备的蜂产品具有良好的抗炎效果,蜂产品的有效活性成分对机体免疫系统有着良好的调节作用,能协助维持机体免疫系统的动态平衡与相对稳定。但由于蜂产品中含有一定量的蜂毒肽,存在过敏的风险。因此,采用灵芝孢子粉、灵芝、三七、冬虫夏草和铁皮石斛作为佐制药,制约君、臣药的峻烈之性,减轻君、臣药毒性,通过有序的配伍调其偏胜,制其毒性,减缓药物对人体的不良反应,发挥药物间相辅相成或相反相成等综合作用,使各具特性的药物组合成为一个整体,从而发挥更好的预防与治疗疾病的作用。
35.优选的,所述中药组合物还包括5份灵芝孢子粉、6-8份灵芝、6-8份三七、2-4份冬
虫夏草和0.6-1份铁皮石斛。
36.进一步限定了上述组合物的使用量,在达到较好的治疗效果的基础上减少了原料的使用量,进一步减少了用药的成本,使患者的用药负担得以减小。
37.优选的,所述有机微量元素是由有机硒、有机铬、有机锰、有机锌和有机钙之间的质量比为1:(0.2-0.6):(0.1-0.4):(0.1-0.5):(0.4-1.2)。
38.将上述有机微量元素进行合理搭配,与其余原料一起制备成中药组合物
39.优选的,所述有机微量元素是由有机硒、有机铬、有机锰、有机锌和有机钙之间的质量比为1:(0.3-0.4):(0.3-0.35):(0.2-0.3):(0.6-0.9)。
40.第二方面,本技术提供一种含蜂胶治疗老年慢性疾病的中药组合物的制备方法,包括以下步骤:
41.将蜂胶粉、蜂王浆、蜂花粉、蜂蜜、蜂巢提取物、雄蜂蛹粉、蜂王胚胎粉、蚯激酶和有机微量元素,混合搅拌均匀,制成含蜂胶治疗老年慢性疾病的中药组合物。
42.能够促使人体对微量元素的吸收,使体内谷胱甘肽过氧化酶(gsh-px)活性增加,由于gsh-px在体内有保护细胞膜完整性、消除自由基、增强体内免疫功能等作用,促进糖代谢,改善脂肪代谢,有利于胆固醇的合成,帮助胰岛素促进葡萄糖进入细胞内的效率,重要的血糖调节剂,在血糖调节方面,有助于生长发育,能够预防治疗糖尿病。
43.优选的,与所述有机微量元素一起加入的还有灵芝孢子粉,获得蜂产品;将灵芝、三七、冬虫夏草和铁皮石斛混合,先用水浸泡10-20分钟,然后在温度为70-80℃的水中煮30-60分钟,过滤、浓缩成中药膏;将中药膏与蜂产品在30-60℃的温度下搅拌均匀,静置1h以上,获得含蜂胶治疗老年慢性疾病的中药组合物。
44.通过本技术的制备方法,将蜂产品、有机微量元素、蚯激酶以及中药充分地融合在一起,使彼此的药效更好地相容。能够防治脑心血管疾病,调节人体的内分泌,平衡人体机能,由体内直达肌肤从根本上激活表皮细胞,增强皮肤的新陈代谢,提高人体的抵抗力,促进体液免疫以及细胞的免疫功能,提高人体免疫力;激活人体细胞的活性,对抗细胞突变,使体内细胞结构序列排序正常化,抑制肿瘤细胞生成,抑制肿瘤;保护肝损伤,辐射防护作用;促进糖代谢,改善脂肪代谢,能够预防治疗糖尿病等。
45.第三方面,本技术提供一种含蜂胶治疗老年慢性疾病的中药组合物的应用,将上述得到的任一含蜂胶治疗老年慢性疾病的中药组合物制成丸剂、片剂、膏剂、颗粒剂以及胶囊剂。
46.本技术的含蜂胶治疗老年慢性疾病的中药组合物药效稳定,制成剂、片剂、药丸以及胶囊等形态的药物均能很好地发挥作用,食用量规定50—100克/天,连续服用90—180天能够有效地治疗糖尿病及并发症、高血脂、高血压、高血粘、心脏病、前列腺炎、肥大、阳痿、胃炎、胃溃疡、十二指肠球溃疡、女性内分泌失调以及更年期综合征等老年慢性疾病。
47.综上所述,本技术以蜂胶为君,蜂王浆为臣,辅佐以蜂花粉、蜂蜜、蜂巢提取物、蜂王胚胎粉、雄蜂粉和蚓激酶,配合蜂蛰疗法消炎通经络、驱邪通气血。建立在阴阳二气、五行属性用药,与人体阴阳二气、脏腑五行属性相对应,进行“同类互补”,依据阴阳五行对人体起作用,有效地治疗糖尿病及并发症、高血脂、高血压、高血粘、心脏病、前列腺炎、肥大、阳痿、胃炎、胃溃疡、十二指肠球溃疡、女性内分泌失调以及更年期综合征等老年慢性疾病。
附图说明
48.图1是用于展示应用例8中的含有含蜂胶治疗老年慢性疾病的中药组合物颗粒剂对糖尿病并发坏疽的治疗效果。其中,图1(a)患有糖尿病并发坏疽,发病部位(右手掌),图1(b)是连续服用22天后,发病部位明显好转的效果图,图1(c)是继续服用应用例8的丸剂,20天后,发病部位基本愈合的效果图。
具体实施方式
49.制备例中的蜂胶粉、蜂王浆、蜂花粉、蜂蜜、蜂王胚胎粉、雄蜂蛹粉和蜂巢提取物均来自于北京乐一生蜂胶生化高新技术有限责任公司。
50.制备例中的蚓激酶、有机硒、有机铬、有机锰、有机锌和有机钙啤酒酵母蛋白质粉均为市售。
51.制备例
52.制备例1
53.本制备例公开一种含蜂胶治疗老年慢性疾病的中药组合物
54.由以下原料制备而成:蜂胶粉100g、蜂王浆100g、蜂花粉250g、蜂蜜50g、蜂王胚胎粉50g、雄蜂蛹粉50g、蜂巢提取物50g、蚓激酶5g和有机微量元素16g。其中,有机微量元素是由有机硒啤酒酵母蛋白质粉、有机铬酵母蛋白质、有机锰啤酒酵母蛋白质粉、有机锌啤酒酵母蛋白质粉和有机钙啤酒酵母蛋白质粉以1:0.2:0.1:0.1:0.4的质量比复配而成。
55.将蜂胶粉、蜂王浆、蜂花粉、蜂蜜、蜂巢提取物、雄蜂蛹粉、蜂王胚胎粉、蚯激酶和有机微量元素加入搅拌罐中,混合搅拌均匀,制成含蜂胶治疗老年慢性疾病的中药组合物。
56.制备例2
57.本制备例公开一种含蜂胶治疗老年慢性疾病的中药组合物
58.由以下原料制备而成:蜂胶粉300g、蜂王浆160g、蜂花粉650g、蜂蜜200g、蜂王胚胎粉200g、雄蜂蛹粉200g、蜂巢提取物100g、蚓激酶10g和有机微量元素32g。其中,有机微量元素是由有机硒啤酒酵母蛋白质粉、有机铬啤酒酵母蛋白质粉、有机锰啤酒酵母蛋白质粉、有机锌啤酒酵母蛋白质粉和有机钙啤酒酵母蛋白质粉以1:0.6:0.4:0.5:1.2的质量比复配而成。
59.将蜂胶粉、蜂王浆、蜂花粉、蜂蜜、蜂巢提取物、雄蜂蛹粉、蜂王胚胎粉、蚯激酶和有机微量元素加入搅拌罐中,混合搅拌均匀,制成含蜂胶治疗老年慢性疾病的中药组合物。
60.制备例3
61.本制备例公开一种含蜂胶治疗老年慢性疾病的中药组合物
62.与制备例2的区别在于:还包括以下原料:灵芝孢子粉50g、灵芝50g、三七50g、冬虫夏草10g和铁皮石斛5g。
63.将蜂胶粉、蜂王浆、蜂花粉、蜂蜜、蜂巢提取物、雄蜂蛹粉、蜂王胚胎粉、蚯激酶和有机微量元素加入,混合搅拌均匀。与所述有机微量元素一起加入的还有灵芝孢子粉,获得蜂产品;将灵芝、三七、冬虫夏草和铁皮石斛混合,先用水浸泡10分钟,然后在温度为70℃的水中煮40分钟,过滤、浓缩成中药膏;将中药膏与蜂产品在40℃的温度下搅拌均匀,静置1h,获得含蜂胶治疗老年慢性疾病的中药组合物。
64.制备例4
65.本制备例公开一种含蜂胶治疗老年慢性疾病的中药组合物
66.与制备例2的区别在于:还包括以下原料:灵芝孢子粉50g、灵芝100g、三七100g、冬虫夏草60g和铁皮石斛20g。
67.将蜂胶粉、蜂王浆、蜂花粉、蜂蜜、蜂巢提取物、雄蜂蛹粉、蜂王胚胎粉、蚯激酶和有机微量元素加入,混合搅拌均匀。与所述有机微量元素一起加入的还有灵芝孢子粉,获得蜂产品;将灵芝、三七、冬虫夏草和铁皮石斛混合,先用水浸泡20分钟,然后在温度为80℃的水中煮60分钟,过滤、浓缩成中药膏;将中药膏与蜂产品在60℃的温度下搅拌均匀,静置1.5h,获得含蜂胶治疗老年慢性疾病的中药组合物。
68.制备例5
69.本制备例公开一种含蜂胶治疗老年慢性疾病的中药组合物
70.与制备例4的区别在于:灵芝孢子粉60g、灵芝60g、三七60g、冬虫夏草20g和铁皮石斛6g。
71.制备例6
72.本制备例公开一种含蜂胶治疗老年慢性疾病的中药组合物
73.与制备例4的区别在于:灵芝孢子粉80g、灵芝80g、三七80g、冬虫夏草40g和铁皮石斛10g。
74.制备例7
75.本制备例公开一种含蜂胶治疗老年慢性疾病的中药组合物
76.与实施例6的区别在于:有机微量元素是由有机硒啤酒酵母蛋白质粉、有机铬啤酒酵母蛋白质粉、有机锰啤酒酵母蛋白质粉、有机锌啤酒酵母蛋白质粉和有机钙啤酒酵母蛋白质粉以质量比1:0.3:0.3:0.2:0.6组成。
77.制备例8
78.本制备例公开一种含蜂胶治疗老年慢性疾病的中药组合物
79.与实施例6的区别在于:有机微量元素是由有机硒啤酒酵母蛋白质粉、有机铬啤酒酵母蛋白质粉、有机锰啤酒酵母蛋白质粉、有机锌啤酒酵母蛋白质粉和有机钙啤酒酵母蛋白质粉以质量比1:0.4:0.35:0.3:0.9组成。
80.应用例1-8
81.将制备例1-8中制备的含蜂胶治疗老年慢性疾病的中药组合物制成颗粒剂。
82.应用例9-11
83.将制备例8制备的含蜂胶治疗老年慢性疾病的中药组合物压制成片剂为应用例9、粉碎成颗粒制成丸剂为应用例10以及用胶囊包裹为应用例11。
84.实验验证
85.实验1抑制肿瘤小鼠实验
86.动物和饲料:昆明种小鼠(二级、常备饲料和balb/c专用饲料由中国医学科学院实验动物所繁育场提供)。
87.材料与试剂:s-180及h-22细胞株均购自中国医学科学院药物研究所。鸡红细胞采自雄性健康来杭鸡,yac-1细胞购自军事医学科学院五所,1640培养基购自美国gibco公司,np-40为华美公司产品,ldh集质液及其他试剂均为国产试剂分析纯。
88.s-180细胞株实验:雄性昆明种小鼠,体重18-22克。实验动物随机分为正常对照
nc、高剂量hd.中计量md和低剂量ld4组,每组10只,将应用例1、2颗粒剂用蒸馏水稀释,灌胃给予,高、中、低剂量分别为1g、0.33g和0.11g/kg,nc组同时以蒸馏水灌胃,灌胃量均为0.4ml/20g,灌胃第13天,在无菌条件下,于右侧腋窝皮下接种s-180肿瘤细胞5x10细胞/0.2ml只,接种后继续给受试物,11天后,颈椎脱臼处死小鼠,取出瘤体称重。数据采用单因素方差分析统计,若出现阳性结果,依程序要求,按上述实验方法以10只雄性小鼠复实验一次。
89.h-22细胞株实验:雄性昆明种小鼠,体重18-22克。实验动物随机分为正常对照nc、高剂量nd、中剂量md和低剂量ld4组,每组10只,将应用例11药丸用蒸馏水稀释,灌胃给予,高、中、低剂量分别为1g、0.33g和0.11g/kg,nc组同时以蒸馏水灌胃,灌胃量均为0.4ml/20g,灌胃第13天,在无菌条件下,于右侧腋窝皮下接种h-22肿瘤细胞5x10细胞/0.2ml/只,接种后继续给予受试物,12天后,颈椎脱臼处死小鼠,取出瘤体称重。数据采用单因素方差分析统计,若出现阳性结果,依程序要求,按上述试验方法以10只雄性小鼠重复实验一次。
90.免疫功能试验:6周龄左右雄性balb/c小鼠体重18-22克。试验动物随机分为正常对照nc、高剂量hd和中剂量md和低剂量ld4组,每组10只,灌胃给应用例11的药丸,样品处理同s-180实验,高、中、低剂量分别为1g、0.33g和0.11g/kg,nc组同时用蒸馏水灌胃,灌胃量为0.4ml/20g,持续灌胃25天后宰杀,进行以下实验:用腹腔巨噬细胞吞噬鸡红细胞方法评价巨噬细胞吞噬能力、用乳酸脱氢酶ldh法测定自然杀伤nk细胞活性。
91.统计方法;数据均为mean sd表示,采用单因素方差分析比较各剂量组与对照组的差异。
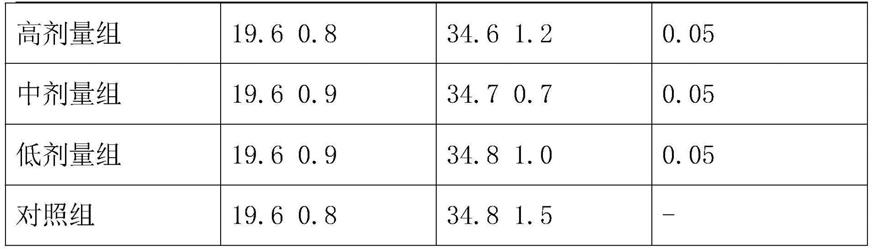
92.应用例2的颗粒剂对小鼠接种s-180瘤细胞后肿瘤生长的影响,结果见表1、表2,两次重复实验均表明,各剂量组小鼠的瘤重均低于对照组,各剂量组之间有一定的剂量反应关系,高剂量组与对照组比较,有显著性差异p《0,01,高剂量组抑瘤率大于30%。给受试物后各剂量组小鼠体重与对照组相比无显著性差异,见表3、4。
93.表1应用例1的颗粒剂对荷s180瘤小鼠重的影响一mean sd
94.组别剂量g/kg鼠数/只瘤重/gp值抑制率/%高剂量组1.0101.68180.70460.0133.9中剂量组0.33102.21960.84460.0512.8低剂量组0.11102.43931.17310.054.2对照组0.0102.54600.4862
‑‑
95.表2应用例2的颗粒剂对荷s180瘤小鼠重的影响二mean sd
96.组别剂量g/kg鼠数/只瘤重/gp值抑制率/%高剂量组1.0101.51160.51630.0139.1中剂量组0.33102.05510.85620.0517.1低剂量组0.11102.25860.87840.058.9对照组0.0102.47970.5998
‑‑
97.表3应用例1的颗粒剂对荷s180瘤小鼠体重的影响一mean sd
98.组别始重/g终重/gp值高剂量组19.60.934.51.40.05
中剂量组19.60.634.21.10.05低剂量组19.61.134.51.40.05对照组19.60.934.51.4-99.表4应用例2的颗粒剂对荷s180瘤小鼠体重的影响二mean sd
[0100][0101][0102]
应用例1、2的颗粒剂对小鼠接种h-22瘤细胞后肿瘤生长影响,结果见表5、表6。两次重复实验均表明,各剂量组小鼠的瘤重均低于对照组,均有显著性差异p《0.05,p 0.01,各剂量组之间有一定的剂量反应关系,高剂量组与对照组比较,抑瘤率大于30%。给受试物后各剂量组小鼠体重与对照组相比无显著性差异,见表7、8。
[0103]
表5应用例1的颗粒剂对荷h-22瘤小鼠瘤重的影响一mean sd
[0104]
组别剂量g/kg鼠数/只瘤重/gp值抑制率/%高剂量组1.0102.09470.41620.0133.8中剂量组0.33102.27580.85520.0528.1低剂量组0.11102.33190.71970.0526.3对照组0.0103.16460.8001
‑‑
[0105]
表6应用例2的颗粒剂对荷h-22瘤小鼠瘤重的影响二mean sd
[0106]
组别剂量g/kg鼠数/只瘤重/gp值抑制率/%高剂量组1.0101.92320.39550.0138.0中剂量组0.33102.11150.41940.0121.9低剂量组0.11102.28470.58370.0526.3对照组0.0103.10030.7972
‑‑
[0107]
表7应用例1的颗粒剂对荷h-22瘤小鼠体重的影响一mean sd
[0108]
组别始重/g终重/gp值高剂量组19.61.034.90.80.05中剂量组19.61.134.51.00.05低剂量组19.61.034.80.90.05对照组19.61.134.51.2-[0109]
表8应用例2的颗粒剂对荷h-22瘤小鼠体重的影响二mean sd
[0110]
组别始重/g终重/gp值高剂量组19.71.034.70.80.05
中剂量组19.61.034.71.00.05低剂量组19.61.134.71.10.05对照组19.61.034.81.2-[0111]
应用例1、2的颗粒剂对小鼠巨噬细胞功能的调节作用(见表9),经口给予小鼠不同剂量的应用例2的颗粒剂25天后,各剂量组的小鼠腹腔巨噬细胞吞噬率和吞噬指数均高于对照组,高、中剂量组小鼠腹腔巨噬细胞吞噬鸡红细胞的吞噬率与对照组比较有显著性差异p《0.01,各剂量组吞噬指数亦与对照组有显著性差异p0.05,p0.01。
[0112]
表9应用例2的颗粒剂对小鼠腹腔巨噬细胞吞噬鸡红细胞能力的影响mean sd
[0113][0114][0115]
应用例2的颗粒剂对小鼠脾脏自然杀伤细胞活性的影响(见表10),结果表明,高、中剂量组的nk活性(%)显著高于对照组(p《0.01,p《0.05),低剂量组与对照组无显著性差异。
[0116]
表10应用例2的颗粒剂对小鼠脾脏nk活性的影响(mean
±
sd)
[0117]
组别小鼠/只剂量(g/kg)nk活性/%吞噬指数高剂量组101.040.9
±
4.32《0.01中剂量组100.3339.4
±
3.32《0.05低剂量组100.1135.2
±
6.58》0.05对照组100.033.1
±
6.66-[0118]
应用例2的颗粒剂对小鼠移植性肿瘤的生长,s-180细胞株两次抑瘤试验结果均表明:高剂量组小鼠瘤重显著低于对照组(p《0.01),抑瘤率大于30%,且有一定的剂量反应关系。h-22细胞株两次抑瘤试验结果均表明:各剂量组小鼠瘤重均显著低于对照组(p《0.05,p《0.01),高剂量组抑瘤率大于30%,且有一定的剂量反应关系。同时高、中剂量组小鼠腹腔巨噬细胞吞噬率及各剂量组吞噬指数明显高于对照组(p《0.05,p《0.01);高、中剂量组小鼠的脾脏自然杀伤细胞活性(%)高于对照组(p《0.05,p《0.01)。应用例2的颗粒剂对小鼠免疫功能未表现抑制作用,可以认为应用例2的颗粒剂对动物肿瘤具有抑制作用。
[0119]
实验2润肠通便小鼠实验
[0120]
实验动物:选用中国医学科学院实验动物研究所繁殖的18-22g二级昆明健康雄性小鼠50只,随机分为5组,每组10只,作为ⅰ组,进行小肠推进实验;另18-22g二级昆明健康雄性小鼠50只,随机分为5组,每组10只,作为ⅱ组,进行排首粒黑便时间、排便粒数和排便重量实验。
[0121]
剂量:应用例4的颗粒剂人体推荐量为每人(按60kg体重计)每日30g,相当于0.5g/
日/kgbw,上、下各设一个剂量组:0.25g/kgbw组和1.5g/kgbw组,受试物以水(已消毒)配制。0ml/kgbw组(包括阴性对照组和模型对照组)以水(已消毒)灌胃。连续灌胃9-10天后测各项润肠通便指标。
[0122]
仪器与试剂:手术剪、眼科镊、直尺、注射器、天平、活性炭粉、阿拉伯树胶、复方地芬诺酯片(每片含复方地芬诺酯2.5mg)
[0123]
实验方法:墨汁的配制,准确称取阿拉伯树胶100g,加工800ml,煮沸至溶液透明,称取活性碳(粉状)50g加至上述溶液中煮沸三次,待溶液凉后加水定容到1000ml,于冰箱中4℃保存,用前摇匀。
[0124]
复方地芬诺酯混悬液的配制,临用前取复方地芬诺酯片50mg(20片),用研钵研碎呈粉末后加水至100ml,配制成复方地芬诺酯混悬液供灌胃用,小鼠灌胃量为0.2ml/kgbw。
[0125]
小肠推进实验:经灌胃给予受试物9d,实验前各组小鼠禁食24小时(期间自由饮水)。小鼠肠蠕动抑制模型对照组和三个剂量组灌胃给予复方地芬诺酯(10ml/kgbw),阴性对照组给水,30分钟后,0.25ml/kgbw、0.50ml/kgbw、1.5ml/kgbw组灌胃给予含受试物的墨汁悬液,0ml/kgbw组(阴性对照组和模型对照组)灌胃给予空白墨汁,小鼠灌胃量为20ml/kgbw。25分钟后脱颈椎处死动物,打开腹腔分离肠系膜,剪取上端自幽门、下端至回肠部的肠管,轻轻将小肠拉成直线,测量肠管长度为“小肠总长度”,从幽门至墨汁前沿为“墨汁推进长度”,计算墨汁推进率:
[0126]
墨汁推进率=墨汁推进长度(cm)/小肠总长度(cm)
×
100%。
[0127]
排首粒黑便时间、排便粒数和排便重量的测定
[0128]
经灌胃给予受试物10d,实验前各组小禁食24小时(期间自由饮水)。便秘模型对照组和三个剂量组灌胃给予复方地芬诺酯10ml/kgbw,阴性对照组给水,30分钟后,0.25ml/kgbw、0.50ml/kgbw、1.50ml/kgbw组灌胃给予含受试物的墨汁悬液,0ml/kgbw组(阴性对照组和模型对照组)灌胃给予空白墨汁,小鼠灌胃量为20ml/kgbw。动物均单笼饲养,正常饮水进食,记录每只动物排首粒黑便时间、6小时内排便总粒数及总重量。
[0129]
实验数据的统计处理:用spss软件对各实验原始数据进行统计处理。阴性对照组模型对照组间的比较用t检验(方差齐)或t’检验(方差不齐);各剂量组和模型对照组间的比较先经方差齐性检验,满足“方差齐”的数据资料用单因素方差分析方法和多个实验组和一个对照(模型对照)组均数的两两比较方法进行统计处理;对非正态分布或方差不齐的数据资料进行适当的变量转换,待满足“正态方差齐”要求后,用转换所得的数据进行统计处理。
[0130]
结果判定:在小鼠肠蠕动抑制模型成立的前提下,受试物组的小肠推进率显著高于模型对照组的小肠推进率,即可判定该项指标结果阳性;在小鼠便秘模型成立的前提下受试物组的排首粒黑便时间显著短于模型对照组,即可判定该项指标结果阳性;6小时内黑便粒数显著高于模型对照组,即可判定该项指标结果阳性;6小时内黑便重量显著高于模型对照组,即可判定该项指标结果阳性。
[0131]
排首粒黑便时间与小肠推进实验至少一项阳性,且排便粒数与排便重量至少一项阳性可判定该受试物具有润肠通便作用。
[0132]
实验结果:
[0133]
表11各组小鼠的初始体重(x
±
sd)
[0134][0135]
原始数据进行方差齐性检验后,符合方差齐的要求,用单因素方差分析方法和多个实验组与一个对照(模型对照)组均数的两两比较方法进行统计处理。由表1可见,在0ml/kgbw(阴性对照)组、0.25ml/kgbw组、0.50ml/kgbw组、1.50ml/kgbw组及其相应的模型对照组间比较,差异均无显著性(p>0.05),即小鼠初始体重在各组间较为均衡。
[0136]
表12应用例4的颗粒剂对小鼠体重的影响(χ
±
sd)
[0137]
[0138][0139]
经口给予小鼠不同剂量的应用例4的颗粒剂9~10天,原始数据进行方差齐性检验后,符合方差齐的要求,用单因素方差分析方法和多个实验与一个对照(模型对照)组间均数的两两比较方法进行统计处理。由表2可见,在各组与模型对照组间比较,差异均无显著性(p>0.05)。即应用例4的颗粒剂对小鼠的体重增长无影响。
[0140]
表13应用例4的颗粒剂对小鼠小肠推进运动的影响(χ
±
sd)
[0141][0142]
注:与模型对照比较,*p<0.05;**p<0.01.
[0143]
原始数据符合正态方差齐的要求,用t检验进行统计处理。由表3可见,在阴性对照组和模型对照组间比较,差异有极显著性p<0.01,即经口给予10ml/kgbw复方地芬诺酯造小鼠肠蠕动抑制模型成立。
[0144]
经口给予小鼠不同剂量的应用例4的颗粒剂9天,原始数据符合正态方差齐的要求,用单因素方差分析方法和多个实验组与一个对照(模型对照)组间均数的两两比较方法进行统计处理。由表3可见,在0.25ml/kgbw组和模型对照组间比较,差异有极显著性p<0.01,在0.50ml/kgbw组、1.50ml/kgbw组和模型对照组间比较,差异有显著性(p<0.05=,即应用例4的颗粒剂在0.25ml/kgbw组、0.50ml/kgbw组、1.50ml/kgbw组均能提高肠动抑制模型小鼠的小肠墨汁推进率。
[0145]
表14应用例4的颗粒剂对小鼠排首粒黑便时间的影响(χ
±
sd)
[0146][0147]
注:与模型对照比较,**p<0.01.
[0148]
原始数据符合正态方差齐的要求,用t检验进行统计处理,由表4可见,在阴性对照组和模型对照组间比较,差异有极显著性p<0.01,即经口给予10ml/kgbw复方地芬诺酯造小鼠便秘模型成立。
[0149]
经口给予小鼠不同剂量的应用例4的颗粒剂10d,原始数据进行方差齐性检验后,符合方差齐的要求,用单因素方差分析方差分析方法和多个实验组与一个对照(模型对照)组间均数的两两比较方法进行统计处理。由表4可见,0.25ml/kgbw组、0.50ml/kgbw组、1.50ml/kgbw组与模型对照组间比较,差异均有极显著性p<0.01,即应用例4的颗粒剂在0.25ml/kgbw组、0.50ml/kgbw组和1.50ml/kgbw组均能缩短便秘模型小鼠的排首粒黑便时间。
[0150]
表15应用例4的颗粒剂对小鼠排便粒数的影响(χ
±
sd)
[0151][0152]
注:与模型对照比较,*p<0.05;**p<0.01.
[0153]
原始数据符合正态方差齐的要求,用t检验进行统计处理,由表5可见,在阴性对照组和模型对照组间比较,差异有极显著性(p<0.01),即经口给予10ml/kgbw复方地芬诺酯造小鼠便秘模型成立。
[0154]
经口给予小鼠不同剂量的应用例4的颗粒剂10天,原始数据符合方差齐的要求,用单因素方差分析方法和多个实验组与一个对照(模型对照)组间均数的两两比较方法进行统计处理。由表5可见,0.25ml/kgbw组与模型对照组比较,差异有显著性(p<0.05=,0.50ml/kgbw组、1.50ml/kgbw组与模型对照组比较,差异无显著性(p>0.05)。即应用例4的颗粒剂在0.25ml/kgbw组能增加便秘模型小鼠的排便粒数。
[0155]
表16应用例4的颗粒剂对小鼠排便重量的影响(χ
±
sd)
[0156][0157]
注:与模型对照比较,**p<0.01.
[0158]
原始数据符合正态方差齐的要求,作t检验进行统计处理,由表6可见,在阴性对照组和模型对照组间比较,差异有极显著性(p<0.01=,即经口给予10ml/kgbw复方地芬诺酯造小鼠便秘模型成立。
[0159]
经口给予小鼠不同剂量的应用例4的颗粒剂10天,原始数据符合方差齐的要求,用单因素方差分析方法和多个实验组与一个对照(模型对照)组间均数的两两比较方法进行统计处理。由表6可见,0.25ml/kgbw组与模型对照组比较,差异有显著性(p<0.01=,0.50ml/kgbw组、1.50ml/kgbw组与模型对照组比较,差异无显著性(p>0.05),即应用例4的颗粒剂在0.25ml/kgbw组能增加便秘模型小鼠的排便重量。
[0160]
可见,经口给予小鼠不同剂量的应用例4的颗粒剂,0.25ml/kgbw、0.50ml/kgbw和1.50ml/bw均能提高肠蠕动抑制模型小鼠的小肠墨汁推进率,缩短便秘模型小鼠的排首粒黑便时间,0.25ml/kgbw剂量能增加便秘模型小鼠的排便重量和排便粒数,各剂量对小鼠的体重增长无影响。根据《保健食品功能学评价程度和检验方法》的判定标准,认为应用例4的颗粒剂具有润肠通便功效。
[0161]
临床验证
[0162]
降血糖人体临床实验
[0163]
受试者选择:选择经饮食控制或口服降糖药治疗后病情较稳定,不需要更换药物品种及剂量,仅服用维持量的成年
ⅱ‑
型糖尿病病人,空腹血糖≥7.8mmo1/l(140mg/d1)或餐后2h血糖≥11.1mmo1/l(200mg/d1);也可选择7.8mmo1/l≥空腹血糖≥6.7mmo1/l(120mg/d1)11.1mmo1/l(200mg/d1)≥餐后2h血糖≥7.8mmo1/l的高血糖人群。受试者无心、肝、肾等主要脏器的并发症,肝肾功能良好,无服用糖皮质激素和其它影响血糖药物史。
[0164]
排除者标准:年龄在18岁以下或65岁以上者,妊娠或哺乳期妇女,有严重心肝肾等并发症,或合并有其它严重原发性疾病,精神病患者,不合作者,无法判疗效或资料不全者。
[0165]
实验方法:每日2次,每次4粒方法:60例受试者,随机分为二组,原服用降糖药物品种及剂量不变,试食组加应用例8的颗粒剂,30g/个,每日2次。对照组服用安慰剂片剂,要求试食者长期坚持饮食控制,按不同劳动强度和体形进食。各组采用自身对照设计,两组间为组间对照设计。
[0166]
仪器与试剂:f-820型血球技数仪,midiron尿十项分析仪(德国产),01ympus全自生化分析仪型号au600(日本产),生化试剂盒全部由中生公司提供。
[0167]
观察指标:各项指标于试食实验开始及结束时各测一次,试食第15天加测空腹血糖一次。
[0168]
症状观察:详细询问病史,了解患者饮食情况,活动量,观察主要临床症状:多食、多饮、多尿以及疲乏无力等。按症状轻重(重症3分中度2分轻症1分)在试食前后统计积分值,并就其主要症状改善(每一症状改善2分显效,改善1分为有效),观测症状改善率。
[0169]
空腹血糖及餐后2小时血糖检测、尿糖尿酮体检测、血糖(总胆固醇tc甘油三脂tc)检测。
[0170]
安全性观察:血尿常规检(红细胞计数,血红蛋白,白细胞计数,尿十项测定)。
[0171]
生化指标测定:血清白蛋白alb,总蛋白tp,心肝肾功能(谷草转氨酶ast,谷丙转氨酶alt,尿素urea,肌苷cre)。腹部b超,心电图.x线胸部透视。
[0172]
功效判定标准:有效-基本症状明显改善,血糖较试食前下降≥10%,无效-基本症状无明显改善,血糖下降未达到上述标准。
[0173]
共观察60例,应用例8含含蜂胶治疗老年慢性疾病的中药组合物的颗粒剂组男性15例,女性15例,年龄最小35岁,年龄最大65岁,平均53.20岁,平均病程6.90年;对照组男性10例,女性20例,年龄最小30岁,最大65岁,平均53.30岁,平均病程5.97年。
[0174]
表17观察前一般情况比较(x
±
sd)
[0175][0176][0177]
表18试食者服用降糖药物情况
[0178][0179]
由表1、表2可见,两组试食前各项指标无明显差异,具有可比性。
[0180]
表19试食前后临床症状的变化(降糖功效临床观察)
[0181][0182]
表20功效比较
[0183][0184]
组间对照#p《0.05
[0185]
表21两组试食前后空腹血糖比较(mmol/l,x
±
sd)
[0186][0187]
自身对照:**p《0.01,组间对照:#p《0.05
[0188]
一个月后,应用例8的颗粒剂组空腹血糖下降1.54mmol/l,对照组空腹血糖下降不明显,两组比较有明显差异。
[0189]
表22两组临床前后餐后2小时血糖比较(mmol/l,x
±
sd)
[0190][0191]
自身对照:*p《0.05,组间对照:#p《0.05
[0192]
一个月后,应用例8的颗粒剂试食组,餐后2小时血糖下降0.92mmol/l,自身对照差异显著,对照组餐后2小时血糖下降不明显,两组比较有明显差异。
[0193]
表23临床前后血脂变化比较(x
±
sd)
[0194][0195][0196]
表24临床前后血液安全指标变化比较(x
±
sd)
[0197][0198]
应用例8的颗粒剂试食组较为明显的降低血糖的功效,一个月后空腹血糖下降1.54
±
1.63mmol/l,餐后血糖下降0.92
±
2.43mmol/l,其中有效20例,总有效率66.67%;对照组空腹血糖和餐后血糖下降均不明显,其中有效10例,总有效率33.33%,两组对比有显著差异,说明应用例8的颗粒剂有调节血糖的功效。
[0199]
服用应用例8的颗粒剂后,血红蛋白、红细胞、白细胞、血清总蛋白、白蛋白、谷草转氨酶、谷丙转转氨酶、肌苷、尿素及尿常规等各项临床检验指标均在正常范围,说明应用例8的颗粒剂对临床者身体健康无不良影响。
[0200]
服用应用例8的颗粒剂在临床过程中未观察到过敏及其不良反应。
[0201]
救治实例
[0202]
糖尿病并发坏疽患者治愈案例:患者年龄46岁,患有糖尿病并发坏疽,发病部位(右手掌)见图1(a),从2010年2月5日开始服用丸剂(应用例8),30g/次,每天2次。2010年2月27日,连续服用22天后,发病部位明显好转,见图1(b)。继续服用应用例8的丸剂,20天后,发
病部位基本愈合,见图1(c)。
[0203]
本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
