颅锁骨发育不良的致病runx2新突变位点基因、多肽及应用
技术领域
1.本发明涉及分子生物学技术领域,具体涉及一种颅锁骨发育不良的致病runx2新突变位点基因、多肽及应用。
背景技术:
2.骨骼的形成和重建主要是骨祖细胞和软骨祖细胞的分化、增殖和细胞外基质的形成,这些过程离不开一些列相关基因的激活和抑制,转录因子对这些基因起着重要的调控作用。
3.成骨细胞和破骨细胞间的动态平衡是保证牙齿正常萌出的基础,若平衡失调则导致牙齿萌出障碍,颅锁骨发育不良(cleidocranial dysplasia,ccd)是一种典型牙齿萌出障碍性疾病,属于累及骨骼和牙齿的常染色体显性遗传性疾病,具有高外显率和不同的表型,有明显的家族聚集性,男女发病率无明显差别。典型的临床症状:囟门闭合延迟,颅骨缝增宽,锁骨钙化不良、缺失,锥形胸,耻骨联合增宽而致骨盆发育不良,身材矮小,上颌骨发育不足,有多生牙,乳牙滞留,恒牙萌出延迟等。
4.颅锁骨发育不良的致病基因是成骨细胞特异性转录因子runx2基因,runx2属于runxx相关因子(runt-related gene)家族,runx
x
相关因子是一类转录因子蛋白的总称,它们都是有α和β亚单位构成的异二聚体。runx
x
家族主要有runx1、runx2和runx3。
5.runx2又称为核心结核因子α1、多瘤病毒增强子结合蛋白或急性髓系白血病因子,其位于人常染色体6p21,长约220kb,包括8个外显子,并具有和其他家族成员相似的runt结构域,是骨发育过程中调节骨髓间充质干细胞向成骨细胞分化和成熟最关键的转录因子,runx2的表达是成骨细胞开始分化的标志,因此它是骨形成过程中最早和最特异性的标志基因,该基因的错意表达、基因插入、缺失或者移码突变等都是造成ccd的重要原因。runx2包括n端的多谷氨酰胺/丙氨酸重复序列结构域(q/a)、中部的runt结构域以及c端的富含脯氨酸、丝氨酸及苏氨酸的pst结构域。
6.虽然现有已有较多颅锁骨发育不良致病基因runx2基因的研究,但是,目前此疾病致病基因的筛选和验证分析工作远远不够,仍存在未知致病基因位点。进一步研究颅锁骨发育不良的致病机理,找出颅锁骨发育不良的runx2新突变致病基因,对于该病的诊断治疗具有重要意义,有利于为ccd的早期发现提供新思路及早期治疗提供新靶点。
技术实现要素:
7.本发明的目的在于提供一种颅锁骨发育不良的致病runx2新突变位点基因、多肽及应用,以解决上述背景技术中存在的至少一项技术问题。
8.为了实现上述目的,本发明采取了如下技术方案:
9.一方面,本发明提供一种颅锁骨发育不良的致病runx2新突变位点基因,所述runx2新突变位点基因的核苷酸序列为野生型runx2基因的核苷酸序列的第1550位碱基t的缺失,野生型runx2基因的序列如seq no.1所示。
10.第二方面,本发明提供一种runx2突变体多肽,所述runx2突变体多肽的氨基酸序列为由野生型runx2基因编码的如seq no.2所示的氨基酸序列的第518、519、520、521位的色氨酸、精氨酸、脯氨酸、酪氨酸被替换得到如seq no.3所示的氨基酸序列。
11.第三方面,本发明提供一种疾病生物分子标志物,所述疾病生物分子标志物为如上所述的runx2新突变位点基因,所述runx2新突变位点基因的核苷酸序列如seq no.4所示。
12.优选的,所述疾病的类型包括颅锁骨发育不良。
13.第四方面,本发明提供一种试剂盒,包括检测如上所述的疾病生物分子标志物的试剂。
14.优选的,所述试剂包括实时荧光定量检测试剂。
15.优选的,所述实时荧光定量检测试剂中包含用于实时荧光定量检测runx2新突变位点基因表达的引物:
16.上游引物:5
’‑
ctcttcccaaagccagagtg-3’17.下游引物:5
’‑
gcagacagctcacaaaaccag-3’。
18.第五方面,本发明提供一种检测如上所述的疾病生物分子标志物的试剂在制备疾病诊断制剂上的应用,所述疾病的类型包括颅锁骨发育不良。
19.第六方面,本发明提供一种如上所述的疾病生物分子标志物在制备治疗疾病的药物中的应用,所述疾病的类型包括颅锁骨发育不良。
20.第七方面,本发明提供一种探针组合物,所述探针组合物用于检测如上所述的疾病生物分子标志物。
21.本发明有益效果:提供颅锁骨发育不良的runx2新突变位点基因,进一步完善了现有runx2蛋白突变数据库,进一步诠释了runx2突变致颅锁骨发育不良的机制;提供了筛选颅锁骨发育不良的生物样本的方法、筛选颅锁骨发育不良的生物样品的系统,用于筛选颅锁骨发育不良的生物样品的试剂盒以及筛选治疗或预防颅锁骨发育不良疾病的药物的方法;所提供的的试剂盒可用于临床对runx2突变基因的检测为颅锁骨发育不良的诊断提供了快速、可靠、准确的新途径,新基因位点的鉴定将为探讨runx2致病的分子遗传学机制打下坚实的基础。
22.本发明附加的方面和优点将在下面的描述中部分给出,这些将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
23.为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
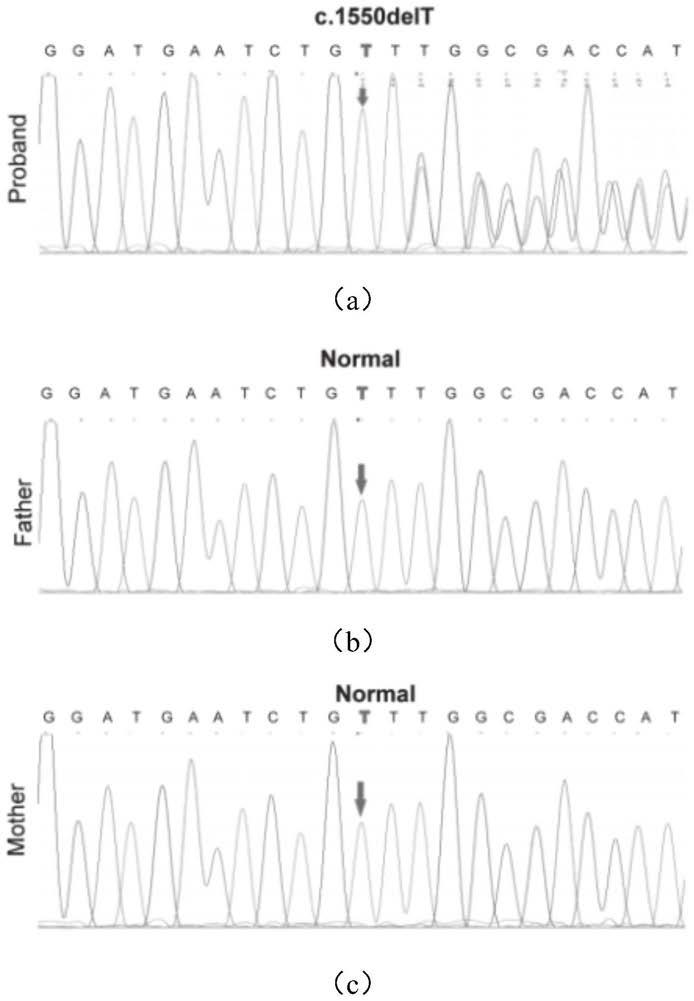
24.图1为本发明实施例所述的基因测序峰图。其中,图1(a)为先证者runx2基因部分序列图。使用箭头显示c.1550delt转换突变(genbank登录号:nm_001024630)。这种移码突变导致从氨基酸trp 518(p.trp518glyfs)开始的氨基酸合成发生变化。图1(b)为父亲的正常runx2基因部分序列图。图1(c)为母亲正常runx2基因部分序列图。
25.图2为本发明实施例所述的runx2结构域,蛋白质水平的突变显示在pst域下方。
26.图3为本发明实施例所述的runx2在不同物种中的序列比对,trp518-runx2的跨物种具有保守性。
27.图4为本发明实施例所述的建立的wt-runx2和w518gfs-runx2结构模型示意图。
28.图5为本发明实施例所述的先证者的口腔x射线图像。
29.图6为本发明实施例所述的先证者的胸部x射线图像。
30.图7为本发明实施例所述的先证者的runx2基因表达水平检测结果示意图。其中,图7(a)为野生型和突变型runx2基因的表达,使用wb测试生成蛋白质的量;(b)为runx2基因表达水平的直方图分析。
31.图8为本发明实施例所述的原位免疫荧光显微镜观察runx2和trp518glyfs突变的亚细胞定位结果示意图。
32.图9为本发明实施例所述的runx2(c.1550delt)变异诱导的骨钙素启动子活性检测结果示意图。
具体实施方式
33.下面详细叙述本发明的实施方式,所述实施方式的示例在附图中示出,其中自始至终相同或类似的标号表示相同或类似的元件或具有相同或类似功能的元件。下面通过附图描述的实施方式是示例性的,仅用于解释本发明,而不能解释为对本发明的限制。
34.本技术领域技术人员可以理解,除非另外定义,这里使用的所有术语(包括技术术语和科学术语)具有与本发明所属领域中的普通技术人员的一般理解相同的意义。
35.还应该理解的是,诸如通用字典中定义的那些术语应该被理解为具有与现有技术的上下文中的意义一致的意义,并且除非像这里一样定义,不会用理想化或过于正式的含义来解释。
36.本技术领域技术人员可以理解,除非特意声明,这里使用的单数形式“一”、“一个”、“所述”和“该”也可包括复数形式。应该进一步理解的是,本发明的说明书中使用的措辞“包括”是指存在所述特征、整数、步骤、操作、元件和/或组件,但是并不排除存在或添加一个或多个其他特征、整数、步骤、操作、元件和/或它们的组。
37.为便于理解本发明,下面结合附图以具体实施例对本发明作进一步解释说明,且具体实施例并不构成对本发明实施例的限定。
38.本领域技术人员应该理解,附图只是实施例的示意图,附图中的部件并不一定是实施本发明所必须的。
39.本发明的一个典型实施方式中,提供了下述任一应用:
40.a1、检测人基因组中runx2 c.1550delt的多态性或基因型的物质在制备筛查颅锁骨发育不良患者产品中的应用;
41.a2、检测人基因组中runx2 c.1550delt的多态性或基因型的物质在制备检测颅锁骨发育不良易感性产品中的应用;
42.a3、检测人基因组中runx2 c.1550delt的多态性或基因型的物质在制备检测与颅锁骨发育不良相关的单核苷酸多态性的产品中的应用;
43.a4、检测人基因组中runx2 c.1550delt的多态性或基因型的物质在制备鉴定或辅
助鉴定与颅锁骨发育不良相关的单核苷酸多态性的产品中的应用;
44.b1)人基因组中runx2 c.1550delt的多态性或基因型在制备筛查颅锁骨发育不良患者产品中的应用;
45.b2)人基因组中runx2 c.1550delt的多态性或基因型在制备检测颅锁骨发育不良易感性产品中的应用;
46.b3)检测人基因组中runx2 c.1550delt的多态性或基因型的物质在筛查颅锁骨发育不良患者中的应用;
47.b4)检测人基因组中runx2 c.1550delt的多态性或基因型的物质在检测颅锁骨发育不良易感性中的应用;
48.b5)检测人基因组中runx2 c.1550delt的多态性或基因型的物质在检测与颅锁骨发育不良相关的单核苷酸多态性的中的应用;
49.b6)检测人基因组中runx2 c.1550delt的多态性或基因型的物质在鉴定或辅助鉴定与颅锁骨发育不良相关的单核苷酸多态性的中的应用;
50.b7)人基因组中runx2 c.1550delt的多态性或基因型在筛查颅锁骨发育不良患者中的应用;
51.b8)人基因组中runx2 c.1550delt的多态性或基因型在检测颅锁骨发育不良易感性中的应用。
52.本发明的又一具体实施方式中,上述用途中,所述检测人基因组中runx2 c.1550delt的多态性或基因型的物质可为扩增包括runx2 c.1550delt在内的基因组dna片段的pcr引物和/或检测runx2 c.1550delt的探针。
53.本发明的又一具体实施方式中,所述产品可包括所述pcr引物和/或所述检测runx2 c.1550delt的探针。
54.本发明的又一具体实施方式中,还提供了含有检测人基因组中runx2 c.1550delt的多态性或基因型的物质的产品,为a)-d)中的任一种产品:
55.a)检测与颅锁骨发育不良易相关的单核苷酸多态性或基因型的产品;
56.b)鉴定或辅助鉴定与颅锁骨发育不良易相关的单核苷酸多态性或基因型的产品;
57.c)筛查颅锁骨发育不良易患者产品;
58.d)检测颅锁骨发育不良易易感性产品。
59.本发明的又一具体实施方式中,上述产品中,所述检测人基因组中runx2 c.1550delt的多态性或基因型的物质可为扩增包括runx2 c.1550delt在内的基因组dna片段的pcr引物。
60.本发明的又一具体实施方式中,本发明还提供了下述m1)或m2)的方法:
61.m1)筛查颅锁骨发育不良患者的方法,包括:检测待测对象基因组中runx2 c.1550delt位点的基因型;
62.m2)检测颅锁骨发育不良易感性的方法,包括:检测待测对象基因组中runx2 c.1550delt位点的基因型。
63.本发明的又一具体实施方式中,上述方法中,检测待测对象基因组中runx2 c.1550delt位点的基因型可采用所述检测runx2 c.1550delt的多态性或基因型的物质进行。
64.本发明在实际应用中,可将检测runx2 c.1550delt的多态性(即等位基因)或基因型的物质与其它物质(如检测其它的与颅锁骨发育不良相关的单核苷酸多态性或基因型的物质)联合在一起制备筛查颅锁骨发育不良患者的产品。
65.其中,检测人基因组中runx2 c.1550delt的多态性或基因型的物质可为通过下述至少一种方法确定runx2 c.1550delt的多态性或基因型所需的试剂和/或仪器:dna测序、限制性酶切片段长度多态性、单链构象多态性、变性高效液相色谱、snp芯片、微流控芯片技术、taqman探针技术和sequenom massarray技术。
66.其中,利用sequenom massarray技术确定runx2 c.1550delt的多态性或基因型所需的试剂和/或仪器包括pcr引物对、基于单碱基延伸反应的延伸引物、磷酸酶、树脂、芯片、maldi-tof(matrix-assisted laser desorption/ionization
–
time of flight,基质辅助激光解吸附电离飞行时间质谱)和/或sequenom massarray技术所需要的其他试剂和仪器;snp芯片包括基于核酸杂交反应的芯片、基于单碱基延伸反应的芯片、基于等位基因特异性引物延伸反应的芯片、基于“一步法”反应的芯片、基于引物连接反应的芯片、基于限制性内切酶反应的芯片、基于蛋白dna结合反应的芯片和/或基于荧光分子dna结合反应的芯片。微流控芯片技术确定runx2 c.1550delt的多态性或基因型所需的试剂和/或仪器包括dna提取微流控模块及试剂、dna扩增模块及pcr引物对、核酸标记模块及相关试剂、snp芯片及相关的杂交、洗脱和扫描微流控模块及试剂。
67.所述产品可为试剂或试剂盒,还可为由试剂或试剂盒和仪器组成的系统,如由引物和dna测序仪组成的系统,由pcr试剂和dna测序试剂和dna测序仪组成的系统,由taqman探针、pcr引物对、定量pcr仪和进行基因分型的模块以及taqman探针技术所需要的其他试剂组成的系统,由探针、pcr引物对以及连接酶检测反应(ldr)所需要的其他试剂和仪器组成的系统,由pcr引物对、单碱基延伸引物、芯片、pcr仪、进行基因分型的模块和/或sequenom massarray技术所需要的其他试剂和仪器组成的系统。
68.采用pcr引物扩增包括runx2 c.1550delt在内的基因组dna片段,以得到的pcr扩增产物为模板,采用所述检测runx2 c.1550delt的探针对得到的延伸产物的序列进行检测,确定runx2 c.1550delt的多态性(即等位基因)和基因型。所述pcr引物在序列上没有特殊要求,只要能扩增出包括runx2 c.1550delt在内的基因组dna片段即可。所述检测runx2 c.1550delt的探针可根据人基因组中runx2 c.1550delt上下游设计,所述探针的序列覆盖人基因组中runx2 c.1550delt的核苷酸。
69.本发明的又一具体实施方式中,所述实时荧光定量检测试剂中包含用于实时荧光定量检测runx2新突变位点基因表达的引物:
70.上游引物:5
’‑
ctcttcccaaagccagagtg-3’71.下游引物:5
’‑
gcagacagctcacaaaaccag-3’。
72.所述上游引物可以是如下a1)至a4)中的任一种单链dna:
73.a1)序列表中序列1所示的单链dna;
74.a2)在a1)的5
′
端和/或3
′
端添加一个或几个核苷酸得到的单链dna;
75.a3)与a1)或a2)限定的单链dna具有85%以上的同一性的单链dna;
76.a4)在严格条件下与a1)或a2)限定的单链dna杂交的单链dna;
77.所述下游引物可以是如下b1)至b4)中的任一种单链dna:
78.b1)序列表中序列2所示的单链dna;
79.b2)在b1)的5
′
端和/或3
′
端添加一个或几个核苷酸得到的单链dna;
80.b3)与b1)或b2)限定的单链dna具有85%以上的同一性的单链dna;
81.b4)在严格条件下与b1)或b2)限定的单链dna杂交的单链dna。
82.这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的序列1或序列2所示的核苷酸序列具有85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
83.所述严格条件是在2
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次15min;或,0.1
×
sspe(或0.1
×
ssc)、0.1%sds的溶液中,65℃条件下杂交并洗膜。
84.本发明的又一具体实施方式中,上述85%以上同一性,可为85%、90%或95%以上的同一性。
85.本发明的又一具体实施方式中,runx2 c.1550delt应用taqman(thermo fisher)基因分型平台进行分型检测。将包含snp位点区域的dna模板通过pcr技术扩增,再使用探针进行检测。
86.临床实例
87.如图1至图4所示,本发明实施例中,采集了先证者及其父亲、母亲的静脉血样,对静脉血dna进行全外显子测序(wes)。基因组dna片段、配对接头连接、扩增和纯化,外显子研究小组捕获所有人类外显子及其相邻内含子中的50bp碱基。dna文库捕获后进行扩增和纯化,然后通过illumina hiseq测序平台进行排列。
88.所有检测和序列分析均由北京福君基因生物技术有限公司提供。
89.患者(先证者)出生时正常,没有明显的临床症状。2岁时发现比同龄人生长缓慢,12岁时出现乳牙脱落,至15岁更替3颗牙齿。反应可,智力正常。在患者的体格检查中,观察到典型的颅锁骨发育不良(cleidocranial dysplasia,ccd)特征,如前额中线凹陷,肩下垂,身材矮小。进行了口腔x线检查,显示混合齿列及乳牙滞留、阻生牙,如图5所示。胸部x线检查发现右侧三分之二锁骨外侧发育不全,左侧三分之一锁骨外侧发育不全,锥形胸,脊柱侧凸,肋骨变形,如图6所示。15岁的患者被临床诊断为ccd。但患者父母及家族中人员均无ccd的临床表现。
90.ccd是一种累及骨骼和牙齿的常染色体显性遗传性疾病,为进一步明确诊断,对参与者(患者及患者父母)均进行了静脉血dna全外显子测序。如图1所示,在致病基因runx2基因编码区进行测序分析,患者检测到runx2(c.1550delt)突变体,但在其父母中检测不到。
91.利用phyer2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)对wt-runx2和w518gfs-runx2的结构构象进行综合分析和预测,此外,还使用了save5.0 3d结构查看器(https://saves.mbi.ucla.edu/)来可视化3d结构。
92.如图2、图3所示,c.1550delt突变聚集在高度保守的pst域的末端vwrpy。据预测,如图4所示,该位点的突变可能改变蛋白质的活性。进一步western blot分析证实,runx2(c.1550delt)突变基因并未导致runx2蛋白表达水平下降(如图7所示)。
93.为了验证runx2突变核定位,将pgfp runx2和pgfp-runx2-trp518glyfs质粒转染
到hek293t细胞中。原位免疫荧光显微镜观察runx2和trp518glyfs突变的亚细胞定位。runx2突变和野生型runx2均在hek293t细胞的细胞核中积累(如图8所示)。这表明runx2突变的亚细胞分隔不受影响。荧光素酶检测显示了runx2的反式激活活性和骨钙素启动子的转录调控。runx2(c.1550delt)变异诱导的骨钙素启动子活性低于runx2-wt(如图9所示)。
94.runx2移码突变分析:
95.分别采用线程法和重头预测法对wt-runx2和w518gfs-runx2结构构型进行综合分析和预测,并建立wt-runx2和w518gfs-runx2结构模型。
96.细胞培养和转染:
97.人胚胎肾293(hek293)细胞在添加10%胎牛血清(fbs,gbico,10099141)、青霉素(100iu/ml)和链霉素(100μg/ml)的dmem培养基(gbico,c11995500bt)中培养。用lipofectaminetm 2000(invitrogen公司)将携带所需基因的质粒转染细胞,研究蛋白表达及其他相关研究。
98.免疫印迹分析:
99.使用人胚胎肾293(hek293)细胞研究wt-runx2和w518gfs-runx2的表达。western blotting分析时,将细胞接种在10cm2的平板上。1天后,用pcdna3.1-gfp、pcdna3.1-wt-runx2-gfp和pcdna3.1 w518gfs-runx2-gfp转染hek293细胞。转染48小时后,培养细胞并进行sds-page检测。western blotting以兔抗gfp多克隆抗体(1:1000,protetech,50430-2-ap)和辣根过氧化物酶标记山羊抗兔igg多克隆抗体(1:1000,洪山金桥,zb-2301)为第二抗体。使用化学发光试剂盒(millipore,ca,usa,wbkls0050)检测信号。
100.荧光素酶报告分析:
101.在此检测前24小时,将hek-293细胞接种到96孔培养板中,10000/孔,200ul细胞悬液,37℃,5%co2培养。第2天,各组分别加入prl-tk和pgl3-basic-骨钙素启动子质粒,并分别转染不同浓度的pcdna3.1、pcdna3.1-wt-runx2、pcdna3.1-w518gss-runx2(0ug、1ug、2ug)。48h后进行后续双荧光素酶检测操作。
102.具体的,采用双荧光素酶报告基因检测系统并分析结果。
103.以上结果显示,runx2 c.1550delt错义突变是该常染色体显性遗传颅锁骨发育不良家系的致病突变,是新的颅锁骨发育不良的致病基因。
104.综上,本发明实施例提供的,颅锁骨发育不良的致病runx2新突变位点基因、多肽及应用,首先,由于颅锁骨发育不良有不同的表现型,轻症仅有牙齿异常,临床诊断困难,检测runx2基因可以进行基因诊断。其次,对已发现颅锁骨发育不良的患者家系进行遗传咨询,产前诊断,利于优生优育。
105.上述虽然结合附图对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明公开的技术方案的基础上,本领域技术人员在不需要付出创造性劳动即可做出的各种修改或变形,都应涵盖在本发明的保护范围之内。
