1.本发明涉及抗原肽技术领域,具体涉及一种肿瘤新生抗原多肽及其应用。
背景技术:
2.肿瘤新生抗原是指肿瘤细胞中因基因突变或病毒整合等事件编码产生的正常组织中不存在的多肽。新生抗原相比肿瘤相关抗原具有更好的特异性和免疫原性,可诱导更强的抗肿瘤免疫应答(chen p, fang q, chen d, et al. neoantigen vaccine: an emerging immunotherapy for hepatocellular carcinoma. world j gastrointest oncol, 2021, 13(7): 673-683.)。
3.肝细胞癌(hcc)是全球第六大常见恶性肿瘤,其预后普遍不佳。近年来,继hcc的传统治疗和靶向治疗之后,免疫和生物治疗为hcc的治疗提供了新的选择。基于新生抗原的免疫和生物治疗已在肝癌中取得一定疗效(liu c, shao j, dong y, et al. advanced hcc patient benefit from neoantigen reactive t cells based immunotherapy: a case report. front immunol, 2021, 12: 685126.)。
4.新生抗原具有高度异质性,其筛选鉴定及验证流程极其复杂。计算机算法是最常用的新生抗原挖掘手段,但是仅基于计算机算法进行挖掘所得结果假阳性较高。cheng y等使用计算机预测了322例候选肝癌新生抗原,但在使用四聚体(tetramer)染色实验进行验证时,发现仅有1例新生抗原特异性t细胞能够在患者体内被检测到,且仅约占cd8
+ t细胞的0.2%(占比极低)(cheng y, gunasegaran b,singh hd, et al. non-terminally exhausted tumor-resident memory hbv-specific t cell responses correlate with relapse-free survival in hepatocellular carcinoma. immunity, 2021, 54(8): 1825-1840.)。因此,目前发现的肝癌新生抗原,特别是具有良好免疫原性的肝癌新生抗原(肝癌优势新生抗原)极为有限,这极大限制了肝癌新生抗原作为肝癌临床治疗靶点的广泛应用。
技术实现要素:
5.本发明的目的是提供一种肿瘤新生抗原多肽,该新生抗原多肽可作为肝癌优势新生抗原,具有较高的免疫原性。本发明还提供该新生抗原多肽的应用及其相关产品。
6.本发明通过高通量测序对部分肝癌患者的基因变异等情况进行捕获,通过计算机算法预测其中与hla具有高亲和性的肝癌候选新生抗原,针对预测所得候选新生抗原,通过四聚体(tetramer)染色实验确定部分患者体内新生抗原特异性t细胞频率,进而挖掘肝癌优势新生抗原。
7.具体地,本发明提供以下技术方案:本发明提供一种抗原肽,所述抗原肽的氨基酸序列包含如seq id no.1所示的序列。
8.seq id no.1所示序列具体如下:fyafscyydl。
9.本发明提供的抗原肽的氨基酸序列可为如seq id no.1所示的序列,或者为在如seq id no.1所示的序列的两端添加一个或多个不影响抗原肽功能的氨基酸得到的氨基酸序列。
10.本发明提供一种衍生多肽,所述衍生多肽经酶解产生以上所述的抗原肽,或者通过在以上所述的抗原肽的n端或c端添加标签序列得到。
11.上述衍生多肽可通过在所述抗原肽的两端添加一个或多个能够在体内或体外通过酶解切除的氨基酸得到,由于经酶解切除后,仍能够得到以上所述的抗原肽序列,因此,上述衍生多肽具有与所述抗原肽相同的功能。
12.对于以上所述的标签序列,在不影响所述抗原肽的功能的情况下,本发明没有特殊限制。
13.本发明提供的抗原肽还可在上述氨基酸序列的基础上进行一种或多种修饰,这些修饰包括:与抗体、载体、配体、白蛋白、fc片段的偶联或融合,磷酸化修饰、peg化修饰、酰胺化修饰、糖基化修饰、生物素化修饰等。
14.本发明提供一种融合蛋白或免疫缀合物,其包含所述抗原肽或所述衍生多肽。
15.所述融合蛋白或免疫缀合物为所述抗原肽或所述衍生多肽与抗体、载体、配体、白蛋白、fc片段的偶联或融合得到。
16.本发明提供编码所述抗原肽或所述衍生多肽的核酸分子。
17.本发明还提供一种表达盒或载体,其包含所述核酸分子。
18.上述表达盒可通过将所述核酸分子与表达调控元件可操作性地连接得到。
19.上述载体可通过将所述核酸分子与质粒载体、转座子连接得到,或将所述核酸分子导入噬菌体或病毒得到。
20.本发明提供一种细胞,其包含或表达所述抗原肽或所述衍生多肽,或者包含所述核酸分子或所述表达盒或载体。
21.以上所述的细胞包括微生物细胞或动物细胞,其中,动物细胞不具备繁殖为动物个体的潜力,包括各种免疫细胞等。
22.本发明提供的抗原肽具有较高的免疫原性,能够高效诱导肿瘤特异性t细胞的产生,可作为肿瘤诊断、预防和治疗的靶标。
23.基于上述功能,本发明提供所述抗原肽或所述衍生多肽或所述融合蛋白或免疫缀合物或所述核酸分子或所述表达盒或载体或所述细胞如下任一种应用:(1)在制备肿瘤特异性t细胞或抗原递呈细胞中的应用;(2)在制备tcr-t细胞中的应用;(3)在制备肿瘤诊断试剂中的应用;(4)在制备用于预防或治疗肿瘤的药物中的应用。
24.本发明所述的肿瘤优选为肝脏肿瘤,更优选为肝癌。
25.本发明提供一种肿瘤特异性t细胞,其由所述抗原肽或所述衍生多肽诱导得到,且特异性靶向所述抗原肽。
26.以上所述的肿瘤特异性t细胞包含细胞毒性t细胞等。
27.以上所述的药物包括疫苗等。
28.本发明还提供一种肿瘤特异性t细胞的制备方法,所述方法包括:分离外周血单个
核细胞,将所述抗原肽或所述衍生多肽与外周血单个核细胞进行共培养,激活并扩增特异性靶向所述抗原肽的t细胞。
29.本发明提供一种药物组合物,其包含所述抗原肽或所述衍生多肽或所述融合蛋白或免疫缀合物或所述核酸分子或所述表达盒或载体或所述细胞。
30.以上所述的药物组合物还可包含药学上可接受的载体或辅料。
31.本发明还提供一种疫苗,其包含所述抗原肽或所述衍生多肽或所述融合蛋白或免疫缀合物或所述核酸分子。
32.上述疫苗可为肽疫苗、dc疫苗或核酸疫苗等。
33.上述药物组合物、疫苗可用于肿瘤的预防或治疗,尤其是肝脏肿瘤的预防或治疗。
34.本发明还提供一种诊断试剂,其包含所述抗原肽或所述衍生多肽或所述融合蛋白或免疫缀合物或所述核酸分子或所述表达盒或载体或所述细胞。
35.上述诊断试剂可用于肿瘤的诊断,尤其是肝脏肿瘤的诊断。
36.本发明的有益效果在于:本发明提供的肿瘤新生抗原具有优异的免疫原性,其诱导产生的特异性t细胞在cd
8+
t细胞中的占比达到52.21%,是一种肝癌优势新生抗原,该新生抗原可作为肝癌临床治疗或诊断的靶点,可制备为肽疫苗直接对存在该位点的肝癌患者以及其他肿瘤患者进行免疫治疗,也可负载dc制备为dc疫苗,对存在该位点的肝癌患者以及其他肿瘤患者进行免疫治疗。
附图说明
37.图1为本发明实施例1中quickswitch
™ꢀ
quant tetramer hla-a*24:02 kit-apc部分候选新生抗原多肽及野生抗原多肽置换效率的标准曲线。
38.图2为本发明实施例1中 quickswitch
™ꢀ
quant tetramer hla-a*24:02 kit-apc部分候选新生抗原多肽置换效率的标准曲线。
39.图3为本发明实施例1中采用流式细胞术检测患者(patient 190606)pbmc来源的野生抗原特异性t细胞的占比情况的阴性对照多肽(irrelevant peptide)的流式细胞检测结果。
40.图4为本发明实施例1中采用流式细胞术检测患者(patient 190606)pbmc来源的野生抗原(fyafsyyydl)特异性t细胞的占比情况的流式细胞检测结果。
41.图5为本发明实施例1中采用流式细胞术检测患者(patient 190606)pbmc来源的野生抗原(ryidtcmvif)特异性t细胞的占比情况的流式细胞检测结果。
42.图6为本发明实施例1中采用流式细胞术检测患者(patient 190606)pbmc来源的野生抗原(ryidtcmvi)特异性t细胞的占比情况的流式细胞检测结果。
43.图7为本发明实施例1中采用流式细胞术检测患者(patient 190606)pbmc来源的野生抗原特异性t细胞的占比情况的统计结果,其中,****, p 《 0.0001。
44.图8为本发明实施例1中采用流式细胞术检测患者(patient 190606)pbmc来源的候选新生抗原特异性t细胞的占比情况的阴性对照多肽(irrelevant peptide)的流式细胞检测结果。
45.图9为本发明实施例1中采用流式细胞术检测患者(patient 190606)pbmc来源的候选新生抗原(fyafscyydl)特异性t细胞的占比情况的流式细胞检测结果。
46.图10为本发明实施例1中采用流式细胞术检测患者(patient 190606)pbmc来源的候选新生抗原(rfidtcmvif)特异性t细胞的占比情况的流式细胞检测结果。
47.图11为本发明实施例1中采用流式细胞术检测患者(patient 190606)pbmc来源的候选新生抗原(rfidtcmvi)特异性t细胞的占比情况的流式细胞检测结果。
48.图12为本发明实施例1中采用流式细胞术检测患者(patient 190606)pbmc来源的候选新生抗原特异性t细胞的占比情况的统计结果,其中,****, p 《 0.0001。
49.图13为本发明实施例2中新生抗原特异性t细胞的细胞状态检测结果。
50.图14为本发明实施例2中新生抗原特异性t细胞的细胞毒作用检测结果。
51.图15为本发明实施例2中新生抗原特异性t细胞的细胞毒作用检测的统计结果。
具体实施方式
52.以下实施例用于说明本发明,但不用来限制本发明的范围。
53.实施例1 新生抗原多肽的获得和免疫原性检测本实施例提供一种新生抗原多肽,其氨基酸序列为fyafscyydl,该新生抗原多肽的发现过程和免疫原性检测过程主要如下:1、样本和细胞系:本发明所涉及肝癌患者就诊于北京大学人民医院并行肝脏切除术。在北京大学人民医院伦理委员会的批准下,收集和使用患者样本,且对患者或患者家属进行了告知,双方签署了知情同意书。肿瘤组织样本从手术室收集样本后,使用液氮运输箱将样本运输至实验室,保存于液氮罐中。患者血液于常温下运输至实验室,6 h内使用ficoll密度梯度离心法完成对外周血单个核细胞(pbmc)的分离,并保存于液氮罐中。实施例中使用的细胞系cos-7购自中国医学科学院基础医学研究所。
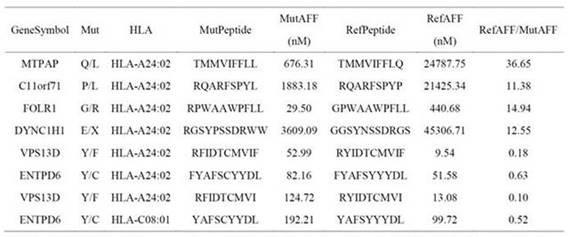
54.2、肝癌患者样本高通量测序及新生抗原预测提取肝癌患者pbmc中的dna,作为对照组。提取肝癌患者癌组织中的dna,作为实验组,进行高通量测序,分析得到突变多肽。接着提取肝癌患者癌组织中的rna进行高通量测序,对突变多肽在rna上的表达量进行分析,获取在rna层面有显著表达的突变多肽。然后使用netmhcpan-4.1算法(reynisson b, alvarez b, paul s, et al. netmhcpan-4.1 and netmhciipan-4.0: improved predictions of mhc antigen presentation by concurrent motif deconvolution and integration of ms mhc eluted ligand data. nucleic acids res, 2020, 48(1): 449-454.)对突变多肽与hla的亲和性进行预测。筛选出满足如下两种优化滤值中任一项的候选新生抗原:(1)refaff/mutaff ≥10;(2)mutaff ≤ 200 nm。最后剔除存在hla杂合性缺失的候选新生抗原。最终所得部分候选新生抗原的序列等信息如表1所示。
55.表1 基于计算机算法预测基因突变所产生的候选新生抗原多肽及其对应野生多肽序列及相关特征
注:表1中,genesymbol为基因名,mut为突变的碱基位点,hla为呈递新生抗原的hla型别,mutpeptide为突变多肽,mutaff为突变多肽亲和性,refpeptide为对应的野生多肽,refaff为野生多肽亲和性,refaff/mutaff为野生多肽亲和性和突变多肽亲和性的比值。
56.3、外周血来源的肝癌新生抗原特异性t细胞的培养分别合成候选新生抗原多肽及其对应野生抗原多肽,使用候选新生抗原多肽及其对应野生抗原多肽分别与外周血单个核细胞(pbmc)进行共孵育,从而激活并扩增患者特异性t细胞,具体方法如下:在6孔板中每孔加入2 ml的x-vivo 15培养基,添加5%人ab血清、1% p/s、100 iu/ml il2以及4 μm步骤2中预测所得候选新生抗原多肽或对应野生多肽,复苏肝癌患者的pbmc(2
×
106)于其中,每2-3天半量换液,至21天收集培养所得细胞,取部分进行流式细胞术分析其表型,剩余冻存待用。
57.4、tetramer制备及染色通过分别置换候选新生抗原多肽及其对应野生抗原多肽得到能够检测对应抗原特异性t细胞的tetramer抗体,用于tetramer染色实验,具体如下:(1)quickswitch
™ꢀ
quant tetramer肽置换所用的试剂盒为quickswitch
™ꢀ
quant tetramer hla-a*24:02 kit-apc(品牌:mbl,货号:tb-7302-k1),用dmso制备10 mm置换用候选肽溶液,分别继续用水稀释至2 mm,从-20℃取出1 mm参比肽恢复至室温。依据检测量分装quickswitch
™ꢀ
quant tetramer 50 μl/样至ep管中,分别加入1 μl上述候选肽和参比肽至ep管中,再加入1 μl多肽置换因子,用移液器混匀后避光于室温下孵育5 h,冷藏于4℃冰箱中待用。
58.(2)quickswitch
™ꢀ
quant tetramer肽置换效率检测根据需要,将10
×
assay buffer稀释至1
×
工作浓度,将捕获磁珠涡旋振荡60 s,取圆底96孔微孔板,根据需要每孔加入20 μl磁珠。对微孔进行编号,将2号孔加入5 μl 1
×
assay buffer,1号孔和3号孔加入5 μl tetramer,其余孔各加入5 μl已完成肽置换的tetramer。用铝箔避光后,将微孔板放置于平板振荡器上,以550 rpm的速度振荡45 min。每孔加入150 μl 1
×ꢀ
assay buffer,置于磁力板上静置5 min,去除上清液。保持微孔板置于磁力板上状态下,涡旋2 s,然后将微孔板从磁力板上取下。将25
×
exiting peptide antibody用1
×
assay buffer稀释到1
×
工作浓度。除1号孔加入25 μl 1
×
assay buffer,
其余各孔加入25 μl 1
×
exiting peptide antibody。用铝箔避光后,将微孔板放置于平板振荡器上,以550 rpm的速度振荡55 min。每孔加入150 μl 1
×
assay buffer,置于磁力板上静置5 min,去除上清液。保持微孔板置于磁力板上状态下,涡旋2 s,然后将微孔板从磁力板上取下。每孔加入200 μl 1
×
assay buffer重悬磁珠,同时将200 μl 1
×ꢀ
assay buffer加入孔x,再加入5 μl的捕获磁珠并混匀,作为磁珠对照品。进行流式细胞术分析,计算获得肽置换效率。
59.(3)quickswitch
™ꢀ
quant tetramer细胞染色实验按照常规方法制备细胞,使用pbs溶液重悬细胞,使浓度在1
×
10
6-7 cell/ml。每50 μl的细胞悬液中加入10 μl的clear back(品牌:mbl,货号:mtg-001),并在室温下反应5分钟,将细胞以60 μl/管分装到流式管中,每管分别加入10 μl不同的已成功置换肽的tetramer。在室温下孵育30分钟。加入cd8抗体,在4℃下孵育20分钟。加入适量的pbs,400 g,离心5分钟。小心地去掉上清液。将每管细胞用500 μl的pbs再次重悬,各加入20 μl 7aad。将样品于4℃避光保存,并在24小时内进行流式细胞术分析。
60.5、quickswitch
™ꢀ
quant tetramer hla-a*24:02 kit-apc候选新生抗原肽置换效率检测结果针对预测所得候选新生抗原,通过置换合成了能够检测对应新生抗原特异性t细胞及其对应野生抗原特异性t细胞的tetramer抗体,所用的试剂盒为quickswitch
™ꢀ
quant tetramer hla-a*24:02 kit-apc(品牌:mbl,货号:tb-7302-k1),并对各抗体的置换效率使用流式细胞学进行了检测,当tetramer抗体置换效率》75%,其用于特异性t细胞的检测结果可被广泛接受。野生型抗原多肽和上游实验突变位点预测得到的其他候选新生抗原多肽的置换效率标准曲线如图1所示,置换效率统计结果如表2所示,三个候选新生抗原多肽的置换效率标准曲线如图2所示,置换效率统计结果如表3所示。
61.表2和表3中,control #2为多肽置换效率100%的对照,negtive control为多肽置换效率0%的对照,reference peptide为试剂盒置换用多肽标准品,cmsptipsf作为后续实验的不相关肽(阴性多肽对照),表3中最后三行为三个候选新生抗原多肽的结果,表2中的最后三行为这三个候选新生抗原多肽对应的野生抗原多肽的结果,表2中的其他多肽为上游实验突变位点预测得到的其他候选新生抗原多肽。
62.表2 候选新生抗原多肽及野生抗原多肽置换效率计算结果
表3 候选新生抗原多肽置换效率计算结果基于上述结果,使用置换效率》75%的tetramer抗体对患者体内特异性t细胞频率进行检测。
63.6、quickswitch
™ꢀ
quant tetramer hla-a*24:02 kit-apc细胞染色结果使用候选新生抗原对应野生多肽5
’‑
fyafsyyydl-3’、5
’‑
ryidtcmvif-3’、 5
’‑
ryidtcmvi-3’,各4 μm(多肽溶于dmso,超量的dmso对细胞状态有影响)形成的混合物对患者(patient 190606)pbmc中的t细胞进行诱导,诱导时间为21天。随后使用能够检测对应野生抗原特异性t细胞的tetramer抗体进行检测发现,位于entpd6基因上的野生抗原(fyafsyyydl)特异性t细胞在cd8
+ t细胞中的占比<1%(图3、图4、图5、图6、图7)。同时,使用预测所得候选新生抗原多肽5
’‑
fyafscyydl-3’(位于entpd6基因上)、5
’‑
rfidtcmvif-3’和5
’‑
rfidtcmvi-3’,各4 μm(多肽溶于dmso,超量的dmso对细胞状态有影响)形成的混合物对患者(patient 190606)pbmc中的t细胞进行诱导,诱导时间为21天。随后使用能够检测对应新生抗原特异性t细胞的tetramer抗体进行检测发现,位于entpd6基因上的候选新生抗原(fyafscyydl)特异性t细胞在cd8
+ t细胞中的占比为52.21%,而候选新生抗原rfidtcmvif、rfidtcmvi特异性t细胞在cd8
+ t细胞中的占比均<1%(图8、图9、图10、图11、图12)。由此可见,候选新生抗原5
’‑
fyafscyydl-3’具有极佳的免疫原性,为肝癌优势新生
抗原。
64.实施例2 新生抗原特异性t细胞对携带新生抗原的靶细胞的细胞毒作用检测本发明通过置换候选新生抗原(fyafscyydl)多肽得到了能够检测对应抗原特异性t细胞的tetramer抗体,该tetramer抗体可用于检测肝癌患者或其他肿瘤患者中新生抗原(fyafscyydl)特异性t细胞。通过流式分选,本发明得到了1000个新生抗原(fyafscyydl)特异性t细胞,经体外培养14天(培养条件:x-vivo 15培养基 + 5%人ab血清 + 1%青霉素/链霉素 + 100 iu /ml il2 + 10 μl/ml美天旎t cell transact ea),扩增至约2
×
106,细胞状态的检测结果如图13所示。结果显示,分选所得t细胞活化状态极佳,后续可用于tcr-t测序,从而构建tcr-t细胞。
65.对新生抗原(fyafscyydl)特异性t细胞对携带该新生抗原的靶细胞的细胞毒作用检测,具体方法如下:采用能够共表达患者hla-抗原肽的单质粒系统(专利zl202010634108.1),该质粒载体包含人类白细胞抗原(hla)亚型连接区、抗原表位连接区以及位于两者之间的标签序列。将编码新生抗原多肽5
’‑
fyafscyydl-3’和对应野生多肽5
’‑
fyafsyyydl-3’的dna序列分别连入携带有hla-a*1101亚型序列载体的抗原表位连接区,进而将hla-a*1101分子和上述新生抗原或对应的野生抗原以慢病毒的形式分别转导于cos-7靶细胞中。
66.将新生抗原多肽5
’‑
fyafscyydl-3’与pbmc共孵育诱导而来的特异性t细胞作为效应细胞,对上述携带新生抗原和携带对应野生抗原的cos-7靶细胞分别进行共孵育。
67.将效应细胞于x-vivo 15培养基中静息10 h,以效应细胞:靶细胞 = 10:1的比例(细胞数分别为1
×
104和1
×
103)于酶联免疫斑点实验(elispot)平板中共孵育12 h,分析效应细胞释放ifn-γ情况,并进行对比,发现相对于野生多肽,新生抗原多肽5
’‑
fyafscyydl-3’可引起显著的细胞毒作用(图14和图15)。
68.虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
