1.本发明属于均相催化剂配体技术领域,具体涉及氮膦配体及其的制备方法和在芳基乙烯氢甲酰化反应中的应用。
背景技术:
2.氢甲酰化反应是指烯烃在过渡金属催化剂的作用下与一氧化碳和氢气发生氧化加成反应得到产物醛的化学过程。目前氢甲酰化反应是工业应用中规模最大的均相催化反应。氢甲酰化催化剂中的金属组分主要为rh,co以及ru。配体是氢甲酰化催化剂设计的核心问题,配体的结构影响此反应过程的化学选择性,区域选择性以及立体选择性。有机膦配体络合的rh金属催化剂在烯烃氢甲酰化反应中有着优异的催化性能。
3.对于rh络合物催化的烯烃氢甲酰化反应,水溶性膦配体与rh前驱体化合物形成的铑络合物可以在水/有机两相体系中催化烯烃氢甲酰化反应,实现了催化反应中产物与催化剂的快速分离。具有良好水溶性水溶性三苯基膦的三磺酸钠盐(tppts)作为氢甲酰化反应的膦配体,在碳原子数目小于5的低碳数烯烃的氢甲酰化反应中展现出良好的反应活性以及对产物醛的化学选择性。之后的研究中发展了不同结构的新型水溶性膦配体,如bisbis、binas、norbos、sulfonated-xantphos、膦改性的聚乙二醇基配体等,但上述配体在芳基乙烯氢甲酰化反应中存在反应活性差,区域选择性不高的问题。
4.基于芳基乙烯氢甲酰化反应的现状,本发明开发了一种水溶性氮膦配体,该类具有良好的水溶性,而且其独特的空间构型和电子效应能高效催化芳基乙烯在水-有机两相中高选择性的转化为相应的芳基丙醛。
技术实现要素:
5.本发明的目的在于提供一种在芳基乙烯氢甲酰化反应中催化性能优异的氮膦配体及其制备方法和在催化芳基乙烯氢甲酰化反应的应用。该氮膦配体作为催化剂,在芳基乙烯氢甲酰化反应中,可以高区域选择性获得异构醛产物2-芳基丙醛。
6.本发明提供的作为芳基乙烯氢甲酰化反应催化剂的氮膦配体,具有水溶性,能够在水-有机两相体系内高效转化芳基乙烯为醛,且对2-芳基丙醛有着良好的区域选择性。所述的氮膦配体,其结构式为:
[0007][0008]
其中,x为磺酸根或羧酸根的钠盐,钾盐或锂盐形式,r为甲基、乙基、异丙基、甲氧
基或苯基。
[0009]
作为优选,所述氮膦配体具有如下的结构式,其中r1为羧酸钠或磺酸钠官能团,连接在苯环c2到c6任意位置;r2为甲氧基,连接在苯环c2到c6任意位置。
[0010][0011]
本发明提供的上述氮膦配体的制备方法,包括两种:
[0012]
方法一,其合成反应式为:
[0013][0014]
具体步骤为:
[0015]
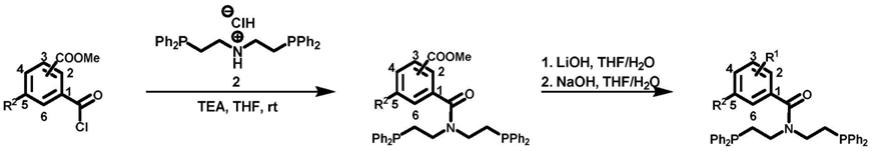
步骤一,在溶剂存在下,连接有取代基的苯甲酰氯类似物与化合物2(双(2-(二苯基膦基)乙基)胺盐酸盐)在碱催化剂的作用下发生偶联反应,生成中间产物苯甲酰胺;
[0016]
其中,-coome在苯环上c2-c6任意位置;取代基r2化学结构为-coome或h,连接位置为苯环上c2到c6任意位置;含有苯甲酰氯类似物与化合物2(双(2-(二苯基膦基)乙基)胺盐酸盐)的摩尔比例为1:1到1:10之间;所述催化剂为三乙胺tea,三乙胺tea与苯甲酰氯类似物的摩尔比例在0.1-1.5之间;所述溶剂为四氢呋喃,反应温度为零下30摄氏度到室温之间;
[0017]
步骤二,在溶剂存在下,中间产物苯甲酰胺在无机碱作用下发生水解反应,取代基的化学结构由-coome转变为相应的羧酸钠盐-coona,最终获得氮膦配体;
[0018]
其中,苯甲酰氯类似物中苯环上的取代基r1化学结构式:
[0019]
r1=-coona;
[0020]
第二种取代基的化学结构式:
[0021]
r2=-ome,取代基r2的连接位置为苯环上除r1之外的任意位置。
[0022]
特别地,当r1=2-coona,r2=h时,得到的氮膦配体记为l1;当r1=3-coona,r2=h时,得到的氮膦配体记为l2;当r1=3-coona,r2=5-ome时,得到的氮膦配体记为l3;当r1=4-coona,r2=h时,得到的氮膦配体记为l4。
[0023]
所述溶剂为四氢呋喃与水的混合溶剂,两者比例在1:10到10:1之间,所述催化剂为无机碱催化剂,具体选自lioh,naoh,koh的一种或者几种;
[0024]
方法二,其合成反应式为:
[0025]
[0026]
具体步骤为:
[0027]
步骤一,在溶剂存在下,由催化剂催化含有取代基的苯甲酰氯类似物与化合物2(双(2-(二苯基膦基)乙基)胺盐酸盐)反应,生成中间产物苯甲酰胺;
[0028]
其中,含有取代基的苯甲酰氯与化合物2(双(2-(二苯基膦基)乙基)胺盐酸盐)的物质的量比例为1:1到1:10之间;所述催化剂为三乙胺tea,三乙胺tea与苯甲酰氯类似物的摩尔比例在0.1-1.5之间;所述溶剂为四氢呋喃,反应温度为零下30摄氏度到室温之间;
[0029]
步骤二,在溶剂存在下,中间产物苯甲酰胺在无机盐的作用下发生水解反应,取代基的化学结构转变为相应的磺酸钠盐,最终获得氮膦配体。
[0030]
其中,苯环上的取代基r2和r3化学结构式为:r2=-ome,r3=-so3na;其中,取代基r3的连接位置为苯环上c2到c6任意位置,取代基r2的连接位置为苯环上除r3之外的任何位置。
[0031]
特别地,当r2=h,r3=2-so3na时,得到的氮膦配体记为l5;当r2=h,r3=3-so3na时,得到的氮膦配体记为l6;当r2=4-ome,r3=3-so3na时,得到的氮膦配体记为l7;当r2=h,r3=4-so3na,得到的氮膦配体记为l8;当r2=3-ome,r3=4-so3na时,得到的氮膦配体记为l9。
[0032]
所述溶剂为有机溶剂,在添加nai的条件下进行回流操作,即得到配体。本发明还提供前述氮膦配体在芳基乙烯氢甲酰化反应中的应用。实验表明,氮膦配体在芳基乙烯氢甲酰化反应中,以高区域选择性获得异构醛产物2-芳基丙醛,而且在反应结束后可高效分离回收。
[0033]
本发明还提供所述氮膦配体在芳基乙烯氢甲酰化反应中的应用,具体步骤为:
[0034]
(1)首先,制备催化剂:将铑金属化合物与氮杂卓氮膦配体在有机溶剂中原位络合形成rh金属络合物催化剂;其中:
[0035]
所述铑金属化合物选自铑的卤化物、羰基铑络合物、乙酰丙酮基铑络合物、环辛二烯基铑络合物的一种或多种;优选的铑金属化合物为rhcl3、rh(co)2acac、rh4(co)
12
或rh6(co)
16
,二苯基膦(1,5-环辛二烯)铑(i)二聚体,(1,5-环辛二烯)氯铑(i)二聚体中的一种或多种。
[0036]
所述铑金属化合物和氮膦配体的摩尔比为1:1-1:100(1:(1-100)),优选为1:10-1:50。
[0037]
(2)用所述rh金属络合物催化剂催化芳基乙烯氢甲酰化反应,所选的反应介质为水和有机相,水作为溶解催化剂的溶剂,所述有机相为苯、甲苯、间二甲苯、对二甲苯、邻二甲苯、均三甲苯、乙醚、氯代烷烃、环己烷、正己烷、甲基叔丁基醚中的一种或者多种。优选为甲苯、间二甲苯、对二甲苯、邻二甲苯、均三甲苯中的一种或者多种。其中:
[0038]
作为优选,所述芳基乙烯氢甲酰化反应中,芳基烯烃选自苯乙烯或芳基上存在取代基的芳基乙烯;芳基乙烯上取代基包括甲基、乙基、正丙基、异丙基、叔丁基、异丁基、甲氧基、氰基、羟基、卤素原子中的一种或几种。
[0039]
作为优选,所述芳基乙烯还包括具有如下特殊结构的芳基乙烯,依次记为化合物6、化合物7、化合物8、化合物9;其结构分别如下:
[0040][0041]
作为优选,所述的芳基乙烯氢甲酰化反应中,芳基乙烯在催化剂的作用下与一氧化碳和氢气的混合气发生反应,反应温度为40-120℃,优选为60-100℃;反应时间为0.5-48h;所述氢甲酰化反应的所需一氧化碳与氢气混合气的压力为0.1-5mpa,优选为1-4mpa。
[0042]
作为优选,所述的芳基乙烯氢甲酰化反应中,所述催化剂在反应体系中的用量以铑金属化合物的质量计为0.001-1%,优选为0.05-0.5%;一氧化碳和氢气的摩尔比为3:1-1:3,优选为2:1-1:2。
[0043]
本发明技术方案有以下效果:
[0044]
本发明所提供的氮膦配体,在芳基乙烯氢甲酰化反应中,与rh金属盐前驱体发生络合后高效催化芳基乙烯与一氧化碳和氢气的混合气反应,以高区域选择性获得异构醛产物2-芳基丙醛;基于该氮膦配体制备的催化剂,具有一个氮原子和两个磷原子作为电子供体与铑金属进行配位,可以提高芳基乙烯氢甲酰化反应产物中异构醛的比例,且该催化剂具有水溶性,在反应结束后可经相分离回收,其操作流程简单,分离的催化剂可以循环利用,适合工业化生产应用。
具体实施方式
[0045]
结合实施例进一步阐明本发明中氮膦配体及催化剂的制备方法,以及在芳基乙烯氢甲酰化反应中的应用,但需特别指出,发明的内容并不仅仅局限于以下实施例。
[0046]
实施例1,配体l1的制备
[0047][0048]
步骤1,反应瓶中加入1a(2mmol),2(2mmol)及dcm(4ml),在0℃条件下加入tea(8mmol),然后移到室温反应24h,蒸干溶剂进行柱分离得到产品(3a:83%).
[0049]
步骤2,thf(2ml)溶解3a(1mmol),然后将lioh
·
h2o(1.5mmol)溶解在1ml水中加入到反应瓶中,当原料反应完全后,加入5%hcl调节ph到2,蒸出thf后用dcm萃取,na2so4干燥,蒸干溶剂得到无色油状产物然后用thf(1ml)及h2o(1ml)溶解,加入naoh(1mmol),室温搅拌2h,蒸干溶剂得到产品(l1:95%).
[0050]
实施例2,配体l5的制备
[0051][0052]
步骤1,反应瓶中加入4a(2mmol),2(2mmol)及thf(4ml),在0℃条件下加入tea
(8mmol),然后移到室温反应24h,蒸干溶剂进行柱分离得到产品(5a:89%).
[0053]
步骤2,反应瓶中加入nai(1.5mmol),5a(1mmol)及丙酮,加热回流至反应完全,蒸干溶剂产品用丙酮洗涤得到(l5:83%).
[0054]
实施例3,配体l6的制备
[0055][0056]
步骤1,反应瓶中加入4b(2mmol),2(2mmol)及thf(4ml),在0℃条件下加入tea(8mmol),然后移到室温反应24h,蒸干溶剂进行柱分离得到产品(5b:85%).
[0057]
步骤2,反应瓶中加入nai(1.5mmol),5b(1mmol)及丙酮,加热回流至反应完全,蒸干溶剂产品用丙酮洗涤得到(l6:81%).
[0058]
实施例4,配体l8的制备
[0059][0060]
步骤1,反应瓶中加入4d(2mmol),2(2mmol)及thf(4ml),在0℃条件下加入tea(8mmol),然后移到室温反应24h,蒸干溶剂进行柱分离得到产品5d(90%).
[0061]
步骤2,反应瓶中加入nai(1.5mmol),5d(1mmol)及丙酮,加热回流至反应完全,蒸干溶剂产品用丙酮洗涤得到l8(82%).
[0062]
实施例5,配体l9的制备
[0063][0064]
步骤1,反应瓶中加入4f(2mmol),2(2mmol)及thf(4ml),在0℃条件下加入tea(8mmol),然后移到室温反应24h,蒸干溶剂进行柱分离得到产品(5f:87%).
[0065]
步骤2,反应瓶中加入nai(1.5mmol),5f(1mmol)及丙酮,加热回流至反应完全,蒸干溶剂产品用丙酮洗涤得到(l9:85%)。
[0066]
实施例6,氮膦配体在苯乙烯氢甲酰化反应中的应用
[0067]
本实施例采用并行的微型高压反应釜,釜内有编号1、2、3、4、5的反应管五只。在无水无氧氛围下,分别向1、2、3、4、5的反应管添加0.0015mmol(1,5-环辛二烯)氯铑(i)二聚体,然后向1、2、3、4、5的反应管添加各0.018mmol配体l1、l5、l6、l8、l9。后加入溶于1.5ml甲苯,在0.1mpa氮气中室温搅拌2h,得到催化剂溶液。在氮气保护下向1、2、3、4、5的反应管加入3mmol苯乙烯,1.5ml水,表面活性剂十二烷基苯磺酸钠(5mm)。通入4.0mpa合成气(co/h2=1:1)。加热至60℃搅拌反应24h,降温至室温放出气体,反应液上层为有机产品层,下层为催化剂水溶液层。有机产品层经稀释后经气相色谱分析,转化率大于99%,正构及异构产物
醛选择性大于99%。实验结果见表1。
[0068]
表1,不同配体在苯乙烯氢甲酰反应中的活性表现
[0069][0070]
实施例7,具有特殊结构的芳基乙烯氢甲酰化反应
[0071]
本例采用并行的微型高压反应釜,釜内有编号1、2、3、4、5的反应管五只。在无水无氧氛围下,将0.0015mmol(1,5-环辛二烯)氯铑(i)二聚体与0.018mmol氮膦配体l5溶于1.5ml甲苯中,在0.1mpa氮气中室温搅拌2h,得到催化剂溶液。在氮气吹扫下向1、2、3、4号反应管内分别加入3mmol特殊结构的芳基乙烯化合物6、7、8、9。然后分别加入1.5ml水,表面活性剂十二烷基苯磺酸钠(5mm)。通入4.0mpa合成气(co/h2=1:1)。加热至反应稳定后搅拌反应24h,降温至室温放出气体,反应液上层为有机产品层,下层为催化剂水溶液层。有机产品层经无水硫酸钠干燥后旋干,经快速柱层析即得目标产物醛。实验结果见表2。
[0072]
表2,具有特殊结构的芳基乙烯氢甲酰化反应结果
[0073][0074]
