人aurkb和tm4sf20基因甲基化位点的检测方法和应用
技术领域
1.本发明涉及肝癌治疗技术领域,尤其涉及人aurkb和tm4sf20基因甲基化位点的检测方法和应用。
背景技术:
2.肝癌是全球范围内致死率排名第三的恶性肿瘤,也是我国位居第二的癌症“杀手”。目前对肝癌的治疗主要以手术、放化疗为主,同时结合免疫治疗、中医等其他治疗方法;但由于对于肝癌的发病机制尚不明确及缺乏有效的治疗靶点,中后期的病人治疗效果不佳,生存率低。研究表明,肝癌发生发展是一个表观遗传学调控的过程。dna甲基化是目前表观遗传学研究的热点之一,它是指在dna甲基转移酶(dnamethyltransferase,dnmt)介导下,以s-腺苷蛋氨酸为甲基供体,将甲基基团转移到dna某些碱基上的过程。dna甲基化异常被认为是发生肿瘤的一个重要原因。研究肝癌相关基因特异性位点甲基化的改变,有助于了解肝癌的发病机理,为肝癌的预防和治疗提供有效的作用靶点。
3.aurkb基因位于17号染色体短臂1区3带,该基因编码丝氨酸/苏氨酸激酶的极光激酶亚家族的成员。编码这个亚家族其他两个成员的基因位于染色体19和20上。这些激酶通过与微管的结合参与有丝分裂和减数分裂过程中染色体排列和分离的调节。该基因的一个假基因位于8号染色体上。据arihiroaihara报道,aurkb基因的高表达与肝癌复发相关。但aurkb基因的dna特异性位点的甲基化与肝癌的关系目前国内外未见报道。
4.tm4sf20基因位于人2号染色体长臂3区6带,其编码的蛋白质是四次跨膜l6超家族的成员。这个家族的成员通过与整合素的相互作用在各种细胞过程中发挥作用,包括细胞增殖、运动和粘附。在人脑组织中,该基因在顶叶、枕叶、海马、脑桥、白质、胼胝体和小脑中呈高水平表达。敲除小鼠的同源基因导致神经行为表型,提示运动协调性增强。人类基因的缺失突变与特定的语言障碍-5有关。但该基因目前并无与癌症相关的研究报道,其启动子区甲基化异常与肝癌关系不明。
技术实现要素:
5.1.要解决的技术问题
6.本发明的目的是为了解决现有技术中尚未提出aurkb基因的dna特异性位点的甲基化与肝癌关系的问题,而提出的人aurkb和tm4sf20基因甲基化位点的检测方法和应用。
7.2.技术方案
8.为了实现上述目的,本发明采用了如下技术方案:
9.肝癌相关的人aurkb基因甲基化位点,甲基化芯片筛查原发性肝细胞癌与对应的癌旁组织中甲基化谱之间的差异,发现在原发性肝细胞癌的dna中,aurkb基因的一个位点cg11009596的甲基化水平明显低于癌旁组,差异具有显著性,该特异性位点所在的核酸序列为:
10.tgggcgctggtctcaccgcccccgccctgctatcgtccctacctccttccagccctgcggcgtgcgcg
caggccagcccaacggaccctctgatctacctgatcatctgcccactcccggcg;
11.下划线处碱基为甲基化位点的确切位置,该位点距转录起始位点215个碱基。
12.优选地,焦磷酸测序法定量检测人aurkb基因特异性甲基化位点cg11009596,特异性甲基化位点的引物包括pcr引物和甲基化测序引物,其中,所述pcr上游引物序列为:biotin-5
’‑
gagtgggtagatgattaggtagattaga-3’,下游引物序列为:5
’‑
caacacactaaccccaatctaaa-3’,甲基化测序引物序列为:5
’‑
ccctacctccttccaa-3’。
13.本发明还提出了人tm4sf20基因甲基化位点,甲基化芯片筛查原发性肝细胞癌与对应的癌旁组织中甲基化谱之间的差异,发现在原发性肝细胞癌的dna中,tm4sf20基因的一个位点cg20683151的甲基化水平明低于癌旁组,差异具有显著性,该特异性位点所在的核酸序列为:
14.gaactactcctaacagcagtagaaccagcaggctgaatccattgcaggatgtccatccttcgcagcaggtcatggtcacccctggctcagaaacgttgtcaaagtggctatgcttgcatggt;
15.该位点距转录起始位点11个碱基。
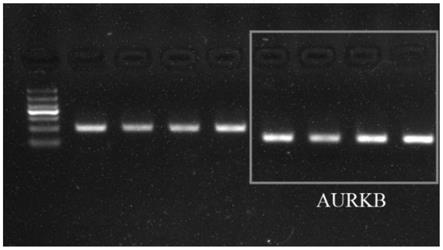
16.本发明还提出了焦磷酸测序法定量检测人tm4sf20基因特异性甲基化位点cg20683151,特异性甲基化位点的引物包括pcr引物和甲基化测序引物,所述pcr上游引物序列为:5
’‑
ttaattgagttaggggtgattatga-3’;下游引物序列为:biotin-5
’‑
aaaccaacaaactaaatccattaca-3’;甲基化测序引物序列为:5
’‑
gttaggggtgattatgat-3’。
17.优选地,人aurkb和tm4sf20基因甲基化位点的检测方法,包括如下步骤:
18.步骤1:分别提取原发性肝细胞癌组织及癌旁组织的基因组dna,分别对所有样本的基因组dna进行重亚硫酸盐转化,将未甲基化的胞嘧啶转变为尿嘧啶,而甲基化的胞嘧啶不变;
19.步骤2:以重亚硫酸盐转化后的人基因组dna为模板,针对位点(cg11009596、cg20683151)的上下游序列设计所述的pcr引物和测序引物;
20.步骤3:以重亚硫酸盐转化后的人基因组dna为模板,利用所述的pcr引物和测序引物进行焦磷酸测序,分析(cg11009596、cg20683151)位点的甲基化水平。
21.优选地,应用焦磷酸测序对tm4sf20基因cg20683151甲基化程度进行检测,原发性肝细胞癌与对应的癌旁组织存在显著性差异;该位点在原发性肝癌中甲基化程度显著降低,该位点甲基化定量信息的改变为了解肝癌的发病机理,寻找到有潜在临床意义的肿瘤预防及治疗靶点提供支持。
22.3.有益效果
23.相比于现有技术,本发明的优点在于:
24.(1)本发明中,发现了与原发性肝细胞癌人群相关基因的特异性dna甲基化位点,并针对该特异性位点设计焦磷酸测序pcr引物和测序引物,通过焦磷酸测序能对该特异性位点的甲基化进行快速准确的定量检测。
25.本发明中,经检测原发性肝细胞癌组中cg11009596位点的甲基化水平明显低于同一标本来源的癌旁组织,cg20683151位点的甲基化水平明显低于同一标本来源的癌旁组织,与甲基化芯片的筛测结果一致。表明cg11009596和cg20683151位点分别是aurkb和tm4sf20基因中的特异性位点。
附图说明
26.图1为aurkb基因pcr扩增产物的琼脂糖凝胶电泳图。
27.图2为aurkb基因焦磷酸测序结果图,其中框内柱状部分显现甲基化的位点及甲基化百分比;1为癌组织,2为癌旁组织。
28.图3为tm4sf20基因pcr扩增产物的琼脂糖凝胶电泳图。
29.图4为tm4sf20基因焦磷酸测序结果图,其中框内柱状部分显现甲基化的位点及甲基化百分比;1为癌组织,2为癌旁组织。
具体实施方式
30.下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。
31.实施例1:
32.参考图1-4,肝癌相关的人aurkb基因甲基化位点,甲基化芯片筛查原发性肝细胞癌与对应的癌旁组织中甲基化谱之间的差异,发现在原发性肝细胞癌的dna中,aurkb基因的一个位点cg11009596的甲基化水平明显低于癌旁组,差异具有显著性,该特异性位点所在的核酸序列为:
33.tgggcgctggtctcaccgcccccgccctgctatcgtccctacctccttccagccctgcggcgtgcgcgcaggccagcccaacggaccctctgatctacctgatcatctgcccactcccggcg;
34.下划线处碱基为甲基化位点的确切位置,该位点距转录起始位点215个碱基。
35.本发明中,焦磷酸测序法定量检测人aurkb基因特异性甲基化位点cg11009596,特异性甲基化位点的引物包括pcr引物和甲基化测序引物,其中,所述pcr上游引物序列为:biotin-5
’‑
gagtgggtagatgattaggtagattaga-3’,下游引物序列为:5
’‑
caacacactaaccccaatctaaa-3’,甲基化测序引物序列为:5
’‑
ccctacctccttccaa-3’。
36.本发明中,人tm4sf20基因甲基化位点,甲基化芯片筛查原发性肝细胞癌与对应的癌旁组织中甲基化谱之间的差异,发现在原发性肝细胞癌的dna中,tm4sf20基因的一个位点cg20683151的甲基化水平明低于癌旁组,差异具有显著性,该特异性位点所在的核酸序列为:gaactactcctaacagcagtagaaccagcaggctgaatccattgcaggatgtccatccttcgcagcaggtcatggtcacccctggctcagaaacgttgtcaaagtggctatgcttgcatggt;
37.该位点距转录起始位点11个碱基。
38.焦磷酸测序法定量检测人tm4sf20基因特异性甲基化位点cg20683151,特异性甲基化位点的引物包括pcr引物和甲基化测序引物,所述pcr上游引物序列为:5
’‑
ttaattgagttaggggtgattatga-3’;下游引物序列为:biotin-5
’‑
aaaccaacaaactaaatccattaca-3’;甲基化测序引物序列为:5
’‑
gttaggggtgattatgat-3’。
39.人aurkb和tm4sf20基因甲基化位点的检测方法,包括如下步骤:
40.步骤1:分别提取原发性肝细胞癌组织及癌旁组织的基因组dna,分别对所有样本的基因组dna进行重亚硫酸盐转化,将未甲基化的胞嘧啶转变为尿嘧啶,而甲基化的胞嘧啶不变;
41.步骤2:以重亚硫酸盐转化后的人基因组dna为模板,针对位点(cg11009596、cg20683151)的上下游序列设计所述的pcr引物和测序引物;
42.步骤3:以重亚硫酸盐转化后的人基因组dna为模板,利用所述的pcr引物和测序引物进行焦磷酸测序,分析(cg11009596、cg20683151)位点的甲基化水平。
43.本发明中,人aurkb和tm4sf20基因甲基化位点的应用,应用焦磷酸测序对tm4sf20基因cg20683151甲基化程度进行检测,原发性肝细胞癌与对应的癌旁组织存在显著性差异;该位点在原发性肝癌中甲基化程度显著降低,该位点甲基化定量信息的改变为了解肝癌的发病机理,寻找到有潜在临床意义的肿瘤预防及治疗靶点提供支持。
44.特异性位点分析
45.本发明中,用infiniumhumanmethylation27beadchip甲基化芯片筛查原发性肝细胞癌与对应的癌旁组织中甲基化谱之间的差异,发现在原发性肝细胞癌的基因组dna中,aurkb基因启动子区一个位点(该位点在上述甲基化芯片中的编号为(cg11009596)的甲基化水平明显低于癌旁组,tm4sf20基因启动子区一个位点(cg20683151)的甲基化水平明显低于癌旁组。
46.aurkb基因特异性位点所在的序列为(seqidno.1):tgggcgctggtctcaccgcccccgccctgctatcgtccctacctccttccagccctgcgg[cg]tgcgcgcaggccagcccaacggaccctctgatctacctgatcatctgcccactcccggcg
[0047]
tm4sf20基因特异性位点所在的序列为(seqidno.5):gaactactcctaacagcagtagaaccagcaggctgaatccattgcaggatgtccatcctt[cg]cagcaggtcatggtcacccctggctcagaaacgttgtcaaagtggctatgcttgcatggt
[0048]
为检测该筛查结果的准确性,设计相关特异性引物,利用焦磷酸测序法对该特异性位点的特异性进行验证。
[0049]
本发明中,人基因组dna提取包括以下步骤:
[0050]
s1.采集42例原发性肝细胞癌患者的癌组织及癌旁组织,提取每个样本的基因组dna,操作按照德国qiagenqiaampdnaminikit(cat.no.51304)说明书进行。
[0051]
s2.对获取的基因组dna样本进行琼脂糖凝胶电泳分析。
[0052]
s3.重亚硫酸盐转化
[0053]
使用德国qiagen公司转化试剂盒epitectfastdnabisulfitekit(cat.no.59824)进行重亚硫酸盐转化,步骤按照该试剂盒说明书进行。
[0054]
s4.引物设计以经重亚硫酸盐转化后的基因组dna为模板,使用qiagen公司pyromarkassaydesign2.0软件设计焦磷酸测序pcr引物及测序引物,并由上海生工生物工程有限公司合成。
[0055]
本发明中,焦磷酸测序包括以下步骤:
[0056]
s1.pcr扩增:以重亚硫酸盐转化后的基因组dna为模板,利用下列条件进行pcr反应,体系如下:
[0057][0058]
反应条件:95℃15min;94℃30sec,60℃1min,72℃1min(45个循环);72℃10min。
[0059]
s2.反应完成后对pcr产物进行2%琼脂糖凝胶电泳,验证产物的特异性与准确性,见图1、3。
[0060]
s3.焦磷酸测序:在德国qiagenpyromarkq48id平台上,进行焦磷酸测序,具体步骤按仪器说明书进行。
[0061]
本发明中,dna甲基化检测结果甲基化结果显示:cg11009596位点癌旁组的甲基化水平明显高于癌组,该位点癌旁组甲基化平均水平为16.00
±
6.12,癌组甲基化平均水平为2.06
±
0.60(p《0.01);cg20683151位点癌旁组的甲基化水平明显高于癌组,该位点癌旁组甲基化平均水平为91.84
±
1.79,癌组甲基化平均水平为58.53
±
23.35(p《0.01)。测序图分别见图2、4。
[0062]
本发明中,研究结果发现原发性肝细胞癌中,aurkb基因cg11009596位点的甲基化水平明显低于癌旁组,tm4sf20基因cg20683151位点的甲基化水平明显高于癌旁组。因此,本发明针对位点cg11009596和cg20683151设计的焦磷酸测序pcr引物和测序引物可用于原发性肝细胞癌中两位点的甲基化水平进行定量检测。
[0063]
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
