ldha在心脏成纤维细胞中的应用
技术领域
1.本发明属于细胞工程和基因工程技术领域,涉及ldha在心脏成纤维细胞中的应用。
背景技术:
2.纤维化的广义的定义为细胞外基质的积累,纤维化可以分为修复性纤维化和反应性纤维化。心肌梗死后的组织修复即为替代性心肌纤维化即修复性心肌纤维化;而非缺血性心肌病导致的细胞外基质积累及代谢过程的改变即为反应性心肌纤维化。心肌梗死后形成的替代性心肌纤维化中,交联型胶原纤维的沉积形成瘢痕为心脏提供强有力的结构支撑,而在高血压心脏病,糖尿病心脏病,肥厚性心脏病等长期适应不良信号时所导致的反应性纤维化,表现为血管周围和间质的纤维化。心肌纤维化虽然能在细胞丢失时提供结构性支撑,但心肌纤维化引起的心肌结构改变,会导致心功能障碍的进一步发展,诱发心率失常,也会使心衰患者的病情恶化。成纤维化细胞分化为肌成纤维细胞后,细胞外基质大量沉积,在梗死处形成瘢痕,维持心脏的稳定结构。而在间质性纤维化中,纤维化的激活在没有心肌细胞死亡的情况下即可以发生,成纤维细胞激活转化为肌成纤维细胞后α-sma表达增加,细胞外基质弥漫性的沉积在心肌间质中,影响心脏的舒张功能。
3.心肌纤维化是指在各种病理因素的刺激下,心脏中的成纤维细胞过度增殖,并且转化为α-sma阳性的肌成纤维细胞。肌成纤维细胞是细胞外基质的主要来源,细胞外基质的主要成分是i型胶原蛋白和iii型胶原蛋白。细胞外基质的过度沉积会改变心脏原有的正常结构,发生心肌重塑。心肌纤维化是多种心脏疾病的终末期表现,导致心肌僵硬度增加、心腔扩大、收缩和舒张功能障碍。心肌重塑导致心房颤动、恶性心律失常、心力衰竭甚至心源性猝死等恶性心血管事件的发生。
4.乳酸脱氢酶(ldha)是一种通过将丙酮酸和nadh转化为乳酸来催化沃伯格效应最后一步的酶。在肿瘤中,有助于上皮-间质转化(emt)和转移。据报道,在许多类型的肿瘤中都存在上调的ldha与不良预后相关。ldha减少显著抑制细胞转化,显著延迟肿瘤形成。有研究表明ldha与nadh结合,通过稳定软骨细胞中关键的促炎介质iκb-ζ,促进活性氧(ros)诱导分解代谢变化。而ros的增加于心肌纤维化及心肌肥厚作用相关,ldha在心脏中的作用尚无进一步的研究。
5.自噬是真核生物细胞内特有的一种高度保守的代谢过程,主要指溶酶体对细胞内结构(细胞器、长寿命蛋白质或核酸等生物大分子)进行降解,为细胞重建、再生、修复提供原材料,从而实现细胞的再循环及再利用。自噬的主要作用是清除、降解细胞内受损的细胞结构、衰老的细胞器和不再需要的大分子等,并选择性的移除受损的线粒体。因此,自噬与细胞的生长、发育及细胞稳态的平衡的维持密不可分。自噬有助于细胞产物的合成以及维持代谢的平衡,是细胞在缺乏营养的状态下获取能量的主要机制。自噬在心肌细胞中起着重要作用,主要原因包括:
①
心肌细胞是一种长寿命的分裂后期细胞,分化、再生能力几乎没有,因此在心肌细胞中自噬对于维持心脏功能和活力具有重要的作用。
②
如前文所述,自
噬可以选择性清除受损的线粒体,心肌细胞富含线粒体,故自噬对心肌病理生理状态具有重要意义,具有心肌保护作用。
③
心脏疾病患者中,心肌细胞凋亡水平很低,心脏疾病患者心肌细胞的死亡与ⅱ型程序性细胞死亡一自噬性细胞死亡有关。
技术实现要素:
6.本发明针对传统心肌纤维化研究过程中存在的问题提出ldha基因作为靶点在制备抗心肌纤维化药物中的应用。
7.为了达到上述目的,本发明是采用下述的技术方案实现的:尼古丁诱导心肌纤维化,并以浓度依赖的方式加剧心肌纤维化的发生。本发明提出ldha蛋白在尼古丁诱导心肌纤维化的过程中发挥作用。
8.本发明提出通过基因工程技术改变ldha基因在成纤维细胞的表达量,能够影响成纤维细胞增殖、迁移、胶原合成与分化,所述ldha基因的序列为核苷酸序列表中的seq id no.1。
9.本发明的同时提供抑制ldha基因的sirna,序列如下:si-r-ldha_001 :5
’‑
gcttgtgccatcagtatct-3’;si-r-ldha_002 :5
’‑
gggagagatgatggatctt-3’;si-r-ldha_003 :5
’‑
tcccatttccaccatgatt-3’。
10.在心脏成纤维细胞中补充抑制ldha基因的sirna片段后,能够抑制心肌成纤维细胞的增殖与分化,抑制胶原蛋白沉积,起到抗纤维化的作用。
11.与现有技术相比,本发明的优点和积极效果在于:成纤维细胞的增殖、迁移、分化与合成胶原的能力是影响心肌纤维化的重要机制,本发明第一次提出并证实ldha在心脏成纤维细胞中参与影响以上进程。因此,本发明提出了心肌纤维化治疗的新靶点,对于心肌纤维化在生物基因手段方面的诊断和防治提供了新的思路和方法。
附图说明
12.图1为darts实验结果。
13.图2 为qrt-pcr检测sirna对于ldha的敲除效率结果。
14.图3为敲低ldha对尼古丁诱导的细胞增殖活力影响结果。
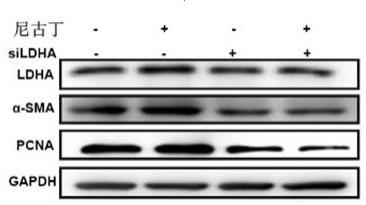
15.图4 为western blot检测敲低ldha及尼古丁刺激对于心脏成纤维细胞活化指标α-sma和增殖细胞核抗原pcna的影响结果。
16.图5 为western blot检测敲低ldha对于自噬的影响。
17.图6为ldha的抑制剂fx11预处理后,western blot检测成纤维细胞增殖和活化相关指标pcna和α-sma的表达情况。
18.图7为western blot检测ldha的抑制剂fx11对尼古丁引起的自噬阻断的影响。
具体实施方式
19.为了能够更清楚地理解本发明的上述目的、特征和优点,下面结合具体实施例对本发明做进一步说明。需要说明的是,在不冲突的情况下,本技术的实施例及实施例中的特
征可以相互组合。
20.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是,本发明还可以采用不同于在此描述的其他方式来实施,因此,本发明并不限于下面公开说明书的具体实施例的限制。
21.实施例11.材料准备。
22.(1)实验前准备:将培养瓶采用紫外消毒30 min。
23.(2)取乳鼠的心脏,剪成1-3 mm3的小碎块,ii型胶原酶进行消化3次,在培养瓶中进行差速贴壁1.5小时,以去除心肌细胞。
24.(3)弃掉培养瓶中的上层清液,加入dmem培养基,在37℃、5%co2培养箱中培养24 h。
25.其中,乳鼠为出生2-3天的wistar大鼠,购自济南朋悦动物繁育有限公司。培养基为美国的gibco的高糖dmem培养基。
26.2.心脏成纤维细胞的接种和转染。
27.(1)倒置显微镜下观察心脏成纤维细胞汇合度达到90%时,去掉培养基,用含1%双抗(双抗为青霉素和链霉素)的pbs清洗细胞2次。
28.(2)用0.25%胰酶消化2 min,显微镜下观察到细胞大部分变圆时,加入10%fbs的dmem培养液终止消化。
29.(3)用巴氏吸管轻轻吹打细胞,制成细胞悬液并转移至15ml离心管,800 rpm离心5 min。
30.(4)用完全培养基重悬细胞沉淀,完成细胞计数后,均匀种到每孔中,放置于培养箱中继续培养。
31.(5)24小时后观察细胞的形态及汇合度,细胞状态良好且汇合度达到70%~90%时,可用于转染。取第3代心脏成纤维细胞进行转染,转染步骤参照赛默飞公司的lipofectamine 2000转染试剂盒的说明书进行。
32.(6)转染后,细胞置于37℃,5%的二氧化碳培养箱中继续培养。
33.(7)转染后48 h收集细胞。
34.3.药物亲和反应的靶点稳定性实验(darts)。
35.(1)m-per 裂解液的配制(1ml):10μl蛋白酶抑制剂cocktail、50 μl的1 m氟化钠、100μl的100 mmβ-甘油磷酸钠、100μl的50mm 焦磷酸钠、10μl的200mm正钒酸钠、730μl的m-per。
36.(2)预冷pbs洗涤细胞 2 次后,每孔加入 200 μl pbs,用细胞刮刮取6个孔的细胞至1.5 ml ep 管,1000 rpm 4 ℃离心5 min,弃pbs后加入500μlm-per裂解液,用枪头吹打后置于冰上30 min,中间可用枪头吹打2-3次。
37.(3)13000rpm、4 ℃下离心10 min。
38.(4)离心结束后取上清,测定浓度。
39.(5)将 500μl 蛋白平均分装到两个1.5 ml 离心管,其中一管加入2μl超纯水,另一管加入2μl古丁原液,避光摇床室温孵育 1-1.5h。
40.(6)tnc 的配制:500μl的1 m ph 8.0的 tris-hcl 、100μl的5 m 氯化钠、100 μl
的1 m氯化钙、300μl超纯水混合得到tnc储液,使用时用超纯水稀释10倍。
41.(7)将每管蛋白分为 4 管,每管 50 μl。准备四个空 离心 管,配制不同浓度的蛋白酶。按照蛋白酶(储存浓度为 10 mg/ml,每管 2 μl 加入):蛋白=0、1 : 800、1 : 400、1 : 200 的量分别加入相对应的蛋白管内,对照组加入 2 μl 稀释后的tnc储液。室温孵育 15 min 后,每管加入1 μl cocktail冰上孵育5 min终止消化。
42.(8)加入蛋白上样缓冲液,水浴锅煮沸5-10 min后-80℃保存。
43.消化完成后,跑胶,然后进行银染或考马斯亮蓝染色,切下差异条带送质谱检测。根据分子量和功能,筛选出与功能相关的靶蛋白。结果如图1所示。从图1中可以看出,尼古丁能够与ldha结合抑制其被蛋白水解酶降解。
44.实施例2qrt-pcr实验。
45.用预冷pbs清洗贴壁心脏成纤维细胞2~3次,倾斜细胞培养皿,吸净pbs,加入1 ml的trizol组织液,裂解细胞5 min,直至显微镜下观察到细胞全部裂解后,用枪头吹打均匀并转移到1.5 ml的rnase-free 离心管中。
46.每管加入200μl氯仿,剧烈震荡15~30 s,静置5 min,然后12000 rpm,4 ℃下,离心10 min。小心吸取上层无色液相。将上层液相移入新的1.5 ml 离心管中,加入等体积异丙醇溶液,轻轻上下颠倒摇匀10次,冰上静置10 min。然后12000 rpm,4℃下,离心15 min。弃去上清,沿管壁加入预冷的1ml,75%乙醇-depc以洗涤rna沉淀,12000rpm,4℃,离心5 min后去掉上清。将液体吸干,室温自然干燥5~10min,避免rna沉淀干燥过度。根据沉淀量,加入约20μl的depc水以溶解rna沉淀。分光光度计测定rna浓度和纯度。
47.逆转录反应采用takara公司的primescripttmrtmastermix(perfectreal time)kit。qrt-pcr分别采用thermo公司的sybrgreenqrt-pcrmastermix(2x),rox solutionprovidedmix。以2
‑△△
ct
法计算mrna与mirna的相对表达量。
48.qrt-pcr引物序列如下:β-actin:正向5
’‑
cgttgacatccgtaaagacc-3’,反向5
’‑
tagagccaccaatccacaca-3’;col1:正向5
’‑
ccagcggtggttatgacttca-3’,反向5
’‑
tgctggctcaggctcttga-3’;col3:正向5
’‑
ggtcactttcactggttgacga-3’,反向5
’‑
ttgaatatcaaacacgcaaggc-3’;a-sma:正向5
’‑
catccgaccttgctaacgga-3’,反向5
’‑
gtccagagcgacatagcaca-3’;fn:正向5
’‑
ggatcccctcccagagaagt-3’,反向5
’‑
gggtgtggaagggtaaccag-3’;
ldha:正向5
’‑
atctggattcggctcggttc-3’,反向5
’‑
aacacaactggaccaactgga-3’。
49.结果如图2所示,用靶向ldha的3个sirna片段si-r-ldha_001(s1)、si-r-ldha_002(s2)、si-r-ldha_003(s3)及对照scramble sirna(ctr)转染细胞,发现三个片段均能不同程度的抑制ldha的表达。3个sirna片段序列分别如下:si-r-ldha_001:5
’‑
gcttgtgccatcagtatct-3’,si-r-ldha_002:5
’‑
gggagagatgatggatctt-3’,si-r-ldha_003:5
’‑
tcccatttccaccatgatt-3’。
50.上述3个sirna片段由广州市锐博生物科技有限公司合成。
51.qrt-pcr结果显示,三个sirna片段中si-r-ldha_001显著抑制ctgf、α-sma、fn、col1与col3在mrna的表达,即ldha能够促进心脏成纤维细胞中α-sma的mrna的表达。
52.实施例3心脏成纤维细胞增殖实验。
53.本实施例中细胞增殖实验参照广州市锐博生物科技有限公司的cell-lighttm edu apollo 567 in vitro kit进行。
54.具体步骤如下:用细胞培养基按1000:1的比例稀释edu溶液,得到浓度为50μm的edu培养基。每孔加入50μl浓度4%多聚甲醛的pbs固定液,室温孵育30 min后,去除固定液。
55.每孔再加入100μl浓度4%多聚甲醛的pbs固定液,脱色摇床清洗5min,然后去除固定液。
56.每孔再加入100μl的1
×
apollo染色反应液,避光室温下脱色摇床孵育30 min后,弃染色反应液。
57.每孔再加入100μl渗透剂(0.3% triton x-100的pbs)脱色摇床清洗2~3次,每次5min,弃渗透剂。
58.用去离子水稀释hoechst3342反应液(1:100),避光保存。
59.每孔加入100μl稀释后的hoechst3342反应液,避光、室温、脱色摇床孵育30min后,弃染色反应液。
60.每孔加入150μl的pbs清洗1~3次;然后每孔加入100μl的pbs保存待用;染色完成后,用荧光显微镜进行照片采集。
61.免疫荧光检测a-sma和pcna:首先,成纤维细胞用4%多聚甲醛固定15分钟;打孔使用0.3% triton x-100渗透3分钟;用磷酸盐缓冲盐水 (pbs) 洗涤3次,每次5分钟。封闭10% 驴血清封闭膜后,室温下保持40分钟。敷一抗将细胞与原代培养 a-sma 和 pcna 抗体(1:200,稀释)在 4
°
c 过夜。pbs洗涤3次,每次5分钟。将细胞采用荧光二抗孵育40分钟,荧光二抗为alexa fluor 488(驴抗兔)igg和 alexa fluor 568(驴抗小鼠),分别1:200稀释,荧光二抗购自invitrogen,美国。
62.结果如图3所示,500 nm的尼古丁刺激心脏成纤维细胞,edu检测、cck8实验及免疫荧光细胞核增殖抗原(pcna)均验证了尼古丁导致呈现细胞增殖,但明显受到抑制。图3证明尼古丁能通过ldha诱导心肌纤维化。尼古丁预处理显著促进心脏成纤维细胞的增殖,敲低
ldha能够抑制尼古丁的作用。
63.实施例4western blotting实验。
64.(1)心脏成纤维细胞总蛋白的提取。
65.细胞转染后48h后,用pbs清洗细胞3次,6孔板细胞每孔加入80μl ripa裂解液进行细胞裂解,细胞裂解液转移到1.5ml的离心管中。12000 rpm,4℃离心15 min,取上清至新的1.5 ml的离心管中,低温保存防止蛋白降解。
66.sds-page电泳:bca法蛋白样品初步定量后,每组取20μg总蛋白和5
×
上样缓冲液按5:1混合,煮沸10min。sds-page电泳至溴酚蓝刚出胶底部止。
67.(2)转膜。
68.甲醛浸泡聚偏二氟乙烯膜(pvdf膜)15 s,清水冲洗后与吸附滤纸一起用转膜液浸泡。从正极开始依次按照吸附滤纸(1张)-凝胶-pvdf膜-吸附滤纸(1张)顺序叠放,合上负极。装入电泳槽中。转膜过程在冰上进行,恒压80 v,根据目的蛋白不同选择转膜时间。
69.(3)蛋白检测与结果分析。
70.转膜完成后,将膜放入1
×
pbst缓冲液中漂洗,用5%脱脂奶粉室温下封闭2 h。1
×
pbst缓冲液洗膜,用抗体稀释液稀释所需抗体,4℃孵育过夜。回收一抗(ldha一抗;α-sma一抗;上述一抗均为常规市售产品),1
×
pbst缓冲液洗膜。室温孵育二抗(二抗:辣根过氧化物酶标记山羊抗兔igg-hrp,购自中杉金桥)2h。1
×
pbst缓冲液洗膜。用ecl化学发光法进行检测,用bio-rad曝光系统曝光并采集图片。使用image j进行电泳条带灰度值测定。
71.结果如图4,从图4中可以看出,尼古丁预处理能够显著诱导a-sma和pcna的表达,提示心脏成纤维细胞活化和增殖能力显著增加。敲低ldha后,能显著改善尼古丁诱导的心脏成纤维细胞的活化和增殖。
72.为了进一步检测ldha对于尼古丁在心肌纤维化的调控作用是否通过调控自噬来实现的,进一步通过western blot检测敲低ldha后自噬的情况。结果如图5所示,尼古丁刺激后诱导自噬标志蛋白lc3-ii和自噬特异性底物p62的表达增加,提示自噬流阻断。敲低ldha,能够抑制尼古丁对于自噬流的阻断。
73.进一步加入ldha的抑制剂fx11(型号hy-16214,购自mce公司),western blot检测成纤维细胞中pcna和α-sma的表达,以及自噬阻断情况。结果如图6和图7所示。从图6可以看出,加入ldha的抑制剂fx11预处理后,尼古丁诱导的pcna和α-sma增加显著被改善,提示fx11能够改善尼古丁诱导的成纤维细胞增殖和活化。从图7中可以看出,加入ldha的抑制剂fx11预处理后,能够改善尼古丁引起的自噬阻断,减少lc3和p62在胞内的聚集。
74.各实施例未特殊说明之处,采用本领域常规操作,未特殊说明的材料,均为市售试剂。
75.以上所述,仅是本发明的较佳实施例而已,并非是对本发明作其它形式的限制,任何熟悉本专业的技术人员可能利用上述揭示的技术内容加以变更或改型为等同变化的等效实施例应用于其它领域,但是凡是未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与改型,仍属于本发明技术方案的保护范围。
