一种利用大肠杆菌生物合成吲哚-3-甲基芥子油苷i3m的方法
技术领域
1.本发明涉及生物技术领域,特别是涉及一种利用大肠杆菌生物合成吲哚-3-甲基芥子油苷i3m的方法。
背景技术:
2.芥子油苷(glucosinolates,简称gs)又被称作硫代葡萄糖苷,是一种含有氮元素和硫元素的植物次生代谢产物,种类繁多。自然界中芥子油苷主要分布在十字花科(brassicaceae)植物中,大部分属于十字花科芸薹属(brassica),但在其他科中也有极少量的分布,一些常见的芸薹属食用蔬菜中大多含有芥子油苷。芥子油苷及其降解产物具有多种生物活性,是芸薹属蔬菜独特风味的主要来源,主要降解产物异硫代氰酸盐类不仅具有抗癌活性,而且在植物的抗虫抗病害等防卫反应中也具有重要作用。
3.芜菁(brassica rapa var.rapa)是十字花科芸薹属二年生草本植物,肉质块根,外皮白、黄或是紫红色,原产于欧洲地区,如今在中国已有广泛种植,块根可熟食或当饲料,具有耐贫瘠低温等特征,在高寒地区用以代粮。由于芜菁中含有较为丰富的芥子油苷,其中吲哚族芥子油苷的含量在同属蔬菜中具有一定的优势,因此是研究芥子油苷合成的理想材料。
4.大肠杆菌表达系统近年来在重组蛋白类药物和基因工程疫苗生产方面得到了广泛的应用(proffitt,2012;qiao et al.,2020),除此之外,大肠杆菌表达系统也常应用于天然化合物或者药物前体的异源合成(martin et al.,2003;zhao et al.,2013)。大肠杆菌表达系统具有良好的应用前景,且用于改善其表达效率降低包涵体形成概率的技术也在不断进步,大肠杆菌表达系统在合成生物学相关的生产研究领域中依旧占有重要地位。
5.有文献报道了在大肠杆菌中导入芳香族芥子油苷的合成通路,并且加入了硫元素供应途径,使得脱硫芥子油苷前体能够在磺基转移酶的作用下硫酸化形成了完整的芳香族芥子油苷(petersen et al.,2019),说明使用大肠杆菌作为生物合成工程菌株进行芥子油苷的合成可行且具有较大的应用价值,然而关于吲哚族芥子油苷在大肠杆菌中的合成还未见报道。
技术实现要素:
6.本发明的目的在于提供一种利用大肠杆菌生物合成吲哚-3-甲基芥子油苷i3m的方法,能够使用芜菁基因构建载体,并在bl21(de3)中成功诱导合成i3m。
7.为解决上述技术问题,本发明提供了以下技术方案:
8.本发明提供了一种利用大肠杆菌生物合成吲哚-3-甲基芥子油苷i3m的方法,所述方法包括以下步骤:
9.将目的基因cyp79b2、cyp83b1和gstf9进行优化构建得到载体a;将目的基因ggp1和sur1进行优化构建得到载体b;将目的基因ugt74b1和st5a进行优化构建得到载体c;
10.分别提取载体a、载体b、载体c的质粒转化至大肠杆菌bl21中,培养得到菌液a、菌
液b和菌液c;
11.将菌液a、菌液b和菌液c混合,加入iptg诱导培养,培养所得菌液经提取得到所述吲哚-3-甲基芥子油苷i3m。
12.优选的,所述目的基因cyp79b2、cyp83b1、gstf9、ggp1、sur1、ugt74b1和st5a来源于芜菁(brassica rapa var.rapa)基因组。
13.优选的,所述载体a的构建包括:
14.a)利用引物1和引物2扩增载体pet-52b的t7启动子和cyp83b1基因,得到片段p1;利用引物3和引物4扩增载体pet-52b的t7启动子和gstf9基因,得到片段p2;
15.b)将含有基因cyp79b2的载体质粒与片段p1和片段p2进行连接得到载体pet-52b-1-p1-p2;
16.c)所述载体pet-52b-1-p1-p2经重组连接终止子片段ter1和ter2,得到的载体pet-52b-1*-p1*-p2,即为载体a。
17.优选的,所述引物1的核苷酸序列如seq id no.1所示;所述引物2的核苷酸序列如seq id no.2所示;所述引物3的核苷酸序列如seq id no.3所示;所述引物4的核苷酸序列如seq id no.4所示。
18.优选的,所述载体b的构建包括:
19.1)利用引物9和引物10扩增载体pet-52b的t7启动子和sur1基因,得到片段p4;
20.2)将含有基因ggp1的载体质粒与片段p4进行连接所得到的载体经重组连接终止子片段ter3,即得所述载体b。
21.优选的,所述引物9的核苷酸序列如seq id no.9所示,所述引物10的核苷酸序列如seq id no.10所示。
22.优选的,所述载体c的构建包括:
23.1)利用引物13和引物14扩增载体pet-52b的t7启动子和st5a基因,得到片段p6;
24.2)将含有基因ugt74b1的载体质粒与片段p6进行连接所得到的载体经重组连接终止子片段ter4,即得所述载体c。
25.优选的,所述引物13的核苷酸序列如seq id no.13所示,所述引物14的核苷酸序列如seq id no.14所示。
26.优选的,所述菌液a、菌液b和菌液c混合的体积比为0.5-2:1-2:1-3。
27.优选的,所得菌液与甲醇混合超声提取,离心所得上清液干燥后,即得所述吲哚-3-甲基芥子油苷i3m。
28.本发明提供了一种使用大肠杆菌生物合成吲哚-3-甲基芥子油苷i3m的方法,通过使用芜菁基因cyp79b2、cyp83b1、gstf9、ggp1、sur1、ugt74b1和st5a构建载体,在大肠杆菌菌株bl21(de3)中利用iptg诱导成功合成了i3m。经定量分析可知,利用本发明所述方法合成吲哚-3-甲基芥子油苷i3m的产量达到1.89mg/l,提高了i3m的合成效率,可应用于其他种类芥子油苷的生物合成,为芥子油苷的工业合成提供了一定的理论支持,前景十分广阔。
附图说明
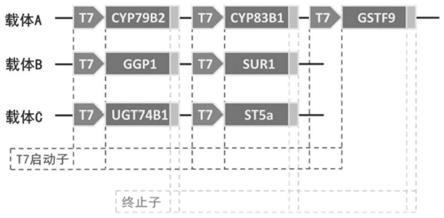
29.图1为载体构建示意图。
30.图2为载体构建完成后三种载体的菌液pcr检测结果,其中,a为载体a菌液pcr检测
结果,b为载体b菌液pcr检测结果,c为载体c菌液pcr检测结果,d为空载和终止子菌液pcr检测结果。
31.图3表示使用iptg诱导后,诱导产物、标准品和空对照的菌液上清的lc-ms检测结果,其中,a代表标准品芸苔葡糖硫苷钾盐的结果,b代表诱导产物i3m的结果,c代表空对照,纵坐标表示吸收强度,横坐标表示保留时间。
32.图4为诱导产物、标准品和空对照在保留时间为5.2min附近的质谱结果,其中,a代表标准品芸苔葡糖硫苷钾盐的结果,b代表诱导产物i3m的结果,c代表空对照,纵坐标表示吸收强度,横坐标表示质荷比(m/z)。
33.图5表示使用hplc进行定量分析制作的标准品标准曲线。
34.图6表示使用iptg诱导后,阳性对照、诱导产物和空白对照的菌液上清的hplc检测结果,其中,a为加入标准品芸苔葡糖硫苷钾盐溶液后的阳性对照的检测结果,b为诱导产物i3m样品的检测结果,c为空白对照的检测结果,纵坐标表示吸收强度,横坐标表示保留时间。
具体实施方式
35.本发明提供了一种利用大肠杆菌生物合成吲哚-3-甲基芥子油苷i3m的方法,所述方法包括以下步骤:
36.将目的基因cyp79b2、cyp83b1和gstf9进行优化构建得到载体a;将目的基因ggp1和sur1进行优化构建得到载体b;将目的基因ugt74b1和st5a进行优化构建得到载体c;
37.分别提取载体a、载体b、载体c的质粒转化至大肠杆菌bl21中,培养得到菌液a、菌液b和菌液c;
38.将菌液a、菌液b和菌液c混合,加入iptg诱导培养,培养所得菌液经提取得到所述吲哚-3-甲基芥子油苷i3m。
39.本发明中,所述目的基因cyp79b2、cyp83b1、gstf9、ggp1、sur1、ugt74b1和st5a来源于芜菁(brassica rapa var.rapa)基因组。所述目的基因cyp79b2、cyp83b1、gstf9、ggp1、sur1、ugt74b1和st5a优选的通过将芜菁基因组中搜索获得的7组基因与拟南芥对应的7个基因进行蛋白序列多重比对筛选得到。本发明中,所述从芜菁基因组中筛选7个目的基因的实验方法包括:以tair(http://www.arabidopsis.org)中拟南芥的7个吲哚族芥子油苷(i3m)生物合成基因(cyp79b2;cyp83b1;gstf9;ggp1;sur1;ugt74b1;st5a)以及brad(http://brassicadb.org/brad/glucogene.php)中白菜(brassica pekinensis)的对应的7个家族的基因和甘蓝(brassica oleracea var.capitata)中对应家族的基因分别作为queries文件,从芜菁基因组库中搜索芜菁(brassicarapavar.rapa)对应的7个基因家族成员。使用circus软件(http://www.circos.ca/software/download/circos/)生成芜菁基因组序列的染色体分布图以确定搜索得到基因的染色体定位。使用mega软件中的邻接法(neighborjoining)构建系统发育树,对从芜菁基因组中筛选出来的基因与拟南芥中的7个基因进行同源性分析,选取与对应基因同源性最高的基因。使用meme在线程序在提取得到的基因序列中搜索保守的基序。利用dnaman软件将选取基因的氨基酸序列与拟南芥中对应基因进行多序列比对,选择序列结构最相似的作为目的基因,最终筛选得到7个目的基因(cyp79b2;cyp83b1;gstf9;ggp1;sur1;ugt74b1;st5a)。
40.本发明中,为成功构建后续的载体,优选的需要对目的基因cyp79b2、cyp83b1、gstf9、ggp1、sur1、ugt74b1和st5a进行优化,并添加酶切位点;所述酶切位点优选为kpn i(ggtacc)和ecori(gaattc)酶切位点。本发明中,所述载体a的构建包括:a)利用引物1和引物2扩增载体pet-52b的t7启动子和cyp83b1基因,得到片段p1;利用引物3和引物4扩增载体pet-52b的t7启动子和gstf9基因,得到片段p2;b)将含有基因cyp79b2的载体质粒与片段p1和片段p2进行连接得到载体pet-52b-1-p1-p2;c)所述载体pet-52b-1-p1-p2经重组连接终止子片段ter1和ter2,得到的载体pet-52b-1*-p1*-p2,即为载体a。本发明中,所述引物1的核苷酸序列如seq id no.1所示;所述引物2的核苷酸序列如seq id no.2所示;所述引物3的核苷酸序列如seq id no.3所示;所述引物4的核苷酸序列如seq id no.4所示。
41.本发明中,所述载体b的构建包括:1)利用引物9和引物10扩增载体pet-52b的t7启动子和sur1基因,得到片段p4;2)将含有基因ggp1的载体质粒与片段p4进行连接所得到的载体经重组连接终止子片段ter3,即得所述载体b。本发明中,所述引物9的核苷酸序列如seq id no.9所示,所述引物10的核苷酸序列如seq id no.10所示。
42.本发明中,所述载体c的构建包括:1)利用引物13和引物14扩增载体pet-52b的t7启动子和st5a基因,得到片段p6;2)将含有基因ugt74b1的载体质粒与片段p6进行连接所得到的载体经重组连接终止子片段ter4,即得所述载体c。本发明中,所述引物13的核苷酸序列如seq id no.13所示,所述引物14的核苷酸序列如seq id no.14所示。
43.本发明对所述提取载体a、载体b或载体c质粒的方法并没有特殊限定,在本发明的具体实施例中,所述提取载体a、载体b或载体c质粒优选采用试剂盒tianprep mini plasmid kit(tiangen biotech,beijing)。本发明对所述质粒转化至大肠杆菌bl21的方法并没有特殊限定,在本发明的具体实施例中,所述转化方法优选为热激法。
44.本发明将转化得到的大肠杆菌进行培养,分别得到大肠杆菌的菌液a、菌液b和菌液c。所述培养为液体培养,所述培养基优选为含有100mg/l氨苄青霉素的lb液体培养基,所述液体培养的温度优选为37℃。本发明中,所述液体培养优选为二级扩大培养,具体的,将转化的大肠杆菌菌液经过第一次液体培养和第二次液体培养后得到培养液。本发明中,所述第一次液体培养优选至液体od
600
约为1.0,所述第一次液体培养的时间优选为18-24h。本发明中,所述第二次液体培养优选至液体od
600
约为0.6,培养时间优选为2h。
45.本发明将菌液a、菌液b和菌液c混合,加入iptg诱导培养。本发明中,所述菌液a、菌液b和菌液c混合的体积比优选为0.5-2:1-2:1-3,更优选为0.5-1:1-1.5:1-2。本发明中,所述iptg的浓度优选为0.5-1.0mm/l,更优选为0.8-1.0mm/l。所述iptg诱导的温度优选为18-30℃,更优选为18-25℃,所述iptg诱导培养的转速优选60-120rpm,更优选为80-100rpm;所述iptg诱导培养的时间优选为24-72h,更优选为48-60h。
46.诱导后,所得菌液与甲醇混合,超声提取吲哚-3-甲基芥子油苷i3m。本发明中,优选菌液与甲醇混合的体积比为0.5-2:0.5-1,更优选为1:1。本发明中,所述超声的时间优选为20min,所述超声的频率优选为40hz,所述超声的功率优选为100%。本发明中,所述离心的时间优选为10min。本发明中,所述离心后收集上清液,经常温烘干至晶体析出,即得本发明所述所述吲哚-3-甲基芥子油苷i3m。
47.本发明中,所述菌株bl21(de3)购自angyubio;所述lb液体培养基的制备方法为:将5g lb broth(sangonbiotech,shanghai)与200ml蒸馏水充分混匀;120℃高温灭菌
20min。
48.本发明中,所用原料、试剂与设备均为已知产品,采用常规市售产品即可。
49.为了进一步说明本发明,下面结合实施例对本发明提供的技术方案进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
50.实施例1芜菁吲哚族芥子油苷(igs)合成通路基因的筛选
51.以tair(http://www.arabidopsis.org)中拟南芥的7个吲哚族芥子油苷(i3m)生物合成基因(cyp79b2;cyp83b1;gstf9;ggp1;sur1;ugt74b1;st5a)以及brad(http://brassicadb.org/brad/glucogene.php)中白菜(brassica pekinensis)的对应的7个家族的基因和甘蓝(brassica oleracea var.capitata)中对应家族的基因分别作为queries文件,从芜菁基因组库中搜索芜菁(brassicarapavar.rapa)对应的7个基因家族成员。使用circus软件(http://www.circos.ca/software/download/circos/)生成芜菁基因组序列的染色体分布图以确定搜索得到基因的染色体定位。使用mega软件中的邻接法(neighbor joining)构建系统发育树,对从芜菁基因组中筛选出来的基因与拟南芥中的7个基因进行同源性分析,选取与对应基因同源性最高的基因。使用meme在线程序在提取得到的基因序列中搜索保守的基序。利用dnaman软件将选取基因的氨基酸序列与拟南芥中对应基因进行多序列比对,选择序列结构最相似的作为目的基因,最终筛选得到7个目的基因(cyp79b2;cyp83b1;gstf9;ggp1;sur1;ugt74b1;st5a)。
52.实施例2序列优化
53.使用大肠杆菌的密码子优化表对目的基因进行优化,序列的优化与合成由上海捷瑞生物工程有限公司(generay biotech,shanghai)完成,表达载体为pet-52b,原载体质粒由上海捷瑞生物工程有限公司(generay biotech,shanghai)提供,考虑到后续载体构建需要,在部分基因序列5’端和3’端添加酶切位点。具体的酶切位点添加如下表1所示:
54.表1酶切位点添加
[0055][0056]
其中,ggtacc为kpni酶切位点;gaattc为ecori酶切位点。
[0057]
实施例3载体构建并转化bl21(de3)
[0058]
将7个目的基因按照附图1所示分别完成载体a、载体b和载体c的构建,具体构建方法如下:
[0059]
(一)构建载体a
[0060]
1.使用高保真酶(super-fidelity dna polymerase,vazyme biotech co.,ltd)扩增目的片段,表2为构建载体a扩增片段使用的引物列表(包括扩增终止子使用的引物):
[0061]
表2构建载体a使用的引物
[0062][0063]
注:终止子片段序列一致,由于连接位置不同所以接头序列和酶切位点不同
[0064]
2.使用引物pet-52b-p1-f/r将载体pet-52b上的t7启动子与目的基因cyp83b1一起扩增,得到基因片段p1(t7+cyp83b1);使用引物pet-52b-p2-f/r将载体pet-52b上的t7启动子与目的基因gstf9同时扩增,得到基因片段p2(t7+gstf9);
[0065]
3.提取含有目的基因cyp79b2的载体质粒并进行第一次酶切,使用重组酶(vazyme biotech co.,ltd)连接片段p1,菌液检测和测序结果显示p1连接完成后,获得载体pet-52b-1-p1;
[0066]
4.提取载体pet-52b-1-p1质粒并进行第二次酶切,使用重组酶(vazyme biotech co.,ltd)连接片段p2;菌液检测和测序结果显示p2连接成功后,获得载体pet-52b-1-p1-p2;
[0067]
5.利用t7ter-1-f/r引物扩增终止子片段t7ter1,然后提取载体pet-52b-1-p1-p2质粒,利用基因cyp79b2末端酶切位点进行第三次酶切,重组连接扩增得到的终止子片段t7ter1;菌液检测和测序结果显示连接完成后,获得载体pet-52b-1*-p1-p2;
[0068]
6.利用t7ter-2-f/r引物扩增终止子片段t7ter2,然后提取载体pet-52b-1*-p1-p2质粒,利用片段p1末端酶切位点进行第四次酶切,重组连接终止子片段t7ter2,菌液检测并测序之后,获得载体pet-52b-1*-p1*-p2,即为载体a,所述载体a菌液检测结果如附图2所示。
[0069]
(二)构建载体b
[0070]
构建方法与顺序同构建载体a,扩增片段用引物如下表3所示:
[0071]
表3构建载体b使用的引物
[0072][0073]
具体方法如下:
[0074]
1)利用引物pet-52b-p4-f/r扩增载体pet-52b的t7启动子和目的基因sur1,得到片段p4(t7+sur1);
[0075]
2)提取含有基因ggp1的载体质粒,利用重组酶(vazyme biotech co.,ltd)将其与片段p4进行连接得到载体pet-52b-1-p4;
[0076]
3)利用t7ter-3-f/r引物扩增终止子片段t7ter3,然后提取载体pet-52b-1-p4质粒,重组连接终止子片段ter3,菌液检测并测序之后,即得所述载体b,所述载体b菌液检测结果如附图2所示。
[0077]
(三)构建载体c
[0078]
构建方法与顺序同构建载体a,扩增和测序用引物如下表4所示:
[0079]
表4构建载体c使用的引物
[0080][0081][0082]
具体方法如下:
[0083]
1)利用引物pet-52b-p6-f/r扩增载体pet-52b的t7启动子和目的基因st5a,得到片段p6(t7+st5a);
[0084]
2)提取含有基因ugt74b1的载体质粒,利用重组酶(vazyme biotech co.,ltd)将其与片段p6进行连接得到载体pet-52b-1-p6;
[0085]
3)利用t7ter-4-f/r引物扩增终止子片段t7ter4,然后提取载体pet-52b-1-p6质粒,重组连接终止子片段ter4,菌液检测并测序之后,即得所述载体c,所述载体c菌液检测结果如附图2所示。
[0086]
(四)转化大肠杆菌表达载体bl21(de3)
[0087]
使用试剂盒tianprep mini plasmid kit(tiangen biotech,beijing)提取载体a、载体b和载体c的质粒,分别使用热激法转化至大肠杆菌bl21(de3)感受态,得到菌株a、菌株b和菌株c。
[0088]
实施例4i3m诱导合成
[0089]
(1)将含有载体a/b/c质粒的大肠杆菌bl21(de3)菌液各吸取50μl分别接种于3ml
含有100mg/l氨苄青霉素的lb液体培养基中,37℃,200rpm过夜培养,至od
600
为1.0;
[0090]
(2)吸取1ml菌液接种至10ml(使用高温灭菌的50ml锥形瓶)含有100mg/l氨苄青霉素的lb液体培养基,37℃,200rpm培养至od
600
为0.6(培养时间一般为2h);
[0091]
(3)将含有三种载体质粒的菌液按照1:1:1的比例混合(每种菌液10ml,总体积为30ml,使用高温灭菌的100ml锥形瓶),加入1.0mm iptg(1.0m/l)诱导,18℃,80-100rpm培养48h;
[0092]
(4)菌液中加入等体积的甲醇(meoh),使用超声细胞破碎仪常温条件下超声20min(40hz,功率100%);
[0093]
(5)超声后的菌液倒入50ml离心管中,6000rpm离心10min,收集上清,所述上清中即含有本发明所述的i3m。
[0094]
实施例5目的产物检测
[0095]
(1)定性检测:
[0096]
将实施例4中所得的上清液倒入干净培养皿中(每皿约20ml上清),放置于通风橱中常温挥发至晶体析出,加入2ml ddh2o溶解;
[0097]
将溶解后的液体加入2ml ep管中,12000rpm离心10min,取上清,使用0.45μm除菌滤膜过滤后,使用uplc-ms进行定性分析得到附图3和附图4。
[0098]
其中,所述uplc-ms条件为:agilent sb-c182.1
×
50mm,1.8μm;流动相为乙腈:甲酸-水(v/v,1%);流速:0.5ml/min;柱温:40℃;梯度洗脱:0-1.2min,3%乙腈;1.2-4.3min,3-65%乙腈;4.3-4.4min,65-100%乙腈;4.4-4.9min,100%乙腈;4.9-5.0min,100-3%乙腈;5.0-6.0min,3%乙腈。电离源:esi;正负电离离子喷雾电压:3000v/-4000v;雾化气体/干燥气体:n2;碰撞气体:氩气。
[0099]
可以看出,标准品和诱导产物在5.2min处有吸收峰,m/z=447,表明本发明所述方法成功合成了吲哚-3-甲基芥子油苷i3m。
[0100]
(2)定量检测:
[0101]
芸苔葡糖硫苷钾盐(glucobrassicin potassium salt,c16h19kn2o9s2,mw=486.56g/mol)标准品配制成浓度为0.2mg/ml的母液,按比例稀释成0.02mg/ml,0.01mg/ml,0.004mg/ml,0.002mg/ml,0.001mg/ml五个浓度梯度,使用hplc测试峰面积后绘制标准曲线,得到附图5。
[0102]
将实施例4中所得的上清液倒入干净培养皿中(每皿约20ml上清),放置于通风橱中常温挥发至晶体析出,加入2ml ddh2o溶解;将溶解后的液体加入2ml ep管中,12000rpm离心10min,取上清,使用0.45μm除菌滤膜过滤后,进行hplc检测,检测结果如附图6所示。
[0103]
其中,hplc条件:进样量10μl;agilent sb-c18 hplc column4.6
×
150mm,5μm;流动相为乙腈:甲酸-水(v/v,0.05%);流速:0.5ml/min;柱温:40℃;梯度洗脱:0-8min,1.5-5%乙腈;8-10min,5-7%乙腈;10-42min,7-52%乙腈;42-44min,52-92%乙腈;44-49min,92%乙腈;49-52min,92-1.5%;52-60min,1.5%乙腈。
[0104]
将附图6中hplc检测结果中获得的样品结果中显示与标准品峰保留时间一致的峰面积带入附图5中求得的公式:y=7e-05x-0.0005,计算出检测样品中i3m的浓度,再除以稀释倍数即可计算原菌液上清中i3m的浓度,经计算,本发明所述方法合成吲哚-3-甲基芥子油苷i3m的产量达到1.89mg/l。其中,稀释倍数为原菌液上清体积与稀释后样品体积的比
值。
[0105]
由以上实施例可知,本发明成功得到了一种使用大肠杆菌生物合成吲哚-3-甲基芥子油苷i3m的方法,通过使用芜菁基因cyp79b2、cyp83b1、gstf9、ggp1、sur1、ugt74b1和st5a构建载体,在大肠杆菌菌株bl21(de3)中利用iptg诱导成功合成了i3m。经定量分析可知,利用本发明所述方法合成吲哚-3-甲基芥子油苷i3m的产量达到1.89mg/l,提高了i3m的合成效率,可应用于其他种类芥子油苷的生物合成,为芥子油苷的工业合成提供了一定的理论支持。
[0106]
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
