1.本发明涉及多肽技术领域,具体涉及具有美白功效的泥蚶多肽、多肽粉及制备方法和应用。
背景技术:
2.多肽是一类化合物,其在体内与目标结合具有更强的特异性,使得其生物活性更高效和更好的适用性,且其无关的副作用也更有限。与蛋白质相比,肽类的小分子尺寸更小,完善的多肽化学合成方法提供了更多和更经济的产量。此外肽的较短长度表明他们的使用不仅在系统性注射也为医学临床方便药片口服诱导骨生长刺激。泥蚶,属软体动物门,双壳纲,列齿目,蚶科,蚶属。作为中国传统养殖贝类中的一种,在中国沿海各地均有分布。泥蚶于每年8~10月份进入产卵和生产的旺季高峰期,此季节产量颇丰。泥蚶肉味鲜美,可鲜食或酒渍,亦可制成干品,蚶肉含多量蛋白质和维生素,是营养成分较为优质的蛋白源海洋食品。基于泥蚶的高蛋白特性,以泥蚶为原料开发功能多肽是值得研究的方向。
技术实现要素:
3.为开发泥蚶蛋白资源,本发明的目的在于:提供具有美白功效的泥蚶多肽、以及含有泥蚶多肽的多肽粉;泥蚶多肽和多肽粉的制备方法;泥蚶多肽和多肽粉在制备美白乳液上的应用。
4.本发明提供如下的技术方案:
5.本发明一方面提供了一种具有美白功效的泥蚶多肽,所述泥蚶多肽为短肽或至少两种短肽的混合物;
6.所述短肽为qcrtdcpstykd、keqhaemkq、ldmgdsetek、hngqpltslcefmsta、 dcekdidec、fqfmtvte、addegne、tsktmndpc、spsppldeda、qevvmgec中的一种;
7.各短肽的氨基酸序列为:
8.qcrtdcpstykd:gln-cys-arg-thr-asp-cys-pro-ser-thr-tyr-lys-asp;
9.keqhaemkq:lys-glu-gln-his-ala-glu-met-lys-gln;
10.ldmgdsetek:leu-asp-met-gly-asp-ser-glu-thr-glu-lys;
11.hngqpltslcefmsta: his-asn-gly-gln-pro-leu-thr-ser-leu-cys-glu-phe-met-ser-thr-ala;
12.dcekdidec:asp-cys-glu-lys-asp-ile-asp-glu-cys;
13.fqfmtvte:phe-gln-phe-met-thr-val-thr-glu;
14.addegne:ala-asp-asp-glu-gly-asn-glu;
15.tsktmndpc:thr-ser-lys-thr-met-asn-asp-pro-cys;
16.spsppldeda:ser-pro-ser-pro-pro-leu-asp-glu-asp-ala;
17.qevvmgec:gln-glu-val-val-met-gly-glu-cys。
18.本发明另一方面提供了上述泥蚶多肽的制备方法,包括以下步骤:
19.(1)将泥蚶去壳后取全组织,然后清洗、匀浆;
20.(2)向泥蚶的匀浆液中先后加入胃蛋白酶、胰蛋白酶分段酶解;
21.(3)将步骤(2)酶解后的酶解液离心处理,然后取上清液;
22.(4)过滤步骤(3)所得的上清液,并截留分子量1000~3000da的分子,冻干得多肽粉;
23.(5)将多肽粉分离纯化得到泥蚶多肽。
24.作为本发明方法的优选,步骤(2)中胃蛋白酶酶解时,保持匀浆液的ph值为2~4,酶解时间2~4小时,酶解温度30~38℃,胃蛋白酶加入量为匀浆液中蛋白重量的1~3%,胃蛋白酶的活力≥250u/mg。
25.作为本发明方法的优选,步骤(2)中加入胰蛋白酶酶解时,保持匀浆液的ph值为7.0~ 8.6,酶解时间0.5~2小时,酶解温度30~38℃,胰蛋白酶加入量为匀浆液中蛋白重量的1~ 3%,胰蛋白酶的活力10000u/mg。
26.本发明还提供了一种包含上述泥蚶多肽的多肽粉。
27.上述多肽粉的制备方法,包括以下步骤:
28.(1)将泥蚶去壳后取全组织,然后清洗、匀浆;
29.(2)向泥蚶的匀浆液中先后加入胃蛋白酶、胰蛋白酶分段酶解;
30.(3)将步骤(2)酶解后的酶解液离心处理,然后取上清液;
31.(4)过滤步骤(3)所得的上清液,并截留分子量1000~3000da的分子,冻干得多肽粉。
32.作为本发明方法的优选,步骤(4)所得的多肽粉为多种短肽的混合物,可进一步将步骤(4)得到的多肽粉进行分离纯化得到单一的短肽或其中几种短肽的混合物。
33.作为本发明方法的优选,步骤(2)中胃蛋白酶酶解时,保持匀浆液的ph值为2~4,酶解时间2~4小时,酶解温度30~38℃,胃蛋白酶加入量为匀浆液中蛋白重量的1~3%,胃蛋白酶的活力≥250u/mg。
34.作为本发明方法的优选,步骤(2)中加入胰蛋白酶酶解时,保持匀浆液的ph值为7.0~ 8.6,酶解时间0.5~2小时,酶解温度30~38℃,胰蛋白酶加入量为匀浆液中蛋白重量的1~ 3%,胰蛋白酶的活力10000u/mg。
35.本发明还提供了上述泥蚶多肽或者多肽粉在制备美白乳液上的应用。
36.食用多肽常用的酶解方法主要为碱性蛋白酶、中性蛋白酶以及风味蛋白酶等,然而这些酶类水解得到的肽类在体内发挥生物功效存在一些缺点,因为人异源消化酶的多肽被食用后可能会被胃肠道中蛋白酶的二次或者多次水解,很难保证原始多肽的生物活性。很多多肽在体外活性测试得到的效果在体内会有所降低。而经过胃肠道同源蛋白酶水解的多肽可以较好的减少其再水解的可能性,有利于保留原始的完整性,防止体内胃肠道酶导致的活性改变或降低。
37.本发明的有益效果如下:本发明利用胃肠道同源蛋白酶水解泥蚶蛋白,获得具有美白功效的多肽,保留了更好的原始完整性。
附图说明
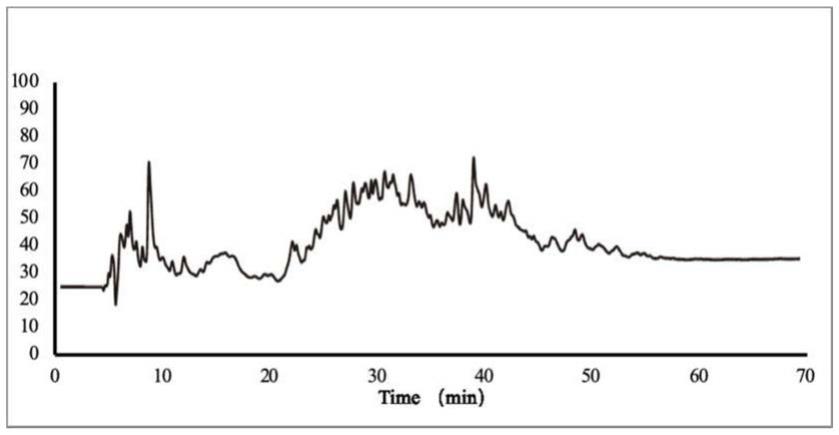
38.图1为多肽分离鉴定的lc-ms谱图;
39.图2为酶解多肽与主要活性多肽的酪氨酸酶抑制率。
具体实施方式
40.下面就本发明的具体实施方式作进一步说明。
41.如无特别说明,本发明中所采用的原料均可从市场上购得或是本领域常用的,如无特别说明,下述实施例中的方法均为本领域的常规方法。
42.实施例1
43.具有美白功效的泥蚶多肽,经以下过程制成:
44.(1)将泥蚶去壳后取全组织,然后清洗、匀浆;
45.(2)向泥蚶的匀浆液中先后加入胃蛋白酶、胰蛋白酶分段酶解;
46.(3)将步骤(2)酶解后的酶解液经10000g离心处理,然后取上清液;
47.(4)过滤步骤(3)所得的上清液,并截留分子量1000~3000da的分子,冻干得多肽粉;
48.(5)将多肽粉序列鉴定,分别为短肽:qcrtdcpstykd、keqhaemkq、ldmgdsetek、hngqpltslcefmsta、dcekdidec、fqfmtvte、addegne、tsktmndpc、 spsppldeda、qevvmgec。
49.步骤(2)中胃蛋白酶酶解时,保持匀浆液的ph值为2~4,酶解时间2~4小时,酶解温度30~38℃,胃蛋白酶加入量为匀浆液中蛋白质量的1~3%,胃蛋白酶的活力≥250u/mg;在本发明的优选实施方法中,胃蛋白酶酶解时,保持匀浆液的ph值为2,酶解时间1小时,酶解温度37℃,胃蛋白酶加入量为匀浆液中蛋白质量的2%,
50.步骤(2)中加入胰蛋白酶酶解时,保持匀浆液的ph值为7.0~8.6,酶解时间0.5~2小时,酶解温度30~38℃,胰蛋白酶加入量为匀浆液中蛋白质量的1~3%,胰蛋白酶的活力 10000u/mg。在本发明的优选实施方法中,胰蛋白酶酶解时,保持匀浆液的ph值为8.6,酶解时间2小时,酶解温度37℃,胰蛋白酶加入量为匀浆液中蛋白质量的2%。
51.实施例2
52.具有美白功效的泥蚶多肽,为实施例1中制备的短肽qcrtdcpstykd、keqhaemkq、 ldmgdsetek、hngqpltslcefmsta、dcekdidec、fqfmtvte、addegne、 tsktmndpc、spsppldeda、qevvmgec中的至少两种的混合物,可以通过控制分离纯化条件得到或者直接采用短肽复配。
53.实施例3
54.具有美白功效的泥蚶多肽粉,通过实施例1的步骤(1)~步骤(4)得到。
55.实施例4
56.具有美白功效的乳液,向化妆品基础乳液配方中加入实施例1或实施例2或实施例3中的泥蚶多肽或者泥蚶多肽粉制备得到。
57.性能测试
58.1、实施例1中的各短肽对酪氨酸酶对接分子模拟结果
59.ꢀꢀ
cdocker energycdocker interaction energy1qcrtdcpstykd207.471146.7252keqhaemkq195.108138.0913ldmgdsetek193.95146.414
4hngqpltslcefmsta192.806146.7065dcekdidec176.21114.4946fqfmtvte175.22147.1777addegne169.886133.0628tsktmndpc152.527148.3689spsppldeda151.638163.6510qevvmgec150.557117.8211曲酸112.33963.052
60.通过上表可以看出,上述短肽的评分均要高于阳性对照曲酸,均潜在一定的酪氨酸酶抑制效果,并且不同的短肽的抑制作用不同,其中qcrtdcpstykd、keqhaemkq、 ldmgdsetek、hngqpltslcefmsta、dcekdidec等效果较佳,从而表现出美白作用。
61.2、各短肽的美白功效测试。
62.(1)测试条件和测试数据
63.1.溶液配制
64.1)50mm磷酸缓冲液或pbs溶液,ph 6.4;
65.2)500μm l-dopa解于pbs溶液(先用含有1%体积的dmso溶解);
66.3)酪氨酸酶(sigma)溶解于pbs溶液,终浓度1000u/ml。
67.4)实验组多肽溶液:多肽溶解于pbs溶液,浓度1mg/ml。
68.5)阳性对照曲酸溶液:曲酸定溶液溶解于pbs溶液,浓度500μm。
69.2.实验步骤
70.1)160μl l-dopa液于96孔板中,三个平行;
71.2)20μl多肽溶液加入96孔板,空白组加入20μl pbs溶液,阳性对照加入20μl曲酸溶液。
72.3)各孔加入20μl终浓度为1000u/ml的酪氨酸酶,37℃孵育10min,20min后,分别在492nm下检测吸光度。
73.3.抑制率计算
[0074][0075]
s0=样品自身吸光度sa=多肽样品反应后吸光度c0=底板吸光度ca=只有底物和酶反应后吸光度。
[0076]
(2)酶解的多肽的酪氨酸酶抑制效果
[0077]
图1为多肽分离鉴定的lc-ms谱图,该图显示了多肽通过液相分离后被质谱检测到的总离子流信号(tic,total lon chromatograms)。
[0078]
图2为酶解多肽与主要活性多肽的酪氨酸酶抑制率。其中,碱性蛋白酶酶解方法:泥蚶组织匀浆后,调ph为9.0,温度为50℃,酶解时间2h,加酶量:2%(蛋白质量);中性蛋白酶酶解方法:泥蚶组织匀浆后,调ph为7.0,温度为40℃,酶解时间2h,加酶量:2%(蛋白质量)。本方法的酪氨酸酶抑制率约为76%,略低于阳性对照曲酸,高于其他方法酶解多肽的酪氨酸酶抑制率。将本发明中所有预测活性多肽合成(也可以通过对本发明的多肽粉进行分离纯化得到)后分别进行酪氨酸酶抑制率试验(各活性多肽溶解于pbs溶液,浓度为1mg/
ml,试验步骤同上),发现序列fqfmtvte对酪氨酸酶抑制活性明显。
