1.本发明涉及纳米生物材料技术领域,尤其涉及一种纳米荧光材料、纳米荧光探针及其制备方法和应用。
背景技术:
2.病原性细菌引发的感染约导致全球约三分之一的死亡率,对全球公共卫生健康构成了严重威胁。当前各类抗菌药物已成为保卫人类健康和挽救人类生命的有效武器,然而由于不合理的使用,它们正逐渐引发全球的细菌耐药性危机。临床应用中对病原菌感染进行早期快速诊断并开展及时治疗对于提高感染治疗效果、缓解细菌耐药性形势具有重要意义。对于病原菌检测而言,目前临床诊断主要依靠传统检测技术(例如组织切片培养,组织学分析和外周血采样)辅以生化检测,虽然能够获得较为可靠的细菌鉴定结果,但具有费时费力以及效率低下的缺点,常导致严重的治疗延误。在细菌感染治疗方面,目前已发展出诸多有效的治疗策略,包括阳离子聚合物、抗菌肽、光热/ 光动力治疗剂和气态药物(如co、no)等广泛地用于对抗细菌以及耐药性细菌感染的研究中。然而,目前细菌诊断和治疗在临床实践中是独立的操作过程,这不可避免地导致最佳治疗时间的延误,降低治疗效果并增加患者经济和心理负担。因此,发展有效的细菌检测和靶向治疗的集成抗菌策略一直以来备受关注。
3.荧光检测技术具有简单、快速、灵敏的特点,成为细菌检测和成像应用中一项不可或缺的技术。在各种已开发的荧光材料(分子荧光探针,荧光蛋白和纳米探针等)中,纳米荧光探针由于具有尺寸与结构的特殊性,表现出小尺寸独特的理化性质,在细菌诊断和治疗过程中显示出巨大的潜力。将荧光探针分子和杀菌功能组分集成是构建具有细菌检测和功能一体化抗菌体系的常用办法。然而,目前大多数构建通过将荧光染料和杀菌组分化学附着或物理封装到纳米颗粒中而制备的,具有制备过程复杂、药物装载效率低,稳定性差以及荧光染料和杀菌组分的意外释放或泄漏等缺点,这严重限制其临床应用。此外,一些纳米载体会在人体内降解或代谢过程中会引起毒性和炎症反应。
技术实现要素:
4.有鉴于此,本发明的目的是提供一种纳米荧光探针。与传统的诊疗一体化抗菌体系相比,该纳米荧光探针具有优异的细菌检测特异性和较好的稳定性以及生物相容性,并且制备过程极其简便的优势。
5.本发明提供一种纳米荧光材料,具有式i所示的结构:
6.7.其中,r1选自-h或c6~c30的芳基;r2选自酰胺基或酯基,m为0~15 的整数,n为0~10的整数。
8.本发明提供的纳米荧光材料中,所述r1为-h,r2为酰胺基。
9.本发明提供的纳米荧光材料,具有式vi所示的结构:
[0010][0011]
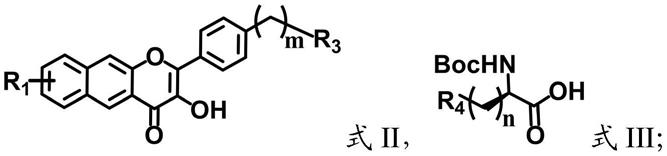
本发明提供的纳米荧光材料,由式ii和式iii所示的化合物制备得到:
[0012][0013]
其中,r1选自-h或c6~c30的芳基;
[0014]
r3选自-cooh、-nh2、-cho、-cocl、(ch2)mcooh、(ch2)mnh2、 (ch2)mcho或(ch2)mcocl,m为0~15的整数;
[0015]
r4选自-oh、-cooh或-nh
2-,n为0~10的整数。
[0016]
一些实施方案中,r1为-h,r3为-cooh,r4为-nh2。
[0017]
一些具体实施例中,本发明提供的纳米荧光材料,由式ii-a所示的化合物和iii-a所示的化合物制备得到:
[0018][0019]
本发明还提供了所述的纳米荧光材料的制备方法,包括:
[0020]
在0℃、保护气氛下,将式ii化合物与式iii化合物反应,得到中间体;
[0021]
将所述中间体脱除boc保护基,得到式i所示的化合物;
[0022][0023]
本发明中,所述保护气氛为本领域技术人员熟知的保护气氛即可,并无特殊的限制,本发明中优选为氮气。
[0024]
本发明中,所述式ii化合物与式iii化合物的反应为缩合反应。本发明对缩合反应采用的缩合剂的具体种类没有特殊限定,为本领域常用的缩合剂种类即可。缩合反应在室温搅拌条件下进行。
[0025]
本发明中,脱除boc保护基采用的脱除剂为三氟乙酸、hcl/四氢呋喃、 hcl/二氧六环,本发明优选三氟乙酸。在本发明的一些具体实施例中,脱除 boc保护基的步骤为:将中间体化合物在0℃下缓慢加入到含有三氟乙酸的溶剂中。
[0026]
本发明提供的荧光纳米材料的制备方法中,在所述脱除boc保护基获得式i所示的化合物的粗品之后,还包括对粗品进行纯化的步骤。
[0027]
本发明还提供一种纳米荧光探针由本发明所述的纳米荧光材料在水性溶剂中自组装制得。
[0028]
一些实施方案中,本发明纳米荧光探针由式ii所示的纳米荧光材料在水性溶剂中自组装制得。
[0029]
其中,所述溶剂为含水溶液,具体可以为h2o、pbs缓冲液、nacl溶液等。
[0030]
一些具体实施例中,本发明纳米荧光探针由式vi所示的化合物在dmso 和水的混合溶液中自组装制得。
[0031]
本发明荧光纳米探针主要利用分子结构间π-π相互作用、亲/疏水作用、静电作用等共同作用,通过简单水相小分子自组装一步制备得到。
[0032]
实验表明,本发明所述的纳米探针既具有快速、灵敏、特异的细菌荧光检测和结构成像能力,还具有检测之后杀菌功能,即诊疗一体抗菌功能。
[0033]
因此,本发明还提供了所述荧光纳米探针在细菌检测、分析和/或杀菌中的应用。
[0034]
本发明提供一种细菌检测、监测和分析的方法,将本发明所述的纳米探针与细菌悬浮液在37℃下共孵育30min-12h后,uv照射,裸眼可见化检测,并利用激光共聚焦或荧光显微镜对其荧光成像进行结构观察。
[0035]
其中,所述细菌悬浮液优选为细菌lb悬浮液。共孵育时间优选为1h-6h。
[0036]
本发明还提供一种杀菌的方法,将本发明所述的纳米探针溶液与细菌lb 悬浮液在37℃下共孵育30min-12h后,暴露于可见光下,连续照射30min-12 h。
[0037]
进一步的,共孵育时间优选为1h-6h。
[0038]
本发明构建的纳米荧光探针,可被细菌诱导发生解组装成小分子,进而被细菌代谢利用进入细胞壁结构中,激活小分子的荧光,因此该纳米探针可具有优势的细菌响应性和特异性,可实现对细菌的快速、灵敏、准确和广谱的检测,并且可对细菌结构进行荧光成像,有助于进一步辅助细菌鉴定。
[0039]
本发明构建的纳米荧光探针在实现细菌检测后,可在可见光照射下释放出co,实现对细菌的非特异广谱杀伤,对耐药菌同样有效,并且不易诱导细菌产生耐药性。
[0040]
本发明所纳米荧光探针在在水相环境中具有良好的分散性及稳定性,可实现多场景下的细菌检测和杀菌功能,可应用到生物成像、细菌检测与监测、卫生防疫等领域。
[0041]
本发明所述的纳米探针涉及其在杀菌中的应用方法为:将代谢了分子荧光探针的细菌溶液暴露于可见光下,连续照射30min-12h;更为优选,照射时间为1h-5h。
[0042]
与现有技术相比,本发明的有益效果在于:
[0043]
本发明提供的纳米探针分子结构中同时具有亲疏水基元,在水相自组装过程中,
分子间π-π相互作用、亲/疏水作用、静电作用等共同驱动作用会诱导分子自组装形成尺寸均一和具有较好水溶稳定性的纳米粒子,具有原料廉价易得、制备方法简单、易实现产业化生产等优点,并解决了传统分子探针因水溶性差和易发生光漂白等原因导致的应用受限等问题。
[0044]
本发明提供的纳米荧光探针分子在自组装成纳米粒子后,会发生荧光淬灭效应,光稳定性较好;另外,其可见光释放co能力明显得到抑制,因此在保存时无需对其进行避光保护,具有易存储的优点。
[0045]
本发明提供的纳米荧光探针在细菌代谢诱导下解离成小分子,并可被细菌代谢到细胞壁结构中,激活分子荧光,实现对细菌的“turn-on型”荧光检测和结构成像,具有检测特异、准确和快速等优点。
[0046]
本发明提供的纳米荧光探针具有特异性细菌识别和杀菌能力,可以在各种复杂、实际场景(比如,细菌与哺乳动物细胞共存的场景、细菌在吞噬细胞内部存在的场景以及细菌生物膜中场景)中只对细菌进行检测和杀伤,可应用到生物成像、细菌检测与监测、卫生防疫等领域。
附图说明
[0047]
图1为实施例1中中间化合物2的1h nmr谱图;
[0048]
图2为实施例1中中间产物化合物2的esi-ms谱图;
[0049]
图3为实施例1中化合物3的1h nmr谱图;
[0050]
图4为实施例1中化合物3的esi-ms谱图;
[0051]
图5为实施例1中化合物3在dmso中吸收和发射光谱图;
[0052]
图6为实施例1中化合物3分子和形成纳米粒子的荧光发射谱图;
[0053]
图7为实施例1中化合物3聚集的纳米粒子tem图a)和化合物1形成的聚集体tem图b);
[0054]
图8为实施例1中纳米探针的细菌检测性能;
[0055]
图9为对照例1中化合物1形成的聚集体与细菌孵育后的clsm荧光图 (9a)和明场图(9b)。
具体实施方式
[0056]
以下结合附图和具体实施例,进一步阐述本发明,但本发明并不限于这些具体实施方案。实施例中所用的仪器、材料、试剂等,如无特殊说明,均为常规仪器和试剂,并可从商业途径得到。
[0057]
实施例1:本实施例提供一种细菌响应型诊疗一体化纳米荧光探针,具体合成路线如下图所示,具体过程如下:
[0058][0059]
1)化合物2的合成:
[0060]
将化合物1(0.332g)溶解在thf中,在0℃、n2气氛中将n-羟基琥珀酰亚胺(nhs,0.105g)和1-乙基-3(3-二甲基丙胺)碳二亚胺(edci,0.221g) 加入到化合物3中,室温下搅拌反应6h。三乙胺(2.3mmol)滴加到反应体系中,搅拌反应30min后,将boc-d-dap-oh(0.204g)加入其中,在室温下搅拌过夜。反应结束后,得到的粗产物依次通过离心、洗涤、干燥的方式进行纯化,得到黄色产物化合。图1为化合物2的1h nmr谱图,从图中可以看出:1h nmr(dmso-d6,400mhz)δ8.86(s,1h),8.76(s,1h), 8.39(d,j=8.3hz,2h),8.36(s,1h),8.27(d,j=8.3hz,1h),8.10 (d,j=8.4hz,1h),8.03(d,j=8.4hz,2h),7.70(t,j=7.6hz,1h), 7.59(t,j=7.5hz,1h),6.43-6.38(m,1h),4.18(q,j=6.7hz,1h), 3.76(s,1h),3.74(s,1h),3.63-3.58(m,1h),1.39(s,9h)。图2为化合物2的esi-ms谱图,从图中可以看出:[mh]-的理论分子量为517.5,实际分子量为517.2。
[0061]
2)化合物3的合成:
[0062]
将化合物2(0.202g)加入到dcm(4ml)中,在0℃下缓慢加入tfa (3ml),在室温下搅拌反应4h。反应结束后,通过减压蒸馏的方法浓缩得到粗产物。粗产物通过离心、洗涤、干燥的方式纯化,最终得到黄色产物 hf-d-ala。图3为化合物3的1h nmr谱图,从图中可以看出:1h nmr (dmso-d6,400mhz)δ8.95(s,1h),8.87(s,1h),8.42(d,j=8.1hz, 2h),8.36(s,1h),8.28(d,j=8.3hz,1h),8.10(d,j=9.2hz,1h), 8.08(d,j=8.7hz,2h),7.71(t,j=7.5hz,1h),7.60(t,j=7.5hz, 1h),3.70(t,j=6.7hz,1h),3.61(dt,j=7.2hz,j=6.8hz,1h),3.46 (t,j=6.4hz,1h)。图4为化合物3的esi-ms谱图,从图中可以看出:[mh]-的理论分子量为417.4,实际分子量为417.3。
[0063]
3)基于化合物3的纳米探针制备:
[0064]
将化合物3加入到dmso中,搅拌使其快速溶解,取适量混合均匀的溶液,将去离子水加入其中,通过沉淀法制备得到。
[0065]
实施例2:分子荧光探针3和其形成的纳米粒子光谱信息
[0066]
化合物3的uv-vis光谱表征:将化合物3溶于dmso中,取出2ml溶液,将其加入比色皿中,在可见光波长范围内收集其吸收光谱。
[0067]
纳米粒子的荧光光谱表征,具体步骤为:将2ml纳米粒子的水溶液,将其加入比色皿中,在445-700nm波长范围内收集其荧光发射光谱,激发光波长为415nm。
[0068]
如图5所示,化合物3在dmso中的最大吸收波长为415nm,最大发射波长为619nm,其stokes位移为204nm。纳米粒子在水中的最大吸收波长
[0069]
图6为化合物3和其形成的纳米探针的荧光发射图,从结果可知,在 dmso中化合物3以分子形式存在,其在620nm左右具有强烈的发射峰;当其在水相中聚集形成纳米粒子后,由于聚集诱导淬灭的原因,其发射峰大幅衰减,几乎不发射荧光。
[0070]
实施例3:纳米荧光探针的稳定性表征:
[0071]
通过动态光散射(dls)表征纳米粒子的步骤为:首先制备得到纳米粒子,将其加入到比色皿中,直接用于测试,结果如表1所示。
[0072]
表1为实施例1中纳米探针的粒径和在水中的稳定性表征
[0073][0074]
结果显示,本发明制备的纳米荧光探针粒子的粒径约为58nm,在水中分散5天后的其粒径能够一直稳定在60nm左右,主要原因为是分子结构中的氨基酸亲水基团使其可以在水相环境中均匀稳定地分散,从而提高了纳米探针在水相环境中的稳定性。
[0075]
实施例4:纳米荧光探针tem结构表征:
[0076]
通过tem探究化合物1形成的聚集体和化合物3的纳米探针的形貌差异,如图7所示,化合物3在水相溶剂中可自组装成一种圆球状,尺寸大约50-60 nm的纳米粒子,而化合物1形成的聚集体是一种无序、缠结的状态,说明分子结构中氨基酸亲水基元对纳米粒子的形貌和稳定性至关重要。
[0077]
实施例5:分子荧光探针co释放表征:
[0078]
将5ml hf-d-ala的dmso溶液加入到密封小瓶中,密封后用可见光灯 (410nm,10mw/cm2)对其辐照30min,通过co检测器检测辐照后小瓶中 co的含量。
[0079]
通过检测co释放量进一步确认纳米粒子的水溶稳定性,具体步骤为:选取含有纳米粒子的水溶液,并将其转移至可密封小瓶中,密封后用可见光(410 nm,10mw/cm2)辐照,使用co探测器检测辐照后瓶中co的含量。结果见表2。
[0080]
表2为实施例1中化合物3和纳米探针在黑暗和光照条件下的co释放量
[0081][0082]
表2中显示了纳米粒子及其分子形式释放co的性能,在黑暗条件下,纳米粒子及其分子形式均不释放co;而在纯dmso中,可见光照射分子荧光探针溶液可释放约187ppm的co,而纳米粒子仅释放约6ppm的co。这主要是由于分子的聚集状态抑制导致分子吸收的能量以非辐射跃迁的方式将能量耗散,从而无法激活co释放,也证明了纳米探针比其分子形式具有更好的光稳定性,避免光诱导的co泄露。
[0083]
实施例5:纳米荧光探针的细菌检测性能表征:
[0084]
将纳米粒子(30μm)与含有细菌的lb悬液液体培养基在37℃摇床上共孵育。随后,通过离心收集细菌沉淀,在便携式紫外灯下观察细菌的发光情况。
[0085]
如图8所示,用纳米粒子处理两种细菌沉淀物(金黄色葡萄球菌和大肠杆菌)在紫外灯下均发出强烈的红色荧光,而没有经过处理的细菌沉淀物没有发出任何荧光,这证明了细菌能够诱导纳米探针解聚,通过消除聚集诱导淬灭效应点亮细菌,实现对细菌的检测。
[0086]
实施例6:纳米荧光探针的杀菌性能表征:
[0087]
通过平板菌落计数法验证其杀菌性能,具体步骤为:将代谢了荧光探针分子的细菌用可见光(410nm,10mw/cm2)辐照1h后,将菌液涂覆到lb 固体琼脂板上,置于37℃培养箱
中培育24h,通过记录菌落的数量计算杀菌效率。结果如表3所示。
[0088]
表3为实施例1的纳米探针在不同时间的可见光照下的杀菌率;
[0089][0090]
由结果可知,分子标记后的细菌死亡率与可见光辐照时间相关,照射时间越长,co的杀菌率越高;在照射2h后,可实现对金黄葡萄球菌(s.aureus)、大肠杆菌(e.coli)和耐甲氧西林金黄色葡萄球菌(mrsa)的完全灭活。
[0091]
实施例6:纳米荧光探针的细胞毒性测试:
[0092]
采用cck-8法评估纳米荧光探针对小鼠成纤维细胞(l929细胞)的细胞毒性,具体步骤为:首先将l929细胞复苏,并转移至高糖型dmem中,于 37℃、5%co2的培养箱中培养。制备纳米荧光探针(100μm,2% dmso/dmem,v/v)的dmem分散液。将l929细胞(1
×
104cells/well)置于96孔板中培养24h,加入100μl含有纳米荧光探针的dmem分散液。然后用可见光(410nm,10mw/cm2)辐照1h,再放入培养箱中黑暗条件下孵育24h。共孵育后,用pbs缓冲液轻洗细胞,除去dmem,每孔中加入10% cck-8溶液(v/v),置于37℃培养箱中孵育2h。最后用多功能酶标仪测定其在450nm处的吸光度。
[0093]
细胞毒性结果如表4所示。
[0094]
表4为实施例1中纳米探针的细胞毒性
[0095][0096]
结果显示,纳米荧光探针与细胞共培养后细胞存活率在光照下仍均高于 90%,证明纳米荧光探针对l929细胞活性均没有明显不良影响。
[0097]
对比例1:化合物1形成的聚集体及相关性能测试
[0098]
(1)化合物1形成的聚集体的制备
[0099]
将化合物1加入到dmso中,搅拌使其快速溶解,取适量混合溶解的溶液,将去离子水加入其中,制备得到化合物1的聚集体。
[0100]
(2)化合物1形成的聚集体的稳定性测试通过动态光散射(dls)表征化合物1的聚集体的步骤为:首先制备得到化合物1形成的聚集体,将其加入比色皿中,直接测试,测试结果分析如表5所示。
[0101]
表5为实施例1中纳米探针的粒径和在水中的稳定性表征
[0102][0103]
结果显示,对比例1(化合物1形成的聚集体)在与纳米探针同样制备操作下得到的聚集体不稳定的,主要原因为是分子结构中并无亲水基团提供足够的亲/疏水作用和静电相互作用。
[0104]
(3)化合物1形成的聚集体的tem测试
[0105]
通过tem探究化合物1形成的聚集体的形貌,如图7所示,化合物3形成的聚集体是一种无序、缠结的状态,这也说明了分子结构中亲水基元对纳米粒子的形貌以及稳定性都至关重重要。
[0106]
(4)化合物1形成的聚集体的细菌检测性能测试
[0107]
将化合物1形成的聚集体与含有细菌的lb悬液液体培养基在37℃摇床上共孵育。随后,通过离心收集细菌沉淀,通过激光共聚焦显微镜观察细菌 (金黄色葡萄球菌)的荧光情况。通过结果分析,可以证明化合物1形成的聚集体并不能实现细菌检测成像的能力。
[0108]
(5)化合物1形成的聚集体的杀菌性能测试
[0109]
通过平板菌落计数法验证其杀菌性能,具体步骤为:将与化合物1形成的聚集体共孵育的细菌用可见光(410nm,10mw/cm2)辐照1h后,将菌液稀释后涂覆到lb固体琼脂板上,置于37℃培养箱中培育24h,通过记录菌落的数量计算杀菌效率。结果如表6所示。
[0110]
表6为化合物1形成的聚集体的纳米探针在不同时间的可见光照下的杀菌率;
[0111][0112]
由结果可知,与化合物1形成的聚集体共孵育的细菌死亡率与可见光辐照时间无关,杀菌效果很长,这与化合物1由于聚集导致的co释放被抑制相关。
[0113]
结论:
[0114]
由以上结果可以得知,本发明所述的纳米探针具有合成和制备简单、水溶稳定性好、光稳定性好等优势。在细菌感染时,纳米探针可以特异性识别细菌,通过荧光“点亮”细菌,从而实现对细菌感染的检测;光照后,代谢分子探针的细菌可以释放co,进行原位杀菌,即本发明提供的纳米可以同时实现细菌的特异性检测和治疗。
[0115]
对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。
