1.本发明涉及一株可发酵石斛且其发酵液可有效修复日光皮炎的罗伊氏乳杆菌,属于发酵工程领域以及医药技术领域。
背景技术:
2.近年来,肠道益生菌被广泛研究,被证明具有绝对安全性和广泛的功效潜能。利用益生菌发酵中药原料,挖掘能够发酵中药,提高发酵后发酵液的活性的菌株和发酵工艺,不但可以节约石斛资源,还可以提高中药的有效性及应用范围。
3.石斛为兰科石斛属植物,开始记载于《神农本草经》,是我国一味传统的名贵中药,自古以来就有“药中黄金”的美誉。石斛味甘,性微寒,具有益胃生津,滋阴清热的功效。研究表明,石斛中含有的主要活性成分为石斛多糖、石斛碱、氨基酸、芪类及其衍生物以及多种挥发性成分,其具有增强人体免疫能力、缓解身体疲劳、抗氧化、抑制衰老、降低血压、降低血糖、抑制肿瘤细胞等独特功效。
4.研究发现,石斛经过发酵后,其生理活性增强,发酵液中的总糖、还原糖及多糖分子量分布都会发生显著的变化,同时微生物生长过程中还会合成各种对人体有益的酶。在某些条件下,经发酵后的石斛提取液,其抗氧化能力,降血糖能力和调节人体脂肪代谢能力都有不同程度的提升,发酵也极大的改善了石斛在护肤方面的应用价值,而这种护肤作用的提升主要来自于发酵对石斛活性成分的改变。
5.日光性皮炎俗称晒斑,为强烈日光照射后引起的急性皮肤炎症,是由于中波紫外线过度照射,在皮肤上发生的急性光毒性反应,多见于春末夏初,妇女和儿童易发病。中医称本病为晒疮,认为是在日光暴晒之下,阳热毒邪侵入体表,蕴郁肌肤,灼皮伤肌而致;若毒热夹暑湿或与内湿搏结,浸淫肌肤,则会出现肿胀、水疱,破后糜烂、渗液。引起日光性皮炎的原因一般分为三大类原因,一类是食物因素,一类是美容因素,另一类是体质因素。
6.皮肤作为保护人体免受外界环境侵袭的屏障,是抵御外界机械、化学、物理及生物等各种刺激的第一道防线。研究表明,皮肤在收到紫外线辐照后,除了形成红斑和或色斑外,表皮细胞增殖速率加快,很多酶或蛋白被激活或者抑制,生成多量的氧自由基,这些改变都对皮肤屏障功能有着显著性影响。而皮肤屏障受损和皮肤免疫应答反应同时发生,皮肤屏障功能受损导致皮肤免疫应答失调,而皮肤免疫应答失调会加重皮肤屏障受损,从而恶性循环。只有在维持皮肤屏障完整性同时促使皮肤免疫应答正常化,才是保证皮肤健康的重要凭证。
7.随着人们对生活质量要求的提高,日光性皮炎带来的烦恼就越多。根据研究发现,针对日光性皮炎,大多数选择用中药进行修复治疗。但是,中药未经发酵直接提取的提取液,在护肤功效方面的效果无明显提升。而利用微生物生长代谢,中药的有效成分通过酵解后,含量有所提升,从而增加了原有功效,或者生成了原本不具有的有效成分,从而产生新的功效。近年来,随着石斛活性物质和功效成分的研究越来越多,石斛在化妆品中的应用逐
渐受到重视。但是,目前尚无能有效发酵石斛原料,使其发酵后的发酵液具有显著功效的发酵工艺。因此,利用现代发酵工程技术使发酵过程中限制性因素得到解决,使中药原料得到充分的开发利用,提高其有效成分,筛选出一株益生菌能够发酵石斛原料,且发酵后的提取液在针对有效修复日光皮炎方面,具有重要价值。
技术实现要素:
8.为了得到一种可提高石斛发酵液显著修复日光皮炎的能力的方法,本发明筛选出了一株罗伊氏乳杆菌(lactobacillus reuteri)ccfm1187。此罗伊氏乳杆菌ccfm1187可发酵石斛,石斛发酵液具有有效修复日光皮炎的作用,具体体现在:(1)罗伊氏乳杆菌ccfm1187在石斛发酵培养基中快速增殖,可发酵石斛,在15-16h时其活菌数为2.6
×
108cfu/ml;(2)石斛发酵液对3t3-l1细胞无细胞毒性;(3)石斛发酵液提高了sds诱导的hacat细胞的存活率,即提高皮肤屏障的修复效果;(4)石斛发酵液降低了lps的raw 264.7细胞的no含量,即具有有效修复日光皮炎的作用;因此,罗伊氏乳杆菌(lactobacillus reuteri)发酵石斛发酵液在针对有效修复日光皮炎的产品中,具有巨大的应用前景。
9.本发明提供了一株罗伊氏乳杆菌(lactobacillus reuteri)ccfm1187,所述罗伊氏乳杆菌ccfm1187保藏于广东省微生物菌种保藏中心,其保藏编号为gdmcc no:61729,保藏日期为2021年06月21日,保藏地址为广州市先烈中路100号大院59号楼5楼,广东省微生物研究所。
10.所述罗伊氏乳杆菌来源于云南大理邓川县的样本,该菌株经测序分析,其16s rdna序列如seq id no.1所示,将测序得到的序列在genebank中进行核酸序列比对,结果显示菌株ccfm1187与罗伊氏乳杆菌的相似度为:97.39%,因此,该菌株ccfm1187为罗伊氏乳杆菌,命名为罗伊氏乳杆菌(lactobacillus reuteri)ccfm1187。
11.所述罗伊氏乳杆菌ccfm1187的微生物形态学特征为:性状呈轻微不规则、圆形末端的弯曲杆菌。菌落呈现灰白色或乳白色,不透明、表面光滑、凸起、边缘整齐,直径1~1.5mm。
12.本发明还提供了上述罗伊氏乳杆菌ccfm1187在发酵含有石斛的原料中的应用。
13.本发明还提供了一种石斛发酵液,所述石斛发酵液是将上述罗伊氏乳杆菌ccfm1187接种至含有石斛的发酵培养基中进行发酵。
14.在本发明的一种实施方式中,所述罗伊氏乳杆菌ccfm1187在石斛发酵培养基中的接种量至少为1.0
×
106cfu/ml。
15.在本发明的一种实施方式中,所述罗伊氏乳杆菌ccfm1187在石斛发酵培养基中的接种量为1.0
×
106~1.0
×
107cfu/ml。
16.在本发明的一种实施方式中,所述发酵培养基包括:40~80g/l的石斛,10~40g/l的增殖因子,0.1~0.8g/l的微量元素,0.5~1.5ml/l的吐温;所述增殖因子为酵母浸粉、酵母提取物、酵母蛋白胨、胰蛋白胨、大豆蛋白胨等其中的一种或多种;所述微量元素为硫酸镁和/或硫酸锰。
17.在本发明的一种实施方式中,所述石斛发酵培养基的初始ph值为5.5~7.0。
18.本发明还提供了一种发酵石斛原料及提取石斛原料发酵液的方法,所述方法的具体步骤如下:
19.(1)将上述罗伊氏乳杆菌ccfm1187接种至含有石斛的培养基中进行发酵,得到发酵液;
20.(2)将步骤(1)中的发酵液离心去除沉淀,获得石斛发酵上清液;
21.(3)将步骤(2)中的发酵上清液进行灭菌,获得无菌石斛发酵上清液。
22.在本发明的一种实施方式中,步骤(1)中所述石斛发酵培养基的组成为干重40~80g/l的石斛,10~40g/l的增殖因子,0.1~0.8g/l的微量元素和0.5~1.5ml/l的吐温。
23.在本发明的一种实施方式中,所述石斛的制备方法为将新鲜或干石斛粉碎至颗粒小于60目。
24.在本发明的一种实施方式中,所述增殖因子为酵母浸粉、酵母提取物、酵母蛋白胨、胰蛋白胨、大豆蛋白胨等其中的一种或多种。
25.在本发明的一种实施方式中,所述微量元素为硫酸镁或硫酸锰的一种或两种。
26.在本发明的一种实施方式中,所述石斛发酵培养基的初始ph值为5.5~7.0。
27.在本发明的一种实施方式中,所述灭菌的条件为温度115-121℃,时间15~20min。
28.在本发明的一种实施方式中,步骤(1)中所述罗伊氏乳杆菌ccfm1187在石斛发酵培养基中的接种量为1
×
106~1.0
×
107cfu/ml。
29.在本发明的一种实施方式中,步骤(1)中所述发酵温度为32~38℃。
30.在本发明的一种实施方式中,步骤(1)中所述发酵ph为5.5~7.0。
31.在本发明的一种实施方式中,步骤(1)中所述发酵时间为15~24h。
32.在本发明的一种实施方式中,步骤(2)中所述离心的条件为:6000~10000g,时间为5~20min。
33.在本发明的一种实施方式中,步骤(2)中所述超声处理的条件为:温度25~80℃,超声功率200~500w,时间为10~30min。
34.本发明还提供了一种产品,所述产品包含上述罗伊氏乳杆菌ccfm1187,或包含上述石斛发酵液。
35.在本发明的一种实施方式中,所述产品中,罗伊氏乳杆菌ccfm1187的添加量至少为1.0
×
106cfu/ml。
36.在本发明的一种实施方式中,所述产品为食品、药品或化妆品。
37.在本发明的一种实施方式中,所述产品为保健品。
38.在本发明的一种实施方式中,所述药品含有罗伊氏乳杆菌ccfm1187或上述石斛发酵液、药物载体和/或药用辅料。
39.在本发明的一种实施方式中,所述药物载体包含微囊、微球、纳米粒以及脂质体;所述药用辅料包含赋形剂以及附加剂。
40.在本发明的一种实施方式中,所述食品是含有罗伊氏乳杆菌ccfm1187或其发酵代谢物,或上述石斛发酵液的食品。
41.在本发明的一种实施方式中,所述食品是使用罗伊氏乳杆菌ccfm1187或含罗伊氏乳杆菌ccfm1187的发酵剂生产得到的乳制品、豆制品或果蔬制品。
42.在本发明的一种实施方式中,所述食品是含有罗伊氏乳杆菌ccfm1187的固体饮料。
43.在本发明的一种实施方式中,所述化妆品为护肤品或洗护用品。
44.在本发明的一种实施方式中,所述药品包含涂抹行为药品。
45.在本发明的一种实施方式中,还含有附加剂。
46.在本发明的一种实施方式中,所述附加剂为软膏剂、防腐剂和/或抗氧化剂。
47.在本发明的一种实施方式中,所述涂抹型药品的剂型为膏剂、膜剂或凝胶剂。
48.本发明还提供了上述罗伊氏乳杆菌ccfm1187,或上述石斛发酵液在制备缓解日光皮炎症状的产品中的应用。
49.在本发明的一种实施方式中,所述产品为食品、药品或化妆品。
50.有益效果
51.本发明提供了一株罗伊氏乳杆菌(lactobacillus reuteri)ccfm1187,此罗伊氏乳杆菌ccfm1187能够发酵石斛,采用本发明的罗伊氏乳杆菌ccfm1187发酵得到的石斛发酵液具有有效修复日光皮炎的作用,具体体现在:
52.(1)罗伊氏乳杆菌ccfm1187在石斛发酵培养基中快速增殖,可发酵石斛,在15-16h时其活菌数为2.6
×
108cfu/ml;
53.(2)石斛发酵液对3t3-l1细胞无细胞毒性;
54.(3)石斛发酵液提高了sds诱导的hacat细胞的存活率,即提高皮肤屏障的修复效果,且优于石斛原料未发酵液和罗伊氏乳杆菌ccfm1187的发酵液,细胞存活率别是石斛原料未发酵液和罗伊氏乳杆菌ccfm1187的发酵液的1.11倍和1.08倍;
55.(4)石斛发酵液降低了lps的raw 264.7细胞的no含量,即具有有效修复日光皮炎的作用,且优于石斛原料未发酵液和罗伊氏乳杆菌ccfm1187的发酵液,细胞中的no含量分别是石斛原料未发酵液和罗伊氏乳杆菌ccfm1187的发酵液的0.82倍和0.88倍;
56.可见,罗伊氏乳杆菌(lactobacillus reuteri)发酵石斛发酵液在制备预防或治疗日光皮炎的产品中,具有巨大的应用前景。
57.生物材料保藏
58.一株罗伊氏乳杆菌(lactobacillus reuteri)ccfm1187,分类学命名为lactobacillus reuteri,已于2021年06月21日保藏于广东省微生物菌种保藏中心,保藏编号为gdmcc no:61729,保藏地址为广州市先烈中路100号大院59号楼5楼,广东省微生物研究所。
附图说明
59.图1:不同组别对3t3-l1细胞毒性效果对比。
60.图2:不同组别改善sds诱导的hacat细胞存活率效果对比。
61.图3:不同组别降低lps诱导的raw 264.7细胞炎症效果对比。
具体实施方式
62.下述实例中涉及的细胞(3t3-l1细胞,hacat细胞,raw264.7细胞)购自中国典型培养物保藏中心;下述实例中涉及的dmem培养基购自赛默飞世尔(苏州)仪器有限公司;下述实例中涉及的胎牛血清(fbs)、青霉素、链霉素和胰蛋白酶购自西格玛奥德里奇(上海)贸易有限公司;下述实例中涉及的mtt工作液购自北京索莱宝科技有限公司;下述实施例中涉及的no的试剂盒购自上海碧云天生物技术有限公司;下述实施例中所涉及的石斛购自北京东
方淼森生物科技有限公司。
63.下述实施例中所涉及的植物乳杆菌qs6-12公开于mao bingyong,yin ruimin,li xiaoshu,cui shumao,zhang hao,zhao jianxin,chen wei.comparative genomic analysis of lactiplantibacillus plantarum isolated from different niches.[j].genes,2021,12(2):论文当中;所涉及的干酪乳杆菌2-l2保藏于江南大学食品生物技术中心菌种保藏中心,从内蒙呼伦贝尔酸奶样本中筛选得到;所涉及的罗伊氏乳杆菌dl5-6保藏于江南大学食品生物技术中心菌种保藏中心,从云南大理邓川县奶牛样本中筛选得到。
[0064]
下述实施例的计算方法如下:
[0065]
1)活菌数的检测方法:采用国标《gb 4789.35-2016食品安全国家标准食品微生物学检测乳酸菌检测》。
[0066]
2)细胞存活率=(给药组od-空白组od)/(阴性组od-空白组od)
×
100%。
[0067]
3)细胞抑制率=1-细胞存活率。
[0068]
下述实施例中涉及的培养基如下:
[0069]
mrs液体培养基:蛋白胨10g/l、牛肉膏10g/l、葡萄糖20g/l、无水乙酸钠2g/l、酵母粉5g/l、柠檬酸氢二铵2g/l、k2po4·
3h2o 2.6g/l、mgso4·
7h20 0.1g/l、mnso
4 0.05g/l、吐温-80 1ml/l,ph 6.2~6.4。
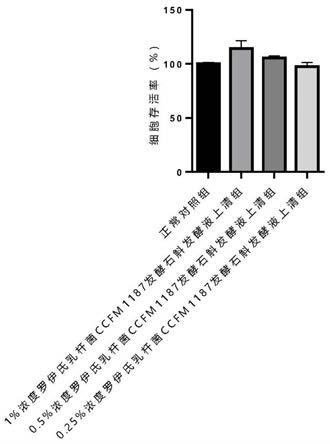
[0070]
mrs固体培养基:在mrs液体培养基的基础上添加20g/l的琼脂。
[0071]
石斛发酵培养基:石斛原料40g/l、酵母浸粉10g/l、七水硫酸镁0.58g/l、硫酸锰0.25g/l、吐温80 1ml/l后混合均匀,添加纯净水定容,调节ph值至7.0。
[0072]
完全培养基:10%胎牛血清(fbs)、100u/ml青霉素、100mg/ml链霉素、90%dmem培养基。
[0073]
实施例1:菌株的筛选与鉴定
[0074]
具体步骤如下:
[0075]
1、筛选
[0076]
样本来源于云南大理邓川县,将样本经预处理后,在20%甘油中保存于-80℃冰箱,取出解冻后,混匀并吸取0.5ml样本加到4.5ml生理盐水中,以含有9g/l生理盐水进行梯度稀释,选择合适的梯度稀释液涂布在mrs固体培养基上,于37℃培养48h,挑取罗伊氏乳杆菌的典型菌落至mrs固体培养基上划线纯化,挑取单菌落转接至mrs液体培养基增菌,30%甘油保藏,得到菌株,命名为ccfm1187;其中,罗伊氏乳杆菌的典型菌落呈现灰白色或乳白色,不透明、表面光滑、凸起、边缘整齐,直径1~1.5mm。
[0077]
2、鉴定
[0078]
提取菌株ccfm1187的基因组,将菌株ccfm1187的16s rdna进行扩增和测序(由苏州金唯智生物科技有限公司进行,ccfm1187的16s rdna核苷酸序列如seq id no.1所示),将该序列在ncbi中进行核酸序列比对,结果显示菌株ccfm1187与罗伊氏乳杆菌的相似度为:97.39%,因此,该菌株ccfm1187为罗伊氏乳杆菌,命名为罗伊氏乳杆菌(lactobacillus reuteri)ccfm1187。
[0079]
实施例2:采用罗伊氏乳杆菌发酵石斛制备得到的石斛发酵液
[0080]
具体步骤如下:
[0081]
1、菌株的活化与培养
[0082]
(1)将所有容器和工具灭菌。
[0083]
(2)取菌种ccfm1187保藏管震荡均匀后用无菌接种环蘸取少量菌液在mrs固体培养基划线纯化。静置一段时间后,将平板倒置于37℃恒温培养箱中48h。培养结束后挑取单菌落接种于5ml的mrs液体培养基中,静置于37℃恒温培养箱中培养12~18h;即得菌株ccfm1187的活化液,将制备得到的活化液按照上述方法连续活化两代,每次的接种量均为2%(v/v);制备得到经活化后的种子液。
[0084]
2、罗伊氏乳杆菌ccfm1187发酵石斛发酵液的制备
[0085]
(1)配制石斛发酵培养基:40g/l石斛、10g/l的酵母浸粉、0.58g/l的七水硫酸镁、0.25g/l的硫酸锰和1ml/l的吐温80后混合均匀,添加纯净水定容,调节ph值至7.0,于115℃条件下加热20min灭菌;
[0086]
(2)将步骤(1)中灭过菌的石斛发酵培养基冷却到40℃以下,于无菌环境下,在石斛发酵培养基中以终浓度为1
×
106cfu/ml的添加量加入步骤1中制备得到的罗伊氏乳杆菌ccfm1187种子液,在温度37℃,ph值为7.0条件下恒温恒ph发酵15-16h,此时,活菌数达到2.6
×
108cfu/ml;继续发酵至24h,达到发酵终点,获得含有石斛的发酵液,其中罗伊氏乳杆菌ccfm1187的活菌数为:7.2
×
108cfu/ml。
[0087]
(3)将步骤(2)中的含有石斛的发酵液在超声清洗机中以500w功率,80℃,超声10min后,8000g离心5min,离心除掉菌体和石斛发酵液的残渣,得到含有石斛的发酵上清液。将含有石斛的发酵上清液于115℃条件下加热20min灭菌,得到无菌的石斛发酵液,此时,石斛发酵液中不含有罗伊氏乳杆菌活菌。
[0088]
对照:
[0089]
将不采用罗伊氏乳杆菌发酵的含有石斛的发酵液命名为石斛原料未发酵液,制备方法如下:
[0090]
(1)配制石斛原料未发酵液:40g/l石斛、10g/l的酵母浸粉、0.58g/l的七水硫酸镁、0.25g/l的硫酸锰和1ml/l的吐温80后混合均匀,添加纯净水定容,调节ph值至7.0,于115℃条件下加热20min灭菌;
[0091]
(2)将步骤(1)中的含有石斛的发酵液在超声清洗机中以500w功率,80℃,超声10min后,8000g离心5min,离心除掉石斛原料未发酵液的残渣,得到含有石斛的上清液。将含有石斛的上清液于115℃条件下加热20min灭菌,得到无菌的石斛上清液,此时,石斛未发酵液中不含有活菌。
[0092]
3、罗伊氏乳杆菌ccfm1187发酵液的制备
[0093]
(1)配制罗伊氏乳杆菌ccfm1187的发酵培养基:蛋白胨10g/l、牛肉膏10g/l、葡萄糖20g/l、无水乙酸钠2g/l、酵母粉5g/l、柠檬酸氢二铵2g/l、k2po4·
3h2o 2.6g/l、mgso4·
7h20 0.1g/l、mnso
4 0.05g/l、吐温80 1ml/l,ph 6.2~6.4,于115℃条件下加热20min灭菌;
[0094]
(2)将步骤(1)中灭过菌的发酵培养基冷却至40℃以下,于无菌环境下,在罗伊氏乳杆菌ccfm1187的发酵培养基中以终浓度为1
×
106cfu/ml的添加量加入步骤1中制备得到的罗伊氏乳杆菌ccfm1187种子液,在温度37℃的恒温培养箱中发酵12~18h,此时,活菌数达到2.6
×
108cfu/ml,得到菌液;
[0095]
(3)罗伊氏乳杆菌ccfm1187发酵液:取步骤(2)制备得到的菌液8000rpm条件下离心15min取上清;调节ph至7.2~7.4;0.22μm一次性滤器过滤除菌,分装后于-20℃冰箱保
存。
[0096]
实施例3:罗伊氏乳杆菌ccfm1187发酵石斛发酵液对3t3-l1细胞存活的影响
[0097]
具体步骤如下:
[0098]
(1)培养3t3-l1细胞
[0099]
将3t3-l1细胞接种于25cm2的细胞培养瓶中,用完全培养基于37℃、5%co2、80%湿度的条件下进行常规培养,当细胞达到80%融合时,选取生长状态良好的3t3-l1细胞,用2.5g/l胰蛋白酶消化细胞重悬,制备细胞悬液。将细胞悬液以4
×
103个/孔接种于96孔细胞培养板中,每孔100μl,培养24h。
[0100]
(2)将96孔细胞培养板中的原培养液弃去,每孔加入采用罗伊氏乳杆菌ccfm1187发酵的石斛发酵液上清(以下简称石斛发酵液),培养条件为:37℃、5%co2、80%湿度;培养时间为:24h;所述石斛发酵液的添加量为:100μl;所述石斛发酵液与完全培养基分别按照体积比为(1%:99%)、(0.5%:99.5%)、(0.25%:99.75%)的比例添加至含有3t3-l1细胞的96孔细胞培养板。
[0101]
以未添加石斛发酵液的细胞为正常对照组。
[0102]
(3)取出培养板,mtt法检测细胞存活率,结果图1及表1所示。
[0103]
表1:罗伊氏乳杆菌发酵石斛发酵液对3t3-l1细胞存活率的影响
[0104]
组别/浓度(v/v)%细胞存活率(%)正常对照组100.00
±
1.32罗伊氏乳杆菌ccfm1187发酵石斛发酵液组/1%114.13
±
7.54罗伊氏乳杆菌ccfm1187发酵石斛发酵液组/0.50%105.74
±
1.56罗伊氏乳杆菌ccfm1187发酵石斛发酵液组/0.25%97.51
±
3.89
[0105]
由图1及表1可知,以正常对照组细胞存活率为100%,所述石斛发酵液与完全培养基分别采用体积比为(1%:99%)、(0.5%:99.5%)、(0.25%:99.75%)的比例对3t3-l1细胞的增殖存活率分别为114.13%、105.74%、97.51%(p>0.005)。
[0106]
可见,相比正常对照组,不同浓度的罗伊氏乳杆菌ccfm1187发酵石斛发酵液组的增殖存活率未有明显差别,罗伊氏乳杆菌ccfm1187发酵石斛原料发酵液对细胞无毒性,可用于修复日光皮炎。
[0107]
实施例4:罗伊氏乳杆菌发酵石斛发酵液对sds诱导的hacat细胞存活的影响
[0108]
具体步骤如下:
[0109]
1、培养hacat细胞
[0110]
将冻存的hacat细胞37℃复温后,1000rpm离心5min,取沉淀;将沉淀用完全培养基洗涤一次后,用完全培养基重悬细胞得到细胞重悬液;将细胞重悬液接种至10cm培养皿,于37℃、气相含5%(v/v)co2的细胞培养箱中培养,次日更换完全培养基继续于37℃、气相含5%(v/v)co2的细胞培养箱中培养。细胞生长至培养皿的70%~80%密度时进行传代培养,培养方法为:37℃、气相含5%(v/v)co2的细胞培养箱中培养。
[0111]
选取生长状态良好的hacat细胞,将hacat细胞经浓度为2.5g/l的胰蛋白酶消化后离心、用完全培养基重悬,进行细胞计数,得到细胞重悬液;将细胞重悬液按照5
×
103个/孔接种于96孔培养板中,每孔100μl;将96孔培养板置于37℃、气相含5%(v/v)co2的细胞培养箱中培养24h;更换含50μm sds的完全培养基处理细胞24h。
[0112]
2、不同石斛发酵液的制备:
[0113]
罗伊氏乳杆菌ccfm1187发酵石斛发酵液组:按照实施例2的方法制备得到罗伊氏乳杆菌ccfm1187发酵石斛发酵液;
[0114]
植物乳杆菌qs6-12发酵石斛发酵液组:按照实施例2的方法,区别在于,调整罗伊氏乳杆菌ccfm1187为植物乳杆菌qs6-12,制备得到植物乳杆菌qs6-12发酵石斛发酵液;
[0115]
干酪乳杆菌2-l2发酵石斛发酵液组,按照实施例2的方法,区别在于,调整罗伊氏乳杆菌ccfm1187为干酪乳杆菌2-l2,制备得到干酪乳杆菌2-l2发酵石斛发酵液;
[0116]
罗伊氏乳杆菌dl5-6发酵石斛发酵液组,按照实施例2的方法,区别在于,调整罗伊氏乳杆菌ccfm1187为罗伊氏乳杆菌dl5-6,制备得到罗伊氏乳杆菌dl5-6发酵石斛发酵液;
[0117]
石斛原料未发酵液组:按照实施例2中对照的方法制备得到的石斛原料未发酵液组;
[0118]
罗伊氏乳杆菌ccfm1187发酵液组:按照实施例2的方法制备得到罗伊氏乳杆菌ccfm1187发酵液组。
[0119]
3、不同的石斛发酵液对hacat细胞存活率的影响
[0120]
(1)各个组别分别如下:
[0121]
空白对照组:只含mtt工作液,无细胞作为空白对照组;
[0122]
阴性对照组:步骤1中制备得到的未经sds处理24h的hacat细胞作为阴性对照组;
[0123]
模型组:步骤1中制备得到的经sds处理24h的hacat细胞作为模型组;
[0124]
(2)不同乳杆菌发酵石斛发酵液组的制备:
[0125]
分别将步骤2制备得到的石斛原料未发酵液、罗伊氏乳杆菌ccfm1187发酵液、罗伊氏乳杆菌ccfm1187发酵石斛发酵液、植物乳杆菌qs6-12发酵石斛发酵液、干酪乳杆菌2-l2发酵石斛发酵液、罗伊氏乳杆菌dl5-6发酵石斛发酵液的上清与完全培养基按照体积比为10%:90%的比例进行混合,分别制备得到混合液;
[0126]
(3)混合后,向步骤1中经sds处理过的hacat细胞96孔板中,每孔添加100μl混合液,培养24h;
[0127]
阴性对照组与模型组添加100μl的完全培养基,培养24h;
[0128]
各组培养条件均为:37℃、气相含5%(v/v)co2的细胞培养箱中培养。
[0129]
每组设置5个复孔,mtt法检测细胞存活率。结果如表2及图2所示。
[0130]
表2:不同菌株发酵得到的石斛发酵液对细胞存活率的影响
[0131][0132][0133]
由图2及表2可知,以阴性对照组增殖存活率为100.00%,模型组增殖存活率为59.80%,石斛原料未发酵液组存活率为66.48%,罗伊氏乳杆菌ccfm1187发酵液组存活率为68.29%,而罗伊氏乳杆菌ccfm1187发酵石斛发酵液组存活率为73.68%,是模型组增殖存活率的1.23倍,是石斛原料未发酵液组存活率的1.11倍,是罗伊氏乳杆菌ccfm1187发酵液组存活率的1.08倍,显著促进了细胞的增殖(p<0.001)。植物乳杆菌qs6-12发酵石斛发酵液组存活率为66.75%,干酪乳杆菌2-l2发酵石斛发酵液组存活率为56.53%,罗伊氏乳杆菌dl5-6发酵石斛发酵液组存活率为54.10%。
[0134]
可见,相比于石斛原料未发酵液组,罗伊氏乳杆菌ccfm1187发酵液组,植物乳杆菌qs6-12发酵石斛发酵液组,干酪乳杆菌2-l2发酵石斛发酵液组,罗伊氏乳杆菌dl5-6发酵石斛发酵液组,罗伊氏乳杆菌ccfm1187发酵石斛原料发酵液更能够显著促进hacat细胞生长,缓解细胞屏障损伤。
[0135]
实施例5:罗伊氏乳杆菌发酵石斛发酵液对lps诱导的raw264.7细胞no含量的影响具体步骤如下:
[0136]
1、培养raw264.7细胞
[0137]
培养raw264.7细胞,接种于25cm2的细胞培养瓶中,用完全培养基于37℃、5%co2、80%湿度的条件下进行常规培养。当细胞达到80%融合时,选取生长状态良好的raw264.7细胞,用细胞刮刀收集raw264.7细胞,用完全培养基重悬,制备细胞悬液。将细胞悬液以5
×
104个/孔接种于24孔细胞培养板中,每孔500μl,培养24h。
[0138]
2、不同的石斛发酵液对raw264.7细胞no含量的影响
[0139]
(1)分别将按照实施例2的步骤2的方法制备得到的石斛原料未发酵液组、罗伊氏乳杆菌ccfm1187发酵液组、罗伊氏乳杆菌ccfm1187发酵石斛发酵液组、植物乳杆菌qs6-12发酵石斛发酵液组、干酪乳杆菌2-l2发酵石斛发酵液组、罗伊氏乳杆菌dl5-6发酵石斛发酵液上清与完全培养基按照体积比为(1%:99%)的比例进行混合,分别制备得到混合液;
[0140]
(2)混合后,分别向步骤1中得到的含有raw264.7细胞的24孔板中,每孔添加500μl混合液,将培养板置于37℃,5%co2培养箱中培养24h。
[0141]
各个组别的设置:
[0142]
阴性对照组:吸走步骤(2)培养后的24孔板上每个孔的培养基,加入完全培养基每孔500μl;
[0143]
模型组:向步骤1中得到的含有raw264.7细胞的24孔板中,加入已配置完成的5μg/ml的lps溶液,每孔500μl;
[0144]
样品组(各个乳杆菌发酵石斛发酵液组):吸走步骤(2)培养后的24孔板上每个孔的培养基,加入已配置完成的5μg/ml的lps溶液,每孔500μl;
[0145]
分别将上述各个组别的24孔板放入培养箱,在37℃温度下,继续培养24h后,吸取各组上清50μl于96板中,每组5个复孔,格里斯试剂法测定细胞no含量,结果表3及图3所示。
[0146]
表3不同菌株发酵得到的石斛发酵液对细胞no含量的影响
[0147]
组别no含量(μm)阴性对照组12.23
±
0.50模型组55.80
±
0.33石斛原料未发酵液组49.03
±
0.24罗伊氏乳杆菌ccfm1187发酵液组45.42
±
0.18罗伊氏乳杆菌ccfm1187发酵石斛发酵液组40.19
±
0.15植物乳杆菌qs6-12发酵石斛发酵液组48.23
±
0.27干酪乳杆菌2-l2发酵石斛发酵液组51.54
±
0.18罗伊氏乳杆菌dl5-6发酵石斛发酵液组54.26
±
0.09
[0148]
由图3及表3可知,罗伊氏乳杆菌ccfm1187发酵石斛发酵液组可显著降低细胞no含量。no是免疫调节过程中的重要介质,其产生过量可促发免疫病理过程致使组织损伤,导致皮肤炎症。以正常对照组no含量为12.23μm,模型组no含量为55.80μm,石斛原料未发酵液组no含量为49.03μm,罗伊氏乳杆菌ccfm1187发酵液组no含量为45.42μm,而罗伊氏乳杆菌ccfm1187发酵石斛发酵液组no含量为40.19μm,是模型组的no含量的0.72倍,是石斛原料未发酵液组no含量的0.82倍,是罗伊氏乳杆菌ccfm1187发酵液组no含量的0.88倍,显著降低了细胞的no含量(p<0.001)。植物乳杆菌qs6-12发酵石斛发酵液组no含量为48.23μm,干酪乳杆菌2-l2发酵石斛发酵液组no含量为51.54μm,罗伊氏乳杆菌dl5-6发酵石斛发酵液组no含量为54.26μm。
[0149]
可见,相比于石斛原料未发酵液组,罗伊氏乳杆菌ccfm1187发酵液组,植物乳杆菌qs6-12发酵石斛发酵液组,干酪乳杆菌2-l2发酵石斛发酵液组,罗伊氏乳杆菌dl5-6发酵石斛发酵液组,罗伊氏乳杆菌ccfm1187发酵石斛原料发酵液更能够显著抑制raw264.7细胞的no含量,改善细胞炎症损伤。
[0150]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
