1.本发明涉及基因工程领域,具体地,涉及一种糖链延伸糖基转移酶突变体及其编码基因以及基因工程菌和它们在制备络塞维e中的应用。
背景技术:
2.络塞、络塞维和络塞琳统称为络塞维复合物,是濒危植物玫瑰红景天中一类重要的活性成分,具有抗氧化,保护心脏,增强学习和记忆等功能。其中络塞维是主要活性成分,也是常用来评价玫瑰红景天提取物质量的重要标志物。研究发现络塞维复合物具有多种有益的药理作用,如益智、抗癌、增强免疫、抗抑郁、抗紫外辐射等。
3.cinnamyl-(6'-o-β-d-xylopyranosyl)-o-β-d-glucopyranosi de,2003年首次从玫瑰红景天中分离得到的络塞维类化合物(tolonen,a.,pakonen,m.,hohtola,a.,and jalonen,j.(2003)phenylpropanoid glycosides from rhodiola rosea.chem.pharm.bull.51,467-470.),与络塞维结构类似,将其命名为络塞维e。
4.目前,络塞维e的生产主要来源于植物提取。红景天生长于高寒地区,野生资源珍稀。近年来,因过度开采,玫瑰红景天已被包括中国在内多个国家列为濒危物种。受生长条件、病虫害等的制约,红景天至今未实现大规模人工种植;且植物红景天中活性成分积累周期很长,约需生长5-7年才能获得足够的活性成分。2006年,patov等人报道了络塞维的化学合成(kishida,m.,akita,h.(2005)simple synthesis of phenylpropenoidβ-d-glucopyranoside congeners based on mizoroki-heck type reaction of organoboron reagents.tetrahedron lett.46,4123-4125.)。但是化学合成步骤较多,产率低成本高,环境污染较严重。因此,需要开发一种能够高效生产络塞维e化合物的方法。
技术实现要素:
5.本发明的目的在于克服现有技术存在的上述缺陷,提供一种糖链延伸糖基转移酶突变体及其编码基因以及基因工程菌和它们在制备络塞维e中的应用,利用本发明的突变体,能够高产络塞维e。
6.本发明的发明人通过前期的研究,构建了含有编码苯丙氨酸解氨酶pal的基因,编码4-香豆酸辅酶a连接酶4cl的基因,编码肉桂酰辅酶a还原酶ccr的基因,编码udp葡萄糖基转移酶ugt的基因,实现了肉桂醇单葡萄糖苷络塞的微生物从头合成。在此基础上引入使糖链延伸的糖基转移酶的编码基因caugt3,得到了一种新的化合物,络塞葡糖苷(肉桂醇双葡萄糖苷,新化合物,命名为络塞维b或rosavin b)。
7.本发明的发明人在前期研究的基础上,通过理性设计,将上述糖链延伸糖基转移酶caugt3的145位和/或378位进行突变,并通过引入编码苯丙氨酸解氨酶pal的基因,编码4-香豆酸辅酶a连接酶4cl的基因,编码肉桂酰辅酶a还原酶ccr的基因、编码udp葡萄糖基转移酶ugt的基因,编码udp葡萄糖脱氢酶ugd的基因,编码udp木糖合酶uxs的基因,实现了络塞维e的合成,构建了基因工程菌,表达获得的如上产物的产量较高,最高可达472.86mg。
8.基于如上的发现,第一方面,本发明提供了一种糖链延伸糖基转移酶突变体,该突变体为seq id no.1所示的氨基酸序列经过如下突变且酶活力不变的由seq id no:1衍生的蛋白质;
9.seq id no.1所示的氨基酸序列的第145位的苏氨酸经非极性氨基酸取代;和/或
10.seq id no.1所示的氨基酸序列的第378位的天冬氨酸经极性中性氨基酸取代。
11.第二方面,本发明提供了如上所述的突变体的编码基因。
12.第三方面,本发明提供了一种基因工程菌,该基因工程菌含有编码苯丙氨酸解氨酶pal的基因,编码4-香豆酸辅酶a连接酶4cl的基因,编码肉桂酰辅酶a还原酶ccr的基因,编码udp葡萄糖基转移酶ugt的基因,编码udp葡萄糖脱氢酶的基因,编码udp木糖合酶的基因和如上所述的编码基因。
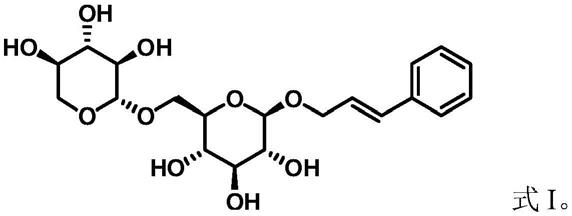
13.第四方面,本发明提供了如上所述的糖链延伸糖基转移酶突变体,或如上所述的编码基因,或者如上所述的基因工程菌在制备络塞维e中的应用;
14.其中,络塞维e的结构式如式i所示:
[0015][0016]
本发明的基因工程菌,可以发酵生产络塞维e(式i),产量最高可达472.86mg/l。因此,本发明提供了一种高产络塞维e的新的生物合成途径,为络塞维e的大规模工业生产奠定了基础,具有重要的科研价值和社会效益。
[0017]
此外,在本发明基因工程菌的摇瓶发酵中还可以同时产络塞,在罐发酵中还可以同时产络塞维b和络塞,以及肉桂醇。
[0018]
本发明的其它特征和优点将在随后的具体实施方式部分予以详细说明。
附图说明
[0019]
附图是用来提供对本发明的进一步理解,并且构成说明书的一部分,与下面的具体实施方式一起用于解释本发明,但并不构成对本发明的限制。在附图中:
[0020]
图1为本发明的在大肠杆菌表达菌株中生物合成络塞维e的途径示意图。
[0021]
图2为大肠杆菌菌株bphe-retn和bphe-re的发酵产物的hplc结果,其中,a是菌株bphe-retn的摇瓶发酵产物hplc检测图,b是菌株bphe-re的发酵产物hplc检测图,c是菌株bphe-retn的罐发酵产物hplc检测图。
[0022]
图3为峰1-4的ms图谱,a是化合物1肉桂醇,b是化合物2络塞,c是化合物3络塞维e,d是化合物4络塞维b。
[0023]
图4为络塞维e的nmr图,a为1h nmr,b为
13
c nmr。
具体实施方式
[0024]
以下对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
[0025]
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
[0026]
本发明中,所述络塞维e具有如下式i所示的结构,为肉桂醇-葡萄糖-木糖苷,本发明命名为络塞维e,英文命名为rosavin e,化学名称trans-cinnamyl-(6'-o-β-d-xylopyranosyl)-o-β-d-glucopyranoside,分子式c
20h28o10
,分子量428.18。
[0027][0028]
第一方面,本发明提供了一种糖链延伸糖基转移酶突变体,该突变体为seq id no.1所示的氨基酸序列经过如下突变且酶活力不变的由seq id no:1衍生的蛋白质;
[0029]
seq id no.1所示的氨基酸序列的第145位的苏氨酸经非极性氨基酸取代;和/或
[0030]
seq id no.1所示的氨基酸序列的第378位的天冬氨酸经极性中性氨基酸取代。
[0031]
组成蛋白质的20种氨基酸残基,按照侧链极性可以分成四类:1、非极性的氨基酸:丙氨酸(ala)、缬氨酸(val)、亮氨酸(leu)、异亮氨酸(ile)、甲硫氨酸(met)、苯丙氨酸(phe)、色氨酸(trp)和脯氨酸(pro);2、极性不带电荷的氨基酸:甘氨酸(gly)、丝氨酸(ser)、苏氨酸(thr)、半胱氨酸(cys)、天冬氨酸(asn)、谷氨酰胺(gln)和酪氨酸(tyr);3、带正电荷的氨基酸:精氨酸(arg)、赖氨酸(lys)和组氨酸(his);4、带负电荷的氨基酸:天冬氨酸(asp)和谷氨酸(glu)(参见“生物化学”(第二版)上册,沈同、王镜岩,第82-83页,高等教育出版社,1990年12月)。蛋白质中如果发生同属一个类别的氨基酸残基取代,例如由arg取代lys或由leu取代ile,所述残基在蛋白质结构域中所起的作用(比如提供正电荷或形成疏水囊袋结构的作用)没有改变,因此对蛋白质的立体结构并不会产生影响,因此仍然可以实现蛋白的功能。所述同属一个类别的氨基酸残基取代可以发生在上述的特定位点上。
[0032]
根据本发明,优选的,所述非极性氨基酸为丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、甲硫氨酸、脯氨酸或色氨酸,优选为缬氨酸、脯氨酸、甘氨酸、丙氨酸或异亮氨酸。
[0033]
根据本发明,优选的,所述极性中性氨基酸为苏氨酸、丝氨酸、半胱氨酸、天冬酰胺、谷氨酰胺、酪氨酸或甘氨酸;优选为谷氨酰胺或酪氨酸。
[0034]
根据本发明一种更为优选的实施方式,所述突变体在seq id no.1所示的氨基酸序列的第145位和第378位均有取代,进一步优选的,所述突变体的氨基酸序列如seq id no:2所示。
[0035]
第二方面,本发明提供了如上所述的突变体的编码基因。
[0036]
公知的,组成蛋白质的20种不同的氨基酸中,除met(atg)或trp(tgg)分别为单一密码子编码外,其他18种氨基酸分别由2-6个密码子编码(sambrook等,分子克隆,冷泉港实验室出版社,纽约,美国,第二版,1989,见950页附录d)。即由于遗传密码子的简并性,决定一个氨基酸的密码子大多不止一个,三联体密码子中第三个核苷酸的置换,往往不会改变氨基酸的组成,因此编码相同蛋白的基因的核苷酸序列可以不同。本领域人员根据公知的密码子表,根据相应酶的氨基酸序列,完全可以推导出能够编码它们的基因的核苷酸序列,通过生物学方法(如pcr方法、突变方法)或化学合成方法得到所述核苷酸序列,这些序列均应该视为在本发明的保护范围内。
[0037]
根据本发明一种更为优选的实施方式,为了进一步提高络塞维e在基因工程菌,特别是大肠杆菌中的表达量,所述基因的核苷酸序列如seq id no.3所示。
[0038]
第三方面,本发明提供了一种基因工程菌,该基因工程菌含有编码苯丙氨酸解氨酶pal的基因,编码4-香豆酸辅酶a连接酶4cl的基因,编码肉桂酰辅酶a还原酶ccr的基因,编码udp葡萄糖基转移酶ugt的基因,编码udp葡萄糖脱氢酶的基因,编码udp木糖合酶的基因和如上所述的编码基因。
[0039]
根据本发明,术语“苯丙氨酸解氨酶pal”为苯丙氨酸解氨酶phenylalanine ammonia-lyase,缩写pal,是催化直接脱掉苯丙氨酸上的氨而生成反式肉桂酸的酶,其可以为各种来源,例如,微生物来源、植物来源,其相应的氨基酸序列均为本领域技术人员所公知,可以利用本领域常规的技术手段获得,例如,可以通过在数据库(如ncbi)中搜索,或者在相关的公开文献中进行查询获得,本发明不再赘述。
[0040]
根据本发明,术语“4-香豆酸:辅酶a连接酶4cl”为hydroxycinnamate:coa ligase,缩写4cl,是单木质醇类和黄酮类生物合成中苯丙素代谢途径中的一个关键酶。其可以为各种来源,例如,微生物来源、植物来源,其相应的氨基酸序列均为本领域技术人员所公知,可以利用本领域常规的技术手段获得,例如,可以通过在数据库(如ncbi)中搜索,或者在相关的公开文献中进行查询获得,本发明不再赘述。
[0041]
根据本发明,术语“肉桂酰辅酶a还原酶ccr”为cinnamyl-coa reductase,缩写ccr,负责催化木质素单体生物合成中最重要的代谢反应,它将类苯丙酸类代谢物转移到木质素的合成途径中。其可以为各种来源,例如,微生物来源、植物来源,其相应的氨基酸序列均为本领域技术人员所公知,可以利用本领域常规的技术手段获得,例如,可以通过在数据库(如ncbi)中搜索,或者在相关的公开文献中进行查询获得,本发明不再赘述。
[0042]
根据本发明,术语“udp葡萄糖基转移酶ugt”为udp-glycosyltransferase,缩写为ugt,其在生物体内催化活化的葡萄糖基连接到不同的受体分子,如蛋白、核酸、寡糖、脂和小分子上,从而赋予糖基化的产物具有很多生物学功能。其可以为各种来源,例如,微生物来源、植物来源,其相应的氨基酸序列均为本领域技术人员所公知,可以利用本领域常规的技术手段获得,例如,可以通过在数据库(如ncbi)中搜索,或者在相关的公开文献中进行查询获得,本发明不再赘述。优选的,所述udp葡萄糖基转移酶ugt为udp葡萄糖基转移酶ugt73c5。
[0043]
根据本发明,术语“udp-葡萄糖脱氢酶”为udp-glucose 6-dehydrogenase,缩写为ugd,其在生物体内催化udp-葡萄糖生成udp-葡萄糖醛酸。其可以为各种来源,例如,微生物来源、植物来源,其相应的氨基酸序列均为本领域技术人员所公知,可以利用本领域常规的
技术手段获得,例如,可以通过在数据库(如ncbi)中搜索,或者在相关的公开文献中进行查询获得,本发明不再赘述。
[0044]
根据本发明,术语“udp木糖合酶”为udp-xylose synthase,缩写为uxs,其在生物体内催化udp-葡萄糖醛酸生成udp-木糖。其可以为各种来源,例如,微生物来源、植物来源,其相应的氨基酸序列均为本领域技术人员所公知,可以利用本领域常规的技术手段获得,例如,可以通过在数据库(如ncbi)中搜索,或者在相关的公开文献中进行查询获得,本发明不再赘述。
[0045]
公知的,组成蛋白质的20种不同的氨基酸中,除met(atg)或trp(tgg)分别为单一密码子编码外,其他18种氨基酸分别由2-6个密码子编码(sambrook等,分子克隆,冷泉港实验室出版社,纽约,美国,第二版,1989,见950页附录d)。即由于遗传密码子的简并性,决定一个氨基酸的密码子大多不止一个,三联体密码子中第三个核苷酸的置换,往往不会改变氨基酸的组成,因此编码相同蛋白的基因的核苷酸序列可以不同。本领域人员根据公知的密码子表,根据相应酶的氨基酸序列,完全可以推导出能够编码它们的基因的核苷酸序列,通过生物学方法(如pcr方法、突变方法)或化学合成方法得到所述核苷酸序列。
[0046]
根据本发明一种优选的实施方式,编码苯丙氨酸解氨酶pal的基因为来自拟南芥的atpal基因,genbank:ay133595.1。
[0047]
根据本发明一种优选的实施方式,编码4-香豆酸辅酶a连接酶4cl的基因如seq id no.5所示,或者为来自欧芹的pc4cl基因,genbank:x13325.1,优选如seq id no.5所示。
[0048]
根据本发明一种优选的实施方式,编码肉桂酰辅酶a还原酶ccr的基因为来自拟南芥的atccr基因,genbank:af332459.1。
[0049]
根据本发明一种优选的实施方式,编码udp葡萄糖基转移酶ugt73c5的基因如seq id no.4所示,或者为来自拟南芥的atugt73c5基因,genbank:kj138865.1,优选如seq id no.4所示。
[0050]
根据本发明一种优选的实施方式,编码udp-葡萄糖脱氢酶的基因为来自大肠杆菌内源的ecugd基因,gene id 946571。
[0051]
根据本发明一种优选的实施方式,编码udp木糖合酶的基因如seq id no.6所示,或者为来自中华根瘤菌sinorhizobium meliloti的smuxs基因,genbank:gu062741,优选如seq id no.6所示。
[0052]
根据本发明,用于构建所述基因工程菌的菌株可以为本领域常规使用的各种菌株,例如,可以真菌,如酵母,也可以为细菌,如杆菌。根据本发明一种优选的实施方式,所述菌株为大肠杆菌,对用于构建大肠杆菌表达菌株的大肠杆菌的种类没有特殊要求,可以为能够表达目的基因的本领域常用的各种大肠杆菌。为了使目的基因能够得到更好的表达,所述大肠杆菌优选为bl21(de3)和大肠杆菌dh5α,更优选为大肠杆菌菌株bl21(de3)。
[0053]
本发明的发明人在研究中发现,与使用野生型的大肠杆菌相比,当将大肠杆菌中构建为高产苯丙氨酸的大肠杆菌后,在引入本发明如上的各基因,获得目标产物的效率能够进一步提高。
[0054]
其中,所述高产苯丙氨酸的大肠杆菌可以为不表达tyrr(dna-binding transcriptional dual regulator tyrr)、tyra(fused chorismate mutase/prephenate dehydrogenase)和trpe(anthranilate synthase subunit trpe)基因的大肠杆菌,其构建
可以采用多种方法实现,例如,可以包括λred重组系统、crispr-cas9重组系统以及rnai等。优选的,本发明高产苯丙氨酸大肠杆菌构建采用λred重组系统。本发明构建的高产苯丙氨酸的大肠杆菌更适用于合成rosavin e。
[0055]
根据本发明,所述基因工程菌的构建方法可以通过本领域常规的技术手段完成,例如,通过在相应的菌株中导入插入有相应基因的载体为获得,本发明对表达载体的种类没有特殊要求,可以为能够在菌株中表达目的基因的本领域常用的各种表达载体,例如质粒等。本领域技术人员应该理解的是,表达载体的构建方法可以采用本领域常用的各种方法,如将目的基因经过酶切处理后连接至载体中,在此不再赘述。
[0056]
其中,用于构建本发明基因工程菌的基因可以通过克隆在一个载体中导入大肠杆菌,也可以克隆在不同的载体中导入大肠杆菌中,出于载体的承受能力以及大肠杆菌外源载体个数的承受能力,优选的,将用于构建本发明基因工程菌的基因克隆至2-3个载体中导入大肠杆菌。
[0057]
其中,用于构建本发明基因工程菌的基因在载体中的排列顺序没有特别的限制,只要能够进行有效地表达即可。
[0058]
第三方面,本发明提供了如上所述的糖链延伸糖基转移酶突变体,或如上所述的编码基因,或者如上所述的基因工程菌在制备络塞维e中的应用。
[0059]
进一步的,本发明还提供了一种生产络塞维e的方法,在含葡萄糖的培养基中培养如上所述的基因工程菌,并诱导外源基因的表达以生产络塞维e。
[0060]
根据本发明,所述培养条件为常规的培养条件,如使用含有作为筛选标记用抗生素的培养基,在35-40℃下培养至od
600
为0.5-0.7,然后加入异丙基-β-d-硫代半乳糖苷(iptg)在14-20℃进行诱导表达。在发酵培养时,上述基因能被翻译为相应的蛋白,并使相应蛋白发挥其作用。
[0061]
其中,以所述基因工程菌为大肠杆菌为例,所述培养基可以为lb培养基(溶剂为水,溶质及其终浓度分别为:tryptone 10g/l,酵母提取物5g/l,nacl 10g/l),也可以为改良m9y(na2hpo4·
12h2o 15.12g/l,kh2po
4 3.0g/l,nacl 0.5g/l,mgso4·
7h2o0.5g/l,cacl
2 0.011g/l,nh4cl 1.0g/l,tryptone 15g/l,酵母提取物5g/l,葡萄糖20g/l)液体培养基,本领域技术人员可以根据实际情况进行选择。
[0062]
根据本发明,在培养所得基因工程菌生产络塞维e时,还优选对构建的基因工程进行活化处理制备种子液,例如,在含有作为筛选标记用抗生素的培养基中,35-40℃培养12-20小时。
[0063]
根据本发明一种优选的实施方式,如上lb培养基可以用于基因工程菌的活化,也即,制备种子液,如上m9培养基可以用于络塞维e的生产。其中,所述种子液的接种量也可以为本领域常规的选择,例如,接种量为1体积%,也即,每100ml的m9液体培养基中加入1ml所述种子液。
[0064]
此外,本发明对iptg的浓度也没有特别的限制,优选地,其加入量可以使其在m9液体培养基中的终浓度为0.08-0.12mm。
[0065]
根据本发明,所述抗生素为表达载体上的作为筛选标记用的抗生素,以大肠杆菌常用转化载体为例,所述抗生素,例如,可以为链霉素和卡那霉素;所述抗生素的浓度为本领域的常规选择,例如,所述链霉素的加入量使其终浓度为80-120mg/l;所述卡那霉素的加
入量使其终浓度为40-60mg/l;所述氨苄青霉素的加入量使其终浓度为50-100mg/l。
[0066]
以下将通过实施例对本发明进行详细描述。
[0067]
以下实施例中,大肠杆菌菌株bl21(de3)和大肠杆菌dh5α购自北京全式金生物技术有限公司,大肠菌株bl21(de3)用于本发明中所有基因的表达,大肠杆菌dh5α用于本发明中所有基因的克隆。
[0068]
大肠杆菌表达载体pcdfduet-1,prsfduet-1,petduet-1购自novagen公司。
[0069]
phusion高保真dna聚合酶、2
×
high-fidelity master mix购自thermo公司。
[0070]
clonexpress multis one step cloning kit购自vazyme公司。
[0071]
所用引物以及基因均由深圳华大基因科技有限公司合成。
[0072]
下列实施例中未注明具体条件的试验方法,按照常规条件进行,例如《分子克隆:实验室手册》中所述的条件,或按照相应生物学试剂的制造厂商所建议的条件。
[0073]
苯丙氨酸解氨酶基因pal来自拟南芥(atpal,genbank:ay133595.1)。
[0074]
4-香豆酸辅酶a连接酶基因4cl如seq id no.5所示。
[0075]
肉桂酰辅酶a还原酶基因ccr来自拟南芥(atccr,genbank:af332459.1)。
[0076]
udp葡萄糖基转移酶ugt基因ugt73c5如seq id no.4所示。
[0077]
糖链延伸糖基转移酶突变体基因caugt3tn如seq id no.3所示。
[0078]
编码葡萄糖磷酸变位酶的基因来自大肠杆菌内源基因ecpgm,gene id 945271。
[0079]
编码utp-葡萄糖1-磷酸尿苷基转化酶的基因来自大肠杆菌内源基因ecgalu,gene id 945231。
[0080]
编码udp-葡萄糖脱氢酶的基因来自大肠杆菌内源基因ecugd,gene id 946571。
[0081]
编码udp木糖合酶的基因smuxs如seq id no.6所示。
[0082]
质粒pkd46(温度敏感型,含有受阿拉伯糖启动子调控的exo、bet和gam基因,ampr)、pkd4(含有两端带有frt位点的卡那抗性基因,kanr)、pcp20(温度敏感型,编码能够识别frt位点的flp重组酶,ampr)均为市售。
[0083]
实施例1
[0084]
本实施例用于说明糖链延伸糖基转移酶突变体caugt3-tn的获得
[0085]
以合成的caugt3基因(seq id no.1)为模板,用引物caugt3-5fpnde(seq id no.7)和引物caugt3-3rpbam(seq id no.8)进行pcr扩增,扩增产物经ndei和bamhi酶切后连入经ndei和bamhi酶切后的质粒pet28a中,转入大肠杆菌dh5α,扩增后抽提质粒,测序验证caugt3序列正确,构建得到pet28a-caugt3。
[0086]
通过tang method(tang,l.,gao,h.,zhu,x.,wang,x.,zhou,m.,jiang,r.,2012.construction of“small-intelligent”focused mutagenesis libraries using well-designed combinatorial degenerate primers.biotechniques 52,149-158.),设计四条突变引物将二十种天然氨基酸均一且无冗余地引入到突变库中,分别构建caugt3的145位点和375位点的饱和突变体库。pcr体系与程序与普通pcr无异,但是由于pcr是为了构建突变库,因此所用引物需使用混合引物。因为ndt/vma/atg/tgg分别编码了12/6/1/1种氨基酸,因此在进行引物混合时,所加入的ndt/vma/atg/tgg引物比例为12:6:1:1,这样才能保证所有氨基酸残基的均一性。以pet28a-caugt3为模板,将引物t145-f1(seq id no.9)、t145-f2(seq id no.10)、t145-f3(seq id no.11)和t145-f4(seq id no.12)按12:6:1:1
混合好,作为正向引物,t145-r(seq id no.13)为反向引物,进行pcr扩增,获得长度为200-300bp的pcr产物。以该pcr产物片段为引物,pet28a-caugt3为模板,进行重叠延伸pcr,pcr体系如下:2
×
high-fidelity master mix 25μl,上述pcr产物22μl,pet28a-caugt3质粒1μl,ddh2o 22μl。pcr产物加入dpn i酶处理2-3个小时后电转入大肠杆菌bl21(de3)宿主菌中。选取2块菌落数量大于突变库95%覆盖率的平板,其中一块平板用无菌ddh2o洗下平板上的菌落,提取混合质粒后送测序,测序结果显示在突变位点t145出现相应叠峰,说明突变库构建成功;另一块平板用于后续挑单克隆验证酶活。
[0087]
n375位点饱和突变体库构建方法与此相同,所用模板为pet-caugt3
t145v
,所用正向引物为n375-f1(seq id no.14)、n375-f2(seq id no.15)、n375-f3(seq id no.16)和n375-f4(seq id no.17),反向引物为n375-r1(seq id no.18)经过迭代饱和突变和活性验证,得到最优突变体质粒pet28a-caugt3
t145v/n375q
,命名为pet28a-caugt3-tn,经测序验证,所述突变体的编码基因的核苷酸序列如seq id no.3所示。
[0088]
测试例1
[0089]
用于说明caugt3t145位点饱和突变体库的活性筛选以及产物的鉴定
[0090]
(1)caugt3t145位点饱和突变体库的活性筛选
[0091]
挑取上述建库成功平板单克隆转移至含有200μl lb培养基的96孔深孔培养板,加入卡那霉素使终浓度为50mg/l,封膜后37℃,800rpm,振荡培养12h。取100μl过夜培养菌液转移至96孔甘油板,加入50μl 60%甘油,密封后于-80℃保存。向余下的过夜培养的96孔深孔培养板中加入800μl lb培养基(含卡那霉素50mg/l),并加入0.1mm iptg,30℃,800rpm,振荡培养12h诱导蛋白表达。4℃,4000rpm,离心10min收集菌体。用300μl 50mm ph7.4的磷酸钾缓冲液洗涤菌体。向洗涤后的菌体中加入400μl 50mm ph7.4的磷酸钾缓冲液重悬菌体,30℃振荡培养1h以破碎细胞,4℃4000rpm 30min离心收集上清。取100μl上清,加入2mm络塞和udp-木糖作为底物,30℃反应2h。加入100μl甲醇终止反应,4℃,4000rpm,离心30min,取上清hplc检测。
[0092]
(2)产物的检测
[0093]
产物的hplc检测:发酵液1ml,12000rpm离心5min后,取上清,进行hplc分析检测。分析条件如下:仪器为:安捷伦液相色谱仪,测定条件包括:c18柱(4.6
×
250mm);检测波长254nm;流动相a=水(含0.1%体积甲酸),b=乙腈;流速=1ml/min;梯度洗脱条件:0-5min 20%体积b;6-25min 20%体积b到100%体积b(6-25min内b的浓度均匀增加);25-30min,100%b;31-40min,20%b。进样量50μl。
[0094]
通过检测,获得可以识别udp-木糖,催化络塞生成络塞维e的突变体若干个,其对底物络塞的转化率表1所示:
[0095]
表1
[0096]
酶转化率caugt野生型无caugt3
t145v
7.6%caugt3
t145p
2.4%caugt3
t145a
1.5%caugt3
t145g
1.2%
ecugd-smuxs。
[0113]
将所述载体v1(pcdfduet-4cl-pal-ccr)、v3(prsfduet-atugt73c5-caugt3-tn)和v4(petduet-ecugd-smuxs)共同转化高产苯丙氨酸大肠杆菌bphe,得到生产络塞维e的大肠杆菌菌株bphe-retn。从葡萄糖到络塞维e的合成通路如图1所示。
[0114]
如上步骤(1)和(2)中,pcr扩增反应的反应体系为:5
×
phusion hf缓冲液10μl,2.5mm dntp 2.5μl,50μm正向引物0.5μl,50μm反向引物0.5μl,模板0.5μl,phusion dna聚合酶0.5μl,水35.5μl。
[0115]
pcr扩增反应的反应程序为:98℃预变性2分钟;98℃变性20秒,56℃退火45秒,72℃延伸2分钟,30个循环;72℃延伸10分钟。
[0116]
本发明菌株:如上步骤中,将质粒v1(pcdfduet-4cl-pal-ccr)、v3(prsfduet-atugt73c5-caugt3-tn)和v4(petduet-ecugd-smuxs)用化学转化的方法转入大肠杆菌菌株bl21(de3),所述转化方法具体为:取100μl大肠杆菌菌株bl21(de3)感受态细胞于冰上,10分钟后加入2μl质粒pcdfduet-4cl-pal-ccr,2μl质粒prsfduet-atugt73c5-caugt3-tn和2μl质粒petduet-ecugd-smuxs,轻轻混匀,冰上放置30分钟后,42℃热激90秒,取出立即于冰上放置2分钟,加入600μl lb液体培养基,37℃,150rpm摇床复苏培养30分钟,然后将菌液涂布在含链霉素、卡那霉素和氨苄青霉素的lb平板上。利用链霉素、卡那霉素和氨苄青霉素抗性筛选同时携带三种表达载体的转化菌株bphe-retn,并通过提取质粒进行酶切验证,得到能够合成络塞维e的重组大肠杆菌菌株bphe-retn。
[0117]
对照菌株:将所述载体v1(pcdfduet-4cl-pal-ccr)、v2(prsfduet-atugt73c5-caugt3)和v4(petduet-ecugd-smuxs)共同转化高产苯丙氨酸大肠杆菌bphe,得到对照菌株,生产络塞维b的大肠杆菌菌株bphe-re。
[0118]
测试例2
[0119]
本实施例用于说明大肠杆菌重组菌株bphe-retn的发酵培养以及产物的鉴定
[0120]
(1)发酵培养
[0121]
a摇瓶发酵
[0122]
1)将如上实施例2中构建的大肠杆菌表达菌株bphe-retn及对照菌株bphre-re分别接种至2ml含有作为筛选标记用抗生素(链霉素、卡那霉素和氨苄青霉素,终浓度分别为100mg/l、50mg/l和100mg/l)的lb液体培养基(胰蛋白胨10g/l,氯化钠10g/l,酵母提取物5g/l)中,并在37℃下培养12小时,得到大肠杆菌种子液。
[0123]
2)将步骤(1)中得到的大肠杆菌种子液以1体积%的接种量分别接种至50ml含有所述作为筛选标记用抗生素(链霉素、卡那霉素和氨苄青霉素,终浓度分别为100mg/l、50mg/l和100mg/l)的发酵培养基(胰蛋白胨15g/l,酵母提取物5g/l,na2hpo4·
12h2o15.12g/l,kh2po
4 3.0g/l,mgso4·
7h2o 0.5g/l,cacl
2 0.011g/l,nh4cl 1.0g/l)液体培养基中,并在37℃下培养,当od600达到0.6时加入异丙基-β-d-硫代吡喃半乳糖苷(iptg)使其终浓度为0.1mm,16℃下诱导培养16小时,加入终浓度为20g/l葡萄糖,30℃下发酵48小时得到含有发酵液。
[0124]
b 5l发酵罐发酵
[0125]
1)将如上实施例2中构建的大肠杆菌表达菌株bphe-retn接种至50ml含有作为筛选标记用抗生素(链霉素、卡那霉素和氨苄青霉素,终浓度分别为100mg/l、50mg/l和100mg/
l)的lb液体培养基(胰蛋白胨10g/l,氯化钠10g/l,酵母提取物5g/l)中,并在37℃下培养12小时,得到大肠杆菌种子液。
[0126]
2)将步骤(1)中得到的大肠杆菌种子液以2体积%的接种量接种至2.5l含有所述作为筛选标记用抗生素(链霉素、卡那霉素和氨苄青霉素,终浓度分别为100mg/l、50mg/l和100mg/l)的发酵培养基(胰蛋白胨15g/l,酵母提取物5g/l,na2hpo4·
12h2o15.12g/l,kh2po
4 3.0g/l,mgso4·
7h2o 0.5g/l,cacl
2 0.011g/l,nh4cl 1.0g/l)液体培养基中;ph设定为7.0,用5m氨水流加调节;葡萄糖浓度诱导前约1g/l,诱导后控制在5-10g/l,通过流加600g/l葡萄糖流加液控制。37℃下培养至od600达到16时加入iptg使其终浓度为0.1mm,16℃下诱导培养16小时后,30℃下发酵48小时,得到含有络塞维e的发酵液。其中,发酵液a为摇瓶发酵菌株bphe-retn发酵液;发酵液b为摇瓶发酵菌株bphe-re发酵液,发酵液c为罐发酵菌株bphe-retn发酵液。
[0127]
(2)产物的检测
[0128]
1)产物的hplc检测:发酵液1ml,12000rpm离心5min后,取上清,进行hplc分析检测。分析条件如下:仪器为:安捷伦液相色谱仪,测定条件包括:c18柱(4.6
×
250mm);检测波长254nm;流动相a=水(含0.1%体积甲酸),b=乙腈;流速=1ml/min;梯度洗脱条件:0-5min 20%体积b;6-25min 20%体积b到100%体积b(6-25min内b的浓度均匀增加);25-30min,100%b;31-40min,20%b。进样量50μl。
[0129]
发酵液hplc检测结果见图2。其中,发酵液a(摇瓶发酵菌株bphe-retn)中出现3个产物峰(峰1,2,3,图2a);发酵液b(摇瓶发酵菌株bphe-re)中出现3个产物峰(峰1,2,4,图2b),发酵液c(罐发酵菌株bphe-retn)中出现4个产物峰(峰1,2,3,4,图2c)。
[0130]
2)产物的lc-ms以及nmr分析:对步骤(1)中各发酵液中监测的峰进行lc-ms分析,其中,进行lc-ms分析的条件包括:c18柱(4.6
×
250mm);检测波长254nm;梯度洗脱条件:0-5min 20%体积b;6-25min 20%体积b到100%体积b(6-25min内b的浓度均匀增加);25-30min,100%b;31-40min,20%b。进样量50μl。esi正离子源,分子量扫描范围50-1000。
[0131]
结果如图3所示,发酵液a中产物峰1-3的扫描结果见图3a-c。峰1的ms图谱(图3a)上有肉桂醇的ms特征峰117.0700;峰2的ms图谱(图3b)上有络塞的ms特征峰319.1151;峰3的ms图谱(图3c)上有络塞维e的ms特征峰446.1997和451.1500。通过进一步的一维和二维nmr可以确定峰3为trans-cinnamyl-(6'-o-β-d-xylopyranosyl)-o-β-d-glucopyranoside,是玫瑰红景天重要活性成分络塞维的类似物,将其命名为络塞维e。nmr数据如下,具体如图4所示,其中,a为1h nmr,b为
13
c nmr。
[0132]1h nmr(600mhz,cd3od)δ7.42(dd,j=8.4,1.4hz,h-2,6),7.30(dd,j=7.5hz,h-3,5),7.26(d,j=7.5hz,h-7),6.69(d,j=15.9hz,h-7),6.36(dt,j=15.9hz,6.1hz,h-8),4.51(ddd,j=12.8,5.7,1.6hz,h-9α),4.37(d,j=7.8hz,h-1
′
),4.34(d,j=7.5hz,h-1
″
),4.32(ddd,j=12.8,5.6,1.5hz,h-9β),4.11(dd,j=11.5,2.1hz,h-6
′
α),3.86(dd,j=11.5,5.4hz,h-5
″
α),3.75(dd,j=11.5,5.9hz,h-6
′
β),3.49(m,h-4
″
),3.45(m,h-5
′
),3.35(m,h-3
″
),3.34(m,h-4
′
),3.32(h-3
′
),3.24(h-2
′
),3.22(h-2
″
),3.19(d,j=10.2hz,h-5
″
β).
13
c nmr(150mhz,cd3od)δ138.2(c-1),133.9(c-7),129.6(c-3,5),128.7(c-4),127.5(c-2,6),126.6(c-8),105.6(c-1
″
),103.4(c-1
′
),77.9(c-3
″
),77.7(c-3
′
),77.0(c-5
′
),75.1(c-2
′
),74.9(c-2
″
),71.5(c-4
′
),71.2(c-4
″
),70.9(c-9),69.8(c-6
′
),66.9(c-5
″
).
[0133]
峰4的ms图谱(图3d)上有络塞维b的ms特征峰476.2126和481.1686。
[0134]
且经测定,菌株bphe-retn摇瓶发酵液a中络塞维e的产量最高可达82.78
±
1.40mg/l,剩余络塞和肉桂醇的量分别为392.34
±
38.49mg/l和80.08
±
0.58mg/l;罐发酵液c中络塞维e的产量最高可达472.86
±
16.58mg/l,络塞维b的产量最高可达442.47
±
9.45mg/l,剩余络塞和肉桂醇的量分别为343.82
±
26.96mg/l和4.20
±
0.24mg/l。
[0135]
本发明的大肠杆菌可以发酵生产络塞维e、络塞、肉桂醇等3种化合物,其中络塞维e产量最高可达0.47g/l。因此,本发明提供了一种高产络塞维e的新的生物合成途径,络塞维e作为红景天重要活性成分或其类似物,具有很好的应用前景,为大规模工业生产奠定了基础,具有重要的经济价值和社会效益。
[0136]
以上详细描述了本发明的优选实施方式,但是,本发明并不限于上述实施方式中的具体细节,在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,这些简单变型均属于本发明的保护范围。
[0137]
另外需要说明的是,在上述具体实施方式中所描述的各个具体技术特征,在不矛盾的情况下,可以通过任何合适的方式进行组合,为了避免不必要的重复,本发明对各种可能的组合方式不再另行说明。
[0138]
此外,本发明的各种不同的实施方式之间也可以进行任意组合,只要其不违背本发明的思想,其同样应当视为本发明所公开的内容。
