1.本发明涉及通过三维培养而由多能干细胞制作胰岛素生产细胞的方法。
背景技术:
2.糖尿病是以各种遗传因素、环境因素作为背景而发病,由于慢性的高血糖而引起肾病等并发症,结果,使患者的qol显著降低的严重的疾病。现在,世界的糖尿病患者数超过4亿人,在医疗经济方面也视为问题。糖尿病大致分类为i型和ii型糖尿病,但在任一病态中,具有胰岛素分泌功能的胰腺β细胞的丧失都是主要原因。作为i型糖尿病、胰腺β细胞的丧失显著的严重的ii型糖尿病的治疗法,胰岛素制剂的施与成为一般的手段,但低血糖等副作用、需要频繁的自己注射等问题多。近年来,从脏器提供者分离出的胰岛细胞向i型糖尿病患者的移植成为可能,作为代替胰岛素治疗而能够进行糖尿病的完全缓解的治疗法被期待。然而,因为胰岛供体的不足而为难以普及的状况,因此期望尽快地实现用于大量地从多能干细胞制作胰岛素生产细胞的技术。
3.作为用于从多能干细胞制作胰岛素生产细胞的技术,报导了从es细胞或ips细胞使用下式所记载的化合物经过5阶段~7阶段的步骤向胰岛素生产细胞分化诱导的方法(专利文献1、非专利文献1、2、3、4、5)。在shahjalal等人的方法(专利文献1、非专利文献4)中,逐步经过5阶段的分化步骤而可以从人ips细胞制作胰岛素生产细胞。首先,在使ips细胞在维持培养基中增殖后,在阶段1中,用包含激活素a、gsk3β抑制剂chir99201的培养基培养几天,诱导成sox17阳性的定型内胚层细胞(definitive endoderm cells)。在阶段2中,将fgf10、音猬因子抑制剂kaad-环杷明对定型内胚层细胞处置几天,诱导成foxa2阳性的原始消化管细胞。进一步,在阶段3中,将原始消化管细胞用包含视黄酸、kaad-环杷明、tgfβ受体激酶抑制剂sb431542、bmp信号抑制因子noggin的培养基处置几天,分化诱导成pdx1阳性的胰腺祖细胞。在阶段4中,对胰腺祖细胞用蛋白激酶c活化剂吲哚内酰胺v、作为tgfβ受体激酶抑制剂的alk5inhibitor ii、noggin给予刺激,诱导成ngn3阳性的胰腺内分泌祖细胞。在最终阶段的阶段5中,通过将胰腺内分泌祖细胞用含有glp-1受体激动剂、烟酰胺的培养基培养几天,从而获得胰岛素生产细胞。
[0004][0005]
进一步也有使用了下式所记载的化合物的报导。有时代替在上述分化培养中使用的noggin而使用低分子抑制剂ldn193189、代替kaad-环杷明而使用sant-1(非专利文献2、6)、dorsomorphin(非专利文献5)。此外,在分化培养最终步骤中,有时使用forskolin、dexamethasone作为分化诱导剂(非专利文献5)。此外,axl抑制剂r428被报导为促进胰岛素生产细胞的功能成熟化的化合物(非专利文献3),akt抑制剂at7867被报导为促进pdx-1阳性的胰腺祖细胞的增殖的化合物(非专利文献7)。
[0006][0007]
为了将来源于多能干细胞的胰岛素生产细胞应用于细胞治疗,细胞功能的稳定性和制造法的效率性是重要的。细胞功能的稳定性是在每个实验中,所得的胰岛素生产细胞对高葡萄糖响应而分泌胰岛素的能力、分泌胰岛素的动态都再现性良好,显示恒定的能力,
但通过现有方法而获得的细胞,这些能力根据制造批次、细胞株的不同而变动,具有难以确保稳定的品质的问题。关于制造法的效率性,在现有的方法中,由于可以分化诱导的胰岛素生产细胞的数少从而具有成本效率差这样的问题。
[0008]
现有技术文献
[0009]
专利文件
[0010]
专利文件1:国际申请公开号2015/178397
[0011]
非专利文件
[0012]
非专利文件1:kroon,e.等人,pancreatic endoderm derived from human embryonic stem cells generates glucose-responsive insulin-secreting cells invivo.nature biotechnology,26:443-452,2008.
[0013]
非专利文件2:pagliuca f.w.,等人,generation of functional human pancreaticβcells in vitro.cell,159:428-439,2014.
[0014]
非专利文件3:rezania a.等人,reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells.naturebiotechnology,32:1122-1133,2014.
[0015]
非专利文件4:shahjalal h.等人,generation of insulin-producingβ-like cells from human ips cells in a defined and completely xeno-free culture system.journal of molecular cell biology,6:394-408,2014.
[0016]
非专利文件5:kunisada y.等人,small molecules induce efficient differentiation into insulin-producing cells from human induced pluripotent stem cells.stem cell research,8:274-284,2012.
[0017]
非专利文件6:nakashima r.等人,neural cells play an inhibitory role in pancreatic differentiation of pluripotent stem cells.genes cells,20:1028-1045,2015.
[0018]
非专利文件7:kimura a.等人,small molecule at7867proliferates pdx1-expressing pancreatic progenitor cells derived from human pluripotent stemcells.stem cell research,24:61-68,2017.
技术实现要素:
[0019]
发明所要解决的课题
[0020]
本发明的课题是提供实现从干细胞向胰岛素生产细胞的高分化效率的手段,这对于现有技术而言是困难的。
[0021]
用于解决课题的手段
[0022]
本发明人进行了努力研究,结果发现,由式(i)表示的化合物或其盐具有促进从多能干细胞向胰岛素生产细胞分化诱导的显著效果,另外发现这些化合物或其盐对于生产胰岛素生产细胞有用,由此完成了本发明。由式(i)表示的化合物具有完全不同于已知的分化诱导物的新结构,在分化过程的后半步骤中发挥超过已知的分化促进化合物和生长因子的进一步提高分化诱导效率的作用。
[0023]
也就是说,本发明涉及下面描述的[1]~[21]。
1,3-苯并二氧杂环戊烯基、c5-c10环烯基、可以被1或2个独立地选自取代基组α1的取代基取代的苯基、或可以被1或2个独立地选自取代基组α1的取代基取代的5或6元杂环基;
[0044]
所述取代基组α1:卤素原子、氰基、羧基、苯氧基、苯甲酰基、c1-c6烷基、c1-c6烷氧基、卤代c1-c6烷基、卤代c1-c6烷氧基、羟基c1-c6烷基、c1-c6烷氧基c1-c6烷氧基、(c1-c6烷基)羰基、(c1-c6烷氧基)羰基、(c1-c6烷氧基)羰基氧基、苯基c1-c6烷氧基、5或6元非芳族杂环基、可以被1或2个c1-c6烷基取代的氨甲酰基、被可以被1或2个c1-c6烷基取代的氨甲酰基取代了的c1-c6烷氧基、被1或2个c1-c6烷基取代了的氨磺酰基和可以被1或2个独立地选自取代基组β1的取代基取代的苯基;
[0045]
取代基组β1:卤素原子、c1-c6烷基、c1-c6烷氧基和(c1-c6烷氧基)羰基。
[0046]
[3]
[0047]
根据[1]所述的胰岛素生产细胞的制作法,其特征在于,
[0048]
由式(i)表示的化合物中的r3代表萘基、1,3-苯并二氧杂环戊烯基、2,2-二卤代-1,3-苯并二氧杂环戊烯基、c5-c10环烯基、可以被1或2个独立地选自取代基组α2的取代基取代的苯基、或可以被1或2个独立地选自取代基组γ2的取代基取代的5或6元杂环基;
[0049]
取代基组α2:卤素原子、氰基、羧基、苯氧基、苯甲酰基、c1-c6烷基、c1-c6烷氧基、卤代c1-c6烷基、卤代c1-c6烷氧基、羟基c1-c6烷基、c1-c6烷氧基c1-c6烷氧基、(c1-c6烷基)羰基、(c1-c6烷氧基)羰基、(c1-c6烷氧基)羰基氧基、苯基c1-c6烷氧基、5或6元非芳族杂环基、可以被1或2个c1-c6烷基取代的氨甲酰基、被可以被1或2个c1-c6烷基取代的氨甲酰基取代了的c1-c6烷氧基、被1或2个c1-c6烷基取代了的氨磺酰基和可以被1或2个独立地选自取代基组β2的取代基取代的苯基;
[0050]
取代基组β2:卤素原子、c1-c6烷基和c1-c6烷氧基;
[0051]
取代基组γ2:卤素原子、c1-c6烷基、c1-c6烷氧基、(c1-c6烷基)羰基和(c1-c6烷氧基)羰基。
[0052]
[4]
[0053]
根据[1]所述的胰岛素生产细胞的制作法,其特征在于,
[0054]
由式(i)表示的化合物中的r3代表萘基、1,3-苯并二氧杂环戊烯基、2,2-二氟-1,3-苯并二氧杂环戊烯基、c5-c8环烯烃-1-基、可以被1或2个独立地选自取代基组α3的取代基取代的苯基、或可以被1或2个独立地选自取代基组γ3的取代基取代的5或6元杂环基;
[0055]
取代基组α3:卤素原子、氰基、羧基、苯氧基、苯甲酰基、c1-c4烷基、c1-c4烷氧基、卤代c1-c2烷基、卤代c1-c2烷氧基、羟基c1-c4烷基、c1-c2烷氧基c1-c2烷氧基、(c1-c4烷基)羰基、(c1-c4烷氧基)羰基、(c1-c4烷氧基)羰基氧基、苯基c1-c4烷氧基、吗啉-1-基、可以被1或2个c1-c4烷基取代的氨甲酰基、被可以被1或2个c1-c4烷基取代的氨甲酰基取代了的c1-c2烷氧基、被1或2个c1-c4烷基取代了的氨磺酰基和可以被1或2个独立地选自取代基组β3的取代基取代的苯基;
[0056]
取代基组β3:氟原子、氯原子、c1-c4烷基和c1-c4烷氧基;
[0057]
取代基组γ3:卤素原子、c1-c4烷基、c1-c4烷氧基、(c1-c4烷基)羰基和(c1-c4烷氧基)羰基。
[0058]
[5]
[0059]
根据[1]至[4]中的任一项所述的胰岛素生产细胞的制作法,其特征在于,由式(i)
表示的化合物中的r1代表氢原子、氯原子或甲基。
[0060]
[6]
[0061]
根据[1]至[5]中的任一项所述的胰岛素生产细胞的制作法,其特征在于,由式(i)表示的化合物中的r2代表氢原子或甲基。
[0062]
[7]
[0063]
根据[1]至[6]中的任一项所述的胰岛素生产细胞的制作法,其特征在于,由式(i)表示的化合物中的a代表由式(i)表示的基团,且r4代表氢原子、c1-c6烷基、卤代c1-c6烷基或(c1-c6烷氧基)羰基。
[0064]
[8]
[0065]
根据[7]所述的胰岛素生产细胞的制作法,其特征在于,由式(i)表示的化合物中的r4代表氢原子、甲基或三氟甲基。
[0066]
[9]
[0067]
根据[1]至[6]中的任一项所述的胰岛素生产细胞的制作法,其特征在于,由式(i)表示的化合物中的a代表由式(ii)表示的基团,且r5代表氢原子、卤素原子或c1-c6烷基。
[0068]
[10]
[0069]
根据[9]所述的胰岛素生产细胞的制作法,其特征在于,由式(i)表示的化合物中的r5代表氢原子、氟原子或甲基。
[0070]
[11]
[0071]
根据[1]至[6]中的任一项所述的胰岛素生产细胞的制作法,其特征在于,由式(i)表示的化合物中的a代表由式(iii)表示的基团,且r5代表氢原子、氟原子或甲基。
[0072]
[12]
[0073]
根据[1]至[6]中的任一项所述的胰岛素生产细胞的制作法,其特征在于,由式(i)表示的化合物中的a代表由式(iv)表示的基团。
[0074]
[13]
[0075]
根据[1]至[12]中的任一项所述的胰岛素生产细胞的制作法,其特征在于,由式(i)表示的化合物中的n代表1。
[0076]
[14]
[0077]
根据[1]至[13]中的任一项所述的胰岛素生产细胞的制作法,其特征在于,由式(i)表示的化合物中的r3代表2,2-二氟-1,3-苯并二氧杂环戊烯基、1-叔丁氧基羰基-3,6-二氢-2h-吡啶-4-基或可以被1或2个取代基取代的苯基,所述取代基独立地选自氟原子、氯原子、三氟甲基、叔丁氧基、三氟甲氧基、2,2,2-三氟乙氧基、苄氧基和苯氧基。
[0078]
[15]
[0079]
根据[1]至[13]中的任一项所述的胰岛素生产细胞的制作法,其特征在于,由式(i)表示的化合物中的r3代表苯基、或间位或对位被选自氟原子、氯原子、三氟甲基、叔丁氧基、三氟甲氧基、2,2,2-三氟乙氧基、苄氧基和苯氧基中的任1个取代基取代了的苯基。
[0080]
[16]
[0081]
根据[1]所述的胰岛素生产细胞的制作法,其特征在于,由式(i)表示的化合物为选自以下化合物组中的任1个:
[0082][0083]
[17]
[0084]
根据[1]所述的胰岛素生产细胞的制作法,多能干细胞为人es细胞或人ips细胞。
[0085]
[18]
[0086]
根据[1]所述的胰岛素生产细胞的制作法,其特征在于,三维培养在低粘着性或非粘着性的培养容器内进行。
[0087]
[19]
[0088]
根据[1]~[18]中的任一项所述的胰岛素生产细胞的制作法,其特征在于,从多能干细胞向胰岛素生产细胞的分化过程包括以下步骤1~5,在选自步骤3、步骤4和步骤5中的至少一个步骤中,用包含由式(i)表示的化合物或其盐的培养基将细胞进行培养,
[0089]
步骤1:从多能干细胞诱导定型内胚层细胞的步骤,
[0090]
步骤2:从定型内胚层细胞诱导原始消化管细胞的步骤,
[0091]
步骤3:从原始消化管细胞诱导胰腺祖细胞的步骤,
[0092]
步骤4:从胰腺祖细胞诱导胰腺内分泌祖细胞的步骤,以及
[0093]
步骤5:从胰腺内分泌祖细胞诱导胰岛素生产细胞的步骤。
[0094]
[20]
[0095]
根据[19]所述的胰岛素生产细胞的制作法,其特征在于,在步骤3、步骤4和步骤5中,用包含由式(i)表示的化合物或其盐的培养基将细胞进行培养。
[0096]
[21]
[0097]
根据[19]所述的胰岛素生产细胞的制作法,其特征在于,在步骤1中,使用通过蛋氨酸除去培养基进行了前处理的多能干细胞。
[0098]
[22]
[0099]
一种从多能干细胞衍生出的胰岛素生产细胞,其是通过[1]~[21]中的任一项所述的方法制作的。
[0100]
[23]
[0101]
一种起因于胰岛素分泌异常或胰岛素分泌不足的疾病的治疗药,其包含通过[1]~[21]中的任一项所述的方法制作的从多能干细胞衍生出的胰岛素生产细胞。
[0102]
[24]
[0103]
根据[23]所述的治疗药,起因于胰岛素分泌异常或胰岛素分泌不足的疾病为i型糖尿病或ii型糖尿病。
[0104]
本说明书包含作为本技术的优先权的基础的日本专利申请、特愿2019-126861的说明书和/或附图所记载的内容。
[0105]
发明的效果
[0106]
当使从哺乳动物衍生出的多能干细胞分化成胰岛素生产细胞时,与已知的分化诱导方法相比,由式(i)表示的化合物或其盐具有显著效果。因此,使用该化合物的本发明的方法可以有效率地生产胰岛素生产细胞。此外,本发明的方法由于三维地培养细胞,因此与二维培养法相比,可以在更接近于生物体内的环境下培养细胞。
附图说明
[0107]
[图1]促进β细胞的分化的新的小分子化合物的筛选。a)使用sk7mes细胞的用于筛选增强β细胞分化的化合物的培养系统的概略图。b)β细胞分化促进剂的筛选流程的概要。c)k-1的化学结构。d)k-1对全细胞中的pdx1-gfp+ins+双阳性细胞的比例的效果。e)胰岛素1基因表达水平。d、e)通过dunnett的多重比较检验,显著性以
*
p<0.05、
**
p<0.01、或
***
p<0.001表示。f)与γ-分泌酶抑制剂ly411575的k-1的累加效应。计算出pdx1-gfp+和胰岛素+双阳性细胞相对于全细胞数(dapi+)的比例。胰岛素1mrna表达水平通过hprt1表达水平被标准化。值以3次实验的平均值
±
sem表示。显著性通过单侧独立t检验,以
*
p<0.05、
**
p<0.01、或
***
p<0.001表示。
[0108]
[图2-1]k-1及其衍生物促进从人ips细胞衍生出的β细胞的分化。a)用于评价化合物对使用了人ips细胞株(toe,rpchips771,和ffl-01s01)的β细胞分化的有效性的培养系统的概略图。b)toe hips细胞的单层培养中的与dmso对照相比的全细胞数中的所得的ins+细胞数的比例的倍率变化。c)使用rpchipsc771ips细胞,在分化实验方法#1、球培养下的全细胞中的产生的ins+pdx1+双阳性细胞的比例。d)从ips衍生出的细胞的阶段4的结束(左)或阶段5的结束(右)时的分子标志物的阳性。在不同的时间窗,也就是说,阶段3(s3)、阶段4(s4)、阶段5(s5)、阶段3&4(s3/4)、或阶段3、4&5(s3/4/5)中用k-3进行了处理。使用ff-i01s01,在分化实验方法#2下进行了培养。b)、c)和d):显著性通过dunnett的多重比较检验,显著性以
*
p<0.05、
**
p<0.01、或
***
p<0.001表示。
[0109]
[图2-2]k-1及其衍生物促进从人ips细胞衍生出的β细胞的分化。e)(左)用1μm的k-3及其衍生物或阴性对照进行了处理的ips-β细胞的时间依赖性gsis活性。处理在阶段3和4期间进行。在分化实验方法#1下进行了球培养。使用了rpchipsc771ips细胞。测定通过分步的经时方法进行。(右)以间歇式测定了在阶段3和4期间用k-3或阴性对照进行了处理的ips-β细胞的gsis活性。f)(左)ips-β细胞的时间依赖性gsis活性。将ips-β细胞在阶段3和4期间用1μm的k-3、-5、-6和2μm的k-4或阴性对照进行了处理。在分化实验方法#2下进行了球培养。使用了ff-i01s01ips细胞。测定通过分步的经时方法进行。(右)以间歇式测定了在阶段3和4期间用k-3或阴性对照进行了处理的ips-β细胞的gsis活性。g)对用k-3或阴性对照(dmso)进行了处理的ips-β细胞的、对不同的分泌促进物质(100nm艾塞那肽4、10μm格列本脲、和20mm kcl)的响应进行试验。通过dunnett的多重比较检验,显著性以
*
p<0.05、
**
p<0.01、或
***
p<0.001表示。e)左和f)左:显著性通过dunnett的多重比较检验,显著性以
*
p<0.05、
**
p<0.01、或
***
p<0.001表示。e)右和f)右和g):显著性通过单侧独立t检验,以
*
p<0.05、
**
p<0.01、或
***
p<0.001表示。
具体实施方式
[0110]
在下文中,将详细地描述本发明。
[0111]
在本说明书中,将使用下面描述的术语。
[0112]“卤素原子”是氟原子、氯原子、溴原子或碘原子。
[0113]“c1-c6烷基”是具有1-6个碳原子的直链或支链烷基。其具体例子包括甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、异戊基、2-甲基丁基、新戊基、1-乙基丙基、己基、异己基、3-甲基戊基、2-甲基戊基、1-甲基戊基、3,3-二甲基丁基、2,2-二甲基丁基、1,1-二甲基丁基或1,2-二甲基丁基。
[0114]“芳基”是具有6-10个碳原子的单环或二环芳族碳环,其可以与非芳族杂环或环烷烃稠合。其具体例子包括苯基、萘基、萘满基(tetralinyl)、茚满基(indanyl)、色满基(chromanyl)、2,3-二氢苯并呋喃基、1,3-苯并二氧杂环戊烯基、2,3-二氢-1,4-苯并二氧杂环己烯基、1,2,3,4-四氢喹啉基、1,2,3,4-四氢异喹啉基、吲哚啉基或3,4-二氢-2h-1,4-苯并嗪基。苯基、萘基或1,3-苯并二氧杂环戊烯基等是优选的。
[0115]“c5-c10环烯基”是在具有5-10个碳原子的环内具有一个双键的烃环,所述环可以与亚烷基交联。其具体例子包括环戊烯基、环己烯基、环庚烯基、环辛烯基、双环[2.2.1]庚烯基或双环[2.2.2]辛烯基。
[0116]“杂环基”是4至10元环基团(其中除了碳以外构成环的原子是1-4个独立地选自氮、氧和硫的杂原子),它们可以是芳族的或非芳族的,或在非芳族的情况下可以与亚烷基交联。非芳族杂环基的具体例子包括氮杂环丁基、吡咯烷基、哌啶基、氮杂环庚烷基、二氮杂环庚烷基、氮杂环辛烷基、哌嗪基、高哌嗪基、吗啉基、氧氮杂环庚烷基、硫代吗啉基、硫杂氮杂环庚烷基、四氢吡喃基、四氢呋喃基、二氧杂环己烷基、二氧杂环戊烷基、2-氮杂双环[2.2.1]庚基、2,5-二氮杂双环[2.2.1]庚基、3-氮杂双环[3.2.1]辛基、8-氮杂双环[3.2.1]辛基、9-氮杂双环[3.3.1]壬基、3,9-二氮杂双环[3.3.1]壬基、二氢吡喃基、二氢吡咯基、二氢吡啶基、四氢吡啶基、四氢吡嗪基、3,9-二氮杂螺[5.5]十一碳-3-基、1,9-二氮杂螺[5.5]十一碳-9-基、1,8-二氮杂螺[4.5]癸-8-基、或1,4-二氧杂-8-氮杂螺[4.5]癸-8-基。芳族杂环基的例子包括呋喃基、吡咯基、噻吩基、唑基、噻唑基、咪唑基、吡唑基、二唑基、噻二唑基、三唑基、四唑基、吡啶基、吡嗪基、嘧啶基、哒嗪基、三嗪基、吲哚基、异吲哚基、吲唑基、嘌呤基、喹啉基、异喹啉基或萘啶基。
[0117]“c1-c6烷氧基”是上述c1-c6烷基键合于氧原子的基团。其具体例子包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、仲丁氧基、异丁氧基、叔丁氧基、戊氧基、异戊氧基、新戊氧基、己氧基或异己氧基。
[0118]“卤代c1-c6烷基”是上述c1-c6烷基被1-7个卤素原子取代的基团。其具体例子包括三氟甲基、二氟甲基、1,1-二氟乙基、2,2-二氟乙基或2,2,2-三氟乙基。
[0119]“卤代c1-c6烷氧基”是上述c1-c6烷氧基被1-7个卤素原子取代的基团。其具体例子包括氟甲氧基、二氟甲氧基、二氯甲氧基、二溴甲氧基、三氟甲氧基、三氯甲氧基、2-氟乙
氧基、2-溴乙氧基、2-氯乙氧基、2-碘乙氧基、2,2-二氟乙氧基、2,2,2-三氟乙氧基、2,2,2-三氯乙氧基、五氟乙氧基、3-氟丙氧基、3-氯丙氧基、4-氟丁氧基、5-氟戊氧基或6-氟己氧基。
[0120]“羟基c1-c6烷基”是上述c1-c6烷基被一个羟基取代的基团。其具体例子包括羟基甲基、羟基乙基、羟基丙基、羟基丁基、羟基戊基或羟基己基。
[0121]“c1-c6烷氧基c1-c6烷氧基”是上述c1-c6烷氧基被c1-c6烷氧基取代的基团。其具体例子包括甲氧基甲氧基、甲氧基乙氧基、甲氧基丙氧基、乙氧基甲氧基、乙氧基乙氧基、乙氧基丙氧基或丙氧基丙氧基。
[0122]“(c1-c6烷基)羰基”是上述c1-c6烷基键合于羰基的基团。其具体例子包括乙酰基、丙酰基、丁酰基、异丁酰基或新戊酰基。
[0123]“(c1-c6烷氧基)羰基”是上述c1-c6烷氧基键合于羰基的基团。其具体例子包括甲氧基羰基、乙氧基羰基、正丙氧基羰基、异丙氧基羰基、正丁氧基羰基、异丁氧基羰基、仲丁氧基羰基、叔丁氧基羰基、正戊氧基羰基、异戊氧基羰基、新戊氧基羰基、正己氧基羰基或异己氧基羰基。
[0124]“(c1-c6烷氧基)羰基氧基”是上述c1-c6烷氧基键合于羰基氧基的基团。其具体例子包括甲氧基羰基氧基、乙氧基羰基氧基、正丙氧基羰基氧基、异丙氧基羰基氧基、正丁氧基羰基氧基、异丁氧基羰基氧基、仲丁氧基羰基氧基、叔丁氧基羰基氧基、正戊氧基羰基氧基、异戊氧基羰基氧基、新戊氧基羰基氧基、正己氧基羰基氧基或异己氧基羰基氧基。
[0125]“苯基c1-c6烷氧基”是上述c1-c6烷氧基在任何位置被苯基取代的基团。其具体例子包括苄氧基、1-苯基乙氧基、2-苯基乙氧基、1-苯基丙氧基、2-苯基丙氧基或3-苯基丙氧基。
[0126]“可以被1或2个c1-c6烷基取代的氨甲酰基”是氨甲酰基或上述1或2个c1-c6烷基键合于氨甲酰基的基团。其具体例子包括氨甲酰基、甲基氨甲酰基、二甲基氨甲酰基、乙基氨甲酰基、二乙基氨甲酰基、乙基甲基氨甲酰基、丙基氨甲酰基或二丙基氨甲酰基。
[0127]“被可以被1或2个c1-c6烷基取代的氨甲酰基取代了的c1-c6烷氧基”是上述c1-c6烷氧基被氨甲酰基取代了的基团,所述氨甲酰基可以被1或2个c1-c6烷基取代。其具体例子包括氨甲酰基甲氧基、氨甲酰基乙氧基、甲基氨甲酰基甲氧基、甲基氨甲酰基乙氧基、二甲基氨甲酰基甲氧基、二甲基氨甲酰基乙氧基、乙基氨甲酰基甲氧基、乙基氨甲酰基乙氧基、二乙基氨甲酰基甲氧基、二乙基氨甲酰基乙氧基、乙基甲基氨甲酰基甲氧基、乙基甲基氨甲酰基乙氧基、丙基氨甲酰基甲氧基、丙基氨甲酰基乙氧基、二丙基氨甲酰基甲氧基或二丙基氨甲酰基乙氧基。
[0128]“被1或2个c1-c6烷基取代了的氨磺酰基”是上述1或2个c1-c6烷基键合于氨磺酰基的基团。其具体例子包括甲基氨磺酰基、二甲基氨磺酰基、乙基氨磺酰基、乙基甲基氨磺酰基、二乙基氨磺酰基、丙基氨磺酰基或二丙基氨磺酰基。
[0129]“c1-c4烷基”是具有1-4个碳原子的直链或支链烷基。其具体例子包括甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基或叔丁基。
[0130]“c1-c4烷氧基”是上述c1-c4烷基键合于氧原子的基团。其具体例子包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、仲丁氧基、异丁氧基或叔丁氧基。
[0131]“c1-c2烷基”是具有1或2个碳原子的直链烷基,为甲基和乙基。
[0132]“卤代c1-c2烷基”是上述c1-c2烷基被1-5个卤素原子取代的基团。其具体例子包括三氟甲基、二氟甲基、1,1-二氟乙基、2,2-二氟乙基或2,2,2-三氟乙基。
[0133]“c1-c2烷氧基”是上述c1-c2烷基键合于氧原子的基团,具体为甲氧基和乙氧基。
[0134]“卤代c1-c2烷氧基”是上述c1-c2烷氧基被1-5个上述卤素原子取代的基团。其具体例子包括氟甲氧基、二氟甲氧基、二氯甲氧基、二溴甲氧基、三氟甲氧基、三氯甲氧基、2-氟乙氧基、2-溴乙氧基、2-氯乙氧基、2-碘乙氧基、2,2-二氟乙氧基、2,2,2-三氟乙氧基、2,2,2-三氯乙氧基或五氟乙氧基。
[0135]“羟基c1-c4烷基”是上述c1-c4烷基被一个羟基取代的基团。其具体例子包括羟甲基、羟乙基、羟丙基或羟丁基。
[0136]“c1-c2烷氧基c1-c2烷氧基”是上述c1-c2烷氧基被c1-c2烷氧基取代的基团。其具体例子包括甲氧基甲氧基、甲氧基乙氧基、乙氧基甲氧基或乙氧基乙氧基。
[0137]“(c1-c4烷基)羰基”是上述c1-c4烷基键合于羰基的基团。其具体例子包括乙酰基、丙酰基、丁酰基、异丁酰基或新戊酰基。
[0138]“(c1-c4烷氧基)羰基”是上述c1-c4烷氧基键合于羰基的基团。其具体例子包括甲氧基羰基、乙氧基羰基、正丙氧基羰基、异丙氧基羰基、正丁氧基羰基、异丁氧基羰基、仲丁氧基羰基或叔丁氧基羰基。
[0139]“(c1-c4烷氧基)羰基氧基”是上述c1-c4烷氧基键合于羰基氧基的基团。其具体例子包括甲氧基羰基氧基、乙氧基羰基氧基、正丙氧基羰基氧基、异丙氧基羰基氧基、正丁氧基羰基氧基、异丁氧基羰基氧基、仲丁氧基羰基氧基或叔丁氧基羰基氧基。
[0140]“苯基c1-c4烷氧基”是上述c1-c4烷氧基在任何位置被苯基取代的基团。其具体例子包括苄氧基、1-苯基乙氧基、2-苯基乙氧基、1-苯基丙氧基、2-苯基丙氧基或3-苯基丙氧基。
[0141]“可以被1或2个c1-c4烷基取代的氨甲酰基”是氨甲酰基或上述1或2个c1-c4烷基键合于氨甲酰基的基团。其具体例子包括氨甲酰基、甲基氨甲酰基、二甲基氨甲酰基、乙基氨甲酰基、二乙基氨甲酰基、乙基甲基氨甲酰基、丙基氨甲酰基或二丙基氨甲酰基。
[0142]“被可以被1或2个c1-c4烷基取代的氨甲酰基取代了的c1-c2烷氧基”是上述c1-c2烷氧基被氨甲酰基取代了的基团,所述氨甲酰基可以被1或2个c1-c4烷基取代。其具体例子包括氨甲酰基甲氧基、氨甲酰基乙氧基、甲基氨甲酰基甲氧基、甲基氨甲酰基乙氧基、二甲基氨甲酰基甲氧基、二甲基氨甲酰基乙氧基、乙基氨甲酰基甲氧基、乙基氨甲酰基乙氧基、二乙基氨甲酰基甲氧基、二乙基氨甲酰基乙氧基、乙基甲基氨甲酰基甲氧基、乙基甲基氨甲酰基乙氧基、丙基氨甲酰基甲氧基、丙基氨甲酰基乙氧基、二丙基氨甲酰基甲氧基或二丙基氨甲酰基乙氧基。
[0143]“被1或2个c1-c4烷基取代了的氨磺酰基”是上述1或2个c1-c4烷基键合于氨磺酰基的基团。其具体例子包括甲基氨磺酰基、二甲基氨磺酰基、乙基氨磺酰基、乙基甲基氨磺酰基、二乙基氨磺酰基、丙基氨磺酰基或二丙基氨磺酰基。
[0144]“干细胞”是具有自我复制能力和多向分化潜能的细胞,其例子包括es细胞、ips细胞和成体干细胞。
[0145]“多能干细胞”是具有分化成生物体的多种细胞的能力的细胞,优选地是es细胞或ips细胞。
[0146]“胰岛素生产细胞”是这样的细胞:其对高血糖等反应而分泌胰岛素,且与其它胰腺激素诸如胰高血糖素或生长抑素相比具有显著优秀的表达胰岛素的能力。
[0147]“三维培养”:是指细胞在不与培养容器粘着的条件下培养,从而在通过细胞彼此的粘着而形成的球(对于多能干细胞,也称为“胚状体”。)的状态下培养,在本说明书中,也有时表述为“球培养”。
[0148]
<胰岛素细胞的生产法>
[0149]
本发明提供一种胰岛素生产细胞的制作法,是通过使多能干细胞分化成胰岛素生产细胞来制作胰岛素生产细胞的方法,其特征在于,包括下述步骤:用包含由式(i)表示的化合物或其盐的培养基将细胞进行三维培养。通过下面描述的参考例1、实施例1的方法,可以证实由式(i)表示的化合物或其盐的促进分化成胰岛素生产细胞的效果。
[0150]
多种干细胞可以用作成为对象的多能干细胞,只要它们是具有向内胚层细胞分化的分化能的干细胞即可,但是所述多能干细胞优选地是es细胞或ips细胞,更优选ips细胞。多能干细胞的来源只要是哺乳动物,则可以采用多种来源,但是优选人类、小鼠、大鼠、宠物动物诸如狗和猫、家畜动物诸如牛、马、猪和绵羊,更优选人类。
[0151]
从多能干细胞向胰岛素生产细胞的分化过程例如如在非专利文件4中所述,分为五个阶段。也就是说,所述五个阶段是:阶段1,从多能干细胞诱导sox17阳性的定型内胚层细胞;阶段2,从定型内胚层细胞诱导foxa2阳性的原始消化管细胞;阶段3,从原始消化管细胞诱导pdx1阳性的胰腺祖细胞;阶段4,从胰腺祖细胞诱导ngn3阳性的胰腺内分泌祖细胞;和阶段5,从胰腺内分泌祖细胞最终诱导胰岛素生产细胞。根据情况有时阶段1进一步细分化,细分化为成为中内胚层细胞的状态的阶段1-1和然后诱导定型内胚层细胞的阶段1-2,阶段2进一步根据分化培养基中的锌浓度的不同而细分化为阶段2-1和阶段2-2,阶段5进一步根据分化培养基中的视黄酸浓度的不同而细分化为阶段5-1和阶段5-2。在本说明书中,细胞的分化阶段有时可以用这些阶段表达。
[0152]
作为这些培养所使用的培养基,只要是通常的细胞培养所使用的培养基,就没有特别限定,可以使用各种培养基,可以采用例如dmem培养基、α-mem培养基、rpmi培养基、stemfit培养基(味
の
素,ak03、ak03n等)、essential8(thermofisher、a1517001)、tesr1(stem cell technologies、85850)、nutristem(stemgent、01-0005)、cmrl(thermofisher、11530037)等。在培养基中,可以添加血清,可以在无血清培养基中添加ko-serum、b-27补充物那样的血清代替物而使用。此外,在培养基中,可以添加葡萄糖等糖类、β巯基乙醇、维生素c等抗氧化剂、必需氨基酸、非必需氨基酸(neaa)等各种氨基酸类、ca
2+
、mg
2+
、zn
2+
等各种金属离子源、egf、fgf、kgf、igf等各种生长因子等通常的细胞培养所使用的各种培养辅助剂。
[0153]
在这样的分化诱导或其前处理的培养中,也可以使用从通常的培养基组成中,使氨基酸、金属离子等特定的成分的浓度减少、或除去了的培养基。例如,蛋氨酸除去或减少培养基将用于多能干细胞的短时间(例如,1小时、5小时、10小时、24小时等)的培养处理,将处理后的细胞分化诱导。此外,在其它方案中,可以将锌离子浓度减少(例如,1μm以下、优选为0.5μm以下)或除去了的培养基仅用于分化培养步骤前半(例如,阶段1或阶段2的至少一部分,优选为包含阶段1的期间,更优选为仅阶段1、阶段1~阶段2的前半部或阶段1~阶段2的全期间)。这样的调整了特定的成分的浓度的培养基可以基于已知的培养基组成的信息,
通过不添加所希望的成分或使添加量减少来制作。此外,也可以获得不含有所希望的成分的培养基,以成为所希望的浓度的方式添加特定的成分。关于蛋氨酸减少或除去培养基,可以基于例如wo2015/125662等来制作。关于在实施例中作为锌除去培养基而使用的akm培养基,由味
の
素株式会社
バイオ
·
ファイン
研究所获得。
[0154]
在从多能干细胞向胰岛素生产细胞的分化过程中,通过用含有用于适于各阶段的信号诱导的添加剂的培养基进行培养,从而分化阶段进行。以下,例示各阶段的培养基所使用的添加剂。这样的添加剂可以选择适当的种类而使用,也可以使用该阶段用的全部添加剂。此外,可以使用前后的阶段用的添加剂。
[0155]
在阶段1中,选自激活素受体和wnt信号的活化中的至少一个是必要的,作为所使用的培养基的添加剂,通常,使用激活素受体激动剂(例如,激活素a)、wnt信号的活化因子(例如,wnt3a那样的wnt蛋白质、gsk3β抑制剂(例如,chir990221)等)等。阶段1的培养期间为1~4天,优选为2~3天。gsk3β抑制剂可以贯通阶段1的期间而添加,也可以使用仅在阶段1-1添加,然后在阶段1-2中,减少、或不包含gsk3β抑制剂的阶段1用培养基。作为阶段1用培养基的例子,为包含10~1000ng/ml(优选为100ng/ml)的激活素a、和/或1~10μm(优选为3μm)的chir99021的培养基。
[0156]
在阶段2中,fgf受体信号的活化是必要的,作为所使用的培养基的添加剂,通常,使用fgf受体激动剂(例如,fgf10、kgf)等。此外,作为添加剂,也可以使用音猬因子抑制剂(例如,kaad-环杷明,sant-l)。阶段2的培养期间为1~7天,优选为2~6天。音猬因子抑制剂可以贯通阶段2的期间而添加,也可以仅在阶段2的前半添加。阶段2用培养基的例子为包含5~500ng/ml(优选为50ng/ml)的fgf10或kgf、和/或0.05~5μm(优选为0.25μm)的sant1的培养基。
[0157]
在阶段3中,选自视黄酸受体信号的活化、bmp受体信号的抑制、音猬因子信号的抑制、和fgf受体信号的活化中的至少一个是必要的,作为所使用的培养基的添加剂,通常,使用视黄酸受体激动剂(例如,视黄酸)、音猬因子抑制剂(例如,kaad-环杷明、sant-l)、bmp信号抑制因子(例如,noggin、ldn193189)、蛋白激酶c活化剂(例如,吲哚内酰胺v)等。此外,作为添加剂,也可以使用tgfβ受体激酶抑制剂(例如,sb431542)。阶段3的培养期间为1~8天,优选为2~6天。作为阶段3用培养基的例子,为包含0.05~5μm(优选为0.15μm)的sant1、0.1~10μm(优选为2μm)的视黄酸、和0.01~1μm(优选为0.1μm)的ldn193189之中的至少一个的培养基、包含0.05~5μm(优选为0.25μm)的sant1、0.1~10μm(优选为2μm)的视黄酸、5~500ng/ml(优选为50ng/ml)的kgf或fgf10、和5~500nm(优选为50nm)的吲哚内酰胺v之中的至少1个的培养基等。
[0158]
在阶段4中,选自bmp受体信号的抑制、音猬因子信号的抑制、fgf受体信号的活化、和视黄酸受体信号的活化中的至少一个是必要的,作为所使用的培养基的添加剂,通常,使用bmp信号抑制因子(例如,noggin、ldn193189)、音猬因子抑制剂(例如,sant-l)等。此外,作为添加剂,也可以使用蛋白激酶c活化剂(例如,吲哚内酰胺v)、tgfβ受体激酶抑制剂(例如,alk5抑制剂ii)。阶段4的培养期间为1~7天、优选为2~5天。作为阶段4用培养基的例子,为包含0.5~50μm(优选为5μm)的alk5抑制剂(calbiochem、616452)、0.01~10μm(优选为0.3μm)的吲哚内酰胺v、和0.01~1μm(优选为0.1μm)的ldn193189之中的至少一个的培养基、包含0.05~5μm(优选为0.25μm)的sant1、0.01~1μm(优选为0.1μm)的视黄酸、5~
500ng/ml(优选为50ng/ml)的kgf或fgf10、和10~1000nmm(优选为100nm)的ldn193189之中的至少一个的培养基等。
[0159]
在阶段5中,选自tgfβ受体信号的抑制、notch信号的抑制、甲状腺激素受体信号的活化、和视黄酸受体信号的活化中的至少一个是必要的,作为所使用的培养基的添加剂,通常,使用tgfβ受体激酶抑制剂(例如,alk5抑制剂ii)、γ-分泌酶抑制剂(例如,dapt)、甲状腺激素t3、egfr激动剂(例如,egf)、视黄酸受体激动剂(例如,视黄酸)、维生素c等。此外,作为添加剂,也可以使用glp-1受体激动剂(例如,glp-1肽、艾塞那肽-4等)、烟酰胺、腺苷酸环化酶的活化剂(例如,福司柯林)、糖皮质激素受体激动剂(例如,地塞米松)。阶段5的培养期间为5~20天,优选为7~15天。作为阶段5用培养基的例子,为包含5~500ng/ml(优选为50ng/ml)的艾塞那肽4和/或1~100nm(优选为10mm)的烟酰胺的培养基、包含0.5~100μm(优选为10μm)的alk5抑制剂(calbiochem、616452)、0.01~1μm(优选为0.1μm)的视黄酸、1~100μm(优选为10μm)的dapt、1~500ng/ml(优选为33.3ng/ml)的egf、和0.1~10μm(优选为1μm)的t3之中的至少一个的培养基、使上述视黄酸的浓度减少(例如,0.05μm以下、优选为0.025μm)的培养基等。视黄酸的浓度减少培养基优选在阶段5的后半中使用。
[0160]
本发明的胰岛素生产细胞的制作法包括下述步骤:在含有由式(i)表示的化合物或其盐的培养基中将细胞进行三维培养。三维培养的方法可以适当采用本领域技术人员通常使用的方法,可以例示使用了低粘着性或非粘着性的培养容器的培养法、搅拌培养法、悬滴培养法、使用了水凝胶、多孔性支架的培养法等。作为低粘着性或非粘着性的培养容器,可以将通常的培养容器的底面或侧面用阻碍细胞粘着的聚合物系试剂等进行涂布而使用,也可以使用基材采用了细胞粘着性低的原材料的培养容器。作为容器的形状,可以使用各种形状,但通过使用圆底的容器,可以促进细胞的球形成。在采用平底容器的情况下,通过在摇动器上培养而可以促进球形成。通过使用了旋转瓶、培养反应器的搅拌培养,也可以促进球形成,能够适应大量培养。
[0161]
在本发明的胰岛素生产细胞的制作法中,从多能干细胞向胰岛素生产细胞的分化通常在全部步骤中进行三维培养,但也可以仅在一部分步骤(例如,从多能干细胞诱导定型内胚层细胞的步骤,从定型内胚层细胞诱导原始消化管细胞的步骤,从原始消化管细胞诱导胰腺祖细胞的步骤,从胰腺祖细胞诱导胰腺内分泌祖细胞的步骤,或从胰腺内分泌祖细胞诱导胰岛素生产细胞的步骤之中的一个或多个步骤)中进行三维培养。在一部分步骤中采用三维培养的情况下,期望为分化过程的后期(例如,原始消化管细胞以后)。由式(i)表示的化合物或其盐只要在采用三维培养的步骤的至少一部分中添加即可,不需要在全部中添加,此外,也可以在三维培养以外的步骤(通常为粘着培养)中添加。
[0162]
由式(i)表示的化合物或其盐在向胰岛素生产细胞的分化过程中,例如,在原始消化管细胞以后的分化阶段的三维培养步骤中添加,可以显著促进向胰岛素生产细胞的分化。由式(i)表示的化合物在从多能干细胞向胰岛素生产细胞的分化过程的哪个步骤中添加都可以,优选在培养从多能干细胞诱导的原始消化管细胞、胰腺祖细胞和/或胰腺内分泌祖细胞时添加。在上述分化阶段中,相当于阶段3~阶段5,可以仅在阶段3~阶段5中的任何一个阶段添加,也可以在2个阶段、或3个所有阶段中添加,但优选在阶段3~阶段5的所有阶段中添加。
[0163]
由式(i)表示的化合物或其盐可以代替上述各阶段用的添加剂而添加,此外也可
以追加添加。可以将由式(i)表示的化合物或其盐直接以固体状的化合物或制成粉末状,或溶解于二甲亚砜等有机溶剂而添加于培养基。其添加量没有特别限定,本领域技术人员进行设定,使得从多能干细胞向胰岛素生产细胞的分化有效地进行。在本发明的几个实施方式中,添加由式(i)表示的化合物,使得以1ng/ml~5mg/ml,优选为10ng/ml~5mg/ml,更优选为50ng/ml~5mg/ml,进一步更优选为100ng/ml~1mg/ml的量存在于培养基中。
[0164]
作为本发明的胰岛素生产细胞的制作方法,例如,可举出以下所示的方法,具体而言,可以例示实施例1所采用的实验方法#1和实验方法#2。在以下实验方法中,各阶段所使用的培养基例示于下面,但不限定于它们。
[0165]
[细胞的处理/培养方法]
[0166]
前处理:将多能干细胞以未分化维持培养基(例如,stemfit ak03n培养基(味
の
素))中1
×
106细胞/ml的浓度转移到低附着6孔板,在旋转摇动器(95rpm)上培养24小时以上。在以后的培养步骤中,也在相同条件下应用三维培养。在分化诱导开始日,将培养基更换为ak03n基的蛋氨酸除去培养基(ka01,味
の
素),将细胞培养5小时。
[0167]
阶段1:将多能干细胞(可以被前处理)用可以包含由式(i)表示的化合物或其盐的阶段1用培养基培养1~4天,诱导定型内胚层细胞。优选用分化培养基1-1或m1-1 akm培养基培养24小时后,将培养基更换为分化培养基1-2或m1-2 akm培养基而培养1~2天。
[0168]
阶段2:将包含定型内胚层细胞的培养物用可以包含由式(i)表示的化合物或其盐的阶段2用培养基培养2~6天,诱导原始消化管细胞。优选用分化培养基2、m2 akm培养基或s2培养基培养2~3天。作为其它例,用使锌浓度减少了的阶段2用培养基(例如,m2 akm培养基)培养2天,然后用通常的锌浓度的阶段2用培养基(例如,s2培养基,分化培养基2)培养2~3天。
[0169]
阶段3:将包含原始消化管细胞的培养物用可以包含由式(i)表示的化合物或其盐的阶段3用培养基培养2~8天而诱导胰腺祖细胞。优选用分化培养基3培养5~7天或用s3培养基培养2~4天。
[0170]
阶段4:将包含胰腺祖细胞的培养物用可以包含由式(i)表示的化合物或其盐的阶段4用培养基培养1~7天,诱导胰腺内分泌祖细胞。优选用分化培养基4培养2~3天,或用s4培养基培养4~6天。
[0171]
阶段5:将包含胰腺内分泌祖细胞的培养物用可以包含由式(i)表示的化合物或其盐的阶段5用培养基培养5~20天,诱导胰岛素生产细胞。优选用分化培养基5培养10~15天。作为其它方案,用包含0.1μm以上的视黄酸的阶段5用培养基(例如,s5-1培养基)培养3~5天,然后用包含0.05μm以下的低浓度的视黄酸的阶段5用培养基(例如,s5-2培养基)培养2~4天。
[0172]
[培养基]
[0173]
akm培养基为胰岛素和zn
2+
除去stemfit basic 03培养基(味
の
素)。
[0174]
(阶段1用培养基例)
[0175]
分化培养基1-1:dmem高葡萄糖、l-gln、neaa、0.01mm的β-巯基乙醇、100ng/ml的激活素a、b27补充物、3μm的chir99021
[0176]
分化培养基1-2:dmem高葡萄糖、l-gln、neaa、0.01mm的β-巯基乙醇、100ng/ml的激活素a、b27补充物
[0177]
m1-1 akm培养基:添加100ng/ml的激活素a、3μm的chir990221,补充了100ng/ml的igf1和0.5μm的zn的akm培养基。
[0178]
m1-2 akm培养基:添加100ng/ml激活素a,补充了100ng/ml的igf1和0.5μm的zn的akm培养基。
[0179]
(阶段2用培养基例)
[0180]
分化培养基2:rpmi、l-gln、neaa、0.01mm的β-巯基乙醇、除了胰岛素的b27补充物、50ng/ml的fgf10、0.25μm的sant1。
[0181]
m2 akm培养基:添加50ng/ml的fgf10、250nm的sant1,补充了0.5μm的zn的akm培养基。
[0182]
s2培养基:补充了50ng/ml的kgf和44μg/ml的维生素c的stemfit basic 03。
[0183]
(阶段3用培养基例)
[0184]
分化培养基3:dmem高葡萄糖、l-gln、neaa、0.01mm的β-巯基乙醇、0.15μm的sant1、2μm的视黄酸、0.1μm的ldn193189、b27补充物。
[0185]
s3培养基:补充了50ng/ml的kgf、50nm的吲哚内酰胺v、2μm的视黄酸、250nm的sant1、44μg/ml的维生素c的stemfit basic 03。
[0186]
(阶段4用培养基例)
[0187]
分化培养基4:dmem高葡萄糖、l-gln、neaa、0.01mm的β-巯基乙醇、5μm的alk5抑制剂(calbiochem、616452)、0.3μm的吲哚内酰胺v、0.1μm的ldn193189、b27补充物
[0188]
s4培养基:补充了50ng/ml的kgf、100nm的视黄酸、250nm的sant1、44μg/ml的维生素c、100nm的ldn193189的stemfit basic 03。
[0189]
(阶段5用培养基例)
[0190]
分化培养基5:ko dmem/f12、l-gln、neaa、0.01mm的β-巯基乙醇、50ng/ml的艾塞那肽4、10mm的烟酰胺、10μm的znso4、1mm的n-乙酰-l-半胱氨酸、b27补充物。
[0191]
s5-1培养基:补充了10μm的alk5抑制剂、10μm的dapt、33.3ng/ml的egf、100nm的视黄酸、1μm的t3、44μg/ml的维生素c的stemfit basic 03。
[0192]
s5-2培养基:补充了10μm的alk5抑制剂、10μm的dapt、33.3ng/ml的egf、25nm的视黄酸、1μm的t3的stemfit basic 03。
[0193]
在评价化合物对分化速度和细胞功能的有效性的情况下,将试验化合物和阴性对照(0.01%dmso)在阶段3和4期间(第5天~第13天)处理,为了证实对胰岛素、nkx6.1、和pdx1的阳性的效果,在第14天和第21天实施了免疫细胞化学染色。在第21天实施了gsis。
[0194]
<化合物>
[0195]
下面将描述在本发明中由式(i)表示的化合物的优选方案。
[0196]
本发明中的取代基r1的例子可以包括氢原子、卤素原子和c1-c6烷基。r1优选地是氢原子、氯原子、溴原子或甲基,更优选地是氢原子、氯原子或甲基。作为r1的取代位置,可以采取任何位置,可以采取下面所示的(i-i)至(i-iii)。
[0197][0198]
本发明中的取代基r2的例子可以包括氢原子或c1-c6烷基。r2优选地是氢原子或c1-c2烷基,更优选地是氢原子或甲基。
[0199]
本发明中的取代基r3的例子包括可以被1-4个独立地选自取代基组α的取代基取代的芳基、可以被1-4个独立地选自取代基组α的取代基取代的c5-c10环烯基、或可以被1-4个独立地选自取代基组α的取代基取代的杂环基。r3优选地是萘基、1,3-苯并二氧杂环戊烯基、2,2-二卤代-1,3-苯并二氧杂环戊烯基、c5-c10环烯基、可以被1或2个独立地选自取代基组α1的取代基取代的苯基、或可以被1或2个独立地选自取代基组α1的取代基取代的5或6元杂环基,更优选地是萘基、1,3-苯并二氧杂环戊烯基、2,2-二卤代-1,3-苯并二氧杂环戊烯基、c5-c10环烯基、可以被1或2个独立地选自取代基组α2的取代基取代的苯基、或可以被1或2个独立地选自取代基组γ2的取代基取代的5或6元杂环基。r3甚至更优选地是萘基、1,3-苯并二氧杂环戊烯基、2,2-二氟-1,3-苯并二氧杂环戊烯基、c5-c8环烯烃-1-基、可以被1或2个独立地选自取代基组α3的取代基取代的苯基、或可以被1或2个独立地选自取代基组γ3的取代基取代的5或6元杂环基,特别优选地是2,2-二氟-1,3-苯并二氧杂环戊烯基、1-叔丁氧基羰基-3,6-二氢-2h-吡啶-4-基或可以被1或2个取代基取代的苯基,所述取代基独立地选自氟原子、氯原子、三氟甲基、叔丁氧基、三氟甲氧基、2,2,2-三氟乙氧基、苄氧基和苯氧基。进一步特别优选地为苯基或间位或对位被选自氟原子、氯原子、三氟甲基、叔丁氧基、三氟甲氧基、2,2,2-三氟乙氧基、苄氧基、和苯氧基中的任1个取代基取代了的苯基。取代基组α至γ如下所述。
[0200]
本发明中的取代基组α的例子包括卤素原子、氰基、羧基、c1-c6烷基、c1-c6烷氧基、卤代c1-c6烷基、卤代c1-c6烷氧基、羟基c1-c6烷基、c1-c6烷氧基c1-c6烷氧基、(c1-c6烷基)羰基、(c1-c6烷氧基)羰基、(c1-c6烷氧基)羰基氧基、苯基c1-c6烷氧基、非芳族杂环基、可以被1或2个c1-c6烷基取代的氨甲酰基、被可以被1或2个c1-c6烷基取代的氨甲酰基取代了的c1-c6烷氧基、被1或2个c1-c6烷基取代了的氨磺酰基、可以被1-4个独立地选自取代基组β的取代基取代的苯氧基、可以被1-4个独立地选自取代基组β的取代基取代的苯基、和可以被1-4个独立地选自取代基组β的取代基取代的苯甲酰基。优选地,所述取代基组α1是卤素原子、氰基、羧基、苯氧基、苯甲酰基、c1-c6烷基、c1-c6烷氧基、卤代c1-c6烷基、卤代c1-c6烷氧基、羟基c1-c6烷基、c1-c6烷氧基c1-c6烷氧基、(c1-c6烷基)羰基、(c1-c6烷氧基)羰基、(c1-c6烷氧基)羰基氧基、苯基c1-c6烷氧基、5或6元非芳族杂环基、可以被1或2个c1-c6烷基取代的氨甲酰基、被可以被1或2个c1-c6烷基取代的氨甲酰基取代了的c1-c6烷氧基、被1或2个c1-c6烷基取代了的氨磺酰基或可以被1或2个独立地选自取代基组β1的取代基取代的苯基。更优选地,所述取代基组α2是卤素原子、氰基、羧基、苯氧基、苯甲酰基、c1-c6烷基、c1-c6烷氧基、卤代c1-c6烷基、卤代c1-c6烷氧基、羟基c1-c6烷基、c1-c6烷氧基c1-c6烷氧基、(c1-c6烷基)羰基、(c1-c6烷氧基)羰基、(c1-c6烷氧基)羰基氧基、苯基c1-c6
烷氧基、5或6元非芳族杂环基、可以被1或2个c1-c6烷基取代的氨甲酰基、被可以被1或2个c1-c6烷基取代的氨甲酰基取代了的c1-c6烷氧基、被1或2个c1-c6烷基取代了的氨磺酰基或可以被1或2个独立地选自取代基组β2的取代基取代的苯基。甚至更优选地,所述取代基组α3是卤素原子、氰基、羧基、苯氧基、苯甲酰基、c1-c4烷基、c1-c4烷氧基、卤代c1-c2烷基、卤代c1-c2烷氧基、羟基c1-c4烷基、c1-c2烷氧基c1-c2烷氧基、(c1-c4烷基)羰基、(c1-c4烷氧基)羰基、(c1-c4烷氧基)羰基氧基、苯基c1-c4烷氧基、吗啉-1-基、可以被1或2个c1-c4烷基取代的氨甲酰基、被可以被1或2个c1-c4烷基取代的氨甲酰基取代了的c1-c2烷氧基、被1或2个c1-c4烷基取代了的氨磺酰基、或可以被1或2个独立地选自取代基组β3的取代基取代的苯基,特别优选地是氟原子、氯原子、三氟甲基、叔丁氧基、三氟甲氧基、2,2,2-三氟乙氧基、苄氧基或苯氧基。
[0201]
本发明中的取代基组β的例子包括卤素原子、c1-c6烷基、c1-c6烷氧基、卤代c1-c6烷基、卤代c1-c6烷氧基和(c1-c6烷氧基)羰基。优选地,所述取代基组β1是卤素原子、c1-c6烷基、c1-c6烷氧基或(c1-c6烷氧基)羰基。更优选地,所述取代基组β2是卤素原子、c1-c6烷基或c1-c6烷氧基。甚至更优选地,所述取代基组β3是氟原子、氯原子、c1-c4烷基或c1-c4烷氧基,特别优选地是甲基或甲氧基。
[0202]
作为本发明中的取代基组γ,取代基组γ2包括卤素原子、c1-c6烷基、c1-c6烷氧基、(c1-c6烷基)羰基和(c1-c6烷氧基)羰基。优选地,取代基组γ3是卤素原子、c1-c4烷基、c1-c4烷氧基、(c1-c4烷基)羰基和(c1-c4烷氧基)羰基,更优选地是氟原子、氯原子、甲基、异丁氧基或叔丁氧基羰基。
[0203]
在本发明中,n可以代表0或1的数值。当n=0时,由式(i)表示的化合物是由下面式(ii)表示的具有二氢吡咯里嗪酮(dihydropyrrolizinone)结构的化合物,当n=1时,由式(i)表示的化合物是由下面式(iii)表示的具有二氢吲嗪酮(dihydroindolizinone)结构的化合物。在本发明中,n优选地是1,具有二氢吲嗪酮结构的化合物是更优选的。
[0204][0205]
[其中r1~r3具有与上面所述相同的含义]
[0206][0207]
[其中r1~r3具有与上面所述相同的含义]
[0208]
在本发明中,a代表由下面式(i)~(iv)表示的基团:
[0209]
[0210]
[其中
·
、*、r4、r5、和y具有与上面所述相同的含义]
[0211]
当a具有由式(i)表示的基团时,由式(i)表示的化合物是由下面式(iv)表示的化合物。
[0212][0213]
[其中r1~r4、和n具有与上面所述相同的含义]
[0214]
在a具有由式(ii)表示的基团时,由式(i)表示的化合物是由下面式(v)表示的化合物。作为r5的取代位置,可以采取任何位置,可以采取下面所示的(v-i)~(v-iii)。
[0215][0216]
[其中r1~r3、r5、n、和y具有与上面所述相同的含义]
[0217][0218]
在a具有由式(iii)表示的基团时,由式(i)表示的化合物是由下面式(vi)表示的化合物。作为r5的取代位置,可以采取任何位置,可以采取下面所示的(vi-i)~(vi-iii)。
[0219][0220]
[其中r1~r3、r5、和n具有与上面所述相同的含义]
[0221][0222]
在a具有由式(iv)表示的基团时,由式(i)表示的化合物是由下面式(vii)表示的化合物。
[0223]
[0224]
[其中r1~r3、和n具有与上面所述相同的含义]
[0225]
本发明中取代基r4的例子包括氢原子、c1-c6烷基、卤代c1-c6烷基或(c1-c6烷氧基)羰基。优选地,r4是氢原子、c1-c4烷基或卤代c1-c2烷基,更优选地是氢原子、甲基或三氟甲基。
[0226]
本发明中取代基r5的例子包括氢原子、卤素原子或c1-c6烷基。优选地,r5是氢原子、氟原子或甲基。
[0227]
本发明中y的例子包括n或ch。当y是n时,a中的(ii)代表吡啶环,当y是ch时,a中的(ii)代表苯环。a的(ii)中的y优选地是ch。
[0228]
具有式(i)的化合物优选地是在合成例中描述的化合物,更优选地是下述化合物:
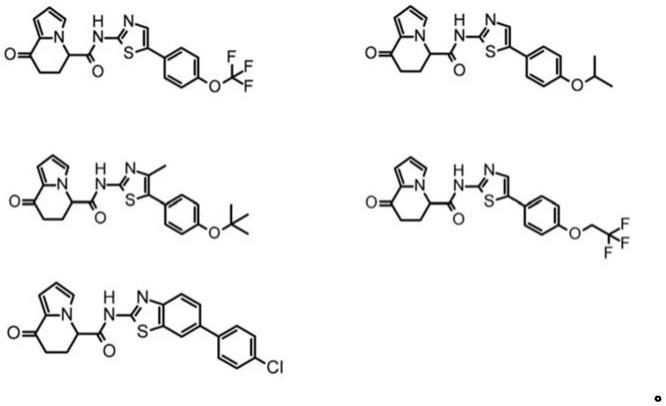
[0229]
8-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0230]
n-[5-(4-异丙氧基苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0231]
n-[5-(4-叔丁氧基苯基)-4-甲基噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0232]
8-氧代-n-[5-[4-(2,2,2-三氟乙氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0233]
n-[6-(4-氯苯基)-1,3-苯并噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0234]
其结构式依次显示在下面。
[0235][0236]
上述8-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺、和n-[5-(4-叔丁氧基苯基)-4-甲基噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺包含光学活性体。
[0237]
8-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺的光学活性体是(5r)-8-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺、或(5s)-8-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺。
[0238]
n-[5-(4-叔丁氧基苯基)-4-甲基噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰
胺的光学活性体是(5r)-n-[5-(4-叔丁氧基苯基)-4-甲基噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺、或(5s)-n-[5-(4-叔丁氧基苯基)-4-甲基噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺。
[0239]
其结构式依次显示在下面。
[0240][0241]
各光学异构体从外消旋化合物的分离/分析能够通过使用了手性柱的高效液相色谱(hplc)等而实现。采用hplc的光学异构体的鉴定能够以其保留时间作为参考而进行,但其保留时间有时因为柱的劣化、装置间的再现性等而受影响,因此优选通过将外消旋化合物或光学异构体的标准试样与分析试样的混合物进行分析而进行。此外,在各光学异构体的采用hplc的测定中,在同一测定条件下洗脱各光学异构体的顺序不变化,因此也有时可以通过在特定条件下保留时间相对短的第一峰和保留时间相对长的第二峰,而使光学异构体具有特征。
[0242]
(盐)
[0243]
所谓“其盐”,对于化合物,在具有酸性基或碱性基的情况下,通过与碱或酸反应,从而可以制成“与碱形成的盐”或“酸加成盐”,因此显示其盐。在对温血动物(特别是人)的治疗的目的下使用的情况下,其盐优选为药学上可接受的盐。此外,所谓“其盐”和“药学上可接受的盐”,也包含其水合物。
[0244]
作为化合物的“与碱形成的盐”,优选为钠盐、钾盐、锂盐那样的碱金属盐;镁盐、钙盐那样的碱土金属盐;n-甲基吗啉盐、三乙胺盐、三丁基胺盐、二异丙基乙基胺盐、二环己基胺盐、n-甲基哌啶盐、吡啶盐、4-吡咯烷基吡啶盐、皮考啉盐那样的有机碱盐类、或甘氨酸盐、赖氨酸盐、精氨酸盐、鸟氨酸盐、谷氨酸盐、天冬氨酸盐那样的氨基酸盐,更优选为碱金属盐或碱土金属盐。
[0245]
作为化合物的“酸加成盐”,优选为氢氟酸盐、盐酸盐、氢溴酸盐、氢碘酸盐那样的氢卤酸盐、硝酸盐、高氯酸盐、硫酸盐、磷酸盐等无机酸盐;甲磺酸盐、三氟甲磺酸盐、乙烷磺酸盐那样的低级链烷磺酸盐、苯磺酸盐、对甲苯磺酸盐那样的芳基磺酸盐、乙酸盐、苹果酸盐、富马酸盐、琥珀酸盐、柠檬酸盐、抗坏血酸盐、酒石酸盐、草酸盐、马来酸盐等有机酸盐;和甘氨酸盐、赖氨酸盐、精氨酸盐、鸟氨酸盐、谷氨酸盐、天冬氨酸盐那样的氨基酸盐,更优选为氢卤酸盐(特别是盐酸盐)。
[0246]
(水合物等)
[0247]
由式(i)表示的化合物或其盐有时通过在大气中放置或重结晶而吸收水分,而带有吸附水,或成为水合物,在本发明中,也包含那样的各种水合物、溶剂合物和多晶型的化
合物。
[0248]
(异构体)
[0249]
在由式(i)表示的化合物中,根据取代基的种类,可能存在互变异构体、几何异构体。本说明书中,由式(i)表示的化合物有时仅以异构体的一个形态记载,但本发明也包含除其以外的异构体,也包含分离了的异构体、或它们的混合物。
[0250]
在由式(i)表示的化合物中,有时具有不对称碳原子、轴不对称,可能存在基于此的光学异构体。本发明也包含分离了的光学异构体、或它们的混合物。
[0251]
(同位素)
[0252]
由式(i)表示的化合物也包含标记体,即,将化合物的1个或2个以上原子用同位素(例如,2h、3h、
13
c、
14
c、
35
s等)取代了的化合物。
[0253]
(前药)
[0254]
在本发明中,也包含由式(i)表示的化合物的药理学上可接受的前药。所谓药理学上可接受的前药,是具有通过溶剂分解或在生理学的条件下,能够转变为氨基、羟基、羧基等基团的化合物。作为形成前药的基团,可举出例如,prog.med,5,2157-2161(1985)所记载的基团。
[0255]
作为该前药,更具体而言,在化合物存在氨基的情况下,可以举出该氨基被酰基化、磷酸化了的化合物(例如,该氨基被二十烷酰化、丙氨酰基化、戊基氨基羰基化、(5-甲基-2-氧代-1,3-二氧杂环戊烯-4-基)甲氧基羰基化、四氢呋喃基化、吡咯烷基甲基化、新戊酰氧基甲基化了的化合物等)等。
[0256]
在化合物存在羟基的情况下,可以举出该羟基被酰基化、烷基化、磷酸化、硼酸化了的化合物(例如,该羟基被乙酰化、棕榈酰化、丙酰基化、新戊酰基化、琥珀酰基化、富马酰基化、丙氨酰基化、二甲基氨基甲基羰基化了的化合物等。)等。
[0257]
在化合物存在羧基的情况下,可举出该羧基被酯化、酰胺化了的化合物(例如,该羧基被乙基酯化、苯基酯化、羧基甲基酯化、二甲基氨基甲基酯化、新戊酰氧基甲基酯化、乙氧基羰氧基乙基酯化、酰胺化或甲基酰胺化了的化合物等。)等。
[0258]
(制造方法)
[0259]
接下来,对由式(i)表示的化合物的代表性的制造方法进行说明。由式(i)表示的化合物可以通过各种制造方法来制造,以下所示的制造方法为一例,本发明不应该限定于此而解释。
[0260]
由式(i)表示的化合物、其盐和它们的合成中间体可以利用基于它们的基本骨架或取代基的种类的特征,应用各种公知的制造方法而制造。作为公知的方法,有例如,“organic functional group preparations”,第2版,academic press,inc.,1989年、“comprehensive organic transformations”、vch publishers inc.,1989年等所记载的方法。
[0261]
此外,由式(i)表示的化合物及其盐可以按照以下所记载的a~c法来合成。在合成由式(i)表示的化合物时,根据官能团的种类,有时将该官能团在从原料到中间体的阶段预先用适当的保护基(能够容易地转化为该官能团的基团)进行保护在制造技术上是有效果的。作为这样的保护基,可以举出例如,
ウッツ
(p.g.m.wuts)和
グリーン
(t.w.greene)著,protective groups in organic synthesis(第3版,1999年)所记载的保护基等,只要适当
选择使用这些反应条件即可。一般而言如果由本领域技术人员设定合成途径,则由本领域技术人员适当设定对于该合成途径最佳的保护基。
[0262]
在这样的方法中,通过在导入该保护基进行了反应后,根据需要将保护基除去,从而可以获得所希望的化合物。此外,由式(i)表示的化合物的前药与上述保护基同样地,可以通过在从原料到中间体的阶段,导入特定基团,或使用所得的化合物进一步进行反应来制造。反应可以通过应用通常的酯化、酰胺化、脱水等方法来进行。
[0263]
由式(i)表示的化合物可以使用能够通过公知的方法或其变法而合成的中间体来制造。特别是关于包含相当于a的通式(ii)~(iv)所示的基团的中间体,可以通过使用市售的原料而应用公知的方法或其变法来制造。
[0264]
在下述a~c法的各步骤中获得的化合物可以为与该化合物一起形成的盐。可举出例如,盐酸盐或硫酸盐等、或者钠盐或钾盐等。
[0265]
在下述a~c法的各步骤的反应中使用的溶剂只要不阻碍反应,并将起始原料一部分溶解,就没有特别限定,例如,选自下述溶剂组中。溶剂组由己烷、戊烷、石油醚、环己烷那样的脂肪族烃类;苯、甲苯、二甲苯那样的芳香族烃类;二氯甲烷(氯化亚甲基)、氯仿、四氯化碳、二氯乙烷、氯苯、二氯苯那样的卤代烃类;二乙基醚、二异丙基醚、四氢呋喃、二烷、二甲氧基乙烷、二甘醇二甲基醚那样的醚类;丙酮、甲基乙基酮、甲基异丁基酮、环己酮那样的酮类;乙酸乙酯、乙酸丙酯、乙酸丁酯那样的酯类;乙腈、丙腈、丁腈、异丁腈那样的腈类;乙酸、丙酸那样的羧酸类;甲醇、乙醇、1-丙醇、2-丙醇、1-丁醇、2-丁醇、1-甲基-1-丙醇、2-甲基-2-丙醇那样的醇类;甲酰胺、二甲基甲酰胺、二甲基乙酰胺、n-甲基-2-吡咯烷酮、六甲基磷酰三胺那样的酰胺类;二甲亚砜、环丁砜那样的亚砜类;水;和它们的混合物构成。
[0266]
在下述a~c法的各步骤的反应中使用的酸只要不阻碍反应,就没有特别限定,选自下述酸组。酸组由盐酸、氢溴酸、氢碘酸、磷酸、硫酸、硝酸那样的无机酸、乙酸、丙酸、三氟乙酸、五氟丙酸那样的有机酸、和甲磺酸、三氟甲磺酸、对甲苯磺酸、樟脑磺酸那样的有机磺酸构成。
[0267]
在下述a~c法的各步骤的反应中使用的碱只要不阻碍反应,就没有特别限定,选自下述碱组。碱组由碳酸锂、碳酸钠、碳酸钾、碳酸铯那样的碱金属碳酸盐;碳酸氢锂、碳酸氢钠、碳酸氢钾那样的碱金属碳酸氢盐;氢氧化锂、氢氧化钠、氢氧化钾那样的碱金属氢氧化物;氢氧化钙、氢氧化钡那样的碱土金属氢氧化物;氢化锂、氢化钠、氢化钾那样的碱金属氢化物;氨基锂、氨基钠、氨基钾那样的碱金属氨化物;甲醇锂、甲醇钠、乙醇钠、叔丁醇钠、叔丁醇钾那样的碱金属醇盐;二异丙基氨基锂那样的烷基氨基锂;双三甲基甲硅烷基氨基锂、双三甲基甲硅烷基氨基钠那样的甲硅烷基氨化物;正丁基锂、仲丁基锂、叔丁基锂那样的烷基锂;甲基氯化镁、甲基溴化镁、甲基碘化镁、乙基氯化镁、乙基溴化镁、异丙基氯化镁、异丙基溴化镁、异丁基氯化镁那样的烷基卤化镁;和三乙胺、三丁基胺、二异丙基乙基胺、n-甲基哌啶、n-甲基吗啉、n-乙基吗啉、吡啶、皮考啉、4-(n,n-二甲基氨基)吡啶、4-吡咯烷基吡啶、2,6-二(叔丁基)-4-甲基吡啶、喹啉、n,n-二甲基苯胺、n,n-二乙基苯胺、1,5-二氮杂二环[4,3,0]壬-5-烯(dbn)、1,4-二氮杂二环[2,2,2]辛烷(dabco)、1,8-二氮杂二环[5,4,0]十一碳-7-烯(dbu)那样的有机胺构成。
[0268]
在下述a~c法的各步骤的反应中,反应温度根据溶剂、起始原料、试剂等而不同,反应时间根据溶剂、起始原料、试剂、反应温度等而不同。
[0269]
在下述a~c法的各步骤的反应中,在反应结束后,各步骤的目标化合物按照常规方法从反应混合物被分离。目标化合物可通过例如(i)根据需要将催化剂等不溶物漏去,(ii)在反应混合物中加入水和与水不混溶的溶剂(例如,二氯甲烷、二乙基醚、乙酸乙酯等)而提取目标化合物,(iii)将有机层水洗,使用无水硫酸镁等干燥剂使其干燥,(iv)将溶剂蒸馏除去而获得。所得的目标化合物根据需要可以通过常规方法,例如,重结晶、再沉淀、蒸馏、或使用了硅胶或氧化铝等的柱色谱(包含正相和反相)等而进一步精制。所得的目标化合物可以通过元素分析、nmr、质谱分析(massspectroscopy)、ir分析等标准的分析技术鉴定,对其组成或纯度进行分析。此外,各步骤的目标化合物也可以不精制而直接使用于以下反应。
[0270]
在下述a~c法的各步骤中,通过使用了(r)或(s)-苯乙基胺那样的光学活性胺的分级重结晶、或使用了光学活性柱的分离,可以将光学异构体分离、精制。
[0271]
以下对由式(i)表示的化合物的制造方法进行描述。然而,制造方法不受下述方法任何限定。
[0272]
[a法]
[0273]
a法是在制造由式(i)表示的化合物时制造可以作为合成中间体而使用的化合物(a2)的方法。化合物(a2)除了本法和实施例中例示的合成法以外也可以通过公知的方法或其变法等来制造。
[0274][0275]
[式中,r3和r4表示与上述相同含义]
[0276]
(步骤a-1)噻唑环形成
[0277]
步骤a-1是对化合物(a1)使等量或过剩量的卤化剂或溴三甲基硅烷、和硫脲作用,制造化合物(a2)的步骤。作为卤化剂,可举出氯、溴等。反应的溶剂只要反应进行,就没有特别限定,可使用二氯甲烷、氯仿、乙醇、乙腈、n,n-二甲基甲酰胺、乙酸等。反应温度通常为0~100℃,反应时间通常为0.5小时~2天左右。
[0278]
(b法)
[0279]
b法为制造在制造由式(i)表示的化合物时可以作为合成中间体而使用的化合物(b3)的方法。以下图中的p1和p2表示氨基的保护基或氢原子,作为具体的保护基,可举出boc基(叔丁氧基羰基)、cbz基(苄氧基羰基)、亚苄基、或二苯基亚甲基等。在p1为亚苄基、二苯基亚甲基的情况下p2表示与p1相同的保护基。r3和a可以在它们所包含的取代基上具有保护基,各步骤包含根据需要进行取代基的保护、保护基的除去的步骤。
[0280][0281]
[式中,r3与上述含义相同,x1表示卤原子或甲磺酰氧基、三氟甲磺酰氧基或对甲苯磺酰氧基等离去基团,p1和p2表示任意的保护基]
[0282]
(步骤b-1)偶联反应
[0283]
步骤b-1是对化合物(b1)的a上的取代基x1,通过在钯催化剂存在下,使用等量或过剩量的硼酸或硼酸酯(r
3-b(oh)2或r
3-b(or)2,r表示任意的烷基)的条件(铃木
·
宫浦偶联);使用有机锡试剂(r
3-snr3)的条件(stille偶联);或使用有机锌试剂(r
3-znx;x表示卤原子)的条件(根岸偶联)等,进行取代基r3的导入而获得化合物(b2)的步骤。在上述反应中根据需要可以加入碱。作为钯催化剂,可举出四(三苯基膦)钯、[1,1
’‑
双(二苯基膦基)二茂铁]二氯化钯(ii)二氯甲烷配位化合物(1:1)、氯(2-二环己基膦基-2
’4’6’‑
三异丙基-1,1
’‑
联苯)[2-(2
’‑
氨基-1,1
’‑
联苯)]钯(ii)、三(二亚苄基丙酮)二钯、乙酸钯(ii)、乙酰丙酮钯(ii)、或双(三苯基膦)二氯化钯(ii)等。此外,作为碱,可举出三乙胺、二异丙基乙基胺、1,8-二氮杂二环[5.4.0]-7-十一碳烯(dbu)、或1,5-二氮杂二环[4.3.0]-5-壬烯(dbn)等有机碱、碳酸氢钾、碳酸氢钠、碳酸钾、碳酸钠、氢氧化钾、氢氧化钠、磷酸钾、或磷酸钠等无机碱。作为反应溶剂,只要反应进行,就没有特别限定,但可以举出甲醇、乙醇、四氢呋喃、1,2-二甲氧基乙烷、1,4-二烷、水、n,n-二甲基甲酰胺、二甲亚砜、苯、甲苯、二甲苯、或它们的混合物等。反应温度通常为20~150℃左右。反应时间通常为1小时~2天左右。关于本偶联反应,可以按照a.meijere和f.diederich著,“metal-catalyzed cross-coupling reactions(第2版、2004年)”所记载的方法进行。
[0284]
(步骤b-2)脱保护
[0285]
步骤b-2是将化合物(b2)中的保护基p1和p2除去而制造化合物(b3)的步骤。在本步骤中根据需要可以进行r3中的保护基的脱保护。本反应条件根据保护基p1和p2的种类而变化,例如,可以按照t.w.greene和p.g.wuts著,“protective groups in organic synthesis(第3版,1999年)”所记载的方法来进行。
[0286]
(c法)
[0287]
c法是从能够使用公知的方法或其变法等而合成的化合物(c1)制造由式(i)表示的化合物的方法。
groups in organic synthesis(第3版,1999年)”所记载的方法进行。缩合反应通过对由化合物(c2)和化合物(c4)获得的羧酸在碱存在下,使适当的磺酰化剂或适当的缩合剂作用来进行。对于缩合反应,可以根据需要加入促进反应的添加剂。作为磺酰化剂,可举出例如2,4,6-三异丙基苯磺酰氯、对甲苯磺酰氯、苯磺酰氯等。作为缩合剂,可举出例如wsc(1-乙基-3-(3-二甲基氨基丙基)碳二亚胺)、dcc(1,3-二环己基碳二亚胺)、dmt-mm(4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉氯化物)、cdi(1,1
’‑
羰基二咪唑)、depc(氰代磷酸二乙酯)、dppa(叠氮磷酸二苯酯)等。作为碱,可举出吡啶、卢剔啶等芳香族胺类、三乙胺、n,n-二异丙基乙基胺、dmap(4-二甲基氨基吡啶)等叔胺类等。作为添加剂的代表性的例子,可举出hoat(3h-[1,2,3]三唑并[4,5-b]吡啶-3-醇)、hobt(1h-苯并三唑-1-醇)、hosu(n-羟基琥珀酰亚胺)等。反应溶剂只要反应进行,就没有特别限定,但优选为二氯甲烷、n,n-二甲基甲酰胺。反应温度通常为0~50℃。反应时间通常为0.5~24小时。
[0300]
(步骤c-6)缩合反应
[0301]
步骤(c-6)是在将化合物(c4)的羧基的保护基除去后,与胺衍生物缩合,制造化合物(c6)的步骤。可以使用与步骤(c-5)同样的方法。
[0302]
(步骤c-7)偶联反应
[0303]
步骤(c-7)是对化合物(c6)进行偶联反应而制造由式(i)表示的化合物的步骤。可以使用与步骤(b-1)同样的方法而进行。
[0304]
<胰岛素生产细胞>
[0305]
通过本发明的方法而生产的胰岛素生产细胞由于显示与生物体的胰脏β细胞类似的功能,因此对于糖尿病的治疗是有用的。通过本发明的制法而生产的细胞除了良好的胰岛素生产能力以外,具有在周边环境的糖水平低的状况下胰岛素分泌量少,在糖水平高的环境下胰岛素分泌量增加这样的特性。因此,通过本发明的制法而生产的细胞提供低血糖的风险少,安全性高的治疗方法。
[0306]
对通过本发明的方法而制作的细胞中的胰脏β细胞标志物基因(例如胰岛素、nkx6.1、和pdx1等)的mrna水平或蛋白质水平的表达进行评价,可以证实为目标细胞。此外,通过本发明的方法而制作的细胞的胰岛素分泌能力可以通过以下实施例1的方法(6)所记载的时间依赖性gsis活性测定来评价。
[0307]
通过本发明的方法而制作的细胞在时间依赖性gsis活性测定中,具有显示迅速的第1相胰岛素分泌和/或长期持续的第2相胰岛素分泌这样的特性。此外,通过本发明的方法而制作的细胞具有对由胰岛素分泌促进药(例如,格列本脲那样的su剂、艾塞那肽4那样的glp-1受体激动剂、kcl等)带来的刺激进行反应而显示胰岛素分泌增强、c-肽分泌增强等的特性。此外,具有显示功能成熟化的标志物nkx6.1的阳性率高、每个细胞的胰岛素分泌量多这样的特性。根据这些特性,可以认为通过本发明的方法而制作的胰岛素生产细胞为作为胰腺β细胞而功能成熟被增强了的细胞,是与已知的从多能干细胞衍生出的胰岛素生产细胞明确区别的细胞。
[0308]
采用这样的胰岛素生产细胞的治疗对象为起因于胰脏β细胞中的胰岛素分泌异常或分泌不足的疾病的患者,具体而言,可例示i型糖尿病或ii型糖尿病的患者。
[0309]
在将这样的细胞用于治疗的情况下,可以向患者的皮下、腹腔内、胰脏内、胰脏表面、或其周边移植。
[0310]
通过本发明的方法而生产的细胞可以以通过三维培养形成的凝集体(球)的形式移植,也可以以被分散了的细胞的形式移植。此外,也可以加工为使一度进行了分散的细胞再凝集了的凝集体、片状而移植。
[0311]
在下文中,将通过参考合成例、合成例、参考例和实施例进一步详细描述本发明,但是本发明的范围不限于这些实施例。
[0312]
在参考合成例和合成例中,在基于tlc(薄层色谱法)的观察下进行柱色谱法中的洗脱。在tlc观察中,将可得自merck社制的硅胶60f
254
用作tlc板,将在柱色谱法中用作洗脱溶剂的溶剂用作展开溶剂,并将紫外检测器用作检测方法。作为柱的硅胶,使用也可得自merck社制的硅胶sk-85(230-400目)或可得自fuji silysia chemical ltd的chromatorex nh(200-350目)。除了通常的柱色谱法装置以外,适当地使用可得自shoko science co.,ltd的自动化色谱法装置(purif-α2或purif-espoir2)等。基于tlc观察来确定洗脱溶剂。
[0313]
在下面参考合成例、合成例、参考例和实施例中使用的缩写具有下述含义:
[0314]
mg:毫克,g:克,μl:微升,ml:毫升,mmol:毫摩尔,mm:毫摩尔浓度,μm:微摩尔浓度,μm:微米,mm:毫米,和mhz:兆赫。
[0315]
在下面参考合成例和合成例中的核磁共振(其在下文中将被称作1h nmr)谱中,使用四甲基硅烷作为标准物质以δ值(ppm)的方式描述化学位移值。如下显示分裂模式:s代表单峰,d代表双峰,t代表三重峰,q代表四重峰,m代表多重峰,和br代表宽峰。通过ei(电子电离)法、esi(电喷射电离)法或fab(快速原子轰击)法进行质谱法(其在下文中将被称作ms)。
[0316]
实施例
[0317]
参考合成例1
[0318]
n-(5-溴噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0319]
向商购可得的8-氧代-6,7-二氢-5h-吲嗪-5-甲酸(1.51g,8.43mmol)、商购可得的5-溴噻唑-2-胺(2.64g,10.2mmol)和3-羟基三唑并[4,5-b]吡啶(1.23g,9.04mmol)的二氯甲烷(30ml)溶液中加入1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(2.43g,12.6mmol)和n,n-二异丙基乙胺(2.94ml,16.9mmol),随后在室温搅拌2小时。将反应溶液用1n盐酸和饱和氯化钠水溶液洗涤,经无水硫酸钠干燥,然后过滤,在减压下蒸馏出溶剂。将残余物通过硅胶柱色谱法(正己烷/10%甲醇-乙酸乙酯溶液=3/1-0/1)纯化以得到1.88g(收率:66%)作为固体的标题化合物。
[0320]
参考合成例2
[0321]
n-(4-溴苯基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0322]
使用商购可得的4-溴苯胺,根据参考合成例1的方法得到4.66g(收率:84%)作为固体的标题化合物。
[0323]
参考合成例3
[0324]
n-(4-溴-2-氟苯基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0325]
使用商购可得的4-溴-2-氟苯胺,根据参考合成例1的方法得到345mg(收率:58%)作为固体的标题化合物。
[0326]
参考合成例4
[0327]
n-(5-溴-4-甲基噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0328]
使用商购可得的5-溴-4-甲基-噻唑-2-胺,根据参考合成例1的方法得到252mg(收
率:25%)作为固体的标题化合物。
[0329]
参考合成例5
[0330]
n-(6-溴-1,3-苯并噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0331]
使用商购可得的2-氨基-6-溴苯并噻唑,根据参考合成例1的方法得到585mg(收率:42%)作为固体的标题化合物。
[0332]
参考合成例6
[0333]
n-(4-溴-2-甲基苯基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0334]
使用商购可得的4-溴-2-甲基-苯胺,根据参考合成例1的方法得到515mg(收率:66%)作为固体的标题化合物。
[0335]
参考合成例7
[0336]
n-(5-溴-2-吡啶基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0337]
使用商购可得的5-溴吡啶-2-胺,根据参考合成例1的方法得到455mg(收率:58%)作为固体的标题化合物。
[0338]
参考合成例8
[0339]
n-(2-氯-1,3-苯并噻唑-6-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0340]
使用商购可得的2-氯-1,3-苯并噻唑-6-胺,根据参考合成例1的方法得到637mg(收率:76%)作为固体的标题化合物。
[0341]
参考合成例9
[0342]
5-[4-(三氟甲氧基)苯基]噻唑-2-胺
[0343]
向在国际公开号wo 2003014095中公开的n-(5-溴噻唑-2-基)-1,1-二苯基甲烷亚胺(1.46g,4.25mmol)、商购可得的4-(三氟甲氧基)苯基硼酸(4.30g,20.0mmol)、碳酸钾(2.97g,21.5mmol)、水(3ml)和1,4-二氧杂环己烷(15ml)的混合物中,加入[1,1'-双(二苯基膦基)二茂铁]二氯化钯(ii)-二氯甲烷络合物(1:1)(338mg,0.414mmol),随后在氮气氛下在100℃搅拌4小时。向反应混合物中加入水以后,将它用乙酸乙酯萃取。将有机层合并,用水和饱和盐水洗涤,然后经无水硫酸钠干燥。在减压下蒸馏出溶剂,并将得到的残余物通过硅胶柱色谱法(正己烷/乙酸乙酯=9/1-3/1)纯化。向得到的油状物的甲醇(20ml)溶液中加入1n盐酸(5ml,5.0mmol),随后在室温搅拌5.5小时。将反应混合物在减压下浓缩,并将析出的固体用二氯甲烷洗涤以得到897mg(收率:81%)作为固体的标题化合物。
[0344]
参考合成例10
[0345]
n-[5-[4-(二甲基氨甲酰基)苯基]噻唑-2-基]氨基甲酸叔丁酯
[0346]
在室温向商购可得的n-(5-溴噻唑-2-基)氨基甲酸叔丁酯(500mg,1.89mmol)的1,4-二氧杂环己烷(30ml)溶液中加入[4-(二甲基氨甲酰基)苯基]硼酸(519mg,2.69mmol)和[1,1'-双(二苯基膦基)二茂铁]二氯化钯(ii)-二氯甲烷络合物(1:1)(74mg,0.09mmol),随后搅拌。向反应混合物中加入碳酸钾(743mg,5.38mmol)和水(3.0ml),随后在100℃在氩气氛中搅拌4.5小时。向反应混合物中加入水以后,将它用乙酸乙酯萃取。将有机层合并,用水和饱和盐水洗涤,然后经无水硫酸钠干燥。在减压下蒸馏出溶剂,并将得到的残余物通过硅胶柱色谱法(二氯甲烷/甲醇=100/0-93/7,90/10-70/30)纯化以得到172mg(收率:28%)作为固体的标题化合物。
[0347]
参考合成例11
[0348]
4-(2-氨基噻唑-5-基)-n,n-二甲基苯甲酰胺
[0349]
在室温向在参考合成例10中得到的n-[5-[4-(二甲基氨甲酰基)苯基]噻唑-2-基]氨基甲酸叔丁酯(172mg,0.495mmol)的二氯甲烷(10ml)溶液中加入三氟乙酸(2.0ml,26mmol),随后搅拌并此后静置。将反应溶液在减压下浓缩以后,向其中加入饱和的碳酸氢钠水溶液,然后将混合物用二氯甲烷萃取。将有机层经无水硫酸钠干燥以后,在减压下蒸馏出溶剂以得到118mg(收率:96%)作为固体的标题化合物。
[0350]
参考合成例12
[0351]
5-(1,3-苯并二氧杂环戊烯-5-基)噻唑-2-胺
[0352]
使用商购可得的1,3-苯并二氧杂环戊烯-5-基硼酸,根据参考合成例10的方法得到产物。此后,根据参考合成例11的方法得到123mg(31%,2步)作为固体的标题化合物。
[0353]
参考合成例13
[0354]
4-(2-氨基噻唑-5-基)苄腈
[0355]
在冰冷却下将溴(56μl,1.09mmol)的二氯甲烷(0.56ml)的溶液加入到商购可得的4-(2-氧代乙基)苄腈(142mg,0978mmol)的二氯甲烷(10ml)溶液中。将反应溶液温热至室温以后,将混合物搅拌3小时。在冰冷却下向反应溶液中加入饱和的碳酸氢钠水溶液进行中和以后,将混合物用二氯甲烷萃取。将有机层合并和经无水硫酸钠干燥以后,在减压下蒸馏出溶剂。向得到的残余物的乙醇(30ml)溶液中加入硫脲(150mg,1.97mmol),随后在加热回流下搅拌4.5小时。冷却后,在减压下蒸馏出溶剂,并将得到的残余物通过硅胶柱色谱法(二氯甲烷/甲醇=99/1-95/5)纯化以得到8.3mg(4.2%)作为固体的标题化合物。
[0356]
参考合成例14
[0357]
2-[4-[2-(叔丁氧基羰基氨基)噻唑-5-基]苯氧基]乙酸叔丁酯
[0358]
使用商购可得的2-[4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯氧基]乙酸叔丁酯(2.4g,7.2mmol),根据参考合成例10的方法得到248mg(11%)作为固体的标题化合物。
[0359]
参考合成例15
[0360]
2-[4-(2-氨基噻唑-5-基)苯氧基]乙酸甲酯
[0361]
使用在参考合成例14中得到的2-[4-[2-(叔丁氧基羰基氨基)噻唑-5-基]苯氧基]乙酸叔丁酯(193mg,0.475mmol),根据参考合成例11的方法得到固体。在室温向得到的固体的四氢呋喃(10ml)和甲醇(3ml)的混合溶液中加入三甲基甲硅烷基重氮甲烷(0.6m己烷溶液,1.0ml),随后搅拌6小时。将反应溶液在减压下浓缩并向其中加入饱和的碳酸氢钠水溶液以后,将混合物用二氯甲烷萃取。将有机层经无水硫酸钠干燥以后,在减压下蒸馏出溶剂,并将得到的残余物通过硅胶柱色谱法(二氯甲烷/甲醇=99/1-97/3)纯化以得到92.5mg(收率:74%)作为固体的标题化合物。
[0362]
参考合成例16
[0363]
2-[4-[2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-5-基]苯氧基]乙酸甲酯
[0364]
使用在参考合成例15中得到的2-[4-(2-氨基噻唑-5-基)苯氧基]乙酸甲酯,根据合成例1的方法得到85.7mg(收率:89%)作为固体的标题化合物。
[0365]
参考合成例17
[0366]
2-溴-8-氧代-6,7-二氢-5h-吲嗪-5-甲酸甲酯
[0367]
在室温向商购可得的8-氧代-6,7-二氢-5h-吲嗪-5-甲酸甲酯(261mg,1.35mmol)的二氯甲烷(5ml)溶液中加入n-溴琥珀酰亚胺(228mg,1.28mmol),随后搅拌4小时。在减压下蒸馏出溶剂,并将得到的残余物通过硅胶柱色谱法(正己烷/乙酸乙酯=4/1-2/1)纯化以得到56.9mg(收率:16%)作为固体的标题化合物。
[0368]
参考合成例18
[0369]
2-溴-8-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0370]
向在参考合成例17中得到的2-溴-8-氧代-6,7-二氢-5h-吲嗪-5-甲酸甲酯(56.9mg,0.209mmol)的乙醇(2ml)溶液中加入1n氢氧化钠水溶液(0.5ml,0.50mmol),随后在60℃搅拌2小时。用1n盐酸使其为酸性以后,将混合物用乙酸乙酯萃取。将有机层经无水硫酸钠干燥以后,在减压下蒸馏出溶剂,以得到黄色固体(52.5mg)。使用得到的固体(52.5mmol)和在参考合成例9中得到的5-[4-(三氟甲氧基)苯基]噻唑-2-胺,根据合成例9的方法得到48.0mg(收率:55%)作为固体的标题化合物。
[0371]
参考合成例19
[0372]
n-(5-溴噻唑-2-基)-2-甲基-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0373]
向在参考合成例17中得到的2-溴-8-氧代-6,7-二氢-5h-吲嗪-5-甲酸甲酯(65.2mg,0.24mmol)、商购可得的2,4,6-三甲基-1,3,5,2,4,6-三氧杂三硼杂环己烷(0,201ml,1.44mmol)和碳酸钾(171mg,1.24mmol)的混合物中加入1,4-二氧杂环己烷(1.5ml)和水(0.5ml)。此后,进一步向其中加入[1,1'-双(二叔丁基膦基)二茂铁]二氯化钯(ii)(15.6mg,0.024mmol),随后在氮气氛下在100℃搅拌2.5小时。将水和1n盐酸加入到反应溶液以后,将它用乙酸乙酯萃取。将有机层用饱和盐水洗涤和经无水硫酸钠干燥以后,在减压下蒸馏出溶剂。使用得到的残余物,根据参考合成例1的方法得到23.9mg(收率:22%)作为固体的标题化合物。
[0374]
参考合成例20
[0375]
2-氯-8-氧代-6,7-二氢-5h-吲嗪-5-甲酸甲酯
[0376]
使用商购可得的n-氯琥珀酰亚胺,根据参考合成例17的方法得到56.3mg(收率:5.2%)作为固体的标题化合物。
[0377]
参考合成例21
[0378]
5-甲基-8-氧代-6,7-二氢吲嗪-5-甲酸甲酯
[0379]
在-78℃向商购可得的8-氧代-6,7-二氢-5h-吲嗪-5-甲酸甲酯(987mg,4.89mmol)和碘代甲烷(1.27ml,20.4mmol)的四氢呋喃溶液中,历时30分钟或更久滴加1.0m双(三甲基甲硅烷基)氨基钾四氢呋喃溶液(11.2ml,11.2mmol)。将混合物在相同温度搅拌1小时以后,向其中加入饱和的氯化铵水溶液进行骤冷。向反应溶液中加入水以后,将它用乙酸乙酯萃取。将有机层用饱和盐水洗涤和经无水硫酸钠干燥。在减压下蒸馏出溶剂,并将得到的残余物通过硅胶柱色谱法(正己烷/乙酸乙酯=6/1-1/1)纯化以得到592mg(收率:56%)作为油状物的标题化合物。
[0380]
参考合成例22
[0381]
5-甲基-8-氧代-6,7-二氢吲嗪-5-甲酸
[0382]
向在参考合成例21中得到的5-甲基-8-氧代-6,7-二氢吲嗪-5-甲酸甲酯(63.0mg,0.304mmol)的乙醇(1.0ml)溶液中加入1n氢氧化钠水溶液(0.91ml,0.91mmol),随后在80℃搅拌2小时。将1n盐酸加入到反应溶液进行中和以后,将它用乙酸乙酯萃取。将有机层用饱和盐水洗涤和经无水硫酸钠干燥。在减压下蒸馏出溶剂,以得到48.3mg(收率:82%)作为固体的标题化合物。
[0383]
参考合成例23
[0384]
n-(5-溴噻唑-2-基)-5-甲基-8-氧代-6,7-二氢吲嗪-5-甲酰胺
[0385]
使用在参考合成例22中得到的5-甲基-8-氧代-6,7-二氢吲嗪-5-甲酸(472mg,2.44mmol),根据参考合成例1的方法得到628mg(收率:73%)作为固体的标题化合物。
[0386]
参考合成例24
[0387]
n-(5-溴-4-异丙基噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0388]
使用商购可得的5-溴-4-异丙基噻唑-2-胺,根据参考合成例1的方法得到287mg(收率:43%)作为固体的标题化合物。
[0389]
参考合成例25
[0390]
5-溴-2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-4-甲酸甲酯
[0391]
使用商购可得的2-氨基-5-溴噻唑-4-甲酸甲酯,根据参考合成例1的方法得到219mg(收率:29%)作为无定形物的标题化合物。
[0392]
合成例1
[0393]
8-氧代-n-(5-苯基噻唑-2-基)-6,7-二氢-5h-吲嗪-5-甲酰胺
[0394]
在室温向商购可得的8-氧代-6,7-二氢-5h-吲嗪-5-甲酸(1.5g,8.4mmol)、在journal of medicinal chemistry 1983,26,1158-1163中描述的5-苯基噻唑-2-胺(1.0g,5.7mmol)、n,n-二甲基吡啶-4-胺(0.14g,1.1mmol)和n,n-二异丙基乙胺(2.5ml,14mmol)的二氯甲烷(50ml)溶液中加入商购可得的2,4,6-三异丙基磺酰氯(2.5g,8.3mmol),随后搅拌3小时。通过加入二氯甲烷稀释反应溶液以后,加入饱和的碳酸氢钠水溶液进行中和和洗涤。将有机层经无水硫酸钠干燥以后,在减压下蒸馏出溶剂。将残余物通过硅胶柱色谱法(二氯甲烷/甲醇=99/1-95/5)纯化以得到1.59g(收率:83%)作为固体的标题化合物。
[0395]
合成例2
[0396]
4-[2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-5-基]苯甲酸甲酯
[0397]
使用在国际公开号wo 2012121168中描述的4-(2-氨基噻唑-5-基)苯甲酸甲酯,根据合成例1的方法得到18.4g(收率:54%)作为固体的标题化合物。
[0398]
合成例3
[0399]
n-[5-[4-(二甲基氨甲酰基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0400]
使用在参考合成例11中得到的4-(2-氨基噻唑-5-基)-n,n-二甲基苯甲酰胺,根据合成例1的方法得到7.17g(收率:75%)作为固体的标题化合物。
[0401]
合成例4
[0402]
n-[5-(1,3-苯并二氧杂环戊烯-5-基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0403]
使用在参考合成例12中得到的5-(1,3-苯并二氧杂环戊烯-5-基)噻唑-2-胺,根据
合成例1的方法得到130mg(收率:62%)作为固体的标题化合物。
[0404]
合成例5
[0405]
4-[2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-5-基]苯甲酸
[0406]
向在合成例2中得到的4-[2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-5-基]苯甲酸甲酯(383mg,0.969mmol)的乙醇(3ml)和水(2ml)的混合溶液中加入1n氢氧化钠水溶液(3.8ml,3.8mmol),随后在50℃搅拌4小时。将水加入到反应溶液,随后用1n盐酸中和,并将析出的固体通过过滤进行收集。将得到的固体用水洗涤并在此后干燥以得到326mg(收率:88%)作为固体的标题化合物。
[0407]
合成例6
[0408]
n-[5-(4-氨甲酰基苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0409]
在室温向在合成例5中得到的4-[2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-5-基]苯甲酸(17mg,0.045mmol)的n,n-二甲基甲酰胺(1ml)溶液中加入[二甲基氨基(三唑并[4,5-b]吡啶-3-基氧基)亚甲基]-二甲基-六氟磷酸铵(25mg,0.067mmol)、n,n-二异丙基乙胺(39μl,0.22mmol)和7m氨甲醇溶液(64μl,0.45mmol),随后搅拌15小时。将反应溶液通过直接硅胶柱色谱法(二氯甲烷/50%甲醇乙酸乙酯溶液=95/5-90/10)纯化,以得到4.9mg(收率:29%)标题化合物。
[0410]
合成例7
[0411]
n-[5-(4-氰基苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0412]
使用在参考合成例13中得到的4-(2-氨基噻唑-5-基)苄腈,根据合成例1的方法得到9.0mg(收率:60%)标题化合物。
[0413]
合成例8
[0414]
n-[5-[4-[2-(二甲基氨基)-2-氧代-乙氧基]苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0415]
在室温向在参考合成例16中得到的2-[4-[2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-5-基]苯氧基]乙酸甲酯(84mg,0.197mmol)的四氢呋喃(8.0ml)和甲醇(3.0ml)的混合溶液中加入5n氢氧化钠水溶液(0.20ml,1.0mmol),随后搅拌并此后静置过夜。用5n盐酸中和以后,在减压下蒸馏出溶剂,以得到固体。在室温向得到的固体的n,n-二甲基甲酰胺(3ml)溶液中加入n,n-二异丙基乙胺(52μl,0.30mmol)和2.0m二甲基胺四氢呋喃溶液(0.50ml,1.0mmol)。此后,进一步向其中加入[二甲基氨基(三唑并[4,5-b]吡啶-3-基氧基)亚甲基]二甲基六氟磷酸铵(42mg,0.11mmol),随后搅拌3小时。通过加入二氯甲烷稀释反应溶液以后,加入饱和的碳酸氢钠水溶液进行中和和洗涤。将有机层经无水硫酸钠干燥以后,在减压下蒸馏出溶剂。将残余物通过硅胶柱色谱法(二氯甲烷/甲醇=99/1-95/5)纯化以得到39.1mg(收率:89%)作为固体的标题化合物。
[0416]
合成例9
[0417]
8-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0418]
在室温向商购可得的8-氧代-6,7-二氢-5h-吲嗪-5-甲酸(109mg,0.61mmol)、在参考合成例9中得到的5-[4-(三氟甲氧基)苯基]噻唑-2-胺(127mg,0.488mmol)和3-羟基三唑[4,5-b]吡啶(128mg,0.941mmol)的二氯甲烷(3ml)溶液中加入1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(352mg,1.84mmol)和n,n-二异丙基乙胺(0.531ml,3.05mmol),随后在
室温搅拌2小时。将反应溶液用二氯甲烷稀释并此后用水和饱和氯化钠水溶液洗涤。将有机层经无水硫酸钠干燥并此后过滤,在减压下蒸馏出溶剂。将残余物通过硅胶柱色谱法(正己烷/乙酸乙酯溶液=3/1-0/1)纯化以得到74.3mg(收率:29%)作为固体的标题化合物。
[0419]
合成例10
[0420]
(5r)-8-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺和(5s)-8-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0421]
使用在合成例9中得到的8-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺,通过hplc(柱:ymc chiral art cellulose-sb(5μm)250
×
30mmi.d.,流速:31.8ml/min,溶剂:正己烷/乙醇=70/30)进行光学拆分。在收集较早洗脱的第一个峰以后,在减压下蒸馏出溶剂以得到作为固体的标题化合物(48mg,光学纯度:99.9%ee)。进一步,在收集较晚洗脱的第二个峰以后,在减压下蒸馏出溶剂以得到作为固体的标题化合物(48mg,光学纯度:99.8%ee)。
[0422]
合成例11
[0423]
n-[5-(4-叔丁氧基苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0424]
向在参考合成例1中得到的n-(5-溴噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺(137mg,0.401mmol)、商购可得的(4-叔丁氧基苯基)硼酸(389mg,2.01mmol)和碳酸铯(670mg,2.06mmol)的混合物中加入n,n-二甲基甲酰胺(2ml)和水(1ml)。此后,向其中加入氯(2-二环己基膦基-2',4',6'-三异丙基-1,1'-联苯)[2-(2'-氨基-1,1'-联苯)]钯(ii)(33.2mg,0.042mmol),随后在90℃在氮气氛下搅拌5小时。向反应溶液中加入水以后,将它用乙酸乙酯萃取。将有机层用饱和盐水洗涤和经无水硫酸钠干燥以后,在减压下蒸馏出溶剂。将残余物通过硅胶柱色谱法(正己烷/乙酸乙酯=3/1-0/1)纯化以得到63.3mg(收率:39%)作为固体的标题化合物。
[0425]
合成例12
[0426]
n-[5-(4-氯苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0427]
使用商购可得的4-氯苯基硼酸,根据合成例11的方法得到11.0mg(收率:6.4%)作为固体的标题化合物。
[0428]
合成例13
[0429]
n-[5-(3-氯苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0430]
使用商购可得的5-(3-氯苯基)噻唑-2-胺,根据合成例9的方法得到158mg(收率:48%)作为固体的标题化合物。
[0431]
合成例14
[0432]
n-[5-(2-氯苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0433]
使用商购可得的2-氯苯基硼酸,根据合成例11的方法得到13.2mg(收率:8.0%)标题化合物。
[0434]
合成例15
[0435]
n-[5-(3-氟苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0436]
使用商购可得的5-(3-氟苯基)噻唑-2-胺,根据合成例1的方法得到127mg(收率:87%)作为固体的标题化合物。
[0437]
合成例16
[0438]
n-[5-(4-氟苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0439]
使用商购可得的5-(4-氟苯基)噻唑-2-胺,根据合成例1的方法得到198mg(收率:64%)作为固体的标题化合物。
[0440]
合成例17
[0441]
n-[5-(2-氟苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0442]
使用商购可得的5-(2-氟苯基)噻唑-2-胺,根据合成例1的方法得到119mg(收率:82%)作为固体的标题化合物。
[0443]
合成例18
[0444]
8-氧代-n-[5-(对-甲苯基)噻唑]-2-基)-6,7-二氢-5h-吲嗪-5-甲酰胺
[0445]
使用商购可得的4-甲基苯基硼酸,根据合成例11的方法得到24.7mg(收率:18%)作为固体的标题化合物。
[0446]
合成例19
[0447]
n-[5-(邻-甲苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0448]
使用商购可得的2-甲基苯基硼酸,根据合成例11的方法得到16.6mg(收率:11%)作为固体的标题化合物。
[0449]
合成例20
[0450]
n-[5-(间-甲苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0451]
使用商购可得的5-(间-甲苯基)噻唑-2-胺,根据合成例9的方法得到115mg(收率:58%)标题化合物。
[0452]
合成例21
[0453]
8-氧代-n-[5-[4-(三氟甲基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0454]
使用商购可得的[4-(三氟甲基)苯基]硼酸,根据合成例11的方法得到32.9mg(收率:17%)标题化合物。
[0455]
合成例22
[0456]
n-[5-[4-(2-甲氧基苯基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0457]
使用商购可得的[4-(2-甲氧基苯基)苯基]硼酸,根据合成例11的方法得到3.6mg(收率:16%)标题化合物。
[0458]
合成例23
[0459]
8-氧代-n-[5-[4-(对-甲苯基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0460]
使用商购可得的[4-(对-甲苯基)苯基]硼酸,根据合成例11的方法得到9.0mg(收率:42%)标题化合物。
[0461]
合成例24
[0462]
n-[5-(2-萘基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0463]
使用商购可得的4,4,5,5-四甲基-2-(2-萘基)-1,3,2-二氧杂硼杂环戊烷,根据合成例11的方法得到1.6mg(收率:8.2%)标题化合物。
[0464]
合成例25
[0465]
8-氧代-n-[5-[3-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0466]
使用商购可得的[3-(三氟甲氧基)苯基]硼酸,根据合成例11的方法得到9.0mg(收率:43%)标题化合物。
[0467]
合成例26
[0468]
n-[5-(4-甲氧基苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0469]
使用商购可得的(4-甲氧基苯基)硼酸,根据合成例11的方法得到19.7mg(收率:17%)作为固体的标题化合物。
[0470]
合成例27
[0471]
n-[5-(3-甲氧基苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0472]
使用商购可得的(3-甲氧基苯基)硼酸,根据合成例11的方法得到1.9mg(收率:38%)标题化合物。
[0473]
合成例28
[0474]
n-[5-[2-甲基-4-(三氟甲氧基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0475]
使用商购可得的[2-甲基-4-(三氟甲氧基)苯基]硼酸,根据合成例11的方法得到4.2mg(收率:19%)标题化合物。
[0476]
合成例29
[0477]
n-[5-[3-甲基-4-(三氟甲氧基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0478]
使用商购可得的[3-甲基-4-(三氟甲氧基)苯基]硼酸,根据合成例11的方法得到8.4mg(收率:38%)标题化合物。
[0479]
合成例30
[0480]
n-[5-[3-氯-4-(三氟甲氧基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0481]
使用商购可得的[3-氯-4-(三氟甲氧基)苯基]硼酸,根据合成例11的方法得到2.8mg(收率:12%)标题化合物。
[0482]
合成例31
[0483]
n-[5-[3-(羟基甲基)-4-(三氟甲氧基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0484]
使用商购可得的[3-(羟基甲基)-4-(三氟甲氧基)苯基]硼酸,根据合成例11的方法得到9.1mg(收率:40%)标题化合物。
[0485]
合成例32
[0486]
n-[5-(4-苄氧基苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0487]
使用商购可得的(4-苄氧基苯基)硼酸,根据合成例11的方法得到7.6mg(收率:34%)标题化合物。
[0488]
合成例33
[0489]
n-[5-(4-异丙氧基苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0490]
使用商购可得的(4-异丙氧基苯基)硼酸,根据合成例11的方法得到29.0mg(收率:24%)作为固体的标题化合物。
[0491]
合成例34
[0492]
n-(4-甲基-5-苯基噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0493]
使用商购可得的4-甲基-5-苯基噻唑-2-胺,根据合成例9的方法得到160mg(收率:82%)标题化合物。
[0494]
合成例35
[0495]
n-[5-(4-叔丁氧基苯基)-4-甲基噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0496]
向在参考合成例4中得到的n-(5-溴-4-甲基噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺(106mg,0.300mmol)、商购可得的(4-叔丁氧基苯基)硼酸(292mg,1.50mmol)和碳酸铯(596mg,1.83mmol)的混合物中加入n,n-二甲基甲酰胺(1.5ml)和水(1ml)。此后,向其中加入氯(2-二环己基膦基-2',4',6'-三异丙基-1,1'-联苯)[2-(2'-氨基-1,1'-联苯)]钯(ii)(25.0mg,0.032mmol),随后在90℃在氮气氛下搅拌5小时。向反应溶液中加入水以后,将它用乙酸乙酯萃取。将有机层用饱和盐水洗涤和经无水硫酸钠干燥以后,在减压下蒸馏出溶剂。将残余物通过硅胶柱色谱法(正己烷/乙酸乙酯=3/1-0/1)纯化。此后,将得到的固体用乙醚洗涤以得到65.0mg(收率:51%)作为固体的标题化合物。
[0497]
合成例36
[0498]
n-[4-甲基-5-[4-(三氟甲氧基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0499]
使用商购可得的[4-(三氟甲氧基)苯基]硼酸,根据合成例35的方法得到72.0mg(收率:49%)标题化合物。
[0500]
合成例37
[0501]
n-[5-[4-(羟基甲基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0502]
使用商购可得的[4-(羟基甲基)苯基]硼酸,根据合成例11的方法得到5.3mg(收率:29%)标题化合物。
[0503]
合成例38
[0504]
n-[5-[4-(2-甲氧基乙氧基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0505]
使用商购可得的[4-(2-甲氧基乙氧基)苯基]硼酸,根据合成例11的方法得到0.6mg(收率:2.7%)标题化合物。
[0506]
合成例39
[0507]
n-[5-[4-(二氟甲氧基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0508]
使用商购可得的[4-(二氟甲氧基)苯基]硼酸,根据合成例11的方法得到7.0mg(收率:35%)标题化合物。
[0509]
合成例40
[0510]
n-[5-(2,2-二氟-1,3-苯并二氧杂环戊烯-5-基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0511]
使用商购可得的(2,2-二氟-1,3-苯并二氧杂环戊烯-5-基)硼酸,根据合成例11的方法得到9.4mg(收率:45%)标题化合物。
[0512]
合成例41
[0513]
n-[5-(4-吗啉代苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0514]
使用商购可得的4-[4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基]吗啉,根据合成例11的方法得到27.6mg(收率:24%)作为固体的标题化合物。
[0515]
合成例42
[0516]
n-[5-[4-(二甲基氨磺酰基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0517]
使用商购可得的[4-(二甲基氨磺酰基)苯基]硼酸,根据合成例11的方法得到9.7mg(收率:44%)标题化合物。
[0518]
合成例43
[0519]
n-[5-(4-苄氧基-3-氟苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0520]
使用商购可得的(4-苄氧基-3-氟苯基)硼酸,根据合成例11的方法得到62.8mg(收率:33%)作为固体的标题化合物。
[0521]
合成例44
[0522]
n-[5-(4-苄氧基-2-氟苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0523]
使用商购可得的(4-苄氧基-2-氟苯基)硼酸,根据合成例11的方法得到9.7mg(收率:42%)标题化合物。
[0524]
合成例45
[0525]
8-氧代-n-[5-[4-(2,2,2-三氟乙氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0526]
使用商购可得的[4-(2,2,2-三氟乙氧基)苯基]硼酸,根据合成例11的方法得到53.0mg(收率:28%)作为固体的标题化合物。
[0527]
合成例46
[0528]
8-氧代-n-[5-(4-苯氧基苯基)噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0529]
使用商购可得的(4-苯氧基苯基)硼酸,根据合成例11的方法得到53.0mg(收率:29%)作为固体的标题化合物。
[0530]
合成例47
[0531]
n-[5-(4-溴苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0532]
使用商购可得的5-(4-溴苯基)噻唑-2-胺,根据合成例9的方法得到755mg(收率:59%)作为固体的标题化合物。
[0533]
合成例48
[0534]
[4-[2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-5-基]苯基]碳酸叔丁酯
[0535]
使用商购可得的(4-叔丁氧基羰基氧基苯基)硼酸,根据合成例11的方法得到1.0mg(收率:4.3%)标题化合物。
[0536]
合成例49
[0537]
n-[5-(4-异丁氧基苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0538]
使用商购可得的(4-异丁氧基苯基)硼酸,根据合成例11的方法得到6.5mg(收率:32%)标题化合物。
[0539]
合成例50
[0540]
n-[5-(环己烯-1-基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0541]
使用商购可得的2-(环己烯-1-基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷,
根据合成例11的方法得到13.8mg(收率:13%)作为固体的标题化合物。
[0542]
合成例51
[0543]
4-[2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-5-基]-3,6-二氢-2h-吡啶-1-甲酸叔丁酯
[0544]
使用商购可得的4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-3,6-二氢-2h-吡啶-1-甲酸叔丁酯,根据合成例11的方法得到7.7mg(收率:35%)标题化合物。
[0545]
合成例52
[0546]
n-[5-(5-氯-6-异丁氧基-3-吡啶基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0547]
使用商购可得的(5-氯-6-异丁氧基-3-吡啶基)硼酸,根据合成例11的方法得到3.2mg(收率:15%)标题化合物。
[0548]
合成例53
[0549]
3-[2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-5-基]-2,5-二氢吡咯-1-甲酸叔丁酯
[0550]
使用商购可得的3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-2,5-二氢吡咯-1-甲酸叔丁酯,根据合成例11的方法得到7.6mg(收率:35%)标题化合物。
[0551]
合成例54
[0552]
n-[5-(5-甲基-2-呋喃基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0553]
使用商购可得的4,4,5,5-四甲基-2-(5-甲基-2-呋喃基)-1,3,2-二氧杂硼杂环戊烷,根据合成例11的方法得到7.3mg(收率:43%)标题化合物。
[0554]
合成例55
[0555]
n-[5-(2,4-二甲基噻唑-5-基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0556]
使用商购可得的2,4-二甲基-5-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)噻唑,根据合成例11的方法得到3.6mg(收率:19%)标题化合物。
[0557]
合成例56
[0558]
n-[5-(5-氯-2-噻吩基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0559]
使用商购可得的(5-氯-2-噻吩基)硼酸,根据合成例11的方法得到1.0mg(收率:5.2%)标题化合物。
[0560]
合成例57
[0561]
n-[5-(4-乙酰基苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0562]
使用商购可得的(4-乙酰基苯基)硼酸,根据合成例11的方法得到6.2mg(收率:33%)标题化合物。
[0563]
合成例58
[0564]
1-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-2,3-二氢吡咯烷-3-甲酰胺
[0565]
使用商购可得的1-氧代-2,3-二氢吡咯烷-3-甲酸,根据合成例9的方法得到71.9mg(收率:29%)作为固体的标题化合物。
[0566]
合成例59
[0567]
8-氧代-n-[6-[4-(三氟甲氧基)苯基]-1,3-苯并噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0568]
使用在参考合成例5中得到的n-(6-溴-1,3-苯并噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的[4-(三氟甲氧基)苯基]硼酸,根据合成例11的方法得到59.5mg(收率:46%)作为固体的标题化合物。
[0569]
合成例60
[0570]
n-[6-[4-(二氟甲氧基)苯基]-1,3-苯并噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0571]
使用在参考合成例5中得到的n-(6-溴-1,3-苯并噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的[4-(二氟甲氧基)苯基]硼酸,根据合成例11的方法得到11.2mg(收率:49%)标题化合物。
[0572]
合成例61
[0573]
n-[6-(2,2-二氟-1,3-苯并二氧杂环戊烯-5-基)-1,3-苯并噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0574]
使用在参考合成例5中得到的n-(6-溴-1,3-苯并噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的(2,2-二氟-1,3-苯并二氧杂环戊烯-5-基)硼酸,根据合成例11的方法得到12.6mg(收率:54%)标题化合物。
[0575]
合成例62
[0576]
2-甲基-8-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0577]
向在参考合成例18中得到的2-溴-8-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺(42.8mg,0.0856mmol)、商购可得的2,4,6-三甲基-1,3,5,2,4,6-三氧杂三硼杂环己烷(0.127ml,0.908mmol)和碳酸钾(184mg,1.33mmol)的混合物中加入1,4-二氧杂环己烷(1.5ml)和水(0.5ml)。此后,向其中加入氯(2-二环己基膦基-2'4'6'-三异丙基-1,1'-联苯)[2-(2'-氨基-1,1'-联苯)]钯(ii)(15.3mg,0.019mmol),随后在氮气氛下在100℃搅拌4小时。由于原料残存,因此将相同的操作再次重复,证实原料的消失。向反应溶液中加入水以后,将它用乙酸乙酯萃取。将有机层用饱和盐水洗涤和经无水硫酸钠干燥以后,在减压下蒸馏出溶剂。将残余物通过硅胶柱色谱法(正己烷/乙酸乙酯=9/1-1/1)纯化以得到5.6mg(收率:15%)作为固体的标题化合物。
[0578]
合成例63
[0579]
n-[5-(4-叔丁氧基苯基)噻唑-2-基]-2-甲基-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0580]
使用在参考合成例19中得到的n-(5-溴噻唑-2-基)-2-甲基-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺,根据合成例11的方法得到6.4mg(收率:22%)作为固体的标题化合物。
[0581]
合成例64
[0582]
2-氯-8-氧代-n-[5-[4-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0583]
在室温向在参考合成例20中得到的2-氯-8-氧代-6,7-二氢-5h-吲嗪-5-甲酸甲酯(66.2mg,0.291mmol)的乙醇(1ml)和四氢呋喃(1ml)的混合溶液中加入1n氢氧化钠水溶液(0.5ml,0.5mmol),随后搅拌2小时。向反应溶液中加入水以后,加入1n盐酸使其为酸性,并用乙酸乙酯萃取。将有机层用饱和盐水洗涤和经无水硫酸钠干燥以后,在减压下蒸馏出溶
剂。使用得到的残余物(羧酸化合物62mg),根据合成例9的方法得到68.0mg(收率:37%)作为固体的标题化合物。
[0584]
合成例65
[0585]
5-甲基-8-氧代-n-[5-[4-三氟甲氧基]苯基]噻唑-2-基]-6,7-二氢吲嗪-5-甲酰胺
[0586]
向在参考合成例23中得到的n-(5-溴噻唑-2-基)-5-甲基-8-氧代-6,7-二氢吲嗪-5-甲酰胺(168mg,0.475mmol)、商购可得的[4-(三氟甲氧基)苯基]硼酸(588mg,2.86mmol)和碳酸铯(1.03g,3.16mmol)的混合物中加入n,n-二甲基甲酰胺(2ml)和水(1ml)。此后,向其中加入氯(2-二环己基膦基-2'4'6'-三异丙基-1,1'-联苯)[2-(2'-氨基-1,1'-联苯)]钯(ii)(38.6mg,0.049mmol),随后在90℃在氮气氛下搅拌4小时。向反应溶液中加入水以后,将它用乙酸乙酯萃取。将有机层用饱和盐水洗涤和经无水硫酸钠干燥以后,在减压下蒸馏出溶剂。将残余物通过硅胶柱色谱法(正己烷/乙酸乙酯=3/1-0/1)纯化以得到59.7mg(收率:29%)作为固体的标题化合物。
[0587]
合成例66
[0588]
5-甲基-8-氧代-n-[5-(对-甲苯基)噻唑-2-基]-6,7-二氢吲嗪-5-甲酰胺
[0589]
使用商购可得的4-甲基苯基硼酸,根据合成例65的方法得到8.6mg(收率:47%)标题化合物。
[0590]
合成例67
[0591]
5-甲基-n-[5-(间-甲苯基)噻唑-2-基]-8-氧代-6,7-二氢吲嗪-5-甲酰胺
[0592]
使用商购可得的3-甲基苯基硼酸,根据合成例65的方法得到8.1mg(收率:44%)标题化合物。
[0593]
合成例68
[0594]
n-[5-(2,2-二氟-1,3-苯并二氧杂环戊烯-5-基)噻唑-2-基]-5-甲基-8-氧代-6,7-二氢吲嗪-5-甲酰胺
[0595]
使用商购可得的(2,2-二氟-1,3-苯并二氧杂环戊烯-5-基)硼酸,根据合成例65的方法得到0.6mg(收率:3.0%)标题化合物。
[0596]
合成例69
[0597]
n-[5-(4-异丙氧基苯基)噻唑-2-基]-5-甲基-8-氧代-6,7-二氢吲嗪-5-甲酰胺
[0598]
使用商购可得的(4-异丙氧基苯基)硼酸,根据合成例65的方法得到6.8mg(收率:33%)标题化合物。
[0599]
合成例70
[0600]
5-甲基-n-[5-[3-甲基-4-(三氟甲氧基)苯基]噻唑-2-基]-8-氧代-6,7-二氢吲嗪-5-甲酰胺
[0601]
使用商购可得的[3-甲基-4-(三氟甲氧基)苯基]硼酸,根据合成例65的方法得到8.3mg(收率:37%)标题化合物。
[0602]
合成例71
[0603]
n-[5-[3-氯-4-(三氟甲氧基)苯基]噻唑-2-基]-5-甲基-8-氧代-6,7-二氢吲嗪-5-甲酰胺
[0604]
使用商购可得的[3-氯-4-(三氟甲氧基)苯基]硼酸,根据合成例65的方法得到
5.0mg(收率:21%)标题化合物。
[0605]
合成例72
[0606]
5-甲基-8-氧代-n-[5-[3-(三氟甲氧基)苯基]噻唑-2-基]-6,7-二氢吲嗪-5-甲酰胺
[0607]
使用商购可得的[3-(三氟甲氧基)苯基]硼酸,根据合成例65的方法得到7.8mg(收率:36%)标题化合物。
[0608]
合成例73
[0609]
8-氧代-n-[4-[4-(三氟甲氧基)苯基]苯基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0610]
使用在参考合成例2中得到的n-(4-溴苯基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺(1.21g,3.62mmol)和商购可得的4-(三氟甲氧基苯基)硼酸,根据合成例11的方法得到1.29g(收率:86%)作为固体的标题化合物。
[0611]
合成例74
[0612]
n-[4-(2,2-二氟-1,3-苯并二氧杂环戊烯-5-基)苯基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0613]
使用在参考合成例2中得到的n-(4-溴苯基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的(2,2-二氟-1,3-苯并二氧杂环戊烯-5-基)硼酸,根据合成例11的方法得到10.4mg(收率:50%)标题化合物。
[0614]
合成例75
[0615]
n-[4-[4-(二氟甲氧基)苯基]苯基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0616]
使用在参考合成例2中得到的n-(4-溴苯基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的[4-(二氟甲氧基)苯基]硼酸,根据合成例11的方法得到11.5mg(收率:58%)标题化合物。
[0617]
合成例76
[0618]
n-[4-[3-氯-4-(三氟甲氧基)苯基]苯基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0619]
使用在参考合成例2中得到的n-(4-溴苯基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的[3-氯-4-(三氟甲氧基)苯基]硼酸,根据合成例11的方法得到7.0mg(收率:31%)标题化合物。
[0620]
合成例77
[0621]
3-溴-8-氧代-n-[4-[4-(三氟甲氧基)苯基]苯基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0622]
在室温向在合成例73中得到的8-氧代-n-[4-[4-(三氟甲氧基)苯基]苯基]-6,7-二氢-5h-吲嗪-5-甲酰胺(150mg,0.363mmol)的二氯甲烷(15ml)溶液中加入n-溴琥珀酰亚胺(45.9mg,0.258mmol),随后搅拌4.5小时。将反应溶液在减压下浓缩,并将得到的残余物通过硅胶柱色谱法(正己烷/10%甲醇乙酸乙酯溶液=3/1-1/1)纯化以得到93.6mg(收率:52%)作为固体的标题化合物。
[0623]
合成例78
[0624]
n-[2-氟-4-[4-(三氟甲氧基)苯基]苯基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0625]
使用在参考合成例3中得到的n-(4-溴-2-氟苯基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的[4-(三氟甲氧基)苯基]硼酸,根据合成例11的方法得到73.4mg(收率:91%)作为固体的标题化合物。
[0626]
合成例79
[0627]
n-[4-[3-氯-4-(三氟甲氧基)苯基]-2-氟苯基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0628]
使用在参考合成例3中得到的n-(4-溴-2-氟苯基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的[3-氯-4-(三氟甲氧基)苯基]硼酸,根据合成例11的方法得到5.0mg(收率:21%)标题化合物。
[0629]
合成例80
[0630]
n-[4-(4-叔丁氧基苯基)-2-氟苯基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0631]
使用在参考合成例3中得到的n-(4-溴-2-氟苯基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺,根据合成例11的方法得到75.0mg(收率:84%)作为固体的标题化合物。
[0632]
合成例81
[0633]
n-[2-甲基-4-[4-(三氟甲氧基)苯基]苯基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0634]
使用在参考合成例6中得到的n-(4-溴-2-甲基苯基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的[4-(三氟甲氧基)苯基]硼酸,根据合成例11的方法得到184mg(收率:92%)作为固体的标题化合物。
[0635]
合成例82
[0636]
8-氧代-n-[5-[4-(三氟甲氧基)苯基]-2-吡啶基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0637]
使用在参考合成例7中得到的n-(5-溴-2-吡啶基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的[4-(三氟甲氧基)苯基]硼酸,根据合成例11的方法得到4.0mg(收率:17%)标题化合物。
[0638]
合成例83
[0639]
8-氧代-n-[2-[4-(三氟甲氧基)苯基]-1,3-苯并三唑-6-基]-6,7-二氢-5h-吲嗪-5-甲酰胺
[0640]
使用在参考合成例8中得到的n-(2-氯-1,3-苯并噻唑-6-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的[4-(三氟甲氧基)苯基]硼酸,根据合成例11的方法得到86.8mg(收率:58%)作为固体的标题化合物。
[0641]
合成例84
[0642]
n-[5-(2,2-二氟-1,3-苯并二氧杂环戊烯-5-基)-4-甲基噻唑-2-基]-8-氧代-6,7-二氢吲嗪-5-甲酰胺
[0643]
使用商购可得的(2,2-二氟-1,3-苯并二氧杂环戊烯-5-基)硼酸,根据合成例35的方法得到10.4mg(收率:48%)标题化合物。
[0644]
合成例85
[0645]
n-[5-(4-苄氧基-3-氟苯基)-4-甲基噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0646]
使用商购可得的(4-苄氧基-3-氟苯基)硼酸,根据合成例35的方法得到10.4mg(收率:44%)标题化合物。
[0647]
合成例86
[0648]
n-[5-(4-异丁氧基苯基)-4-甲基噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰
胺
[0649]
使用商购可得的(4-异丁氧基苯基)硼酸,根据合成例35的方法得到12.2mg(收率:58%)标题化合物。
[0650]
合成例87
[0651]
n-[5-(5-氯-6-异丁氧基-3-吡啶基)-4-甲基噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0652]
使用商购可得的(5-氯-6-异丁氧基-3-吡啶基)硼酸,根据合成例35的方法得到6.6mg(收率:29%)标题化合物。
[0653]
合成例88
[0654]
n-[4-甲基-5-[4-(2,2,2-三氟乙氧基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0655]
使用商购可得的[4-(2,2,2-三氟乙氧基)苯基]硼酸,根据合成例35的方法得到13.2mg(收率:59%)标题化合物。
[0656]
(合成例89)
[0657]
n-[4-甲基-5-[3-甲基-4-(三氟甲氧基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0658]
使用商购可得的[3-甲基-4-(三氟甲氧基)苯基]硼酸,根据合成例35的方法得到7.5mg(收率:33%)标题化合物。
[0659]
(合成例90)
[0660]
4-[4-甲基-2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-5-基]-3,6-二氢-2h-吡啶-1-甲酸叔丁酯
[0661]
使用商购可得的4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-3,6-二氢-2h-吡啶-1-甲酸叔丁酯,根据合成例35的方法得到12.8mg(收率:56%)标题化合物。
[0662]
(合成例91)
[0663]
n-[5-[4-(二氟甲氧基)苯基]-4-甲基噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0664]
使用在参考合成例5中得到的n-(6-溴-1,3-苯并噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的[4-(二氟甲氧基)苯基]硼酸,根据合成例35的方法得到10.9mg(收率:52%)标题化合物。
[0665]
(合成例92)
[0666]
n-[6-[3-甲基-4-(三氟甲氧基)苯基]-1,3-苯并噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0667]
使用在参考合成例5中得到的n-(6-溴-1,3-苯并噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的[3-甲基-4-(三氟甲氧基)苯基]硼酸,根据合成例11的方法得到14.0mg(收率:58%)标题化合物。
[0668]
(合成例93)
[0669]
n-[6-(4-氯苯基)-1,3-苯并噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0670]
使用在参考合成例5中得到的n-(6-溴-1,3-苯并噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的4-氯苯基硼酸,根据合成例11的方法得到2.8mg(收率:
13%)标题化合物。
[0671]
(合成例94)
[0672]
n-[6-(4-氟苯基)-1,3-苯并噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0673]
使用在参考合成例5中得到的n-(6-溴-1,3-苯并噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的4-氟苯基硼酸,根据合成例11的方法得到13.0mg(收率:64%)标题化合物。
[0674]
(合成例95)
[0675]
n-[5-(4-苯甲酰基苯基)噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0676]
使用商购可得的4-苯甲酰基苯基硼酸,根据合成例11的方法得到75.4mg(收率:28%)作为固体的标题化合物。
[0677]
(合成例96)
[0678]
n-[4-异丙基-5-[4-(三氟甲氧基)苯基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0679]
使用在参考合成例24中得到的n-(5-溴-4-异丙基噻唑-2-基)-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和商购可得的[4-(三氟甲氧基)苯基]硼酸,根据合成例35的方法得到112.2mg(收率:66%)标题化合物。
[0680]
(合成例97)
[0681]
n-[5-[1-(2-甲基丙酰基)-3,6-二氢-2h-吡啶-4-基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0682]
在室温向在合成例51中得到的4-[2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-5-基]-3,6-二氢-2h-吡啶-1-甲酸叔丁酯(139mg,0.315mmol)的二氯甲烷(3ml)溶液中加入三氟乙酸(0.6ml),随后搅拌2小时。将反应溶液在减压下浓缩,加入二氯甲烷共沸几次,得到油状物(226mg)。在冰冷却下向得到的油状物(68mg)和n,n-二异丙基乙胺(0.10ml)的二氯甲烷(3ml)溶液中加入2-甲基丙酰氯(0.032ml,0.30mmol),随后搅拌2小时。将反应溶液用二氯甲烷稀释并此后用水和饱和盐水洗涤。将有机层经无水硫酸钠干燥以后,在减压下蒸馏出溶剂。将残余物通过硅胶色谱法(正己烷/乙酸乙酯=4/1-1/2)纯化以得到50.3mg(收率:81%)作为固体的标题化合物。
[0683]
(合成例98)
[0684]
n-[5-[1-(异丙基氨甲酰基)-3,6-二氢-2h-吡啶-4-基]噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0685]
使用在合成例51中得到的4-[2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-5-基]-3,6-二氢-2h-吡啶-1-甲酸叔丁酯和2-异氰酸基丙烷,根据合成例97的方法得到30.6mg(收率:48%)作为固体的标题化合物。
[0686]
(合成例99)
[0687]
2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]-5-[4-(2,2,2-三氟乙氧基)苯基]噻唑-4-甲酸甲酯
[0688]
使用在参考合成例25中得到的5-溴-2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-4-甲酸甲酯和商购可得的[4-(2,2,2-三氟乙氧基)苯基]硼酸,根据合成例35的方法得到42.3mg(收率:31%)标题化合物。
[0689]
(合成例100)
[0690]
5-(4-叔丁氧基苯基)-2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-4-甲酸甲酯
[0691]
使用在参考合成例25中得到的5-溴-2-[(8-氧代-6,7-二氢-5h-吲嗪-5-羰基)氨基]噻唑-4-甲酸甲酯和商购可得的(4-叔丁氧基苯基)硼酸,根据合成例35的方法得到45.8mg(收率:38%)标题化合物。
[0692]
(合成例101)
[0693]
(5r)-n-[5-(4-叔丁氧基苯基)-4-甲基噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和(5s)-n-[5-(4-叔丁氧基苯基)-4-甲基噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺
[0694]
使用在合成例35中得到的n-[5-(4-叔丁氧基苯基)-4-甲基噻唑-2-基]-8-氧代-6,7-二氢-5h-吲嗪-5-甲酰胺和ymc chiral art cellulose-sc(10μm)250
×
10mmi.d.,流速:2.3ml/min,溶剂:正己烷/乙醇=40/60),进行光学拆分。收集较早洗脱的第一个峰以后,在减压下蒸馏出溶剂,以得到作为无定形物的标题化合物(53mg,光学纯度》99%ee)。进一步,收集较晚洗脱的第二个峰以后,在减压下蒸馏出溶剂,以得到作为无定形物的标题化合物(53mg,光学纯度》99%ee)。
[0695]
下面的表显示了在参考合成例和合成例中合成的化合物的结构式和物理化学数据。
[0696]
[表1-1]
[0697][0698]
[表1-2]
[0699][0700]
[表1-3]
[0701][0702]
[表2-1]
[0703][0704]
[表2-2]
[0705][0706]
[表2-3]
[0707][0708]
[表2-4]
[0709][0710]
[表2-5]
[0711][0712]
[表2-6]
[0713][0714]
[表2-7]
[0715][0716]
[表2-8]
[0717][0718]
[表2-9]
[0719][0720]
[表2-10]
[0721][0722]
[表2-11]
[0723][0724]
[表2-12]
[0725][0726]
[表2-13]
[0727][0728]
[表2-14]
[0729][0730]
[表2-15]
[0731][0732]
[参考例1]
[0733]
从人ips细胞向胰岛素生产细胞的分化促进效果的评价
[0734]
从人ips细胞向胰岛素生产细胞的分化促进效果(药效)的评价体系以公知信息(非专利文献6)作为参考而构建。此外,在各分化阶段中使用的培养基也以上述公知信息为参考而制作(相对于阶段1~5,各自使用非专利文献6记载的分化培养基a~e(medium a~e)。然而,关于分化培养基e,使用不包含glp-1受体激动剂和烟酰胺的物质)。
[0735]
为了评价化合物的药效,作为阳性对照,使用合成例1的化合物,作为化合物无处置对照,使用了终浓度0.1%的二甲亚砜(dmso)(sigma,d2650)。全部化合物用dmso溶解,以向培养基添加后的化合物的终浓度成为2μm和10μm的方式调制出2种化合物溶液。在以下评价中,化合物溶液以dmso的终浓度成为0.1%的方式添加于培养基。
[0736]
首先,按照非专利文献6的“从人ips细胞向胰腺β细胞的分化诱导”的方法,从人ips细胞toe株(医药基础研究所)向培养第7天的细胞(更换为分化培养基c的2天后(从foxa2阳性原始消化管细胞向pdx1阳性胰腺祖细胞的分化过程的细胞)诱导,回收细胞后,使用
バンバンカー
(日本
ジェネティクス
)以1
×
107细胞/ml/管保存在液氮中,制作出评价用细胞储备。在药效评价的开始时将本细胞储备溶解,悬浮于阶段3用的分化培养基c(dmem高葡萄糖(life technologies,11965092),0.25μm sant-1,0.1μm ldn193189(stemgent,04-0074),10μm sb431542,2μm视黄酸(stemgent,04-0021),1%b27无血清补充物(life technologies,17504044)后,在用
シンセマックス
ii(corning,#5656)涂布了的96孔板(corning,#3340)中以1
×
105细胞/孔接种。在培养2天后,将培养基除去,以100μl/孔添加仅添加了化合物或dmso的新的阶段3用的分化培养基c。在培养2天后,将培养基除去,以100μl/孔添加了仅添加了化合物或dmso的新的阶段4用的分化培养基d(dmem高葡萄糖,0.1μm ldn193189,5μm tgf-βi型受体激酶抑制剂ii(calbiochem 616452),0.3μm(-)-吲哚内酰胺v(enzo life science alx-420-011-c300),1%b27无血清补充物)。在培养2~3天后,将培养基除去,以200μl/孔添加了仅添加了化合物或dmso的新的阶段5用的分化培养基e(不含glp-1受体激动剂和烟酰胺;knockout dmem/f-20(life technologies,12660012),1%b27无血清补充物)。在培养2天后,将培养基除去,以150μl/孔添加4%多聚甲醛磷酸缓冲液(wako,163-20145),在室温放置30~60分钟而固定了细胞。以包含1%的triton x-100
(sigma,t8787)的磷酸缓冲液(pbs)(takara,t9181)在室温放置15分钟后,用pbs-t(takara,t9183)洗涤,使用用pbs-t稀释了的20%blocking one(nacalai tesque,tokyo,japan)在室温下进行了1小时封闭。将blocking one除去后,以50μl/孔添加用20%blocking one稀释为200倍的豚鼠抗胰岛素抗体(abcam,ab7842),在4℃放置一晚。用pbs-t洗涤3次后,添加用20%blocking one稀释为1000倍的alexa fluor 548标记抗豚鼠抗体(life technologies,a11075)和6-二脒基-2-苯基吲哚(dapi)(roche diagnostics,basel,switzerland),在室温放置2小时。用pbs-t洗涤3次后,进行了细胞的荧光图像的解析。
[0737]
细胞图像的拍摄使用高内涵成像系统opera phenix或operetta(perkinelmer)进行。进一步,通过使用了harmony(perkinelmer)的解析而计测胰岛素阳性细胞和dapi阳性总细胞数,算出胰岛素阳性细胞数相对于总细胞数的比例(胰岛素阳性细胞率)。作为阳性对照,使用合成例1的化合物,作为化合物无处置对照,使用了终浓度0.1%的dmso。将10μm的合成例1的化合物的胰岛素阳性细胞率(30例的平均胰岛素阳性细胞率,13%)与化合物无处置对照(30例的平均胰岛素阳性细胞率,4.9%)相比的增加值设为100%,以其作为基准而将各化合物各浓度的胰岛素阳性细胞率增加值换算为百分率(%),设为活性值。将包含阳性对照在内的各化合物以2μm和10μm的2种浓度使用多个孔而实施化合物的一次评价。通过将两浓度下的活性值的和与阳性对照进行比较而判断了活性强度。将两浓度下的活性值的和与化合物无处置对照相比明显高,但与阳性对照相比低的情况表述为+,与阳性对照同等的情况表述为++,与阳性对照相比高的情况表述为+++。关于活性强度弱的化合物,以0.4、2、5或10μm的浓度,使用多个孔而实施再评价,将以下化合物判断为有效:与化合物无处置对照相比活性值明显高,或任一浓度下的活性值都显示15%以上,与化合物无处置对照相比的t检验显示显著性差异(p<0.05)。关于显示较强药效的化合物,为了调查浓度依赖的效果,以0.01~10μm的浓度使用多个孔而实施二次评价,使用sigmaplot(systat software)而算出ec50(在将10μm的合成例1的化合物的药效设为100%的情况下,可以发挥相当于其50%的药效的化合物浓度)。
[0738]
表3和表4显示了参考例1的结果。
[0739]
[表3]
[0740][0741]
[表4]
[0742]
合成例编号ec50(μm)15.890.2310a1.210b0.22110.49210.45301.0350.25360.31400.82430.19450.13460.54581.6590.54651.8880.24930.29101b0.09
[0743]
从参考例1的结果可知,与不添加化合物的情况相比,由式(i)表示的化合物或其盐可以使多能干细胞有效地分化成胰岛素生产细胞。
[0744]
[实施例1]
[0745]
(a)结果
[0746]
(1)新的β细胞分化诱导剂的筛选
[0747]
如以前报道地那样(sakano等人,2014;shiraki等人,2008),为了确立用于筛选增强β细胞分化的小分子化合物的测定系统,使用了担载被pdx1启动子驱动的gfp报告基因的小鼠es细胞株sk7。
[0748]
在使用了约55,000的化合物的初步筛选活动、接着用于证实有效性的再现性和用量依赖性的反复测定后,发现了苗头化合物k-1(在合成例1中合成的化合物)作为增强β细胞分化的新化合物(图1)。k-1使pdx1-gfp+胰岛素+双阳性细胞的比率和胰岛素1的表达用量依赖地增加了。k-1进一步增强了由γ-分泌酶抑制剂ly411575引起的pdx1-gfp+ins+双阳性细胞的增加(treff et al.,2006)。其结果显示出,通过与以前报道了促进胰脏内分泌分化的γ-分泌酶抑制不同的作用机理,k-1显示其效力。
[0749]
(2)k-1及其衍生物促进从人ips细胞衍生出的β细胞的分化。
[0750]
使用2个不同的分化实验方法和3个人ips细胞株(toe,rpchipsc771,和ff-i01s01(从hla纯合子患者衍生出的ipsc))而调查了化合物对人ips细胞向胰岛素表达β(hips-β)细胞的分化的有效性(图2-1a)。本发明人在分化实验方法#1下在单层培养中,最初试验了阶段3的后期~阶段5的初始期间的采用k-1的toe ipsc的处理。其带来对ips-β细胞的被强化了的分化(图2-1a和b)。本发明人此外检查了k-3(在合成例9中合成的化合物)、k-4(在合成例33中合成的化合物)、和k-5(在合成例101b中合成的化合物)那样的其它衍生物的效果。判明了k-3和k-5与作为母体化合物(日文原文:元
の
化合物)的k-1相比显示强力的效力(图2-1b)。
[0751]
接下来,本发明人使用最近确立的其它分化实验方法而试验了k-3的效果。本发明人以前发现分化前的短期间的蛋氨酸除去处理带来分化的增强(shiraki等人,2014)。因此,本发明人并入短时间(5小时)的蛋氨酸除去,在分化实验方法#1下进行rpchips771ipsc的球培养,获得了高功能性ips-β细胞(shiraki等人,2014)。k-3以0.25μm增强了向insulin+pdx1+双阳性细胞的分化(图2-1c)。接下来,使用了分化实验方法#2。这里在分化前将细胞通过蛋氨酸除去进行前处理,进而使用能够调节锌浓度的培养基进行了分化。在该实验方法下,k-3增强了ff-i01s01向insulin+nkx6.1+、nkx6.1+pdx1+双阳性、和insulin+nkx6.1+pdx1+三阳性细胞的分化。它们在阶段4的结束出现,然后增加了(图2-1d)。发现了在包含阶段3的时间窗添加了k-3的情况下,k-3最有效地增强分化。k-3此外特别是通过阶段3~5中的处理而促进了nkx6.1+和insulin+nkx6.1+双阳性细胞的生成(图2-1d)。
[0752]
接着,实施了在实验方法#1、rpchipsc771的球培养下生成的ips-β细胞的功能测定。在该功能测定中,除了k-3以外,也使用了k-5、k-6(在合成例45中合成的化合物)、k-7(在合成例93中合成的化合物)。包含k-3的苗头化合物增强所得的ips-β细胞的葡萄糖刺激性胰岛素分泌(gsis)的活性,通过分步的经时测定,显示迅速的第1相和长期持续的第2相胰岛素分泌(图2-2e,左)。为了定量gsis活性,此外也实施了以往的间歇测定(图2-2e,右)。k-3在培养实验方法#2中也显示同样的效果(图2-2f)。因此,这显示出它们的有效性不依赖于培养实验方法、细胞株的变动性。被k-3处理了的ips-β细胞显示通过面对胰岛素分泌促进药(格列本脲、艾塞那肽4、和kcl)的刺激而被增强了的c-肽分泌(图2-2g),这表示化合物
增强功能成熟或使细胞的胰岛素含量增加。
[0753]
(b)方法
[0754]
(1)mes和hips细胞株的培养
[0755]
sk7小鼠es细胞株从具有pdx1-gfp基因的转基因小鼠系统建立,如以前记载地那样(shiraki等人,2008),在mef饲养细胞(stem cell technology)上被维持。toe人ips细胞株从国立
バイオメディカルイノベーション
研究所(japan)的细胞库获得,如以前所记载地那样(shahjalal等人,2014),在无饲养异种条件下维持。rpchips771细胞从
リプロセル
购入,ffi-01s01细胞由cira提供。将rpchips771细胞和ffl-01s01细胞在synthemax ii(invitrogen,3535xx1)被覆皿上,分别使用essential8(invitrogen,a1517001)和stemfit ak03n(味
の
素)进行了培养。
[0756]
(2)sk7小鼠es细胞和人ips细胞的分化
[0757]
使sk7小鼠es细胞基本上按照以前的报道(nakashima等人,2015),分化成β细胞。总而言之,将细胞以每1孔5,000细胞接种于cellbind 384孔(corning,3770)细胞培养板,或以每1孔20,000细胞接种于用0.2%明胶进行了涂布的96孔板(sigma)。然后,将细胞用培养基1从第1天到第5天进行了培养。培养基1由添加了0.1mm的neaa(gibco、11140-50)、2mm的l-谷氨酰胺(nakalai、16948-04)、100u/ml的青霉素-链霉素(nakalai、26252-94)、0.01mm的β-巯基乙醇(sigma)、1%的胰岛素-运铁蛋白-硒补充物(its:life technologies、41400045)、0.25%的albumax(thermofisher、11020021)、和10ng/ml的重组人激活素-a(r&d systems、338-ac)的dmem高葡萄糖(life technologies,11965092)构成。接着,在由补充了10μm的视黄酸(stemgent,04-0021)的培养基1构成的培养基2中培养1天。在第6天将培养基更换为培养基3,为了诱导向β细胞的分化,继续培养直到第12天。培养基3由添加了0.1mm的neaa、2mm的l-谷氨酰胺、100u/ml的青霉素-链霉素、0.1mm的β-巯基乙醇、1%的its、0.25%的albumax、和3mm的烟酰胺(sigma-aldrich、n0636-500g)的dmem低葡萄糖(life technologies、11885084)构成。在第8天添加试验化合物,为了通过高内涵成像仪进行分析,将细胞用4%多聚甲醛固定。
[0758]
将toe人ips细胞接种于用synthemax ii被覆了的cellbind 6孔(corning,cls3335)细胞培养板,通过以前记载的方法(shahjalal等人,2014)分化成原始消化管细胞。使细胞用tryple select(thermofisher,12563011)解离,以1.0~2.0
×
107cells/ml的密度在banbanker(nippon genetics)中冷冻保存直到使用为止。在化合物添加的1天前,将细胞在阶段3的培养基(dmem高葡萄糖、0.25μm的sant1(wako、197-16351)、0.1μm的ldn193189(stemgent、04-0074)、10μm的sb431542、2μm的视黄酸、1%的b27无血清补充物(life technologies、17504044)中解冻,以每1孔150,000细胞接种于用synthemax ii被覆了的cellbind 96孔(corning,3340)细胞培养板。在含有试验化合物或阴性对照(0.01%dmso)的阶段3的培养基中将细胞培养1天。在含有试验化合物或阴性对照的阶段4和5的培养基中分别进一步将细胞培养了2天和1天。次日,为了用高内涵成像仪进行分析,将细胞用4%多聚甲醛固定。
[0759]
将rpchips771细胞如上述那样维持,按照实验方法#1分化。总而言之,在第0天,使细胞用tryple select解离,以essential 8培养基中1
×
106细胞/ml的浓度转移到低附着6孔板(greiner,657185),在旋转摇动器(95rpm)上培养。在第1天,将培养基更换为蛋氨酸除
去培养基ka01(ajinomot),培养5小时。将培养基更换为分化培养基1(dmem高葡萄糖、l-gln、neaa、0.01mm的β-巯基乙醇、100ng/ml的激活素a、b27补充物、3μm的chir99021),将细胞培养1天(阶段1-1)。然后,将培养基更换为不包含chir99021的培养基1,培养2天(阶段1-2)。将细胞用培养基2(rpmi、l-gln、neaa、0.01mm的β-巯基乙醇、除了胰岛素的b27补充物、50ng/ml的fgf10、0.25μm的sant1)持续培养2天(阶段2),用培养基3(dmem高葡萄糖、l-gln、neaa、0.01mm的β-巯基乙醇、0.15μm的sant1、2μm的视黄酸、0.1μm的ldn193189、b27补充物)持续培养6天(阶段3),用培养基4(dmem高葡萄糖、l-gln、neaa、0.01mm的β-巯基乙醇、5μm的alk5抑制剂(calbiochem、616452)、0.3μm的吲哚内酰胺v、0.1μm的ldn193189、b27补充物)持续培养2天(阶段4),用培养基5(ko dmem/f12、l-gln、neaa、0.01mm的β-巯基乙醇、50ng/ml的艾塞那肽4、10mm的烟酰胺、10μm的znso4、1mm的n-乙酰-l-半胱氨酸、b27补充物)持续培养13天(阶段5)。在评价化合物对分化速度和细胞功能的有效性的情况下,将试验化合物和阴性对照(0.01%dmso)在阶段3和4期间(第6天~第14天)处理,为了证实对胰岛素阳性的效果,在第19天进行免疫染色,在第27天进行了gsis(glucose stimulated insulin secretion)测定。
[0760]
将ffi-01s01细胞如上述那样维持,进而按照实验方法#2分化。总而言之,使细胞用tryple select解离,以ak03n培养基(味
の
素)中1
×
106细胞/ml的浓度转移到低附着6孔板,在旋转摇动器(95rpm)上培养24小时,然后,将培养基更换为ak03n基的蛋氨酸除去培养基ka01,将细胞培养5小时。然后,将培养基更换为m1-1 akm培养基,将细胞培养24小时(阶段1-1)。将细胞用m1-2 akm培养基培养2天(阶段1-2),接着用m2 akm培养基培养2天(阶段2-1),用s2培养基培养2天(阶段2-2),用s3培养基培养2天(阶段3),用s4培养基培养5天(阶段4),用s5-1培养基培养4天(阶段5-1),用s5-2培养基培养3天(阶段5)。
[0761]
akm培养基为胰岛素和zn
2+
除去stemfit basic 03培养基。
[0762]
m1-1 akm培养基:补充了100ng/ml的激活素a、3μm的chir990221的akm(100ng/ml的igf1,0.5μm的zn)培养基。
[0763]
m1-2 akm培养基:添加了100ng/ml激活素a的akm(100ng/ml的igf1、z0.5μm的zn)培养基。
[0764]
m2 akm培养基:补充了50ng/ml的fgf10、250nm的sant1的akm(0.5μm的zn)。
[0765]
s2培养基:补充了50ng/ml的kgf和44μg/ml的维生素c的stemfit basic 03。
[0766]
s3培养基:补充了50ng/ml的kgf、50nm的吲哚内酰胺v、2μm的视黄酸、250nm的sant1,44μg/ml的维生素c的stemfit basic 03。
[0767]
s4培养基:补充了50ng/ml的kgf、100nm的视黄酸、250nm的sant1、44μg/ml的维生素c、100nm的ldn193189的stemfit basic 03。
[0768]
s5-1培养基:补充了10μm的alk5抑制剂、10μm的dapt、33.3ng/ml的egf、100nm的视黄酸、1μm的t3、44μg/ml的维生素c的stemfit basic 03。
[0769]
s5-2培养基:补充了10μm的alk5抑制剂、10μm的dapt、33.3ng/ml的egf、25nm的视黄酸、1μm的t3的stemfit basic 03。
[0770]
在评价化合物对分化速度和细胞功能的有效性的情况下,将试验化合物和阴性对照(0.01%dmso)在阶段3和4期间(第5天~第13天)处理,为了证实对胰岛素、nkx6.1、和pdx1的阳性的效果,在第14天(在阶段4结束时)和第21天(在阶段5结束时)实施了免疫染
色。gsis测定在第21天实施。
[0771]
(3)增强β细胞分化的化合物的筛选和通过高内涵成像仪进行的定量分析
[0772]
关于β细胞分化诱导物质,对由约55,000的化合物构成的化学库进行了筛选。关于初步筛选,将化合物以成为2mm的浓度的方式溶解于dmso,在sk-7小鼠es细胞的分化的过程中,在第8天以1:1000添加,在第10天更换培养基。通过将细胞在第12天用豚鼠抗胰岛素、兔抗gfp进行免疫染色来测定。荧光图像通过operetta高内涵成像仪系统和harmony图像解析软件(perkinelmer,germany)来定量化。核通过dapi染色来鉴定,抗体染色的阳性通过包围核的细胞质区域的荧光强度来确定。计数胰岛素和gfp两者为阳性的细胞的数,通过dapi阳性总细胞数或阳性区面积而标准化。计算4重数据的中心值,将筛选苗头定义为与dmso对照相比胰岛素和gfp阳性细胞数增加了的状态。如本文所记载地那样,关于用量依赖性和再现性,对初步苗头化合物进一步进行了试验。候选化合物的活性使用再合成的物质而进行了证实。为了选择对小鼠和人β细胞分化两者都具有有效性的苗头化合物,通过toe人ips细胞测定系统进一步分析了被选择的候选化合物的活性。化合物的添加如上述那样操作而进行,有效性在3连实验中通过q-pcr而通过mrna表达水平进行了评价。筛选苗头定义为与dmso对照相比,用量依赖地伴随与β-肌动蛋白相比增加了的胰岛素表达水平的状态。
[0773]
(4)免疫细胞化学
[0774]
使用以下抗体,与通常的实验方法一起实施了免疫细胞化学:兔抗mafa(abcam;ab26405;1/100x)、山羊抗pdx1(r&d systems;af2419;1/100x)、小鼠抗nkx6.1(developmental studies hybridoma bank、university of iowa;f64a6b4;1/100x)、豚鼠抗insulin(dako;ir002;1/10x)、小鼠抗insulin(sigma-aldrich;i2018;1/1000x)、兔抗c-肽(cell signaling;4593;1/100x)、兔抗gfp(mbl international corp;598;1/1000x)、和小鼠抗glucagon(sigma-aldrich;g2654;1/1000x)。所使用的二抗为alexa 488结合山羊抗小鼠igg(invitrogen、a11029、1/1000x)、alexa 488结合驴抗豚鼠igg(jackson immunoresearch laboratory、706-546-148)、af647结合驴抗兔igg(jackson immunoresearch laboratory、711-606-152)、af568结合驴抗小鼠igg(biotium、20105)、alexa 568结合山羊抗豚鼠igg(invitrogen、a11075、1/1000x)、alexa 568结合山羊抗小鼠igg(invitrogen、a11031、1/1000x)、alexa 568结合山羊抗兔igg(invitrogen、a11036、1/1000x)、alexa 633结合山羊抗兔igg(invitrogen、a21072、1/1000x)。将细胞用dapi(thermofisher、d1306)进行了对比染色。
[0775]
(5)定量的实时pcr
[0776]
小鼠es细胞的cdna调制使用vilo
マスターミックス
进行,实时pcr分析使用taqman qpcr测定(applied biosystems taqman gene expression assay id:mouse hprt1,mm03024075_m1;mouse insulin1,mm01950294_s1)按照生产商的说明书进行。通过使用通过使用适当的试验试样的混合物的稀释系列而制作的各基因的标准曲线来计算基因表达量。各基因的表达水平以hprt1表达水平进行了校正。
[0777]
(6)从人ips细胞衍生出的β细胞的葡萄糖刺激胰岛素分泌(gsis)反应的测定
[0778]
时间依赖性gsis活性测定如以下那样操作而进行。将所得的人ips-β细胞的等分试样在低葡萄糖(lg:3mm葡萄糖)hkrb缓冲液(cosmobio,pmc-pnimg)中数次洗涤10分钟。将细胞在24孔板(corning,3415)中的
トランスウェル
透过性支持体中的lg-hkrb缓冲液中进
一步孵育30分钟,将上清液的极少一部分作为c-肽测定(lg 30分)用的样品而取出。在细胞悬浮液中添加追加量的葡萄糖而使最终葡萄糖浓度从3增加到20mm,从而开始了高葡萄糖刺激。经时地进行上清液的取样(hg刺激的开始后10、30、60分钟;分别hg 10分钟、hg 30分钟、和hg 60分钟),接着依次添加100μm的艾塞那肽4和20mm的kcl,孵育30分钟(分别为ex4 30分钟和kcl 30分钟)。
[0779]
间歇模式gsis测定如以下那样实施。将所得的人ips-β细胞的等分试样如上述那样用lg-krbh洗涤后,将细胞在lg-hkrb缓冲液中孵育30分钟或1小时,接着在hg-hkrb缓冲液中孵育相同时间。在几个实验中,在将细胞洗涤后,将细胞分配成几个等分试样,在含有0.01%的dmso或数种胰岛素分泌促进药的hg-hkrb缓冲液中孵育1小时。样品的c-肽浓度使用alphalisa c-肽试剂盒(perkinelmer,al299f)或c-肽elisa测定,通过gsis测定所使用的细胞的dna含量进行了校正。
[0780]
(7)dna量的测定
[0781]
在gsis测定后回收细胞,将其dna使用allprep dna/rna微试剂盒(qiagen,80284)进行精制,进而使用qubit测定(lifescience technologies,q32854)测定了dna的浓度。
[0782]
[参考文献]
[0783]
nakashima,r.,morooka,m.,shiraki,n.,sakano,d.,ogaki,s.,kume,k.and kume,s.(2015).neural cells play an inhibitory role in pancreatic differentiation of pluripotent stem cells.genes cells 1028-1045.
[0784]
sakano,d.,shiraki,n.,kikawa,k.,yamazoe,t.,kataoka,m.,umeda,k.,araki,k.,mao,d.,matsumoto,s.,nakagata,n.,et al.(2014).vmat2identified as a regulator of late-stageβ-cell differentiation.nat.chem.biol.10,141-8.
[0785]
shahjalal,h.m.,shiraki,n.,sakano,d.,kikawa,k.,ogaki,s.,baba,h.,kume,k.and kume,s.(2014).generation of insulin-producingβ-like cells from human ips cells in a defined and completely xeno-free culture system.j.mol.cell biol.0,1-15.
[0786]
shiraki,n.,yoshida,t.,araki,k.,umezawa,a.,higuchi,y.,goto,h.,kume,k.and kume,s.(2008).guided differentiation of embryonic stem cells into pdx1-expressing regional-specific definitive endoderm.stem cells 26,874-85.
[0787]
shiraki,n.,shiraki,y.,tsuyama,t.,obata,f.,miura,m.,nagae,g.,aburatani,h.,kume,k.,endo,f.and kume,s.(2014).methionine metabolism regulates maintenance and differentiation of human pluripotent stem cells.cell metab.19,780-794.
[0788]
treff,n.r.,vincent,r.k.,budde,m.l.,browning,v.l.,magliocca,j.f.,kapur,v.and odorico,j.s.(2006).differentiation of embryonic stem cells conditionally expressing neurogenin 3.stem cells 24,2529-2537.
[0789]
将在本说明书中引用的全部出版物、专利和专利申请直接作为参考而并入到本说明书中。
