基因vlnhx3d在调节植物细胞na
+
和/或k
+
浓度中的应用
技术领域
1.本发明涉及植物分子生物学领域,具体而言,涉及基因vlnhx3d在调节植物细胞na
+
和/或k
+
浓度中的应用。
背景技术:
2.盐胁迫会导致植株生长发育迟缓,叶子黄化或枯萎,严重时整株干枯死亡。盐胁迫的危害主要包括细胞渗透胁迫、离子毒害和营养失衡三个方面。
3.渗透胁迫:植物受到盐害后,打破了植物细胞原有的水分平衡。植物吸水能力下降从而导致植物遭受生理干旱,致使植物生产受到抑制。渗透胁迫会快速减少根尖和幼叶的细胞扩张,导致气孔关闭。土壤中钠离子含量的增加不仅迅速降低了土壤水分有效性,而且地上部缓慢积累钠离子;这种空间和时间的分布结果表明,早期的盐胁迫反应是由渗透作用或干旱胁迫引起的,而之后才引起特定的离子胁迫反应。低水势诱导aba的产生和信号转导,导致保卫细胞去极化,气孔孔径和电导率降低。随着盐胁迫时间的推移,细胞伸长和细胞分裂的减少将导致叶片更小更厚从而降低光合作用,进一步影响植物的生长发育。
4.离子胁迫:na
+
和cl-等无机离子是植物生命活动所必须的,但当其过量时就会产生离子毒害,损伤质膜的选择透过性,导致胞外的盐离子大量进入细胞内破坏离子平衡。蒸腾作用可以将na
+
从根部转移到地上部的叶片,并在叶片中进行积累,但是叶片中只有很小一部分的na
+
可以通过韧皮部再移动到根部,这样会导致植物叶片中离子含量的升高从而产生危害。植物过量吸收某些盐类会减少对其他盐类的吸收,植物便会产生营养缺乏或离子毒害的症状。
5.营养失衡:当植物生长在nacl胁迫环境下,植物大量吸收na
+
而导致k
+
吸收减少,从而导致钾离子缺乏,并且影响ca
2+
和mg
2+
的吸收,进一步影响植物的营养吸收,扰乱植物的新陈代谢,使植物的生长受到抑制。研究证明在盐胁迫条件下,沙枣中积累较多的na
+
,同时降低了k
+
和ca
2+
含量;耐盐性较强的沙枣品种根系中积累大量的na
+
,从而减少叶片中na
+
积累,相比不耐盐的品种,耐盐的沙枣中较少流失k
+
和ca
2+
。植物吸收cl-和so
42-过多则影响hpo
42-的吸收;而磷酸盐过多又会造成zn
2+
缺乏,致使植物营养失衡。
6.植物对盐胁迫的反应分为两个阶段:一是抑制幼叶生长的快速渗透胁迫阶段,二是加速成熟叶片衰老的缓慢离子毒害过程。
7.na
+
/h
+
逆转运蛋白(na
+
/h
+
antiporter,nhx)是广泛存在于高等植物中的一种逆转运蛋白,在维持细胞内ph和离子平衡等方面起着重要的调节作用。研究人员先后在大麦、水稻、拟南芥、北滨藜、甜菜和大豆等植物中发现该蛋白。目前,已经克隆出不同物种的na
+
/h
+
逆转运蛋白基因,研究nhx的表达特性。结果表明,一些nhx蛋白只有在盐胁迫条件诱导下才会表现出转运活性,在非胁迫环境下不具有转运活性。一些nhx基因在正常环境条件下的表达水平较低,但是随着盐胁迫程度的加深,它们的表达水平也随之诱导增加。也有某些植物nhx基因在盐胁迫条件下检测不到表达。
8.拟南芥中发现6个na
+
/h
+
逆转运蛋白(atnhx1-6),系统进化分析将这6个atnhx分为
两个亚组,其中atnhx1-4属于亚组i,atnhx5-6属于亚组ii。研究表明,亚组i中的nhx位于液泡膜上,对na
+
和k
+
具有相同的亲和力;它们将细胞质中积累的na
+
和(或)k
+
隔离在液泡中,维持细胞的膨压。亚组ii的nhx位于细胞的内膜系统,主要调节细胞内k
+
的平衡,在盐胁迫下通过在细胞中积累更多的k
+
来减轻胁迫带来的危害。
9.液泡膜定位的nhx蛋白是na
+
/h
+
逆向转运蛋白研究领域的热门。已有研究表明,在植物中插入编码液泡膜nhxs基因可以有效提高植物的耐盐性。过表达atnhx1的转基因拟南芥可以在200mmol/lnacl下生长。与野生型相比,转基因拟南芥植株的na
+
含量增加,na
+
/h
+
逆向转运蛋白活性增强。atnhx1在甘薯、苦荞麦和高羊茅等植物中异源表达后导致细胞内na
+
浓度升高,k
+
/na
+
比值升高,并提高了植物对盐胁迫的耐受能力。过表达bnnhx1提高了转基因烟草的耐盐性。因此,我们推测植物液泡型na
+
/h
+
逆向转运蛋白能够特异识别na
+
并对其进行区隔,从而提高植物的耐盐性。然而,对液泡型na
+
/h
+
逆向转运蛋白的深入研究分析表明,它们的耐盐机制可能涉及介导k
+
积累和维持较低的na
+
/k
+
比值。在以往的研究中,过表达atnhx1的转基因番茄可以将更多的k
+
分配到液泡中,通过增加液泡中k
+
的含量反馈抑制na
+
的吸收,从而提高植株的耐盐性。过表达pgnhx1的转基因水稻能够存活并完成其生命周期,成功开花和结种。野生型植株上部叶片na
+
含量较高,而转基因植株上部叶片k
+
含量较高。nhxs1-ires-tvp1基因在转基因烟草中的表达导致叶片na
+
含量减少,k
+
含量增加。这些研究结果表明,不同植物的液泡型nhx蛋白调控耐盐性的机制可能不同。
10.另外,研究还发现,不同的nhx可能分布在细胞的不同结构上,有的位于液泡膜上,有的位于细胞的内膜系统。并且不同生物中鉴定出的na
+
/h
+
逆转运蛋白在结构上存在一定的差异。
11.我国是世界上棉花生产和消费大国,棉花是我国重要的经济作物和国家战略物资。由于我国耕地面积逐渐减少,导致粮食作物和棉花对耕地的竞争强度不断加大。我国具有广阔的盐碱土地,盐碱地植棉可以解决粮棉争地矛盾,促进棉花产业的健康发展,实现可持续发展农业。因此,对棉花耐盐基因的研究具有重大意义。
12.如今,虽然棉花的基因组序列测序已经完成,但是,某些基因的功能还处于未知状态,需要科研工作者的进一步探索。
技术实现要素:
13.本发明从陆地棉遗传标准系tm-1中克隆出一个na
+
/h
+
逆转运蛋白基因vlnhx3d,位于液泡膜。实时荧光定量结果显示,vlnhx3d在盐胁迫初期被诱导在棉花叶片中上调表达,随着盐胁迫程度的加深,vlnhx3d的表达量也逐渐增加。将vlnhx3d在酵母突变体atx3中表达后,转vlnhx3d基因的酵母比对照组(转空载)的酵母具有更高的耐盐性。利用vigs技术降低vlnhx3d的表达后,盐胁迫下,沉默植株的根、茎和叶片中na
+
的积累量显著增加,且根中k
+
含量显著降低,棉花的耐盐性明显降低,表明vlnhx3d参与早期盐胁迫响应,并通过调节细胞内na
+
和k
+
的稳态平衡来提高棉花的耐盐性。
14.本发明的第一方面提供了以下技术方案:
15.基因vlnhx3d在调节植物细胞na
+
和/或k
+
浓度中的应用,所述基因vlnhx3d具有seq id no:1所示的核苷酸序列。
16.本发明通过克隆基因vlnhx3d,构建转基因载体,利用vigs技术降低vlnhx3d表达
后,盐胁迫下,沉默植株的根、茎和叶片中na
+
的积累量显著增加,且根中k
+
含量显著降低,棉花的耐盐性明显降低,表明vlnhx3d参与早期盐胁迫响应,并通过调节细胞内na
+
和k
+
的稳态平衡来提高棉花的耐盐性。
17.进一步地,相比于野生植株,沉默所述基因vlnhx3d植株的根、茎和叶片中na
+
的积累量增加,茎和叶片中k
+
的积累量不变,根中k
+
含量降低。
18.本发明的第二方面提供了基因vlnhx3d在培育或检测耐盐性转基因植物中的应用,所述基因vlnhx3d具有seq id no:1所示的核苷酸序列。
19.本发明发现,基因vlnhx3d在叶片中的表达量随盐胁迫时间的增加而逐渐升高,并在200mm盐胁迫处理后6h达到峰值,而且随着盐浓度的增加基因vlnhx3d在叶片中的表达量也逐渐升高,表明盐胁迫诱导vlnhx3d的表达量变化。进一步将基因vlnhx3d在酵母突变体atx3中表达后,转vlnhx3d基因的酵母比对照组的酵母具有更高的耐盐性。说明基因vlnhx3d具有提高植物耐盐性的作用。因此,该基因可用于培育转基因植物,并可用于检测转基因植物的耐盐性。
20.进一步地,检测到所述基因vlnhx3d过表达或转入,所述植物的耐盐性能增加;
21.所述基因vlnhx3d未检测到或被沉默,所述植物的耐盐性能变弱。
22.本发明中,所述植物包括单子叶植物和双子叶植物;
23.所述单子叶植物包括水稻、玉米、小麦;
24.所述双子叶植物包括大豆、棉花、拟南芥、烟草。
25.进一步地,所述基因vlnhx3d表达的蛋白位于液泡膜。
26.即本发明提供的基因vlnhx3d表达的蛋白位于液泡膜,基因vlnhx3d通过表达在液泡膜上的蛋白发挥作用。
27.本发明的第三方面提供了一种植物耐盐性能的检测方法,检测待检测样品的基因vlnhx3d存在或表达情况,来判断其耐盐性能;
28.所述基因vlnhx3d具有seq id no:1所示的核苷酸序列。
29.即通过检测待测样品的基因vlnhx3d存在情况,如是否存在基因vlnhx3d;或基因vlnhx3d的表达情况,来判断目标植物的耐盐情况。
30.其中,本发明检测待检测样品中是否含有基因vlnhx3d可以通过多种方式进行,如可以直接检测是否含有基因vlnhx3d本身,也可以检测由基因vlnhx3d产生的产物,产物包括直接产物或间接产物或次生产物等,产物可以是mrna,也可以是蛋白,也可以是某种化合物等。
31.直接检测基因vlnhx3d,可采用基因vlnhx3d的特异性引物对检测,也可以采用针对基因vlnhx3d设计的探针或芯片进行检测。进一步地,通过基因vlnhx3d的引物对或探针或芯片对待检测样品进行检测。
32.本发明中涉及的针对基因vlnhx3d的引物对或探针或芯片,按常规方法设计即可。
33.进一步地,所述引物对的核酸序列如seq id no:2和seq id no:3或seq id no:4和seq id no:5所示。
34.即引物对seq id no:2和seq id no:3可以用来检测基因vlnhx3d;引物对seq id no:4和seq id no:5也可以,并且具有更高的灵敏性。
35.本发明检测基因vlnhx3d本身的方式并不限于此,任何在生物学上可实现的检测
方式均在本发明的保护范围内。
36.同样地,检测由基因vlnhx3d产生的产物也可以通过多种手段进行,如elisa检测试剂盒等。
37.进一步地,所述待检测样品包括适宜于有性繁殖、无性繁殖或可再生的细胞的组织培养的材料。
38.这些待检测样品可以是适宜于有性繁殖的材料,如选自花粉、胚囊、胚珠、子房等;
39.适宜于无性繁殖的材料如可以选自根、插枝、茎、原生质体等;
40.适宜于可再生的细胞的组织培养的材料如可以选自种子、胚、子叶、叶、花粉、分生组织细胞、根、根端、下胚轴和茎等。
41.具体地,进一步地,所述待检测样本包括以下材料中的任一种:叶、根、茎、胚根、胚芽、种子。
42.其中,待检测样本取自的植物包括单子叶植物和双子叶植物;单子叶植物包括水稻、玉米、小麦等;双子叶植物包括大豆、棉花、拟南芥、烟草等。
43.本发明的第四方面还提供了一种赋予植物盐耐性的方法,制备含有或过表达基因vlnhx3d的转基因植物;
44.所述基因vlnhx3d具有seq id no:1所示的核苷酸序列。
45.本发明采用常规的生物学方法制备含有或过表达基因vlnhx3d的转基因植物。含有基因vlnhx3d的转基因植物可通过多种方式进行,如常见的载体介导的转化方法,即将目的基因插入到农杆菌的质粒或病毒的dna等载体分子上,随着载体dna的转移而将目的基因导入到植物基因组中;又如基因直接导入法,通过物理或化学的方法直接将外源目的基因导入植物的基因组中,物理方法包括基因枪转化法、电激转化法、超声波法、显微注射法和激光微束法等,化学方法有peg介导转化方法和脂质体法等;又如种质系统法,包括花粉管通道法、生殖细胞侵染法、胚囊和子房注射法等。过表达基因vlnhx3d的转基因植物也可通过多种方式进行,基本同上,不同的是,在载体上增加增强基因转录的启动子。
46.其中,待检测样本取自的植物包括单子叶植物和双子叶植物;单子叶植物包括水稻、玉米、小麦等;双子叶植物包括大豆、棉花、拟南芥、烟草等。
47.本发明的第五方面还提供了基因vlnhx3d在植物种群遗传多样性研究中的应用。
48.与现有技术相比,本发明的有益效果至少包括如下方面:
49.(1)本发明通过系统研究,首次提供了基因vlnhx3d具有调节植物细胞na
+
和/或k
+
浓度的生物学功能,具体地,盐胁迫下,沉默植株的根、茎和叶片中na
+
的积累量显著增加,且根中k
+
含量显著降低。
50.(2)本发明通过基因vlnhx3d在酵母突变体atx3中表达后,转vlnhx3d基因的酵母比对照组的酵母具有更高的耐盐性,说明了基因vlnhx3d具有提高植物耐盐性的作用。
51.(3)本发明提供的vlnhx3d基因的表达产物位于液泡膜上,该基因可应用于培育或检测植物耐盐性能方面,其中植物包括水稻、玉米、小麦、大豆、棉花、拟南芥、烟草等。
附图说明
52.为了更清楚地说明本发明实施例或现有技术中的技术方案,以下将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
53.图1为本发明实施例1中基因vlnhx3d的pcr产物电泳图;
54.图2为本发明实施例1中vlnhx3d蛋白结构及与其他植物nhx的氨基酸序列比对图;
55.图3为本发明实施例1中vlnhx3d蛋白与其他物种nhx蛋白的系统发育分析图;
56.图4为本发明实施例1中vlnhx3d蛋白在拟南芥原生质体中的亚细胞定位图;
57.图5为本发明实施例2中基因vlnhx3d在nacl胁迫下的表达模式示意图;
58.图6为本发明实施例2中转vlnhx3d基因的酵母增强耐盐性能图片;
59.图7为本发明实施例2中trv:cla棉花幼苗的白化表型及vlnhx3d在trv:vlnhx3d的沉默效率图;
60.图8为本发明实施例2中trv:vlnhx3d沉默植株中ghnhx3a的表达水平柱形图;
61.图9为本发明实施例2中vlnhx3d基因沉默后植株的耐盐性图;
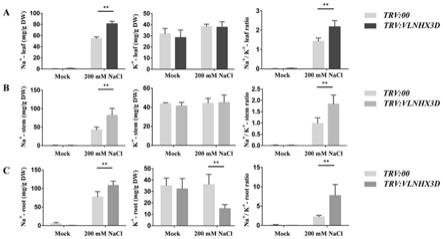
62.图10为本发明实施例2中盐胁迫下trv:vlnhx3d和trv:00植株中na
+
和k
+
含量及na
+
/k
+
柱形图。
具体实施方式
63.下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
64.一、材料及处理
65.棉花材料为陆地棉遗传标准系tm-1(gossypium hirsutum cv tm-1)。
66.棉花材料的种植:选取饱满的棉花种子用蒸馏水浸泡,置于30℃培养箱中过夜促进萌发。第二天挑选已经萌发露白的种子种入含有蛭石的方形塑料盆,覆盖地膜将其置于温室中,温度为23℃,光照时间为16h光照/8h黑暗循环,相对湿度为60%。待种子的子叶露出后揭去地膜,子叶展开后挑选长势一致的棉花幼苗用自来水冲洗干净,用泡沫棉包裹茎基部置入水培箱(含有霍格兰营养液)进行后期培养及处理。
67.棉花材料的处理:在棉花幼苗生长到两叶一心时期进行盐胁迫处理。向霍格兰营养液中分别加入50、100、150、200mmol/l的nacl。在处理后0、1、3、6、12h进行取样,将根、茎和真叶(至少3株)分开取样,用锡纸包裹做好标记后迅速置于液氮速冻,然后保存在-80℃冰箱用于后续实验。
68.二、涉及的引物
69.表1涉及的引物序列
70.[0071][0072]
实施例1
[0073]
一、基因克隆
[0074]
1、总rna提取:取-80℃冷冻保存的棉花材料根、茎和叶分别于液氮中研磨成粉末,各取100mg样品粉末装入2ml的rnase-free离心管中。后续实验步骤按照天根公司rna提取试剂盒(dp441)说明书进行。
[0075]
2、cdna合成:使用诺唯赞公司hiscript iii 1st strand cdna synthesis kit(+gdna wiper)(r312-01)反转录试剂进行cdna的合成。
[0076]
3、基因克隆(rt-pcr):以反转录得到的第一链cdna为模板,用takara公司的高保真酶kod-plus-neo(code no.kod-401)进行目的基因的扩增。
[0077]
表2基因克隆pcr体系
[0078][0079]
表3基因克隆pcr反应程序
[0080][0081]
5、pcr反应结束用1.5%的琼脂糖凝胶电泳检测pcr产物,结果如图1所示,vlnhx3d的pcr产物均位于1000-2000bp的maker之间。
[0082]
使用诺唯赞公司的胶回收试剂盒fastpure gel dna extraction mini kit(dc301)对目的条带进行回收。
[0083]
6、pcr产物连接克隆载体:在200μl干净的离心管中分别加入pcr胶回收产物4μl,peasy-blunt zero cloning vector 1μl,轻轻混匀后于25℃(pcr仪控温)反应30min。反应
结束后置于冰上。
[0084]
7、转化大肠杆菌感受态,在无菌环境挑取单克隆在500μl lb+kan液体培养基中,37℃、200rpm培养6h至菌液浑浊。以菌液为模板进行pcr以及测序(序列如seq id no:1所示)。得到含有vlnhx3d的阳性菌。
[0085]
二、vlnhx3d蛋白结构预测和氨基酸序列比对
[0086]
使用dog 2.0软件揭示vlnhx3d蛋白质保守结构域,tmhmm server v.2.0(http://www.cbs.dtu.dk/services/tmhmm/)用于预测和分析vlnhx3d的跨膜区域。
[0087]
其他物种nhx蛋白质序列和vlnhx3d使用dnaman 9.0软件进行多个序列比对,其他物种nhx包括vlnhx3d(gh_d02g0494)、ghnhx1a(gha11g2132)、ghnhx1d(ghd11g2440)、atnhx1(at5g27150.1)、gmnhx1(aea07714.1)、penhx3和osnhx1(baa83337.1)。
[0088]
通过构建vlnhx3d的蛋白结构示意图(图2),表明vlnhx3d编码的氨基酸序列包含有nhx的典型特征na
+
/h
+
转运蛋白的保守结构域,即na
+
_h
+
_exchanger,并且具有11个跨膜结构保守区域(图2a)。利用dnaman 9.0软件将vlnhx3d的氨基酸序列与其他植物液泡型nhx的氨基酸序列进行多重序列比对。(图2b)表明,vlnhx3d蛋白序列与其他植物液泡型nhx蛋白具有较高的同源性。它们都有一个相同氨基吡嗪脒结合位点(aminopyrazidine amidine binding sites),这个位点与na
+
的竞争性抑制有关,并且在c端有一个保守的cam结合位点。
[0089]
三、进化树构建
[0090]
1、构建vlnhx3d与其他物种nhx进化树
[0091]
为进一步分析vlnhx3d蛋白与其他植物中nhx的关系,以拟南芥(at)、胡杨(pe)、水稻(os)和玉米(zm)为研究对象,结合之前研究已证实的陆地棉中具有na
+
/h
+
逆转运蛋白功能的ghnhx成员,共同构建系统进化树。
[0092]
收集陆地棉、拟南芥、胡杨、水稻和玉米的nhx蛋白质序列信息(表3.8),使用mega x软件进行多重序列比对,采用临接法neighbor-joining构建系统发育树,bootstrap value设置为1000。
[0093]
表4其他物种信息
[0094]
[0095][0096]
如图3所示,在系统进化树中,5个物种的共28个nhx蛋白被分为2个亚家族,液泡型nhx和核内体型nhx。液泡型nhx包含20个nhx基因,核内体型包含8个nhx基因。vlnhx3d与液泡型nhx家族成员penhx4和atnhx4在进化树中距离较近,表明他们之间具有较近的亲缘关系;与拟南芥、胡杨、水稻、玉米和陆地棉的核内体型nhx家族成员的亲缘关系较远。这些结果表明vlnhx3d是液泡型nhx家族的成员。
[0097]
四、基因亚细胞定位
[0098]
1、载体构建
[0099]
(1)载体线性化:把pcambia2300(35s:gfp)载体用bamhi和ecori限制性内切酶进行线性化。
[0100]
(2)载体酶切反应完成后用1.5%的琼脂糖凝胶电泳进行检验,并在紫外灯下切下目的条带进行胶回收。
[0101]
(3)根据载体和基因序列设计含有酶切位点序列,但不含基因的终止密码子的载体同源引物,见表1中亚细胞定位引物,然后进行pcr扩增反应和目的条带的胶回收。
[0102]
(4)用诺唯赞公司的同源重组酶(ultra one step cloning kit)将扩增产物连接到pcambia2300(35s:gfp)载体上,基因扩增胶回收产物3μl,载体胶回收产物2μl,同源重组酶5μl,轻轻混匀后,50℃反应5min。
[0103]
(5)将连接产物转入冻融状态的大肠杆菌中。
[0104]
(6)其余步骤同上述大肠杆菌转化和阳性克隆检测。上游引物为hp158,下游引物为基因的下游载体连接引物。
[0105]
(7)测序正确即获得vlnhx3d-gfp融合表达载体。
[0106]
2、vlnhx3d-gfp的大肠杆菌的质粒提取,使用诺唯赞质粒提取试剂盒(fastpure endo free plasmid maxi kit,dc202-01)。
[0107]
3、拟南芥原生质体制备与转化:使用coolaber公司的拟南芥原生质体制备及转化试剂盒(ppt101)操作。
[0108]
4、亚细胞定位结果观察:使用激光共聚焦显微镜对原生质体进行观察拍照。
[0109]
通过将gfp融合到vlnhx3d上获得vlnhx3d-gfp表达融合载体,使用液泡膜标记融
合蛋白δ-tip-rfp作为阳性对照。将δ-tip-rfp和vlnhx3d-gfp质粒共同转化到拟南芥原生质体中进行瞬时表达,以空载体35s:gfp和δ-tip-rfp质粒共同转化的原生质体作为阴性对照。利用激光共聚焦显微镜观察发现(图4),在拟南芥的原生质体中,转入35s:gfp和δ-tip-rfp融合表达载体后,gfp产生的绿色荧光弥散在整个细胞质中,而δ-tip-rfp产生的红色荧光分布在液泡膜上,它们的荧光信号没有完全重叠。当δ-tip-rfp与vlnhx3d-gfp融合载体在拟南芥原生质体中表达时,vlnhx3d-gfp融合蛋白产生的绿色荧光和δ-tip-rfp产生的位于液泡膜上红色荧光完全叠加产生黄色荧光,并且黄色荧光信号在液泡膜形成一个圆环,这些结果直观表明vlnhx3d蛋白位于液泡膜上。
[0110]
实施例2
[0111]
一、vlnhx3d的实时荧光定量pcr
[0112]
1、棉花材料为盐处理后各个时间点的根、茎和叶,进行rna提取。
[0113]
2、cdna合成:使用诺唯赞公司的hiscriptii q rt supermix for qpcr(+gdna wiper)(r233-01)反转录试剂。
[0114]
3、设计特异性荧光定量引物:使用primerpremier 5设计vlnhx3d和ghnhx3a的特异性引物,ghhis3作为内参基因,引物序列见表1。
[0115]
4、实时荧光定量pcr(rt-qpcr):使用chamq universal sybr qpcr mastermix配制以下反应混合液。
[0116]
每个样品进行三次生物学重复,结果使用2
‑△
ct
进行分析计算。
[0117]
其中,以未进行盐胁迫处理下(0、1、3、6和12h)陆地棉棉花叶片中vlnhx3d的表达量作为对照(mock),nacl胁迫处理下相同时间点叶片中vlnhx3d表达量为实验组。荧光定量结果表明vlnhx3d在叶片中的表达量随盐胁迫时间的增加而逐渐升高,并在200mm盐胁迫处理后6h达到峰值。当处理时间延长到12h后,vlnhx3d的表达量降低。这些结果表明盐胁迫诱导vlnhx3d的表达量变化。
[0118]
进一步分析不同浓度nacl处理下vlnhx3d在陆地棉叶片的表达模式,对两叶一心阶段的棉花幼苗用0、50、100、150和200mm nacl处理。由于vlnhx3d在6h下的表达量最高,因此对不同浓度nacl处理下叶片6h中vlnhx3d的表达量进行分析。如图5所示,根据荧光定量结果表明,随着nacl浓度的增加,叶片中的vlnhx3d表达水平也随之增加。这进一步验证了盐胁迫可以诱导和调节vlnhx3d的表达水平。
[0119]
二、酵母功能互补实验
[0120]
1、构建酵母表达载体:
[0121]
(1)以含有vlnhx3d大肠杆菌的质粒为模板,引物上分别含有bamhⅰ和sacⅰ酶切位点序列(vlnhx3d-y-f/r)进行pcr扩增和胶回收。
[0122]
(2)酵母表达载体pyes2质粒用bamhⅰ和sacⅰ限制性内切酶进行载体线性化,然后进行胶回收。
[0123]
(3)利用同源重组酶将含有酶切位点的vlnhx3d的胶回收产物与(2)中载体回收产物连接,进行载体构建,其中lb培养基抗性为amp。得到酵母表达载体质粒pyes2-vlnhx3d。
[0124]
2、酵母感受态制备:使用coolaber酵母试剂盒(sk2401-200t)。
[0125]
3、酵母质粒转化:将酵母表达载体pyes2-vlnhx3d和pyes2(空载,对照组)分别转入制备好的酵母感受态。
[0126]
4、阳性菌株验证:挑选单克隆菌株于ynb+ade+try液体培养基过夜培养,30℃,200rpm。以酵母菌液为模板进行pcr,进行阳性菌株验证。由于酵母菌含有细胞壁,将预变性时间延长至5min。
[0127]
5、酵母功能互补实验:用不同的apg培养基进行酵母盐胁迫功能筛选。在apg培养基基础上添加ade、ura、try、leu和his五种营养成份,设置0(对照)、40mm nacl和50mm nacl三种培养条件。
[0128]
(1)分别取上述步骤5中的阳性克隆菌株200μl(分别是pyes2-vlnhx3d或pyes2分别加入到含有10ml ynb+ade+try培养基的玻璃三角瓶中,再取野生型w303200μl(活化步骤参见酵母感受态制备),加入到10ml ypd培养基的玻璃三角瓶中。
[0129]
(2)将上述菌液在30℃,200rpm培养箱中培养至od
600
=1.2。
[0130]
(3)取菌液10μl,分别稀释20、200、2000倍。
[0131]
(4)稀释后的四个梯度菌液各取8μl点在含有0、40mm nacl和50mmnacl的apg培养基上。
[0132]
(5)30℃倒置培养5天观察表行并用相机拍照。
[0133]
将pyes2-vlnhx3d酵母融合表达载体转入酵母突变体axt3,以转空载体pyes2的转基因酵母作为阴性对照,阳性对照为野生型酵母w303,对pyes2-vlnhx3d转基因酵母进行耐盐性分析。结果如图6所示:在不含nacl的apg培养基中,野生型酵母w303,空载体pyes2转基因酵母和pyes2-vlnhx3d转基因酵母均能正常生长,且生长状况基本一致。在含有40mm nacl的apg培养基中,w303稀释2000倍仍能正常生长。由于突变体axt3缺失了内源na
+
转运蛋白,axt3受到na
+
毒害时生长受到抑制,所以转空载pyes2的酵母在40mm nacl的培养基生长受到抑制,基本不能生长。pyes2-vlnhx3d转基因酵母的生长与野生型酵母w303相比,稀释2000倍后生长受到轻微抑制。当nacl浓度增加到50mm时,w303的生长没有受到显著抑制,而pyes2和pyes2-vlnhx3d的生长均表现出不同程度的抑制。与pyes2转基因酵母阴性对照相比,pyes2-vlnhx3d酵母的生长受到的抑制较轻,表现出较好的生长状况,在200倍和2000倍稀释后仍可见少量菌斑,而200倍稀释后的pyes2转基因酵母几乎无法生长。这些实验结果表明,pyes2-vlnhx3d不仅可以部分恢复酵母突变体的na
+
转运功能,而且转基因酵母表现出较高的耐盐性。
[0134]
三、病毒诱导vlnhx3d在棉花中沉默
[0135]
1、构建vigs重组表达载体:具体参见上述步骤;酶切位点为ecorⅰ和xhoⅰ。最终获得trv:vlnhx3d的vigs载体。
[0136]
(1)vigs载体trv:vlnhx3d转化农杆菌(gv3101),
[0137]
(2)阳性克隆检测
[0138]
(3)以菌液作为pcr模板进行pcr验证。
[0139]
(4)测序正确对应的菌液扩增培养后加入等体积的50%甘油保菌,-80℃存放。
[0140]
2、水培条件种植陆地棉tm-1。棉花的两片子叶完全展开后,进行vigs菌液注射。
[0141]
3、重悬液配制:向500ml去离子水中分别加入5ml mes溶液,1ml as溶液和5ml mgso4溶液,混匀(现配现用)。
[0142]
4、菌液重悬:
[0143]
(1)取40ml过夜培养的含有vigs载体的农杆菌菌液于50ml干净离心管中,5000rpm
离心5min,收集菌体。
[0144]
(2)用配制好的重悬液将菌体悬浮,并调节od
600
=1.2。
[0145]
(3)黑暗条件下室温静置3h。
[0146]
5、棉花注射:
[0147]
(1)将重悬静置后的ptrv1(辅助质粒)分别与ptrv2(空载),trv:vlnhx3d和trv:cla(阳性对照)等体积混合。
[0148]
(2)用1ml无菌注射器的针头把棉花子叶背面轻轻划破(注意不要划透叶片),然后将菌液从伤口处注射进去使其浸透叶片。
[0149]
(3)侵染完成后避光生长24h,然后正常条件生长。
[0150]
6、基因沉默效率检测:注射菌液10天后,trv:cla(阳性对照)植株的真叶出现白化性状。随机取3株目的基因沉默植株和注射空载植株的根、茎和叶进行rna提取和反转录。利用荧光定量检测基因的沉默效率。
[0151]
为了进一步验证vlnhx3d具有增强耐盐性的功能,利用vigs技术分析了vlnhx3d在棉花盐胁迫下所发挥的作用。病毒诱导的基因沉默(virus induced gene silencing,vigs)技术可以利用含有目的基因片段的病毒或菌液侵染植物,诱导植物内源基因沉默从而引起相应的生理和形态的变化,然后通过这些变化研究基因功能。将构建好的沉默表达载体trv:vlnhx3d、trv:00(阴性对照)和trv:cla(阳性对照)分别于辅助质粒等体积混合后注射到萌发10天后的棉花幼苗子叶的背面。12天后阳性对照的真叶表现出白化性状(图7)。
[0152]
当阳性对照出现白化表型后,检测trv:vlnhx3d植株中vlnhx3d的沉默效率。分别提取trv:vlnhx3d和trv:00棉花植株的根、茎和叶的rna,然后使用荧光定量技术检测vlnhx3d表达水平。结果显示trv:vlnhx3d的根、茎和叶中vlnhx3d表达量均显著低于trv:00植株(图7)。为了确保基因沉默效果的特异性,同时检测vlnhx3d的同源基因ghnhx3a的相应表达水平。图8结果表明,ghnhx3a在trv:vlnhx3d和trv:00植株的叶、茎和根中的表达量均无显著差异。这表明在trv:vlnhx3d沉默棉花植株中,vlnhx3d被高效特异性地沉默。
[0153]
7、沉默植株盐处理:vigs注射后,棉花幼苗生长至两叶一心时,分别对trv:00(空载)和沉默目的基因的植株进行200mm nacl处理。向霍格兰营养液中加入相应质量的nacl,同时以不含nacl的霍格兰营养液的作为对照处理。处理后10天进行基因沉默植株和对照植株的表型观察和拍照。
[0154]
以含有0mm nacl作为对照组,处理组施加200mm nacl,处理10天后观察棉花幼苗的耐盐性。图9结果表明在正常生长条件下,trv:vlnhx3d沉默植物和trv:00生长状况一致;在200mm nacl盐胁迫处理后trv:vlnhx3d叶片明显发黄萎蔫且株高比trv:00矮小。说明当vlnhx3d的表达被沉默后,植株对盐胁迫的敏感性增加。
[0155]
8、离子含量测定:分别取9株处理后10天的trv:00和trv:vlnhx3d植株(处理组和对照组均要进行取样),将根、茎和叶分开,做好标记,在烘箱中105℃,杀青5min,然后75℃烘干至恒重后研磨成粉末。
[0156]
钠离子和钾离子含量测定:使用原子吸收法进行测定。对钠离子和钾离子含量测定。
[0157]
取烘干样品粉末过100目尼龙筛。称取过筛后的植物粉末0.1g,将trv:00和trv:ghnhx3d植株的第二片真叶、茎和根在90℃下烘干,然后研磨成粉末。将0.05g的粉末样品溶
解于5ml浓hno3(硝化作用)。用去离子水稀释12倍后离心。收集上清,用原子吸收法测定钠离子和钾离子含量。
[0158]
植物的耐盐性与细胞内离子含量有关。细胞中离子浓度过高会对细胞造成毒害,从而降低植物的耐盐性。本研究测定了trv:vlnhx3d和trv:00植株根、茎和叶中na
+
和k
+
含量及计算na
+
/k
+
比值,进一步探究vlnhx3d的耐盐机制。图10结果表明,对照组中trv:vlnhx3d和trv:00植株根、茎和叶中na
+
和k
+
含量及na
+
/k
+
比值都显示出相同的水平。200mm nacl处理后,trv:vlnhx3d植株根、茎和叶中na
+
含量显著高于trv:00;trv:vlnhx3d根和茎中k
+
的含量没有差异,但是trv:vlnhx3d根中k
+
的含量显著低于trv:00。
[0159]
与trv:00植株相比,盐胁迫后,trv:vlnhx3d沉默植株根、茎和叶的na
+
/k
+
比值显著升高。说明trv:vlnhx3d植株受到盐胁迫后体内积累了较多na
+
,尤其是根中k
+
含量显著降低,这导致trv:vlnhx3d棉花植株具有较高的na
+
/k
+
,增加了对盐胁迫的敏感性。
[0160]
尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。
