1.本发明属于碱性蛋白酶工程菌技术领域,具体涉及一种碱性蛋白酶表达的工程菌、包含所述菌株的菌剂及其在碱性蛋白酶生产中的应用。
背景技术:
2.公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
3.木霉是重要的微生物蛋白酶来源,许多研究证明木霉具有复杂的胞外蛋白水解酶类系统,并且培养条件的不同可影响胞外蛋白酶的种类及组成。木霉胞外蛋白酶多为丝氨酸蛋白酶和天冬氨酸蛋白酶,可以降解酪蛋白、牛血清白蛋白、溶菌酶、胶原蛋白、线虫体壁等多种蛋白类底物,没有专一的底物酶切位点。碱性蛋白酶(alkaline protease)属于丝氨酸胞外高碱性蛋白酶,它能水解蛋白质分子,具有较强的分解蛋白质的能力,可用于工农业废弃物的降解利用,也在绿色木霉与其他病原菌的相互作用中起着重要作用。同时木霉蛋白酶良好的生化特性使其在工业领域得以应用,其碱性蛋白酶在食品加工、洗涤等领域有广泛的应用。微生物酶的产生受包括ph、碳源、温度等多种参数的影响。其中ph值是改变代谢途径、影响工业酶生产和酶合成效率的主要因素。研究表明,在ph值低于5时,里氏木霉(t.reesei)能够分泌酸性天冬氨酸蛋白酶;当ph值控制在6.0及以上时,里氏木霉(t.reesei)则能够分泌一种类似胰蛋白酶的碱性丝氨酸蛋白酶。
4.自然界中,真菌所处环境的ph值一直处于不断变化之中,这种改变对真菌的生长、发育、次生代谢等生理活动具有非常重要的影响。为了生存和繁衍,真菌必须适应不断改变的酸碱环境。因而,研究真菌对酸碱环境的适应机理,是认知其生命活动规律的重要内容。前人已经在许多真菌中发现,存在一条比较保守的ph响应信号途径,即pal途径。pal途径由碱性ph信号激活,经过一系列传递,最终作用于pacc/riml01转录因子。
5.pacc是pal途径中至关重要的组成部分,也是真菌适应酸碱环境的一个中枢性调控因子,其表达受酸性条件的抑制,而受盐碱条件的诱导。有研究发现,pacc基因对真菌适应高ph环境具有重要作用,真菌中许多有关盐胁迫和金属毒性响应相关基因的表达也受到pacc转录因子的调节。在不同真菌中,pacc/rim101能够调节多种胞外分泌酶的产生,如蛋白酶、几丁质酶、β-1,3-葡聚糖酶等。玉米黑粉菌(u.maydis)rim101敲除菌株分泌的蛋白酶明显比野生型和回补菌株减少。在绿僵菌(m.robertsii)中mrpacc缺失对蛋白酶产生没有影响,但是会导致几丁质酶活力和基因表达量下降。盾壳菌(c.minitans)cmpacc缺失菌株的几丁质酶、β-1,3-葡聚糖酶、蛋白酶的活力都明显降低。在稻瘟病(m.oryzae)中pacc缺失导致多种分泌型糖类降解酶的酶活力明显下降,包括多聚半乳糖醛酸酶、α-葡萄糖苷酶、β-葡萄糖苷酶、α-半乳糖苷酶、β-1,3-葡聚糖酶等。
技术实现要素:
6.本发明所述的tvpacc基因是从绿色木霉(trichoderma viride)tv-1511基因组中鉴定出的编码ph响应因子pacc的编码基因。通过前期对tv-1511开展的全基因组测序和精细基因组图谱绘制工作(genbank accession no.vcec00000000;bioproject:prjna543939;biosample:samn11791795),得到了tvpacc基因及其编码蛋白的详细信息。进一步的,本发明证实了敲除上述tvpacc基因的菌株表现出更加优异的碱性蛋白酶生产特性。
7.基于上述技术效果,本发明提供以下技术方案:
8.本发明第一方面,提供一种碱性蛋白酶表达的工程菌,所述工程菌与野生株相比,被修饰成具有减弱的ph响应信号途径表达。
9.本发明第一方面所述工程菌为木霉属,包括但不限于哈茨木霉(t.harzianum)、棘孢木霉(t.asperellum)、绿色木霉(t.viride)、长枝木霉(t.longibrachiatum)、康氏木霉(t.koningi)或里氏木霉(t.reesei)中的一种。
10.本发明提供的一种可行的方式中,所述工程菌为绿色木霉,具体的实施方式中,所述绿色木霉为发明人课题组分离并鉴定的绿色木霉(trichoderma viride)tv-1511,已经于2018年12月20日在中国微生物菌种保藏管理委员会普通微生物中心进行保藏,地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,菌种保藏号为cgmcc no.16800,该菌株已在申请号为2019106265259的专利中公开。
11.本发明第一方面“所述工程菌与野生株相比”被修饰成具有减弱的ph响应信号途径表达,意味着修饰后的微生物中ph响应信号途径相关蛋白表达的减弱,包括相关蛋白表达被抑制和/或蛋白活力减弱。优选的,所述ph响应信号途径为pal途径,进一步的,所述减弱的ph响应信号途径为减弱的tvpacc蛋白表达,所述“减弱的tvpacc蛋白表达”的一种具体实施方式中,所述tvpacc蛋白的序列如seq id no.1所示,所述tvpacc的核苷酸序列如seq id no.2所示。
12.另外,所述ph响应活性蛋白的减弱并不局限于上述序列所示的tvpacc蛋白,还包括与上述序列具有70%或更多相似性的蛋白,所述相似性可通过blast方法比对得知。优选的,所述蛋白相似性为80%或更多;更优选的,为90%或更多;进一步优选的,为95%或更多;更进一步的,为98%或更多与其同源的氨基酸序列。
13.优选的,所述被修饰成具有减弱的ph响应信号途径表达可以通过本领域中任何已知的方法执行,例如,同源重组。本发明提供所述碱性蛋白酶表达的工程菌一种具体的构建方法,所述构建方法如下:
14.(1)基于tvpacc基因5’侧翼序列(上游)、3’侧翼序列(下游)以及抗性基因hyg-r序列设计引物,通过融合pcr的方法构建tvpacc的敲除基因片段;
15.(2)将构建好的敲除基因片段通过peg-cacl2法转入绿色木霉tv-1511原生质体;
16.(3)利用hyg-r抗性,进行菌落pcr筛选阳性突变子(如图4所示)。
17.本发明提供的一种具体实施方式中,以绿色木霉(trichoderma viride)tv-1511作为出发菌株,以上述构建方法获得缺失tvpacc基因的木霉株tv-1511-δtvpacc。该菌株tv-1511-δtvpacc中,检测不到tvpacc的转录表达,是一种tvpacc基因完全敲除的工程菌株。经测定,出发菌株绿色木霉(trichoderma viride)tv-1511在碱性条件(ph 9)下产蛋白
酶的活性显著低于酸性条件(ph 5),而菌株tv-1511-δtvpacc相比出发菌株,具有更好的碱性环境适应能力,其在碱性条件下的菌落直径和生物量显著提高,并具有更强的分泌碱性蛋白酶的能力,其发酵液中碱性蛋白酶的活力显著提高。
18.本发明第二方面,提供一种菌剂,所述菌剂包括第一方面所述碱性蛋白酶表达的工程菌和/或所述工程菌的培养物。
19.本发明提供的一种具体实施方式中,提供了一种缺失tvpacc基因的木霉工程菌tv-1511-δtvpacc,在正常培养条件下所述菌株的形态与野生型菌株无明显差别。
20.本发明第三方面,提供第一方面所述工程菌株的培养方法,所述培养方式如下:采用pda(马铃薯葡萄糖琼脂培养基)或pd(马铃薯葡萄糖液体培养基)培养基进行培养,培养温度为25~30℃。
21.上述培养方法中,进一步优选的培养温度为26℃、27℃或28℃,效果较好的实施方式中,所述培养温度为28℃。
22.采用上述pd培养基进行培养时,摇床转速为160~200r/min;进一步的,为180r/min。本发明第四方面,提供第一方面所述碱性蛋白酶表达的工程菌、第二方面所述菌剂在碱性蛋白酶生产方面的应用。
23.本发明第五方面,提供一种提高碱性蛋白酶酶活力的方法,所述方法包括减弱所述出发菌株中ph响应途径的蛋白活力。
24.以上一个或多个技术方案的有益效果是:
25.本发明在绿色木霉(trichoderma viride)tv-1511中鉴定到一种ph响应因子tvpacc的编码基因及相对应的蛋白,并利用同源重组方法构建了tvpacc基因缺失的木霉工程菌株。本发明发现,通过敲除基因tvpacc基因,提高了绿色木霉碱性环境的适应能力,增强了木霉菌株产碱性蛋白酶的能力,在工业和农业方面具有良好的实际应用价值。
附图说明
26.构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
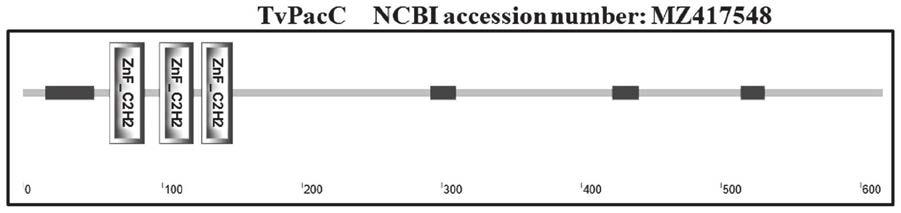
27.图1为所述tvpacc的氨基酸序列结构域示意图。
28.图2为实施例1中不同ph条件下,tvpacc在绿色木霉出发菌株中的转录水平。
29.图3为实施例1中不同ph条件下,绿色木霉出发菌株产蛋白酶能力的测定。
30.图4为实施例2中tvpacc基因敲除片段构建示意图;
31.其中,图4a为绿色木霉tvpacc基因缺失工程菌构建流程图;
32.图4b为引物扩增电泳图。
33.图5为实施例2中tvpacc基因在绿色木霉出发菌株及工程菌中表达的qpcr检测结果;
34.其中,图5a为野生型与tvpacc缺失工程菌株中tvpacc的转录表达结果;
35.图5b为野生型与tvpacc缺失工程菌株中tvpacc蛋白表达条带;
36.图5c为野生型与tvpacc缺失工程菌株中tvpacc蛋白表达直方图结果。
37.图6为实施例3中绿色木霉出发菌株及工程菌株tv-1511-δtvpacc的碱性环境适应能力分析;
38.其中,图6a为野生型与tvpacc缺失工程菌株在碱性条件下的培养结果;
39.图6b为野生型与tvpacc缺失工程菌株的菌落直径;
40.图6c为野生型与tvpacc缺失工程菌株培养后的干重。
41.图7为实施例4中绿色木霉出发菌株及工程菌株tv-1511-δtvpacc的碱性蛋白酶分泌能力的分析;
42.其在ph9的脱脂奶粉mm平板上的水解圈更加明显(图7a),其发酵液中碱性蛋白酶的活力显著提高(图7b)
43.其中,图7a为tvpacc缺失工程菌株水解圈结果;
44.图7b为tvpacc缺失工程菌株发酵液中碱性蛋白酶活力测定结果。
具体实施方式
45.应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
46.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
47.正如背景技术所介绍的,ph信号途径对菌株的生理活性具有诸多影响,本发明明确了tvpacc基因是绿色木霉(trichoderma viride)tv-1511基因组中ph响应因子pacc的编码基因。本发明研究表明,上述菌株敲除tvpacc基因后的重组菌株具有更加优秀的碱性蛋白酶分泌能力,有望作为一种碱性蛋白酶工程菌加以应用。
48.为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
49.实施例1不同ph条件下绿色木霉出发菌株ph响应因子tvpacc转录表达水平及产蛋白酶水平的测定
50.将200μl木霉出发菌株tv-1511的孢子分别接种于mm液体培养基(1lddh2o+15g kh2po4+5g(nh4)2so4+0.6g mgso4(or 1.23g mgso
4.
7h2o)+0.6g cacl2(or 0.8g cacl2·
2h2o)+0.005g feso4·
7h2o+0.0016g mnso4·
h2o+0.0014g znso4·
7h2o+0.0037g cocl2·
6h2o(或0.002g cocl2)+20g葡萄糖)中,28℃,180rpm培养48h,通过2层无菌纱布过滤获得无菌的菌丝体。将等量的菌丝体分别接种于不同ph值(ph5、ph7、ph9)的含有2%脱脂奶粉的mm液体无氮源培养基(1l ddh2o+15g kh2po4+0.6g mgso4(or 1.23g mgso
4.
7h2o),+0.6g cacl2(or 0.8g cacl2·
2h2o)+0.005g feso4·
7h2o+0.0016g mnso4·
h2o+0.0014g znso4·
7h2o+0.0037g cocl2·
6h2o(或0.002g cocl2)+20g葡萄糖)中,28℃,180rpm培养72h,分别收集菌丝体和发酵液。
51.菌丝体液氮研磨,利用trizol法提取总rna并制备cdna,利用如seq id no.3、seq id no.4所示的引物,采用荧光定量pcr的方法检测tvpacc的转录表达。
52.seq id no.3:tvpacc-qpcr-f:gatactctggcggaatgc;
53.seq id no.4:tvpacc-qpcr-r:atccttgcgaatgcgatt。
54.回收的液体发酵液经10,000rpm离心后取上清,制备粗酶提取液,利用福林酚法测定蛋白酶活性。
55.在pda平板上活化木霉出发菌株tv-1511,28℃避光培养48-72h,使得木霉长势均一,再使用打孔器制备大小均一的菌块并分别接种于不同ph(ph5、ph7、ph9)的含有2%脱脂奶粉的mm固体无氮源培养基(mm液体无氮源培养基+2%琼脂)中,28℃静置培养48h,观察菌落直径和水解圈。
56.荧光定量pcr的检测结果显示:tvpacc基因在酸性条件(ph 5)下表达量低,而在碱性条件(ph 9)下tvpacc基因的转录表达显著提高(图2)。
57.蛋白酶活性检测的结果发现:在碱性条件(ph 9)下,出发菌株的蛋白酶水解不明显(图3a),其产碱性蛋白酶的活性极低(图3b)。表明在碱性条件下,出发菌株中碱性蛋白酶的合成受到抑制。
58.实施例2绿色木霉tvpacc基因缺失工程菌的构建
59.(1)敲除片段的构建
60.以绿色木霉tv-1511基因组dna为模板,扩增tvpacc基因的上游片段和下游片段(图4a)。敲除片段扩增引物分别为:上游片段扩增引物
61.tvpacc-up-f:gattcgggcgtctcgagata(seq id no.5)
62.tvpacc-up-r:
63.gagagctaccttacatcaatatggcaagaggcgctttggcgca(seq id no.6);
64.下游片段扩增引物:
65.tvpacc-down-f:
66.ggtactatggcttagatggaatacccgcactgagacgttcatggcattt(seq id no.7)
67.tvpacc-down-r:tcactgcatggcgtctcctt(seq id no.8)。
68.以线性化的pbargpe1-hygro质粒为模板,扩增潮霉素抗性基因(hygr),扩增引物为:hygr-f:gagagctaccttacatcaatatggc(seq id no.9)和hygr-r:ggtactatggcttagatggaataccc(seq id no.10)(图4b)。通过融合pcr构建敲除片段,终浓度为312ng/μl,od
260/280
为1.88,共40μl。
69.(2)原生质体制备
70.接种绿色木霉tv-1511于pda平板,28℃培养10天后,产生大量新鲜分生孢子;用10ml生理盐水(0.9%nacl,0.05%tween-20)洗涤菌丝表面,经玻璃绒纸过滤,去除菌丝体得到孢子悬液。
71.在玻璃纸覆盖的pda平板上,取200μl孢子悬液涂布,28℃避光培养24h,使pda平板上的孢子萌发;
72.配制溶解酶溶液:取0.15g溶解酶(lysing enzyme,sigma:l1412)溶于20ml溶液i(1.2m d-sorbitol,0.1m kh2po
4,
ph 5.6),0.2μm滤膜过滤除菌;
73.取出pda平板,将长有菌丝的纤维膜取出并反向贴在含有3-4ml裂解液的平板上,于28℃、100rpm条件下处理100min;
74.在无菌超净台下将平板中的纤维膜取出,确保大部分菌丝体保留在平板中,在此过程中可以用溶液a冲洗显微膜上残留的菌丝块,利用枪头反复吹吸液体中的菌丝块200次以上,充分释放内部的原生质体;
75.用装有4层纱布的1.5ml管过滤上述混合液,保留下层滤液并进行4℃离心,2000rpm离心10min,弃上清,保留底部的原生质体。
76.加1ml溶液a,再次离心,弃上清;
77.加1ml 4℃预冷的溶液ii(1m sorbitol,50mm cacl2,10mm tris-hcl,ph7.5),冰上得到原生质体;用血球计数板观察计数,稀释原生质体至107个/ml。(3)原生质体转化及突变子筛选
78.冰上放置15ml离心管,分别加入200μl原生质悬浮液、10μl纯化的pcr产物、50μl peg溶液(25%peg600,50mm cacl2,10mm tris-hcl,ph 7.5);用枪头混匀,冰上放置20min;
79.加2ml peg溶液,轻轻混匀,常温下放置5min;加2ml溶液ii,轻轻混匀;
80.加2ml混合液涂布在覆盖层析纸的含1m蔗糖pda平板上,层析纸预先剪成条形;28℃避光培养24h;
81.将条形层析纸转导含抗生素的pda平板上,28℃避光培养36h,待条形层析纸边缘长出菌落后,挑取菌落,转接至新鲜的抗生素平板上,培养2天。
82.转化后,获得tv-1511的转化子8株。利用获得的tvpacc缺失工程菌株,采用荧光定量pcr的方法检测tvpacc的转录表达,扩增引物为:tvpacc-qpcr-f:gatactctggcggaatgc(seq id no.3)和tvpacc-qpcr-r:atccttgcgaatgcgatt(seq id no.4);利用蛋白质免疫印迹wb的方法,检测tvpacc的蛋白表达。结果显示,在tvpacc缺失工程菌株中检测不到tvpacc的转录表达(图5a)和蛋白表达(图5b,5c)。
83.实施例3绿色木霉工程菌株tv-1511-δtvpacc适应碱性胁迫环境能力的测定(1)无菌孢子的收集
84.接种绿色木霉出发菌株及tv-1511-δtvpacc工程菌于pda平板,28℃培养10天后,产生大量新鲜分生孢子;用10ml生理盐水(0.9%nacl,0.05%tween)洗涤菌丝表面,经玻璃绒纸过滤,去除菌丝体得到孢子悬液;用30%的甘油悬浮,充分混匀,分装到1.5ml离心管中,标记好名称和时间,-80℃冻存;取一管孢子液进行活菌计数,确定孢子液的浓度。
85.(2)平板耐碱实验
86.先在pda平板上活化木霉出发菌株(wildtype)和tv-1511-δtvpacc工程菌,28℃避光培养48-72h,使得原始菌株和突变工程菌木霉长势均一,再使用打孔器制备大小均一的菌块并转移到ph9的pda平板。将接有菌块的平板置于28℃培养72h后,测量菌落生长直径。
87.结果发现:tv-1511-δtvpacc工程菌更能适应高ph的碱性环境,其菌落直径相比出发菌株(wildtype)显著增加(图6a)。
88.(3)液体摇瓶耐碱实验
89.将200μl木霉出发菌株(wildtype)和tv-1511-δtvpacc工程菌的孢子分别接种于pdb液体培养基中,28℃,180rpm培养48h,通过2层无菌纱布过滤获得无菌的菌丝体。将等量的菌丝体分别接种于ph9的pdb液体培养基中,28℃,180rpm培养72h,收集菌丝体,测定菌体生物量。
90.结果发现:在ph9的碱性环境下,tv-1511-δtvpacc工程菌的生物量比出发菌株(wildtype)显著提高了(图6b)。
91.实施例4绿色木霉工程菌株tv-1511-δtvpacc产碱性蛋白酶能力的测定
92.无菌孢子收集按上述实施例3的描述进行。
93.平板水解圈实验:在mm固体平板上活化木霉出发菌株(wildtype)和tv-1511-δtvpacc工程菌,28℃避光培养48-72h,使得原始菌株和突变工程菌木霉长势均一,再使用打孔器制备大小均一的菌块并转移到ph9的含有2%脱脂奶粉的mm液固体无氮源培养基(1l ddh2o+15g kh2po4+0.6g mgso4(or 1.23g mgso
4.
7h2o)+0.6g cacl2(or 0.8g cacl2·
2h2o)+0.005g feso4·
7h2o+0.0016g mnso4·
h2o+0.0014g znso4·
7h2o+0.0037g cocl2·
6h2o(或0.002g cocl2)+20g葡萄糖+20g琼脂)平板中。将接有菌块的平板置于28℃培养72h后,观察蛋白酶水解圈。
94.液体发酵产蛋白酶实验:将200μl木霉出发菌株(wildtype)和tv-1511-δtvpacc工程菌株的孢子分别接种于mm液体培养基中,28℃,180rpm培养48h,通过2层无菌纱布过滤获得工程菌和原始菌株的菌丝体。将等量的菌丝体分别接种于ph 9的含有2%脱脂奶粉的mm液体无氮源培养基(1l ddh2o+15g kh2po4+0.6g mgso4(or 1.23g mgso4·
7h2o)+0.6gcacl2(or 0.8g cacl2·
2h2o)+0.005g feso4·
7h2o+0.0016g mnso4·
h2o+0.0014g znso4·
7h2o+0.0037g cocl2·
6h2o(或0.002g cocl2)+20g葡萄糖)中,28℃,180rpm培养,进行进行蛋白酶的诱导,72h后通过2层无菌纱布过滤菌丝体,回收液体发酵液。
95.回收的液体发酵液经10,000rpm离心后取上清,制备粗酶提取液,利用福林酚法测定蛋白酶活性。
96.结果发现:木霉工程菌株tv-1511-δtvpacc,相比出发菌株,具有更强的分泌碱性蛋白酶的能力,其在ph9的脱脂奶粉mm平板上的水解圈更加明显(图7a),其发酵液中碱性蛋白酶的活力显著提高(图7b)。
97.以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
