1.本发明涉及一种多功能西洋参水解肽及其制备方法和应用,属于医药功能产品加工领域。
背景技术:
2.在天然活性成分的提取与分离中常用到有机溶剂,它们不但具有较强的挥发性或毒性,在生产过程中会引起环境污染。离子液体是由体积较大、结构不对称的有机阳离子和体积较小的无机/有机阴离子组成的液态物质。与传统溶剂相比,离子液体具有热稳定性好、不挥发、安全环保、便于重复利用等特点。且由于其对目标物选择性高,能够有效提取天然产物中的活性成分,目前已成为提纯分离领域的一种新型绿色溶剂。
3.gutowski 2003年首次提出了离子液体双水相的概念,研究比较多的是离子液体/无机盐体系,研究结果显示亲水性离子液体[c4mim]cl与k3po4能够形成上相富集离子液体和下相富集磷酸钾的双水相体系。离子液体双水相体系相较于传统双水相不但为提取营造了温和的环境,又避免了提取过程中有机溶剂的使用,综合了离子液体和双水相体系的优点,同时具有分相时间短、不易乳化、提取率高、离子体系易回收利用等优势,因此在分离天然活性物质方面具有广阔的应用前景。
[0004]
西洋参有补气养阴,清热生津的功效,是一种具有极高药用价值的滋补保健产品。西洋参中含有人参皂苷、多糖、甾醇、蛋白质和多肽等各类有效成分。蛋白质及多肽是西洋参中除皂苷外较为重要的有效成分;研究表明其具有调节免疫、降血压、降血糖、降血脂、抗氧化、抗辐射损伤等功效。蛋白质作为生物大分子一般难以被人体直接吸收,尤其是病患和老年人群。由于身体机能下降,消化和吸收能力比较差,更难于吸收食物中的蛋白类成分。肽类成分作为蛋白质的水解产物,在很多方面有更优于蛋白质的理化特性,可不经消化直接在胃肠道吸收,其吸收效率甚至比氨基酸还要显著。
[0005]
现有技术中西洋参多肽的制备主要是利用有机溶剂或者利用昂贵的提取设备,制备工艺复杂且成本较高,不利于市场的推广应用,由于西洋参属于天然产物,成分组成复杂,现有技术中西洋参多肽产品的纯度较低,如何简化提取工艺并有效提高西洋参多肽的纯度是本领域技术人员面临的一个技术难题,
技术实现要素:
[0006]
针对现有技术的不足之处,本技术提供了一种多功能西洋参水解肽及其制备方法与应用。
[0007]
本技术提供的一种多功能西洋参水解肽,活性肽含量高达85%以上,
[0008]
基于肽类成分人体吸收利用的优势,本发明提供了一种多功能西洋参水解肽的制备方法;其提取效率优异、操作流程绿色安全,终产品活性肽含量可达85%以上。该技术极大程度的获取了高品质西洋参活性肽类成分,在抗氧化、免疫调节、抗炎、降血压和降血糖等功能产品开发方面具有广阔的应用前景。
[0009]
本发明技术方案如下:
[0010]
一种多功能西洋参水解肽,所述水解肽是由离子液体溶液提取,无机盐纯化,再经胃蛋白酶-胰蛋白酶两步消化工艺酶解制得,所述水解肽中的活性肽含量按质量分数计达85%以上,所述活性肽的分子量范围《10kd。
[0011]
根据本发明优选的,所述水解肽中的活性肽含量按质量分数计达90%以上,所述活性肽的分子量范围《10kd。
[0012]
进一步优选的,所述水解肽中的活性肽含量达按质量分数计92%以上,所述活性肽的分子量范围《3kd。
[0013]
上述西洋参水解肽的制备方法,包括如下步骤:
[0014]
(1)西洋参粉碎后,按质量体积比g/ml 1:(10~35)加入离子液体溶液,于40~70℃提取0.5~4h,然后固液分离,获得西洋参粗蛋白提取液;
[0015]
(2)取步骤(1)制备的西洋参粗蛋白提取液,按体积质量比ml/g(5~15):0.8加入无机盐,超声震荡0.5~2h,3000~5000r/min条件下离心5~15min使液体分层;去除下层液体,在上层液体中加入聚乙二醇,静置12~48h,3000~5000r/min离心15~30min,收集沉淀即得西洋参蛋白提取物;
[0016]
(3)将步骤(2)制备的蛋白提取物用10~15倍量水溶解,经胃蛋白酶-胰蛋白酶两步消化工艺得西洋参蛋白水解物,然后加入磺基水杨酸溶液室温放置30~90min,固液分离,将沉淀复溶后经超滤、冷冻干燥即得西洋参水解肽。
[0017]
根据本发明优选的,步骤(1)中,离子液体为1-丁基-3-甲基咪唑四氟硼酸盐、1-丁基-3-甲基咪唑六氟磷酸盐、1-丁基-3-甲基咪唑双三氟甲烷磺酰亚胺盐、1-辛基-3-甲基咪唑氯盐或1-己基-3-甲基咪唑六氟磷酸盐。
[0018]
进一步优选的,选用的离子液体为1-丁基-3-甲基咪唑四氟硼酸盐、1-丁基-3-甲基咪唑六氟磷酸盐或1-丁基-3-甲基咪唑双三氟甲烷磺酰亚胺盐。
[0019]
更优选的,离子液体为1-丁基-3-甲基咪唑四氟硼酸盐。
[0020]
根据本发明优选的,步骤(1)中离子液体终浓度为0.001~0.01mol/l。
[0021]
进一步优选的,离子液体终浓度为0.002~0.008mol/l。
[0022]
更优选的,离子液体终浓度为0.004mol/l。
[0023]
根据本发明优选的,步骤(2)中,无机盐为磷酸氢二钾、柠檬酸钠、氯化钾、磷酸二氢钠或硫酸铵。
[0024]
进一步优选的,无机盐为磷酸氢二钾、柠檬酸钠或磷酸二氢钠。
[0025]
更优选的,无机盐为磷酸氢二钾。
[0026]
根据本发明优选的,步骤(2)中,聚乙二醇添加种类为聚乙二醇200、400、600、800或1000。
[0027]
进一步优选的,聚乙二醇添加种类为聚乙二醇400、600或800。
[0028]
更优选的,聚乙二醇添加种类为聚乙二醇600。
[0029]
根据本发明优选的,步骤(2)中,聚乙二醇添加量按质量分数计为5%~20%。
[0030]
进一步优选的,聚乙二醇添加量按质量分数计为12%~18%。
[0031]
更优选的,聚乙二醇添加量按质量分数计为15%。
[0032]
根据本发明优选的,步骤(2)中,超声震荡频率为40khz~100khz。
[0033]
进一步优选的,超声震荡频率为60khz~80khz。
[0034]
更优选的,超声震荡频率为70khz。
[0035]
根据本发明优选的,步骤(3)中,一消化工艺为胃蛋白酶添加量10~100mg/ml、ph值1.5~4、nacl终浓度0.01~0.08mol/l、酶解时间0.5~4h,二级消化工艺为胰蛋白酶添加量4~20mg/ml、ph值7.5~9.5、kh2po4终浓度0.05~0.12mol/l、酶解时间1~6h;磺基水杨酸添加量为质量体积比g/ml 0.15:(8~25);超滤截取分子量范围为《10kda。
[0036]
进一步优选的,一级消化工艺为胃蛋白酶添加量30~80mg/ml、ph值2~3、nacl终浓度0.025~0.06mol/l、酶解时间1~3h,二级消化工艺为胰蛋白酶添加量8~16mg/ml、ph值8~9、kh2po4终浓度0.07~0.10mol/l、酶解时间2~5h;磺基水杨酸添加量为质量体积比g/ml 0.15:(10~15);超滤截取分子量范围为《6kda。
[0037]
更优选的,一级消化工艺为胃蛋白酶添加量60mg/ml、ph值2.5、nacl终浓度0.04mol/l、酶解时间2h,二级消化工艺为胰蛋白酶添加量12mg/ml、ph值8.5、kh2po4终浓度0.08mol/l、酶解时间3h;磺基水杨酸添加量为质量体积比g/ml 0.15:12;超滤截取分子量范围为《3kda。
[0038]
上述西洋参水解肽作为有效成分在制备功能食品、保健食品、药品或日化用品中的应用。
[0039]
根据本发明优选的,上述西洋参水解肽作为有效成分在制备免疫调节、降血压、降血糖、抗炎或抗氧化功能产品中的应用。
[0040]
一种降血糖的药物,其有效成分含有:阿卡波糖和上述西洋参水解肽。
[0041]
根据本发明优选的,所述降血糖的药物中阿卡波糖与西洋参水解肽的质量比为1:1。
[0042]
一种降血压的药物,其有效成分含有:卡托普利和上述西洋参水解肽。
[0043]
根据本发明优选的,所述降血压的药物中卡托普利与西洋参水解肽的质量比为1:2。
[0044]
本发明有益效果
[0045]
1、本发明提供了一种高纯度西洋参水解肽,所述水解肽中的活性肽含量按质量计分数达85%以上,所述活性肽的分子量范围《10kd;本技术提供的西洋参水解肽抗氧化作用显著;
[0046]
2、本发明中制备西洋参水解肽的方法操作简单,不需要昂贵设备,显著减少了有机溶剂的使用量,制备出的西洋参水解肽中活性肽含量达85%以上。
[0047]
3、本发明提供了西洋参水解肽与阿卡波糖联合给药,对α-葡萄糖苷酶和α-淀粉酶活性的抑制优于二者单独使用的抑制效果,具有协同增效的作用;本发明提供了西洋参水解肽与卡托普利联合给药对ace抑制效果优于二者单独使用的抑制效果,具有协同增效的作用;即本发明提供的西洋参水解肽与经典药物联合使用,可发挥更强的血压与血糖的调控能力;有助于提升我国西洋参资源加工利用技术的科技含量,具有重要经济和社会效益。
[0048]
4、本发明提供的西洋参水解肽抗炎作用显著,有效抑制no释放作用,抑制率可达33.5%;可以高效调控lps诱导的相关炎症介质或炎症因子表达,发挥有效的抗炎作用。
[0049]
5、本发明提供的西洋参水解肽免疫调节作用显著,可以有效刺激巨噬细胞,使巨噬细胞的吞噬功能明显增强,增强免疫力功能。
[0050]
6、本发明提供的西洋参水解肽可以有效阻碍有升高血压作用的血管紧张素ii的生成,从而达到治疗高血压症状的效果,抑制率可达到77.2%。
[0051]
7、本发明提供的西洋参水解肽对α-葡萄糖苷酶和α-淀粉酶活性都有抑制作用,抑制率分别可达42.5%和27.2%;对α-葡萄糖苷酶活性的抑制效果甚至优于阿卡波糖阳性组。
附图说明
[0052]
图1西洋参水解肽对lps诱导的raw 264.7细胞no水平影响图。
[0053]
图2西洋参水解肽对ace酶的抑制效果图。
具体实施方式
[0054]
下面结合具体实施方式对本发明进行详细描述,所述的实施案例有助于对本发明的理解和实施,并非构成对本发明的限制。本发明的保护范围并不以具体实施方式为限,而是由权利要求加以限定。
[0055]
实施例中未详加说明的内容均按本领域现有技术。
[0056]
材料来源
[0057]
1-丁基-3-甲基咪唑四氟硼酸盐、1-丁基-3-甲基咪唑六氟磷酸盐、1-辛基-3-甲基咪唑氯盐等离子液体试剂,购自上海成捷化学有限公司;磷酸氢二钾、柠檬酸钠、硫酸铵等无机盐试剂,购自国药集团化学试剂有限公司;聚乙二醇,购自北京索莱宝科技有限公司;胃蛋白酶(1:3000)、胰蛋白酶(1:250)等,购自上海阿拉丁生化科技股份有限公司。
[0058]
实施例1
[0059]
一种多功能西洋参水解肽的制备方法,具体步骤如下:
[0060]
(1)1kg西洋参粉碎后,按质量体积比g/ml 1:20加入0.004mol/l 1-丁基-3-甲基咪唑四氟硼酸盐溶液,于55℃提取2h,获得西洋参粗蛋白提取液;
[0061]
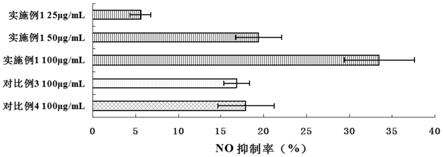
(2)取西洋参粗蛋白提取液,按体积质量比ml/g 12:0.8加入磷酸氢二钾,70khz超声震荡1h,4000r/min条件下离心10min;使液体分层,去除下层液体,上清液加入终浓度15%的聚乙二醇600,在4℃下静置24h,4000r/min离心20min,收集沉淀即得西洋参蛋白提取物。
[0062]
(3)蛋白提取物用12倍量水溶解,一级消化胃蛋白酶添加量60mg/ml、ph值2.5、nacl终浓度0.04mol/l、酶解时间2h,二级消化胰蛋白酶添加量12mg/ml、ph值8.5、kh2po4至终浓度0.08mol/l、酶解时间3h;随后按质量体积比g/ml 0.15:12加入磺基水杨酸室温放置60min,固液分离,沉淀复溶后经截取分子量范围《3kda超滤,冷冻干燥得到粉末形式保存的提取物184g。
[0063]
实施例2
[0064]
一种多功能西洋参水解肽的制备方法,具体步骤如下:
[0065]
(1)1kg西洋参粉碎后,按质量体积比g/ml 1:35加入0.01mol/l 1-丁基-3-甲基咪唑四氟硼酸盐溶液,于70℃提取0.5h,获得西洋参粗蛋白提取液;
[0066]
(2)取西洋参粗蛋白提取液,按体积质量比ml/g 15:0.8加入磷酸氢二钾,100khz超声震荡0.5h,5000r/min条件下离心5min;使液体分层,去除下层液体,上清液加入终浓度
20%的聚乙二醇200在4℃下静置48h,5000r/min离心15min,收集沉淀即得西洋参蛋白提取物。
[0067]
(3)蛋白提取物用10倍量水溶解,一级消化胃蛋白酶添加量20mg/ml、ph值4、nacl终浓度0.08mol/l、酶解时间4h,二级消化胰蛋白酶添加量4mg/ml、ph值9、kh2po4至终浓度0.12mol/l、酶解时间6h;随后按质量体积比g/ml 0.15:25加入磺基水杨酸室温放置90min,固液分离,沉淀复溶后经截取分子量范围《6kda超滤,冷冻干燥得到粉末形式保存的提取物171g。
[0068]
实施例3
[0069]
一种多功能西洋参水解肽的制备方法,具体步骤如下:
[0070]
(1)1kg西洋参粉碎后,按质量体积比g/ml 1:10加入0.001mol/l 1-丁基-3-甲基咪唑四氟硼酸盐溶液,于40℃提取4h,获得西洋参粗蛋白提取液;
[0071]
(2)取西洋参粗蛋白提取液,按体积质量比ml/g 5:0.8加入磷酸氢二钾,40khz超声震荡2h,3000r/min条件下离心15min;使液体分层,去除下层液体,上清液加入终浓度5%的聚乙二醇1000在4℃下静置12h,3000r/min离心30min,收集沉淀即得西洋参蛋白提取物。
[0072]
(3)蛋白提取物用15倍量水溶解,一级消化胃蛋白酶添加量100mg/ml、ph值1.5、nacl终浓度0.01mol/l、酶解时间0.5h,二级消化胰蛋白酶添加量20mg/ml、ph值7.5、kh2po4至终浓度0.05mol/l、酶解时间1h;随后按质量体积比g/ml 0.15:8加入磺基水杨酸室温放置30min,固液分离,沉淀复溶后经截取分子量范围《10kda超滤,冷冻干燥得到粉末形式保存的提取物176g。
[0073]
实施例4
[0074]
一种多功能西洋参水解肽的制备方法,与实施例1的不同之处在于:
[0075]
(1)离子液体为1-丁基-3-甲基咪唑六氟磷酸盐溶液;
[0076]
(2)无机盐为柠檬酸钠;
[0077]
(3)其他均与实施例1相同,得到粉末形式保存的提取物166g。
[0078]
实施例5
[0079]
一种多功能西洋参水解肽的制备方法,与实施例1的不同之处在于:
[0080]
(1)离子液体为1-辛基-3-甲基咪唑氯盐溶液;
[0081]
(2)无机盐为硫酸铵;
[0082]
(3)其他均与实施例1相同,得到粉末形式保存的提取物163g。
[0083]
对比例1
[0084]
一种多功能西洋参水解肽的制备方法,与实施例1的不同之处在于,无机盐为无水碳酸钠,其他均相同,得到粉末形式保存的提取物158g。
[0085]
对比例2
[0086]
一种多功能西洋参水解肽的制备方法,与实施例1的不同之处在于,离子液体为1-庚基-3-甲基咪唑氯盐,其他均相同,得到粉末形式保存的提取物160g。
[0087]
对比例3
[0088]
一种多功能西洋参水解肽的制备方法,具体步骤如下:
[0089]
1kg西洋参粉碎后,加入15倍量的10mmol/l tris-hcl(ph 7.4),于45℃提取2h,5000r/min离心30min,留取上清液,向上清液中加入1.5倍体积丙酮,在4℃下静置24h,收集
沉淀,酶解消化制备步骤同实施例1,得到粉末形式保存的提取物155g。
[0090]
对比例4
[0091]
一种多功能西洋参水解肽的制备方法,具体步骤如下:
[0092]
1kg西洋参粉碎后,加入20倍量的复合酶溶液(胰蛋白酶∶木瓜蛋白酶=1∶1 w/w,500u/l),37℃水解4h,5000r/min离心15min,上清液经截取分子量范围《10kda超滤,冷冻干燥得到粉末形式保存的提取物161g。
[0093]
应用试验例1
[0094]
西洋参活性肽含量检测
[0095]
(1)双缩脲溶液的配制:称取0.6g cuso4·
5h2o,溶于100ml蒸馏水中,加入1.8g酒石酸钾钠,再加入1g ki,待所加试药完全溶解后,搅拌加入6mol/l naoh溶液20ml,蒸馏水稀释至200ml,混匀备用。
[0096]
(2)绘制标准曲线:以还原型谷胱甘肽(gsh)浓度为横坐标,吸光度值为纵坐标,操作如下:向6支刻度比色试管分别加入1ml浓度分别为0.05、0.1、0.2、0.3、0.4、0.5mg/ml的gsh标准溶液,加入4ml双缩脲溶液,50℃显色20min,在540nm下测定并记录吸光度值。
[0097]
线性回归方程:y=0.617x+0.253,r2=0.9961,线性范围0.05~0.5mg/ml
[0098]
(3)活性肽含量检测:称取5mg提取物粉末,定溶至10ml,备用。吸取1ml样品溶液置刻度比色试管中,加入双缩脲试剂4ml,混合均匀,按“标准曲线”项下显色,于540nm下测定吸光度值,对照标准曲线求得样品溶液中活性肽的质量(mg),计算提取物中活性肽含量(%),见表1。
[0099]
表1活性肽含量测定结果
[0100][0101]
由表1可以得出,本发明涉及的制备方法对活性肽类目标组分具有获取量大、富集率高双重优点,本发明提供的西洋参水解肽中活性肽含量达到85%以上。
[0102]
对比例1和对比例2与实施例1相比仅对离子液体和无机盐的配比种类进行了改变,致使产物中西洋参肽含量明显下降;说明西洋参肽的高效制备只有在特定离子液体和无机盐配比的状态下效果显著。
[0103]
对比例3采用传统有机溶剂沉淀的方法对总蛋白进行制备,虽然酶解消化制备工
艺与本发明相同,但产量和活性肽成分的含量大大降低。对比例4仅采用单一的复合酶解工艺制备西洋参活性肽,同样终产物中活性肽类成分的纯度较低。结果说明本发明建立的离子液体-两级酶解技术与传统技术相比制备的西洋参水解肽产量高,纯度高,西洋参水解肽中活性肽含量达到85%以上。
[0104]
应用试验例2
[0105]
西洋参水解肽抗氧化实验
[0106]
(1)dpph
·
自由基清除实验
[0107]
取西洋参水解肽稀释成不同浓度备用。取不同浓度稀释液1ml于试管中,加入1ml 1mmol/ml dpph溶液,加无水乙醇至4ml,摇匀置暗处反应30min后,测定517nm吸光度,计算dpph
·
自由基清除率。
[0108]
dpph
·
清除率(%)=(1-aj/a0)*100%
[0109]
(aj=样品+dpph吸光度,a0=dpph+乙醇吸光度)
[0110]
(2)
·
oh自由基清除实验
[0111]
取西洋参水解肽稀释成不同浓度备用。取不同浓度稀释液1ml于试管中,依次加入2ml6mmol/l feso4溶液、2ml 6mmol/l水杨酸、2ml 6mmol/l h2o2溶液,混匀后静置30min测定510nm吸光度,计算
·
oh自由基清除率。
[0112]
·
oh清除率(%)=[1-(a
j-ai)/a0]*100%
[0113]
(aj=加入样品后吸光度,a0=空白对照吸光度,ai=不加h2o2时样品吸光度)
[0114]
(3)实验结果,见表2
[0115]
表2西洋参水解肽抗氧化活性
[0116][0117]
由表2可以看出,实施例1两组实验的ic
50
分别为0.3519mg/ml和0.4993mg/ml,与对比例3和对比例4相比显现出更为优异的自由基清除能力,尤其
·
oh自由基实验差异较为显著。上述实验结果表明,本发明提供的离子液体-两级酶解工艺与传统工艺相比可以获得抗氧化能力更为高效的西洋参水解肽,这可能与其终产物中目标成分的纯度较高有关。
[0118]
应用试验例3
[0119]
西洋参水解肽抗炎实验
[0120]
(1)将raw264.7细胞接于96孔板(1
×
105个/ml),实验分组如下:空白对照组(dmem培养液)、模型组(1μg/ml lps)、实施例1低中高浓度给药组(25、50、100μg/ml+1μg/ml lps)、对比例3给药组(100μg/ml+1μg/ml lps)和对比例4给药组(100μg/ml+1μg/ml lps),每组设3个复孔。
[0121]
(2)37℃、5%co2恒温培养箱中培养24h后,吸取培养液上清液100μl转移到酶标板中,按照no试剂盒说明书步骤用酶标仪在540nm下测定od值,计算西洋参水解肽对no释放的抑制率。
[0122]
(3)实验结果如图1所示,一氧化氮(no)作为重要的,具有多种生物活性的细胞间
通讯物质,在调节血管扩张和炎性免疫反应等其他病理生理过程中扮演着重要角色。当机体发生炎症后,可显著上调一氧化氮合酶(inos)的蛋白表达量,进而可诱导生成大量no,引发后续相关病理反应。因此,如何有效阻断合成no的路径是调节炎症反应的重要方法之一。
[0123]
实施例1高浓度组(100μg/ml)显示出最强的抑制no释放作用,其抑制率可达33.5%。对比例3和对比例4给药组在100μg/ml浓度下no的抑制率仅分别为16.8%和17.9%。因此,由本发明获得的西洋参水解肽可以高效调控lps诱导的相关炎症介质或炎症因子表达,进而在小鼠巨噬细胞raw 264.7发挥抗炎作用。
[0124]
应用试验例4
[0125]
西洋参水解肽免疫调节实验
[0126]
(1)雌雄各半昆明小鼠42只,体重18~22g,随机分7组,每组6只,设置空白对照组、模型组、实施例1低中高剂量组、对比例3给药组和对比例4给药组。每组受试动物灌胃给药7d,1天1次,每次0.2ml/10g。空白对照组和模型组给予等体积生理盐水,实施例1低中高剂量组剂量分别为50mg/10g、100mg/10g、250mg/10g,对比例3给药组和对比例4给药组剂量为250mg/10g。第4d除空白组外,其余各组每只小鼠腹腔注射环磷酰胺。
[0127]
(2)在实验第4d给每只小鼠腹腔内注射淀粉肉汤l ml,给药期结束后给每只小鼠腹腔注射1%鸡红细胞l ml,30min后再腹腔注射生理盐水l ml,然后颈椎脱臼处死小鼠吸取腹腔液,滴于载玻片上甲醇:丙酮(1:1,v:v)固定5min,giemsa染色,油镜下观察50个巨噬细胞,按以下公式计算吞噬率和吞噬指数(一个巨噬细胞可吞噬数个鸡红细胞)。
[0128]
吞噬率/100%=(吞噬鸡红细胞的巨噬细胞数/50个巨噬细胞数)
×
100%
[0129]
吞噬指数/100%=(被吞噬的鸡红细胞总数/50个巨噬细胞数)
×
100%
[0130]
(3)实验结果,见表3
[0131]
表3西洋参水解肽对小鼠腹腔吞噬鸡红细胞的影响
[0132][0133][0134]
与模型组相比*(p《0.05),**(p《0.01)
[0135]
巨噬细胞受刺激后活化,可使其吞噬功能明显增强。巨噬细胞具有活跃的吞噬功
能,能清除体内抗原物质及变性的细胞,在特异性及非特异性免疫中均起重要作用。实施例1组与正常对照组比较,对小鼠腹腔巨噬细胞的吞噬指数表现为:中剂量组、高剂量组作用极显著(p《0.01),具有统计学差异;对小鼠腹腔巨噬细胞的吞噬率表现为:中剂量组显著(p《0.05)、高剂量组作用极显著(p《0.01),具有统计学差异。与对比例3和对比例4实验结果相比,实施例1持续用药7d能更好的加强小鼠腹腔巨噬细胞的吞噬功能。
[0136]
应用试验例5
[0137]
西洋参水解肽对ace抑制实验
[0138]
(1)用50mmol/l tris-hcl缓冲液(含300mmol/l nacl,ph值7.5)将实施例1样品稀释至0.25mg/ml、0.5mg/ml、1.25mg/ml,将对比例3和对比例4样品分别稀释至1.25mg/ml。在96孔板中每孔加入40μl血管紧张素转换酶(ace溶液,0.25units/ml)和10μl样品溶液,37℃反应10min。随后加入150μl的n-[3-丙烯酰]-l-苯丙氨酰-甘氨酰-甘氨酸溶液(fapgg-tris-hcl,0.88mmol/l)进行检测。空白对照加入10μl的tris-hcl缓冲液代替样品溶液,阳性对照组卡托普利浓度50μg/ml;另设置实施例1联合给药组、对比例3联合给药组和对比例4联合给药组(样品50μg/ml+卡托普利25μg/ml)。
[0139]
(2)在340nm波长处监测ace降解fapgg引起的吸光度衰减,ace活性表示为此吸光度处下降的斜率,记录40min内活性肽的抑制性能。抑制率计算公式为:ace抑制率(%)=(1-δa样品/δa空白)
×
100%。
[0140]
(3)实验结果如图2所示。测试浓度下实施例1给药组的ace抑制效果呈现剂量效应关系,反应浓度250μg/ml时表现出最强的ace抑制作用,抑制率可达到77.2%,与卡托普利阳性对照组的效果相当。而在此浓度下,对比例3和对比例4的ace抑制指标相对实施例1较弱,抑制率仅为60.3%和55.6%。低剂量的卡托普利和实施例1样品联合给药也会带来优异的ace抑制效果,抑制率高达86.1%,明显高于同等剂量对比例3和对比例4联合用药效果,甚至优于卡托普利或实施例1高浓度单独给药结果。因此,本发明提供的离子液体-两级酶解制备技术可以获得ace抑制效果更为显著的西洋参水解肽,且与传统ace类降压药可能存在协同增效作用。血管压力由肾素-血管紧张素系统调节,肾素促进血管紧张素i的产生,在血管紧张素转化酶(ace)的作用下转化为血管紧张素ii。本发明涉及的西洋参活性肽样品可以阻碍有升高血压作用的血管紧张素ii的生成,从而达到治疗高血压症状的效果。
[0141]
应用试验例6
[0142]
西洋参水解肽降血糖实验
[0143]
(1)取10μl不同浓度西洋参水解肽样品溶液与45μl 5u/mlα-葡萄糖苷酶磷酸盐溶液(0.2mol/l,ph 5.0),振荡混匀后置于55℃培养箱,使其反应10min。然后加入35μl 5mmol/l 4-硝基苯-α-d-吡喃葡萄糖苷(pnpg)溶液启动反应,并置于55℃培养箱孵育30min。加入100μl 0.2mol/l na2co3溶液终止反应,于405nm处测定其吸光值。以pbs溶液替代α-葡萄糖苷酶溶液测定样品空白,以pbs溶液替代样品测定酶液空白。并按照下列公式计算抑制率:
[0144]
α-葡萄糖苷酶抑制率(%)=[1
–
(c-d)/(a-b)]
×
100%
[0145]
式中:a,α-葡萄糖苷酶溶液吸光度;b,空白吸光度;c:反应混合溶液吸光度;d:样品吸光度。
[0146]
(2)将100μl不同浓度西洋参水解肽样品溶液分别与200μlα-淀粉酶溶液
(16.67nkat/ml)在37℃下预混合10min,加入400μl 1g/ml可溶性淀粉溶液37℃下反应15min,反应结束后添加400μl dns试剂终止,混合物在沸水浴中加热5min,冰水浴冷却30min,于540nm处测定其吸光度。等体积磷酸盐缓冲液(0.1mol/l,ph值6.8)代替α
–
淀粉酶溶液作对照组,按照下列公式计算抑制率:
[0147]
α-淀粉酶抑制率(%)=(1
–
a0/a)
×
100%
[0148]
式中:a0为对照组的吸光度,a为样品组的吸光度。
[0149]
(3)实验结果,见表4
[0150]
表4西洋参水解肽对α-葡萄糖苷酶和α-淀粉酶活性抑制效果
[0151][0152][0153]
与阿卡波糖组相比*(p《0.05)
[0154]
α-葡萄糖苷酶和α-淀粉酶是机体内消化的一种关键酶,对碳水化合物的分解代谢起到了非常重要的作用。在酶的催化下葡萄糖经小肠进入血液,与糖尿病患者的餐后的血糖水平有重要关联。由表4可知,实施例1组随浓度的增大α-葡萄糖苷酶和α-淀粉酶活性的抑制率均显著上升,浓度150μg/ml时其抑制率分别为42.5%和27.2%。实验结果对比显示,实施例1对两种糖苷酶的抑制效果要明显好于对比例3和对比例4组,且实施例1高浓度下对α
–
葡萄糖苷酶活性的抑制效果甚至优于阿卡波糖阳性组。实施例1与阿卡波糖联合给药对α-葡萄糖苷酶的抑制效果63.2%显著优于对比例联合给药测试组的抑制效果38.6%、36.1%,实施例1与阿卡波糖联合给药对α-淀粉酶的抑制效果55.7%显著优于对比例联合给药测试组的抑制效果35.3%、38.4%,且与单独阿卡波糖给药相比呈现显著差异(p《0.05),显现协同增效作用。本发明涉及的西洋参活性肽可以通过高效的α-葡萄糖苷酶和α-淀粉酶抑制活性发挥降血糖的功效,由于其具有天然活性成分来源的特点,临床可作为辅助膳食补充剂来使用,具有广阔的开发前景。
[0155]
综上,本发明建立了离子液体富集-两级仿生酶解西洋参水解肽制备技术。该技术具有目标组分获取量大、富集率高双重优点,活性肽含量达到85%以上;工艺流程绿色安全、操作简单,便于规模化放大生产。此外,所得的西洋参水解肽产品具有多项优于传统制备工艺的功能活性,如免疫调节、降血压、降血糖、抗炎、抗氧化等,且药效学实验显示采用联合用药的方式对部分症状具有协同增效的作用,因此可作为有效成分在功能食品、保健品乃至药品中的应用,适用于各种常规剂型,易于广大消费者所接受。
[0156]
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
