一种单细胞表观转录组学测序方法
1.本技术是中国专利申请202011057632.3的分案申请,原申请202011057632.3的申请日为2020年9月29日,发明名称为“空间组学测序、单细胞表观转录组学测序及定位标识方法”。
技术领域
2.本公开涉及基因测序技术领域,具体涉及一种单细胞表观转录组学测序方法。
背景技术:
3.空间异质性是器官功能的关键特征,细胞的位置信息对细胞调控机制和细胞谱系发生过程的研究十分重要。传统的基因测序在组织样本或细胞群的整体上进行,细胞之间的差异可能因平均化被掩盖,单细胞测试技术可以在单细胞层面揭示每个细胞的基因信息,使不同的细胞类型得以区分。但是仍然缺乏揭示细胞在组织体内原有位置信息的能力。因此,需要一种保留细胞原有空间位置信息的测序方法。
技术实现要素:
4.为了解决相关技术中的问题,本公开实施例提供一种单细胞表观转录组学测序方法。
5.本公开实施例中提供了一种单细胞表观转录组学测序方法。
6.具体地,所述单细胞表观转录组学测序方法,包括:
7.对样品进行预处理;
8.向预处理后的样品中加入目标蛋白的配偶体,使所述目标蛋白的配偶体与所述目标蛋白相结合;
9.将所述样品与包含barcode a的第一物质和包含barcode b的第二物质进行孵育反应,所述第一物质和第二物质还包括tn5和目标蛋白配偶体结合物质,所述目标蛋白配偶体结合物质用于结合所述目标蛋白配偶体,所述tn5打断所述样品的cdna形成cdna片段,同时在该cdna片段上添加barcode a和barcode b,然后依序进行细胞裂解、cdna扩增及建库测序。
10.可选地,所述对样品进行预处理包括:
11.所述样品中细胞的固定;
12.使用引物对所述样品中的rna进行反转处理;
13.以及包括可选的在固定后使用消化试剂对所述样品的dna进行消化的步骤。
14.可选地,所述目标蛋白配偶体选自抗体、抗体fc片段;所述目标蛋白配偶体结合物质选自protein a、protein g、fc受体蛋白。
15.本公开实施例提供的技术方案可以包括以下有益效果:
16.本公开实施例的单细胞表观转录组学测序方法,对样品进行预处理;向预处理后的样品中加入目标蛋白的配偶体,使所述目标蛋白的配偶体与所述目标蛋白相结合;将所
述样品与包含barcode a的第一物质和包含barcode b的第二物质进行孵育反应,所述第一物质和第二物质还包括tn5和目标蛋白配偶体结合物质,所述目标蛋白配偶体结合物质用于结合所述目标蛋白配偶体,所述tn5打断所述样品的cdna形成cdna片段,同时在该cdna片段上添加barcode a和barcode b,然后依序进行细胞裂解、cdna扩增及建库测序,从而实现了对组织样品的单细胞表观转录组检测。
17.应当理解的是,以上的一般描述和后文的细节描述仅是示例性和解释性的,并不能限制本公开。
附图说明
18.结合附图,通过以下非限制性实施方式的详细描述,本公开的其它特征、目的和优点将变得更加明显。在附图中:
19.图1示出根据本公开实施例的微流控芯片的结构示意图;
20.图2a示出根据本公开实施例的第一芯片的结构示意图;
21.图2b示出根据本公开实施例的第二芯片的结构示意图;
22.图3示出根据本公开实施例的空间组学测序方法的流程示意图;
23.图4为空间转录组测序中交叉定位标识的编码序列结构图;
24.图5为空间蛋白组测序中交叉定位标识的编码序列结构图;
25.图6为空间表观组测序中交叉定位标识的编码序列结构图;
26.图7为空间表观转录组测序中交叉定位标识的编码序列结构图;
27.图8示出根据本公开实施例的载玻片上的定位标识方法的流程示意图;
28.图9示出根据本公开实施例的单细胞表观转录组学测序方法的流程示意图。
具体实施方式
29.下文中,将参考附图详细描述本公开的示例性实施例,以使本领域技术人员可容易地实现它们。此外,为了清楚起见,在附图中省略了与描述示例性实施例无关的部分。
30.在本公开中,应理解,诸如“包括”或“具有”等的术语旨在指示本说明书中所公开的特征、数字、步骤、行为、部件、部分或其组合的存在,并且不欲排除一个或多个其他特征、数字、步骤、行为、部件、部分或其组合存在或被添加的可能性。
31.另外还需要说明的是,在不冲突的情况下,本公开中的实施例及实施例中的特征可以相互组合。下面将参考附图并结合实施例来详细说明本公开。
32.术语配偶体是指与感兴趣的蛋白结合的分子,包括抗体、适体、抗原结合片段,所述抗体包括完整抗体、重组抗体或抗体片段,如抗体fc片段、fab片段,scfv,所述抗体为igm、igg、iga、igd、ige中的任一种。
33.实施例一
34.本公开实施例提供的空间组学测序方法采用了微流控芯片技术,图1示出根据本公开实施例的微流控芯片的结构示意图。图2a示出根据本公开实施例的第一芯片的结构示意图。图2b示出根据本公开实施例的第二芯片的结构示意图。如图1、图2a、图2b所示,所述微流控芯片10包括:第一芯片11、第二芯片12和第三芯片13。所述第一芯片11包括:进样孔111、出样孔112、连通进样孔111和出样孔112的微流体通道113。所述出样孔112的数量小于
进样孔111的数量,并将至少两个以上与进样孔111分别连通的微流体通道113与同一个出样孔112连通,在同样面积的芯片上增加了进样孔111和微流体通道113的数量。
35.第一芯片11上设置有样品标记区域a,该区域具有平行设置的微流体通道113。本公开实施例提供的空间测序方法可以使用第一芯片11独立完成,使用时,第一芯片11的样品标记区域a覆盖样品切片,微流体通道113与样品切片是连通的,向进样孔111加入包括不同barcode(条形码)的物质后,通过抽吸出样孔112的方式可以使其顺利流向样品标记区域,与该区域内的样品切片进行反应,从而在样品切片的细胞物质上添加barcode。
36.所述第二芯片12可以与第一芯片11键合在一起作为一个芯片使用,也可以分体设置,使用时,将第二芯片12叠加在第一芯片11上使用。所述第一芯片11的材质通常是聚二甲基硅氧烷,该材质较软容易在加样时被枪头吸附,第二芯片12可以采用相对第一芯片11较硬的材质,例如聚甲基丙烯酸甲酯,二者配合使用,第二芯片12起到保护作用,避免加样时枪头与第一芯片11直接接触,从而能够有效避免因枪头吸附导致第一芯片11与样品切片所在的载玻片脱离,防止第一芯片11不同进样孔111加入的独立试剂发生混和引起实验失败,还可以与排枪或者自动化移液工作站配合,实现加样的自动化。
37.具体地,所述第二芯片12上开设有第一通孔121,第一通孔121的位置与第一芯片11上的进样孔111、出样孔112的位置相对应。所述第二芯片12上还开设有防回流孔122,所述防回流孔122的位置靠近所述出样孔112,在添加barcode的过程中,可以利用硬物穿过所述防回流孔122,挤压第一芯片11上靠近出样孔附近的区域b,使得该区域b内的微流体通道113变形并完全闭塞通道,防止物质从所述出样孔112回流。反应完成后,取出硬物,被挤压的微流体通道113可自行恢复。
38.所述第三芯片13与第一芯片11配合使用,考虑到第一芯片11上增加进样孔111与微流体通道113的数量后,样品标记区域内相邻微流体通道113的间距、微流体通道113的宽度均可以设置的更小,在提高样品切片的检测通量的同时,可能会导致微流体通道113的堵塞。为了避免进样孔111加入的物质堵塞微流体通道,通过增设第三芯片13叠加在第一芯片11或第二芯片12上使用,第三芯片13以正压充气进样孔111的方式促使进样孔111加入的物质顺利流向样品标记区域。具体地,所述第三芯片13上开设有第二通孔,第二通孔的位置与第一芯片11上的出样孔112以及第二芯片12上的防回流孔122的位置相对应。所述第三芯片13上还设置有与所述进样孔111所在位置对应的镂空区域,叠加在第一芯片11或第二芯片12上形成密闭空间,该镂空区域上设置有充气孔,用于在密闭空间充气,进而在进样孔111的上方形成正压。
39.根据本公开的实施例,所述微流体通道的间距为100nm-200μm,和/或所述微流体通道的宽度为100nm-200μm。
40.例如,微流体通道的间距为10μm,微流体通道的宽度为20μm,能够实现在11cm x 11cm的芯片面积上,设置384个进样孔113,从而实现384x 384共147456种标记组合,对样品切片的有效标记率也提升至44.4%左右,且样品切片的覆盖面积也达到了11.5mm x 11.5mm的覆盖度。
41.以上为示意性说明,本公开方式中,所述进样孔的个数为10-40000个。例如采用768孔,从而实现标记768x 768共589824种组合,在微流体通道宽度20μm,微流体通道宽度间距10μm的精度下,实现覆盖23.04mm x 23.04mm的样品区域。
42.图3示出根据本公开实施例的空间组学测序方法的流程示意图。如图3所示,所述空间组学测序方法包括步骤s110-s130。
43.在步骤s110中,预处理样品切片;
44.在步骤s120中,利用微流控芯片将交叉定位标识添加至所述样品切片,其中,所述交叉定位标识为向微流控芯片的进样孔加入的包括不同barcode的物质所确定的;
45.在步骤s130中,依序对所述样品切片进行细胞裂解、扩增及建库后,根据所述交叉定位标识进行基因测序。
46.本公开实施例提供的空间组学测序方法,在预处理样品切片后,从微流控芯片的进样孔加入包括不同barcode的物质,用于形成标记细胞空间位置的交叉定位标识,然后将该交叉定位标识添加到样品切片的细胞物质(例如rna、dna或蛋白质),依序进行细胞裂解、扩增及建库后,最后进行测序和数据分析。上述测序方法利用微流控芯片加入标记细胞位置的包括不同barcode的物质,操作步骤简单,并且不限于空间转录组测序、空间蛋白组测序、空间表观组测序和空间表观转录组测序等,应用范围广。上述测试方法利用的微流控芯片,出样孔的数量少于进样孔的数量,改变了以往进样孔与出样孔连通一条微流体通道的设计,使得两个以上与进样孔分别连通的微流体通道与同一个出样孔连通,增加了进样孔和微流体通道的数量,能够形成交叉定位标识的微流体通道数量增多、间距设置也可以更小,从而提高了空间组学测序方法的检测通量以及样品的标记面积。
47.根据本公开的实施例,所述样品切片可以是胚胎组织、肿瘤组织等,本公开对此不做限制。
48.根据本公开的实施例,步骤s110中预处理样品切片包括以下方式中的至少一种:
49.样品切片的制作、样品切片的染色、样品切片的固定、样品切片的bsa封闭、样品切片的通透处理、将样品切片放置于载玻片中间的样品区域。
50.根据本公开的实施例,所述交叉定位标识由不同barcode确定,其原理是:微流控芯片的样品标记区域(该区域具有平行微流体通道)覆盖样品切片,第一组barcode a通过微流体通道,从而产生彼此平行且空间上分离的行,各行包括a
1-an标签,n为大于1的正整数;随后洗涤微流控芯片和样品,旋转微流控芯片使其垂直于第一次标记的位置放置,在微流体通道中通入第二组barcode b,从而产生彼此平行且空间上分离的列,各列包括b
1-bn标签,n为大于1的正整数。经过标记后,组织的每一个区域包括唯一复合条形码a
ibj
(i,j∈n),以此来对不同的空间区域进行标记区分。
51.根据本公开的实施例,步骤s120中所述利用微流控芯片将交叉定位标识添加至所述样品切片,包括:
52.将所述微流控芯片覆盖在样品切片上;
53.向所述微流控芯片的进样孔分别加入包含不同barcode a的第一物质,与所述样品切片进行第一反应;
54.使用缓冲液对所述样品切片进行洗涤;
55.以预定角度旋转所述微流控芯片,使得所述第一物质流经的所述微流控芯片的微流体通道的方向与旋转后的所述微流体通道的方向形成所述交叉定位标识;
56.向旋转后的所述微流控芯片的进样孔分别加入包含不同barcode b的第二物质,与所述样品切片进行第二反应。
57.根据本公开的实施例,进行第二反应操作所用的微流控芯片可以与进行第一反应的微流控芯片为同一芯片,只需在洗涤干净第一反应后的芯片后再旋转该芯片进行第二反应即可。可以理解,为了避免第一反应后微流体通道内残留液体对第二反应的影响,避免影响样品切片的标记效果,也可以采用另一新的微流控芯片操作第二反应,本公开对此不做限制。
58.下面分别对空间组学测序方法,具体是空间转录组测序、空间蛋白组测序、空间表观组测序以及空间表观转录组测序为例进行说明。
59.空间转录组测序
60.图4为空间转录组测序中交叉定位标识的编码序列结构图,其中,包含barcode a的第一物质自5’端至3’端的序列依次为:linker a序列、barcode a序列、多t序列,所述多t序列与mrna的多a序列互补结合,包含barcode b的第二物质自5’端至3’端的序列依次为:扩增序列、barcode b序列、唯一分子标识符序列(umi序列),linker b序列,所述linker a序列与linker b序列互补结合,或者所述linker a序列、linker b序列通过额外的linker序列互补结合,经过标记后,组织的每一个区域包括唯一复合条形码a
ibj
,以此来对不同的空间区域进行标记区分。
61.添加包含barcode a的第一物质进行的第一反应为反转反应,添加包含barcode b的第二物质进行的第二反应为连接反应。第一反应时加入rna barcode a、反转酶等试剂,第二反应时加入rna barcode b连接酶等试剂,具体参照现有技术,本公开对此不予赘述。
62.空间蛋白组测序
63.图5为空间蛋白组测序中交叉定位标识的编码序列结构图,与空间转录组测序中交叉定位标识的编码序列相同,同样由含有barcode a的第一物质和含有barcode b的第二物质组成,在此不予赘述。
64.在进行第一反应前,加入偶联了barcode c的配偶体与样品切片孵育,以使配偶体和样品切片上的感兴趣的蛋白结合,所述的barcode c自5’端至3’包括barcode c序列、多a序列,所述barcode c序列偶联配偶体和多a序列,所述多a序列与第一物质中的多t序列互补结合。所述偶联了barcode c的抗体可以通过微流体通道通入到样品切片上与样品切片孵育,也可通过移液器、全自动加样工作站等方式将偶联了barcode c的配偶体加入到样品切片上与组织预先孵育后,再将微流控芯片覆盖在样品切片上进行第一、第二反应。
65.空间表观组测序
66.图6为空间表观组测序中交叉定位标识的编码序列结构图。
67.空间表观组测序中,在预处理样品切片时,向样品切片加入目标蛋白的配偶体和相应的缓冲液,以使配偶体与目标蛋白结合。第一反应以及第二反应均为孵育反应,并未连接barcode a和barcode b。在第一反应中,加入的第一物质是预包埋带barcode a接头的pat混合液和相应缓冲液等试剂,在第二反应中,加入的第二物质是预包埋带barcode b接头的pat混合液和相应缓冲液等试剂。其中,pat混合液是protein a与转座酶tn5形成的融合蛋白,具有特异的抗体靶向性以及高效的dna切割和添加接头的活性,其中,protein a可以特异性识别并结合抗体的fc段,,而tn5可以高效的对dna进行切割并添加接头序列。因此,组织的基因组dna通过与pat孵育,可以得到加有特定接头的dna目的片段。第二反应一段时间后,pat打断抗体结合区的染色质得到目标dna片段,反应完成后加入适当浓度的
edta或其他可以螯合金属离子的试剂如egta等以终止pat的反应。pat中带有barcode a或b的接头序列与目标dna片段连接,从而实现在该dna片段两端添加barcode a和barcode b。
68.本公开实施例的空间组学测序方法,应用于空间表观组测序中,通过在dna片段的两端添加barcode a和barcode b,实现了高通量的空间表观组测序。
69.根据本公开的实施例,应用于空间表观组测序时,包括以下步骤:
70.冰冻或石蜡组织切片(或临近切片)的染色(可选的);
71.切片的固定(可选的);
72.若切片进行了固定,则需使用低渗缓冲液进行染色质开放处理;
73.向切片加入感兴趣蛋白的配偶体和相应缓冲液,使配偶体与组织中相应蛋白质充分结合;
74.使用洗涤缓冲液对切片进行洗涤;
75.将微流控芯片覆盖在组织切片上,向进样孔内加入预包埋tn5-barcode a的混合溶液和反应缓冲液后抽吸出样孔,至微流体通道内充满液体后孵育适当时间;所述tn5-barcode a还包括配偶体结合物质,所述配偶体结合物质用于结合所述目标蛋白配偶体;
76.移除微流控芯片并洗涤组织后,将芯片旋转90度后再次覆盖在组织上,向进样孔内加入预包埋tn5-barcode b的混合溶液和反应缓冲液抽吸出样孔,至微流体通道内充满液体后孵育适当时间;所述tn5-barcode b还包括配偶体结合物质,所述配偶体结合物质用于结合所述目标蛋白配偶体;
77.利用tn5打断所述样品的染色质形成dna片段;
78.向进样孔内加入适当浓度的edta或其他可以螯合金属离子的试剂如egta等后抽吸出样孔,至微流体通道内充满液体后置于相应温度下反应适当时间以终止反应。
79.使用裂解液将组织进行解离,用于后续cdna纯化扩增及建库测序。
80.在一个实施例中,所述含有配偶体结合物质的tn5-barcode a为配偶体结合物质与转座酶tn5形成的融合蛋白预包埋barcode a接头;所述含有配偶体结合物质的tn5-barcode b为配偶体结合物质与转座酶tn5形成的融合蛋白预包埋barcode b接头;
81.在一个实施例中,所述配偶体选自抗体、抗体fc片段;所述配偶体结合物质选自protein a、protein g、fc受体蛋白。
82.空间表观转录组测序
83.图7为空间表观转录组测序中交叉定位标识的编码序列结构图,与空间转录组测序中交叉定位标识的编码序列相同,同样由barcode a和barcode b组成,在此不予赘述。需要说明的是,预处理样品切片时,需对rna利用oligo dt或随机引物进行反转处理得到cdna,之后向样品切片加入目标蛋白的抗体和相应的缓冲液,以使抗体与目标蛋白结合,具体参照空间表观组测试的技术内容,在此不予赘述。另外,为了避免样品切片中原始dna对反转录得到的cdna的影响,还可以利用dnase i(脱氧核糖核酸酶i)对原始dna进行消化处理,之后再进行rna的反转处理。本公开实施例的空间组学测序方法,应用于空间表观转录组测序中,通过在cdna片段的两端添加barcode a和barcode b,实现了高通量的空间表观转录组测序。
84.根据本公开的实施例,应用于空间表观转录组测序时,包括以下步骤:
85.冰冻或石蜡组织切片(或临近切片)的染色(可选的);
86.切片的固定(可选的);
87.使用dnase i对基因组dna进行消化(可选的);
88.使用oligo dt或随机引物进行对rna进行反转处理;
89.向切片加入感兴趣蛋白的配偶体和相应缓冲液,使配偶体与组织中相应蛋白质充分结合;
90.使用洗涤缓冲液对切片进行洗涤;
91.将微流控芯片覆盖在组织切片上,向进样孔内加入预包埋tn5-barcode a的混合溶液和反应缓冲液后抽吸出样孔,至微流体通道内充满液体后孵育适当时间;所述tn5-barcode a还包括配偶体结合物质,所述配偶体结合物质用于结合所述目标蛋白配偶体;
92.移除微流控芯片并洗涤组织后,将芯片旋转90度后再次覆盖在组织上,向进样孔内加入预包埋tn5-barcode b的混合溶液和反应缓冲液后抽吸,至微流体通道内充满液体后孵育适当时间;所述tn5-barcode b还包括配偶体结合物质,所述配偶体结合物质用于结合所述目标蛋白配偶体;
93.利用tn5打断所述样品的染色质形成dna片段;
94.向进样孔内加入适当浓度的edta或其他可以螯合金属离子的试剂如egta等后抽吸,至微流体通道内充满液体后置于相应温度下反应适当时间以终止反应。
95.使用裂解液将组织进行解离,用于后续cdna纯化扩增及建库测序。
96.在一个实施例中,所述含有配偶体结合物质的tn5-barcode a为配偶体结合物质与转座酶tn5形成的融合蛋白预包埋barcode a接头;所述含有配偶体结合物质的tn5-barcode b为配偶体结合物质与转座酶tn5形成的融合蛋白预包埋barcode b接头;
97.在一个实施例中,所述配偶体选自抗体、抗体fc片段;所述配偶体结合物质选自protein a、protein g、fc受体蛋白。
98.根据本公开的实施例,所述空间组学测序方法还包括步骤s140-s150。
99.在步骤s140中,在进行所述第一反应和/或第二反应的过程中,利用正压充气所述微流控芯片的进样孔和/或负压抽吸所述微流控芯片的出样孔的方式,促使所述第一物质和/或第二物质顺利进入样品标记区域;其中,所述样品标记区域为所述微流控芯片覆盖所述样品切片的区域,该区域具有平行设置的所述微流体通道;
100.在本公开方式中,为了避免微流体通道的堵塞,可以在负压抽吸出样孔的同时,结合正压充气进样孔的方式,使得加入的第一物质和/或第二物质能够顺利进入样品标记区域。
101.在步骤s150中,利用硬物穿过所述出样孔附近的防回流孔挤压所述微流体通道,防止所述第一反应和/或第二反应的过程中,所述第一物质和/或第二物质从所述微流控芯片的出样孔回流。
102.在本公开方式中,通过挤压微流体通道使其变形并完全闭塞通道,以防止出样孔流出的物质回流,同时也可以使第一物质和/或第二物质与样品切片的细胞物质充分进行反应,待反应完成后,取出硬物,被挤压的微流体通道可自行恢复。
103.实施例1:空间转录组测序方法包括如下步骤:
104.1、切片的固定(可选的):取新鲜或-80℃储存的7um新生小鼠脑组织切片,首先使用300ul 1xpbs(磷酸盐缓冲液)洗涤10min,再使用300ul4%甲醛(1xpbs配置)固定20min;
105.2、冰冻或石蜡组织切片(或临近切片)的染色(可选的):将组织切片依次置于100%无水乙醇脱水20s,75%乙醇脱水1.5min,然后加入1%甲酚紫染色液染色2min,而后75%乙醇瞬时冲洗,100%无水乙醇瞬时冲洗,而后晾干拍照。
106.3、切片的bsa封闭(可选的):向组织切片上加上300ul1%bsa(1xpbs+1%rnase inhibitor(ri)配置),室温孵育30min后用300ul1xpbs洗涤3分钟。
107.4、切片的通透处理(可选的):向组织切片上加上300ul0.5%tritonx-100(1xpbs+1%ri配置),室温孵育10min后用300ul 1xpbs洗涤10min,最后待组织切片室温晾干后,将组织切片与微流控芯片进行贴合,并用夹具将其固定。
108.5、组织rna的反转录:向每个进样孔中单独加入5ul含有特异性rna barcode a的反转液并缓慢抽吸出样孔,以使液体充满微流体通道,其中反转液包含:1x maxima h minus rt buufer,500um dntp,0.3u/ul superasein rnase inhibitor,0.3u/ul rnase inhibitor,0.05xpbs,rnase free h2o,20u/ul maxima h reverse transcriptase及3um rna barcode a。随后先置于室温反应30min,再置于42℃反应90min,最后将反转液缓慢抽干后向每个进样孔加入8ul 1x neb buffer 3.1+0.5%ri,缓慢抽吸洗涤10min。
109.6、组织rna的连接:将微流控芯片旋转90度后再次覆盖在组织切片上。向每个进样孔中单独加入5ul含有特异性rna barcode b的连接液并缓慢抽吸出样孔,以使液体充满微流体通道,其中连接液包含:1x t4dna ligase buffer,0.3u/ul rnase inhibitor,0.1u/ul superasein rnase inhibito,0.1%tritonx-100,rnase free h2o,0.5x neb buffer 3.1,16u/ul t4dna ligase及6um rna barcode b。随后先置于室温反应30min,将连接液剩余部分缓慢抽干,而后向每个进样孔加入10ul 0.1%triton x-100+0.5%ri,缓慢抽吸洗涤10min后移去微流控芯片。
110.7、组织裂解:向组织切片中加入200ul裂解液,其中裂解液包含:10mm tris(ph8.0),200mm nacl,50mm edta(ph8.0),2.2%sds,water及1xpbs。反复吹打后将裂解液回收至1.5ml ep管中,置于55℃金属浴600rpm裂解2h,随后取出并置于-80℃保存。
111.8、样品与链霉亲和素磁珠(myone c1 beads)的结合:向200ul样品裂解液中加入100ul洗涤好的c1 beads,室温旋转孵育30min。由于rna barcode b的5’端带有生物素修饰,因此可以使用链霉亲和素的磁珠对样品cdna进行富集。
112.9、结合样品cdna的模板转换(template switch):首先对结合样品cdna的磁珠进行洗涤。将配置好的共110ul模板转换液加入结合样品cdna的c1磁珠中混匀,其中模板转换液包含:1x maxima h minus rt buufer,1mm dntp,1u/ul rnase inhibitor,rnase free h2o,5u/ul maxima h reverse transcriptase及2.5um template switch oligo(tso)。随后室温旋转孵育30min,最后42℃旋转孵育1h。
113.10、样品cdna的扩增:向模板转换后的c1磁珠中加入120ul的cdna扩增缓冲液,其中cdna扩增缓冲液包含:1x kapa hifi master mix,0.4um上游扩增引物,0.4um下游扩增引物及water。随后混匀后均分成两管并置于pcr仪中进行扩增。
114.11、扩增dna产物的片段筛选:向120ul扩增产物中加入84ul kapa pure beads后混匀,静置5分钟以结合dna。而后置于磁力架,使用200ul85%乙醇洗涤2次,室温晾干3min,最后使用20ul rnase free water从磁珠上将dna进行洗脱。
115.12、将分选洗脱的dna使用dna library prep kit v2 for illumina
switch oligo(tso)。随后室温旋转孵育30min,最后42℃旋转孵育1h。
127.11、抗体barcode c的扩增:向模板转换后的c1磁珠中加入120ul的扩增缓冲液,其中扩增缓冲液包含:1x kapa hifi master mix,0.4um上游扩增引物,0.4um下游扩增引物及water。随后混匀后均分成两管并置于pcr仪中进行扩增。
128.12、扩增dna产物的片段筛选:向120ul扩增产物中加入84ul kapa pure beads后混匀,静置5分钟以结合dna。而后置于磁力架,将上清吸出至新的ep管,加入108ul kapa pure beads,静置5分钟以结合dna。而后置于磁力架,弃上清,使用200ul 85%乙醇洗涤2次,室温晾干3min,最后使用20ul rnase free water从磁珠上将dna进行洗脱。
129.13、将分选洗脱的dna使用相关建库试剂盒参照商家产品说明进行建库测序。
130.实施例二
131.图8示出根据本公开实施例的载玻片上的定位标识方法的流程示意图。如图8所示,所述空间组学测序方法包括步骤s210-s240。
132.在步骤s210中,对载玻片进行预处理;
133.在步骤s210中,向微流控芯片的进样孔加入包含barcode a的第一物质,与所述载玻片进行第一反应;
134.在步骤s230中,以预定角度旋转所述微流控芯片,使得所述第一物质流经的所述微流控芯片的微流体通道的方向与旋转后的所述微流体通道的方向形成所述交叉定位标识;
135.在步骤s240中,向旋转后的所述微流控芯片的进样孔加入包含barcode b的第二物质,与所述载玻片上进行过第一反应的第一物质进行第二反应;其中,所述barcode a和barcode b用于标记在所述载玻片上形成的所述交叉定位标识。
136.本公开实施例的载玻片上的定位标识方法,通过将barcode a和barcode b连接在载玻片上,获得一个具有多种barcode组合的芯片,制作好的芯片可以放置于-80℃备用,具体可以运用于空间转录组、空间蛋白组、空间表观组、空间表观转录组等测序方面。
137.根据本公开的实施例,所述对载玻片进行预处理包括:在载玻片的样品区域涂覆纳米金颗粒、链霉亲和素或氨基修饰中的一种,使所述修饰区域覆盖样品区域。
138.根据本公开的实施例,第一物质可以是包含rna barcode a和核酸偶联剂等混合液,以使rna barcode a和载玻片之间进行偶联,其中,若载玻片上修饰纳米金颗粒,则rna barcode a的5’端可进行巯基修饰,若载玻片上为氨基修饰,则rna barcode a的5’端可进行羧基修饰;若载玻片上修饰链霉亲和素,则rna barcode a的5’端可进行生物素修饰。第二物质可以是包含预先与linker连接序列退火的rna barcode b和连接酶等的混合液,以使rna barcode b与rna barcode a在linker连接序列和连接酶的帮助下进行连接。
139.通过上述修饰,能够将barcode稳定的固定于载玻片上,避免了洗涤过程中barcode被洗涤液冲走而带来的标记损失;通过链霉素和生物素的相互作用将更多的barcode标记于载玻片上,提高了标记通量。
140.根据本公开的实施例,所述载玻片上的定位标识方法还包括步骤s250-s260。
141.在步骤s250中,在进行所述第一反应和/或第二反应的过程中,利用负压抽吸所述微流控芯片的出样孔的方式,促使所述第一物质和/或第二物质顺利进入载玻片标记区域;其中,所述载玻片标记区域为所述微流控芯片覆盖所述载玻片的中心区域,该区域具有平
行设置的微流体通道;
142.在本公开方式中,为了避免微流体通道的堵塞,可以在负压抽吸出样孔的同时,结合正压充气进样孔的方式,使得加入的第一物质和/或第二物质能够顺利进入样品标记区域。
143.在步骤s260中,利用硬物穿过所述出样孔附近的防回流孔挤压所述微流体通道,防止所述第一反应和/或第二反应的过程中,所述第一物质和/或第二物质从所述微流控芯片的出样孔回流。
144.在本公开方式中,通过挤压微流体通道使其变形并完全闭塞通道,以防止出样孔流出的物质回流,同时也可以使第一物质和/或第二物质与样品切片的细胞物质充分进行反应,待反应完成后,取出硬物,被挤压的微流体通道可自行恢复。
145.下面说明载玻片上的定位标识的具体实验流程如下:
146.1、在载玻片样品区域涂覆纳米金颗粒、链霉亲和素或者对载玻片样品区域进行氨基修饰;
147.2、将微流控芯片覆盖在载玻片上,向进样孔加入巯基、生物素或羧基修饰的barcode a,使其通过纳米金(巯基修饰)、链霉亲和素(生物素修饰)或者氨基修饰(羧基修饰)偶联到玻片上;
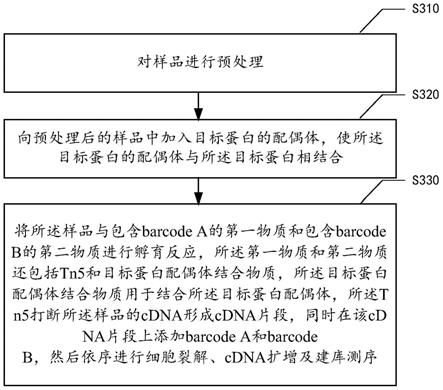
148.3、洗涤去除多余的未结合的barcode a;
149.4、将微流控芯片旋转90度后再次覆盖在载玻片上,向进样孔内加入包含barcode b和t4连接酶的混合液,使barcode b与barcode a进行连接;
150.5、洗涤去除多余的未结合的barcode b;
151.6、将制作好的barcode芯片置于-80℃,以备使用。
152.实施例三
153.图9示出根据本公开实施例的单细胞表观转录组学测序方法的流程示意图。如图9所示,所述表观转录组学测序方法包括步骤s310-s330。
154.在步骤s310中,对样品进行预处理;
155.在步骤s320中,向预处理后的样品中加入目标蛋白的配偶体,使所述目标蛋白的配偶体与所述目标蛋白相结合;
156.在步骤s330中,将所述样品与包含barcode a的第一物质和包含barcode b的第二物质进行孵育反应,所述第一物质和第二物质还包括tn5和目标蛋白配偶体结合物质,所述目标蛋白配偶体结合物质用于结合所述目标蛋白配偶体,所述tn5打断所述样品的cdna形成cdna片段,同时在该cdna片段上添加barcode a和barcode b,然后依序进行细胞裂解、cdna扩增及建库测序。
157.本公开实施例提供的表观转录组学测序可以应用于单细胞测序,同时也可以结合微流控芯片应用于空间表观转录组学测序,通过在cdna片段的两端添加barcode a和barcode b,从而实现了对组织样品的单细胞表观转录组检测。
158.根据本公开的实施例,步骤s310中所述对样品进行预处理包括:
159.所述样品中细胞的固定;
160.使用引物对所述样品中的rna进行反转处理;
161.以及包括可选的在固定后使用消化试剂对基因组dna进行消化的步骤。
162.根据本公开的实施例,应用于单细胞表观转录组空间组学测序时,包括以下步骤:
163.将细胞固定于载玻片上;
164.可选的包括使用消化试剂对基因组dna进行消化的步骤;
165.使用引物对所述细胞的rna进行反转处理;
166.向预处理后的细胞中加入感兴趣蛋白的配偶体,使所述感兴趣蛋白的配偶体与所述感兴趣蛋白充分结合;
167.使用洗涤缓冲液对细胞进行洗涤;
168.向细胞中加入预包埋tn5-barcode a和tn5-barcode b的混合溶液和反应缓冲液进行孵育;所述tn5-barcode a、tn5-barcode b还包括配偶体结合物质,所述配偶体结合物质用于结合所述目标蛋白配偶体;
169.所述tn5打断所述样品的染色质形成dna片段,反应完成后加入适当浓度的edta或其他可以螯合金属离子的试剂如egta等以终止反应,同时在该dna片段上添加barcode a和barcode b,然后依序使用裂解液将细胞裂解、cdna扩增及建库测序。
170.在一个实施例中,所述含有配偶体结合物质的tn5-barcode a为配偶体结合物质与转座酶tn5形成的融合蛋白预包埋barcode a接头;所述含有配偶体结合物质的tn5-barcode b为配偶体结合物质与转座酶tn5形成的融合蛋白预包埋barcode b接头;
171.在一个实施例中,所述配偶体选自抗体、抗体fc片段;所述配偶体结合物质选自protein a、protein g、fc受体蛋白。
172.以上描述仅为本公开的较佳实施例以及对所运用技术原理的说明。本领域技术人员应当理解,本公开中所涉及的发明范围,并不限于上述技术特征的特定组合而成的技术方案,同时也应涵盖在不脱离所述发明构思的情况下,由上述技术特征或其等同特征进行任意组合而形成的其它技术方案。例如上述特征与本公开中公开的(但不限于)具有类似功能的技术特征进行互相替换而形成的技术方案。
