枳转录因子ptrahl及其在植物抗寒遗传改良中的应用
技术领域
1.本发明属于植物基因工程领域,具体涉及枳转录因子ptrahl及其在植物抗寒遗传改良中的应用,申请人从枳(poncirus trifoliata)中分离、克隆得到两个转录调控因子ptrahl14和ptrahl17,将两个基因在不抗寒植株中分别超表达,获得的转基因植株抗寒性明显提高。
背景技术:
2.低温胁迫对植物生长和发育产生不利影响,极大地限制了植物地理分布和作物经济产量(ding et al.,2020)。低温会影响细胞膜的稳定性,降低酶活性,产生活性氧,导致细胞代谢紊乱,最终延缓植株生长,严重时导致植株死亡(barnes et al.,2016)。植物已经进化出一套复杂的适应机制来感知低温信号并通过触发各种信号转导途径做出反应,最终帮助它们维持细胞渗透稳态以获得更好的耐寒性(nagele et al.,2012)。此外,在低温胁迫下,植物一方面可以通过调节体内代谢过程,积累一系列可作为渗透保护剂的相容性化合物,调节渗透平衡,另一方面也可通过抗氧化剂防御系统的增强,提高活性氧的清除能力,从而增强植株抗寒性(chen et al.,2019)。
3.植物低温应答分子主要分为两类,一类是功能蛋白(lea蛋白等),可直接参与胁迫应答;另一类是调节性分子(转录因子,蛋白激酶等),可调控逆境信号转导和相关胁迫响应基因的表达,提高植物抗寒性(zhu,2016)。转录因子作为一类调控基因,通过与真核基因启动子区域的顺式作用元件结合来调控一些不同抗性基因的表达,以此产生逆境胁迫应答,提高植物抗性。因此,利用转录因子来提高植物的抗寒能力可达到事半功倍的效果(nakashima et al.,2014)。
4.at钩基序核定位(ahl)家族是植物特有的一种转录因子家族,在生长发育和胁迫响应中起着重要作用。ahl家族转录因子的n端包含一个或两个dna结合域(dbd),可识别mar中富含a/t的序列,而c端包含一个植物和原核生物保守(ppc)域,可促进核定位和蛋白质-蛋白质相互作用(gallavotti et al.,2011)。相关研究表明,ahl可参与多种植物生长和发育的过程,包括下胚轴伸长(zhao et al.,2013)、花粉壁和花发育(lou et al.,2014;yun et al.,2012)、根发育(zhou et al.,2013)和叶柄生长等(favero et al.,2020)。ahl还涉及了激素信号调节通路,包括赤霉素(matsushita et al.,2007)、脱落酸(wong et al.,2019)、茉莉酸(vom endt et al.,2007)和生长素等(favero et al.,2016;lee and seo,2017)。此外,发现ahl基因参与了植物对非生物或生物胁迫的应答过程(howden et al.,2017;jeong et al.,2020;rayapuram et al.,2021;zhou et al.,2016)。然而,关于ahl转录因子抗寒性研究鲜见报道,研究ahl蛋白的低温抗性作用机制,对作物抗寒育种具有重要价值。
5.枳是柑橘的近缘属,在柑橘生产中常被用作砧木,极抗寒,是研究木本植物抗寒性及发掘重要的抗寒基因的理想材料。因此,克隆枳抗寒有关基因是抗寒基因工程的关键和基础。
技术实现要素:
6.本发明目的在于提供了枳转录因子ptrahl,所述的枳转录因子ptrahl具体为ptrahl14或ptrahl17,其核苷酸序列分别为seq id no.1和seq id no.2,编码的蛋白质为seq id no.3和seq id no.4。
7.本发明还有一目的在于提供了枳转录因子ptrahl在控制植物抗寒性状中的应用。将该基因在植物中超表达或沉默表达,可获得抗寒能力增强或减弱的植株。
8.为了达到上述目的,本发明采取以下技术措施
9.申请人基于植物基因克隆技术从枳中克隆得到两个新基因ptrahl14和ptrahl17,其中ptrahl14基因编码的蛋白为seq id no.3所示,核苷酸为seq id no.1所示,该基因包含1134bp的开放阅读框,编码377个氨基酸,等电点为9.07,预测的分子量为38.89kda。ptrahl17基因编码的蛋白为seq id no.4所示,核苷酸为seq id no.2所示,该基因包含960bp的开放阅读框,编码319个氨基酸,等电点为7.89,预测的分子量为33.31kda。
10.申请人通过用qrt-pcr技术和免疫沉淀技术分析了在低温处理后ptrahl14和ptrahl17基因的相对表达量以及蛋白含量,结果表明ptrahl14和ptrahl17的表达量和蛋白质水平均随低温处理时间的延长而提高。此外,对低温处理前后超表达ptrahl14、ptrahl17转基因植株的表型及相关生理指标进行分析,结果表明:相对于野生型植株,ptrahl14、ptrahl17超表达植株具有更强的抗寒性。此外,与野生型相比,转基因植株fv/fm、a/n-inv活性及葡萄糖和果糖含量显著较高,电导率、mda含量、h2o2含量、蔗糖含量较低。然而,ptrahl14、ptrahl17干涉植株的表型和生理数据则与之相反,表明ptrahl14、ptrahl17基因是两个正调控抗寒性的基因。
11.枳抗寒基因ptrahl在调控植物抗寒性中的应用,包括利用本领域的常规方式,将ptrahl14或ptrahl17基因在植株中进行超表达,可获得抗寒的转基因植株;在植株中干涉ptrahl14或ptrahl17基因的表达,则可获得抗寒能力降低的转基因植株。
12.以上所述的应用中,优选的、所述的植物为柠檬或枳。
13.以上所述的应用中,优选的、通过构建ptrahl14或ptrahl17基因的植物超表达载体,利用农杆菌介导的遗传转化方法将基因导入植株中,获得的转基因植株经生物学功能验证,表明本发明所克隆的ptrahl14或ptrahl17基因具有提高植株抗寒性的功能。
14.与现有技术相比,本发明具有以下优点:
15.枳抗寒基因ptrahl的成功克隆,为植物抗逆分子设计育种提供新的基因资源,为实施绿色农业、节水农业提供新的遗传资源,该遗传资源的开发利用有利于降低农业生产成本和实现环境友好。
附图说明
16.图1是本发明的技术流程图。
17.图2是本发明ptrahl14和ptrahl17响应低温胁迫处理的表达模式示意图;
18.其中:a是ptrahl14基因在低温(4℃)处理下的相对表达量;b是ptrahl17基因在低温(4℃)处理下的相对表达量;c是低温(4℃)处理下ptrahl14和ptrahl17的蛋白表达水平。
19.图3是本发明ptrahl14和ptrahl17亚细胞定位和转录激活活性检测示意图。
20.其中:a是ptrahl14和ptrahl17基因亚细胞定位示意图;b是低温处理前后总核蛋
白(tnp)和基质部分(mf)中ptrahl14和ptrahl17的免疫印迹示意图;c是本发明的ptrahl14和ptrahl17基因转录激活载体构建示意图;d是本发明的ptrahl14和ptrahl17转录激活活性检测。
21.图4是本发明ptrahl14和ptrahl17转基因柠檬相对表达量分析示意图;
22.其中:a是ptrahl14转基因柠檬低温处理前后ptrahl14的相对表达量;b是ptrahl17转基因柠檬低温处理前后ptrahl17的相对表达量。
23.图5是本发明转ptrahl14、ptrahl17基因柠檬低温处理表型和生理指标测定示意图;
24.其中:a是低温处理前后ptrahl14转基因柠檬(#14-7,#14-8)、ptrahl17转基因柠檬(#17-4,#17-6)和野生型柠檬的表型;b是柠檬处理后相对电导率;c是柠檬处理前后mda含量;d是柠檬低温处理前后叶绿素荧光表型图;e是柠檬低温处理前后的fv/fm值;f是柠檬处理前后的dab染色图;g是柠檬处理后a/n-inv酶活性;h是柠檬处理前后蔗糖含量;i是柠檬低温处理前后葡萄糖含量;j是柠檬低温处理前后果糖含量。
25.图6是本发明vigs沉默材料相对表达量分析示意图;
26.其中:a是ptrahl14干涉材料(trv-ptrahl14)中ptrahl14蛋白含量分析,b是ptrahl17干涉材料(trv-ptrahl17)中ptrahl17蛋白含量分析;c是ptrahl14干涉材料中ptrahl14表达量分析;d是ptrahl17干涉材料中ptrahl17表达量分析。
27.图7是枳ptrahl14基因沉默植株(简称trv-ptrahl14)和枳ptrahl17基因沉默植株(简称trv-ptrahl17)抗寒性分析示意图;
28.其中:a是低温处理处理前后空载trv、干涉植株trv-ptrahl14和干涉植株trv-ptrahl17的表型;b是干涉枳低温处理前后的相对电导率;c是干涉枳低温处理前后的mda含量;d是干涉枳低温处理前后的叶绿素荧光表型图;e是干涉枳低温处理前后的fv/fm值。f是干涉枳低温处理前后的dab染色图;g是干涉枳低温处理前后a/n-inv酶活性;h是干涉枳低温处理前后蔗糖含量;i是干涉枳低温处理前后葡萄糖含量;j是干涉枳低温处理前后果糖含量。
具体实施方式
29.以下结合具体实施例对本发明做出详细的描述。根据以下描述和实施例,本领域技术人员可以确定本发明的基本特征,并且在不偏离本发明精神和范围的情况下,可以对本发明做出各种改变和修改,以使其适用各种用途和条件。
30.实施例1:枳ptrahl14和ptrahl17基因全长cdna的克隆
31.以枳cdna为模板,采用高保真酶进行扩增,扩增引物序列为:ptrahl14基因扩增的正向引物:5
’‑
atggaaccaaatgatacgcagc-3’和反向扩增引物:5
’‑
ctagtctgcaatttggtcatagtc-3’;ptrahl17基因扩增的正向引物:5
’‑
atgaaaagtgattatgtagtagaaccc-3’以及扩增的反向引物:5
’‑
tcaataaggcggtggtggtgg-3’;
32.采用axyprep-96 dna凝胶回收试剂盒对扩增得到产物进行纯化回收,利用dna无缝克隆技术,将纯化产物连接到peasy-blunt载体,然后将连接产物转化dh5α感受态细胞,涂板,摇菌,然后进行阳性鉴定。获得阳性克隆后送武汉擎科生物公司测序,根据测序结果,获得ptrahl14和ptrahl17的基因全长序列。
33.测序结果ptrahl14序列orf为1134bp,编码377个氨基酸,该蛋白的分子量为38.89kd,等电点为9.07,核苷酸序列为seq id no.1所示,氨基酸序列为seq id no.3所示。ptrahl17序列orf为960bp,编码319个氨基酸,该蛋白的分子量为33.31kda,等电点为7.89,核苷酸序列为seq id no.2所示,氨基酸序列为seq id no.4所示。
34.实施例2:低温条件处理下ptrahl14和ptrahl17的表达分析
35.取2个月苗龄且长势相同的野生型枳实生苗,放置于低温培养箱(hp400g-e型,瑞华,中国)中进行低温处理(4℃),取样时间点为0h、6h、10h、12h、24h、48h、72h。各时间点采取叶片后迅速放入液氮冷冻,之后置于-80℃冰箱冷藏备用,用于后续的基因表达模式分析以及免疫印迹实验。
36.采用实时荧光定量pcr(qrt-pcr)的方法对ptrahl14和ptrahl17基因的低温表达模式进行分析,实时荧光定量pcr采用aceq qpcr sybr green master mix试剂,方法参照说明书。配制好的反应体系采用quantstudiotm7flex real-time pcr荧光定量分析仪进行反应。
37.以枳中actin作为内参基因(正向引物:5
’‑
ccgaccgtatgagcaaggaaa-3’;反向引物:5
’‑
ttcctgtggacaatggatgga-3’),采用2-δδct
算法对基因表达进行计算。ptrahl14实时定量引物(正向引物:5
’‑
gaaagtacgggacgcctgaa-3’;反向引物:5
’‑
caccaagctgagacttcccc-3’),选用ptrahl17实时定量引物(正向引物:5
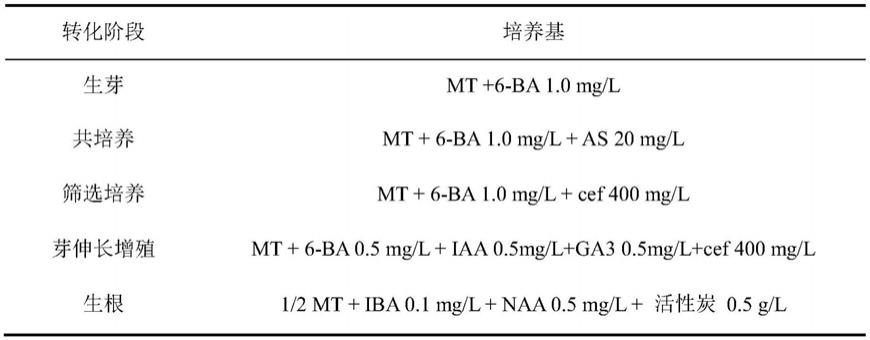
’‑
gggaggtttataggcaagc-3’;反向引物:5
’‑
acggatctgggatcttgc-3’)。利用abclonal biotechnology公司生产的ptrahl14和ptrahl17的多克隆抗体进行免疫印记实验。
38.本实验结果表明,ptrahl14基因表达量(图2中a)和ptrahl17基因的表达量(图2中b)持续受低温诱导,且两种ahl的蛋白质水平随低温处理时间的增长而逐渐升高(图2中c),综合而言,表明ptrahl14和ptrahl17都是冷诱导基因,可能在植物抗寒胁迫中发挥着重要的作用。
39.实施例3:ptrahl14和ptrahl17亚细胞定位和转录激活活性分析
40.扩增ptrahl14和ptrahl17的orf区域(不含终止密码子),并融合到载体peg104(含yfp蛋白)上,由camv35s启动子驱动表达。之后将对照35s:yfp+mcherry,35s:ptrahl14-yfp+mcherry,35s:ptrahl17-yfp+mcherry分别瞬时转化到本氏烟草的叶片表皮细胞,激光共聚焦显微镜观察荧光发现对照的荧光充满整个表皮细胞,包括细胞质与细胞核,而转化35s:ptrahl14-yfp与35s:ptrahl17-yfp的荧光仅在核基质中检测到(图3中a),为了证实这一点,提取了总核蛋白和核基质蛋白,并使用ptrahl14和ptrahl17抗体进行免疫印迹分析。结果显示,ptrahl14和ptrahl17在这两个部分中均可被检测到,但在低温处理后,核基质蛋白水平比总核蛋白水平更高(图3中b),证实ptrahl14和ptrahl17是核基质蛋白。
41.为了检测两个转录因子的转录激活活性,将ptrahl14和ptrahl17基因全长分别构建到pbd载体上,该载体含有5个拷贝的gal4结合元件,由camv 35s启动子驱动表达。将构建成功的效应子和报告子(图3中c)转化到含有psoup辅助质粒的a.tumefaciens gv3101菌株中。将细菌悬浮液注射到n.benthamiana烟草叶片中,并在22℃下培养3天。将d-luciferine试剂涂抹在叶片的近轴侧,并使用lb983 nightowl ii with indigo software软件对luc荧光进行可视化分析。实验结果表明,当含有ptrahl14或ptrahl17的效应子和报告子共同注射烟草后,叶片呈现出较强的luc荧光信号,证实ptrahl14和ptrahl17具有转录激活活性
(图3中d)。总之,这些结果表明ptrahl14和ptrahl17是具有转录激活活性,且定位在核基质的转录因子。
42.实施例4:植物转化载体构建、柠檬遗传转化及阳性苗鉴定
43.1.植物转化载体构建
44.以枳cdna为模板,设计引物将ptrahl14和ptrahl17基因全长扩增,引物序列为:
45.pdonr207-ptrahl14-f:5
’‑
ggggacaagtttgtacaaaaaagcaggcttaatggaaccaaatgatacgcagc-3’;
46.pdonr207-ptrahl14-r:5
’‑
ggggaccactttgtacaagaaagctgggttgtctgcaatttggtcatagtc-3’;
47.pdonr207-ptrahl17-f:5
’‑
ggggacaagtttgtacaaaaaagcaggcttaatgaaaagtgattatgtagtagaaccc-3’;
48.pdonr207-ptrahl17-r:5
’‑
ggggaccactttgtacaagaaagctgggttataaggcggtggtggtgg-3’;
49.扩增回收后与pdonr207载体进行bp反应连接,使用方法参见bp clonasetmⅱ试剂盒说明书,将经过测序正确的阳性克隆菌摇菌。之后用axyprep质粒dna小量提取试剂(axygen,usa)盒提取质粒,并与目的载体pgwb411进行lr反应,方法参照lr clonasetmⅱ(invitrogen)试剂盒说明书,随后即可进行大肠杆菌感受态转化,经阳性鉴定后摇菌,提取质粒,获得最后的超表达载体pgwb411-ptrptrahl14和pgwb411-ptrptrahl17,其中扩增片段回收、阳性克隆检测及送样测序等步骤的方法参照实施例1,最后将载体转入农杆菌感受态gv3101备用。
50.2.柠檬遗传转化
51.1)植物材料准备
52.把柠檬种子浸泡于1mol/l naoh中大约15min,去除果胶,然后用水洗净,将种子拿至超净工作台中,用2%的naclo浸泡灭菌15min,倒掉naclo用无菌水洗涤3-4次。将灭菌后的种子放置于已加入少许水的灭菌之后的三角瓶中,最后将种子放于4℃冰箱中保存。
53.在超净工作台上用镊子剥掉种子的外种皮和内种皮,接种于mt固体培养基上,黑暗培养4-6周左右,转化前将其置于光照下7-10d直至实生苗转绿。在此期间制备农杆菌菌液。
54.2)农杆菌侵染液制备
55.在无菌操作台上,使用烧灼灭菌的接种环挑取-80℃保存的pgwb411-ptrahl14、pgwb411-ptrahl17农杆菌,在含有50mg/l spec抗生素的培养基上划线,将培养基放入28℃培养箱中暗培养2d。挑取单克隆接种于新的含有50mg/l spec抗生素的培养基上,然后置于培养箱继续培养2d。取一个灭菌的100ml的小三角瓶倒入50ml含有20mg/l as(acetosyringone,乙酰丁香酮)的mt液体培养基。将已长好的农杆菌刮下溶于含有20mg/l as的mt液体培养基,28℃条件下,200r/min振荡20min(此期间切取柠檬茎段),向菌液中加入mt液体培养基调整浓度至od
600
值为0.6-0.8。
56.3)外植体准备
57.将柠檬实生苗取出放置于灭菌后的铺有滤纸的大培养皿中进行切段,将柠檬实生苗切成大约1.5cm左右长的茎段。向灭菌后的三角瓶中加少量mt液体培养基浸没切好的茎
段以保湿。
58.4)侵染与共培养
59.向装有切好的茎段的三角瓶中加入制备好的农杆菌菌液,震荡大约20min之后完成侵染。倒掉菌液,将茎段取出放在无菌吸水纸上除去茎段表面的菌液。将表面清除菌液后的茎段均匀摆放到铺有滤纸的共培养培养基。之后遮光暗培养,放置于25℃条件下培养3d。
60.5)筛选培养与再生
61.将暗培养3d的茎段取出放入灭菌后的小三角瓶中,用无菌水浸泡清洗3-5次。把茎段放置于无菌吸水纸上直至吸干水分,然后用镊子将茎段转移到筛选培养基上,黑暗条件下培养至再生芽大于0.5cm时将其切下,放入生芽培养基中。至再生芽2cm大小时,转移到生根培养基上。实验中所用培养基配方如下表所示。
62.转化各阶段所用培养基
[0063][0064]
3.阳性苗鉴定
[0065]
实时荧光定量分析了转基因柠檬中ptrahl14和ptrahl17的表达量,结果显示,相对野生型wt,ptrahl14转基因柠檬(#14-7,#14-8)中ptrahl14基因的相对表达量(图4中a)以及ptrahl17转基因柠檬(#17-4,#17-6)中ptrahl17基因的相对表达量(图4中b)明显升高,对阳性转基因柠檬用于后续抗寒性分析。
[0066]
实施例5:转基因柠檬抗寒性分析
[0067]
ptrahl14转基因柠檬(#14-7,#14-8)、ptrahl17转基因柠檬(#17-4,#17-6)和野生型柠檬(wt)被用于低温抗性鉴定。低温处理前,野生型和转基因柠檬之间没有明显的表型差异。但在4℃驯化12h,然后每2h降低2℃,直至-4℃处理12h后,野生型柠檬基本枯水褐化死亡,而转基因柠檬受伤害程度较小(图5中a)。在低温处理前,野生型wt和转基因柠檬之间的相对电导率和mda含量无明显差异,但经过低温处理后,与超表达柠檬相比,野生型柠檬在低温处理后的相对电导率较高(图5中b,每组左起第一个为wt组),且积累了较低的mda含量(图5中c,每组左起第一个为wt组),说明野生型柠檬低温损伤更为严重。叶绿素荧光参数fv/fm值用于表征psⅱ反应中心光能的转化效率,当植物遭受外界胁迫时,该参数明显降低,与野生型柠檬相比,超表达柠檬显示出更强的叶绿素荧光(图5中d)和更高的fv/fm值(图5中e,每组左起第一个为wt组),说明野生型在低温胁迫下伤害程度更大,且发现转基因植株叶片低温处理后dab染色程度较野生型浅(图5中f),说明转基因植株中h2o2的积累量较少,有着更好的活性氧清除能力。此外,在低温处理前后,碱性/中性蔗糖转化酶a/n-inv酶活性在转基因植株中明显高于wt(图5中g,每组左起第一个为wt组),且发现转基因植物中
factors restrict petiole growth by antagonizing pifs.curr.biol,2020,30:1454-1466
[0079]
6.gallavotti,a.,malcomber,s.,gaines,c.,stanfield,s.,whipple,c.,kellogg,e.,and schmidt,r.j.barren stalk fastigiate1 is an at-hook protein required for the formation of maize ears.plant cell,2011,23:1756-1771
[0080]
7.howden,a.j.m.,stam,r.,martinez heredia,v.,motion,g.b.,ten have,s.,hodge,k.,marques monteiro amaro,t.m.,and huitema,e.quantitative analysis of the tomato nuclear proteome during phytophthora capsici infection unveils regulators of immunity.new phytol,2017,215:309-322
[0081]
8.jeong,h.-n.,sun,h.-j.,zuo,z.-f.,lee,d.h.,song,p.-s.,kang,h.-g.,and lee,h.-y.overexpression of athg1/ahl23 and atpg3/ahl20,arabidopsis at-hook motif nuclear-localized genes,confers salt tolerance in transgenic zoysia japonica.plant biotech.reports,2020,14:351-361
[0082]
9.lee,k.,and seo,p.j.coordination of matrix attachment and atp-dependent chromatin remodeling regulate auxin biosynthesis and arabidopsis hypocotyl elongation.plos one,2017,12:e0181804
[0083]
10.lou,y.,xu,x.f.,zhu,j.,gu,j.n.,blackmore,s.,and yang,z.n.the tapetal ahl family protein tek determines nexine formation in the pollen wall.nat.commun,2014,5:3855
[0084]
11.matsushita,a.,furumoto,t.,ishida,s.,and takahashi,y.agf1,an at-hook protein,is necessary for the negative feedback of atga3ox1 encoding ga 3-oxidase.plant physiol,2007,143:1152-1162
[0085]
12.nagele,t.,stutz,s.,hormiller,ii,and heyer,a.g.identification of a metabolic bottleneck for cold acclimation in arabidopsis thaliana.plant j,2012,72:102-114
[0086]
13.nakashima k,yamaguchi-shinozaki k,shinozaki k.the transcriptional regulatory network in the drought response and its crosstalk in abiotic stress responses including drought,cold,and heat.front plant sci,2014,5:170
[0087]
14.rayapuram,n.,jarad,m.,alhoraibi,h.m.,bigeard,j.,abulfaraj,a.a.,volz,r.,mariappan,k.g.,almeida-trapp,m.,schloffel,m.,lastrucci,e.,et al.chromatin phosphoproteomics unravels a function for at-hook motif nuclear localized protein ahl13 in pamp-triggered immunity.proc.natl.acad.sci,2021,118:e2004670118
[0088]
15.vom endt,d.,soares e silva,m.,kijne,j.w.,pasquali,g.,and memelink,j.identification of a bipartite jasmonate-responsive promoter element in the catharanthus roseus orca3transcription factor gene that interacts specifically with at-hook dna-binding proteins.plant physiol,2007,144:1680-1689
[0089]
16.wong,m.m.,bhaskara,g.b.,wen,t.n.,lin,w.d.,nguyen,t.t.,chong,g.l.,
and verslues,p.e.phosphoproteomics of arabidopsis highly aba-induced1 identifies at-hook-like10phosphorylation required for stress growth regulation.proc.natl.acad.sci,2019,116:2354-2363
[0090]
17.yun,j.,kim,y.s.,jung,j.h.,seo,p.j.,and park,c.m.the at-hook motif-containing protein ahl22 regulates flowering initiation by modifying flowering locus t chromatin in arabidopsis.j.biol.chem,2012,287:15307-15316
[0091]
18.zhao,j.,favero,d.s.,peng,h.,and neff,m.m.arabidopsis thaliana ahl family modulates hypocotyl growth redundantly by interacting with each other via the ppc/duf296 domain.proc.natl.acad.sci,2013,110:e4688-e4697
[0092]
19.zhou,j.,wang,x.,lee,j.-y.,and lee,j.-y.cell-to-cell movement of two interacting at-hook factors in arabidopsis root vascular tissue patterning.plant cell,2013,25:187-201
[0093]
20.zhou,l.,liu,z.,liu,y.,kong,d.,li,t.,yu,s.,mei,h.,xu,x.,liu,h.,chen,l.,et al.a novel gene osahl1 improves both drought avoidance and drought tolerance in rice.sci.rep,2016,6:30264
[0094]
21.zhu jk.abiotic stress signaling and responses in plants.cell,2016,167:313
–
324
