单细胞分析
1.本技术是申请日为2018年3月15日、申请号为201880018953.7、发明名称为“单细胞分析”的发明专利申请的分案申请。
技术领域
2.本发明涉及用于从单细胞中条形码化(barcoding)核酸的方法以及用于对具有感兴趣表型的单细胞进行基因分型的方法。
背景技术:
3.用于分析群中单细胞的多个参数的方法在各种情况下都是令人感兴趣的。特别是,商业和学术实验室广泛关注在细胞群内基于单细胞分析核酸(任选地与一种或多种其他参数组合)的能力。而且,这种分析通常需要实时进行,以揭示生物学和生物化学过程的动态行为。
4.因而,需要能够以高度并行的方式分离、检测和定量异质混合物的个体组分的技术来满足这些挑战。已开发了常规的高通量平台,例如具有机器人分配系统的高密度微孔板,并将其广泛用于高通量分析,如药物筛选。然而,其需要昂贵且笨重的机器人机器并且需要对样品进行蒸发和相当大的反应体积,这会浪费宝贵的生物样品或试剂。
5.最近,微制造装置(microfabricated device)已经成为用于以高通量方式进行各种生物学和化学测定的强大实验平台。这些技术通常允许通过将大量溶液分配到很多分离的皮升至纳升大小的隔室或微反应器中来对复杂样品进行高通量分析。然而,对个体样品进行分析后恢复(retrieval)是难以实现的。此外,在这些装置中混合试剂或者需要复杂的结构,或者通常在区室化之前大量进行,其可以防止初始反应产物与其引发靶点共定位。
6.一种方法是将反应区室化成由不混溶的载体流体包围的离散的微米尺寸的液滴。基于液滴的微流体可精确控制流体混合,最大限度地减少贵重试剂的浪费以及减少分子在设备壁上的蒸发和吸附。
7.white等(proc natl acad sci usa.2011 aug 23;108(34):13999-4004)描述了一种微流体装置,其能够在每次运行时对数百个单细胞的基因表达进行rt-qpcr测量,执行单细胞处理,包括细胞捕获、细胞裂解、逆转录和定量pcr。然而,为了试图尝试更小的反应体积,white等(proc natl acad sci usa.2011 aug 23;108(34):13999-4004)进行了300次平行的rt-qpcr并证实了在所检测的反应条件下当体积小于5nl时rt被抑制。因此,研究者以每个细胞67nl进行rt反应并进一步声称在单个反应中rt与qpcr的组合排除了大规模转录组分析和/或无偏差扩增。
8.此外,dekosky等(nat med.2015 jan;21(1):86-91)针对单细胞mrna捕获已经描述了一种使用简单的轴对称流动聚焦装置的方法。该方法的rt和pcr反应在乳液中进行。已证明该方法是有效的,但是需要进行顺序的3个步骤方法。
9.沿着同一主线,eastburn等(anal chem.2013 aug 20;85(16):8016-21)在小液滴体积中进行rt,但是耗时3-4个步骤。他还提到了细胞蛋白酶在小体积中的rt抑制作用。为
了解决这一问题,他们使用蛋白酶处理细胞、稀释细胞裂解物、分裂液滴和皮注射rt-pcr试剂。
10.rotem等(plos one.2015 may 22;10(5):e0116328)将寡核苷酸包封在液滴群中并将其与含有细胞的液滴融合,同时皮注射rt酶和缓冲液。这3个步骤方法产生了~100pl液滴,允许在3h包封100.000个细胞。尽管这种方法依赖于单细胞cdna标记,但转录组序列数据来自于多个表型和基因型不相关细胞的聚集体。
11.macosko等(cell.2015 may 21;161(5):1202-14)使用基于液滴的微流体以将细胞与裂解试剂和条形码化的珠子包封在一起,以捕获1nl液滴中的mrna。然而,在芯片外使用珠子以将珠子上捕获的mrna转化成cdna,并且其不会负载在大部分已形成的液滴上,从而排除了稀有细胞群的分析。macosko等描述的该方法的第3步是然后致力于文库制备和扩增。
12.国际专利申请wo2015/164212涉及一种用于包封和条形码化单细胞核酸的方法。wo2015/164212公开了在小于3nl的体积中mrna的rt被强烈抑制(wo2015/164212的实施例4)。
13.labanieh等2015描述了一种微流体方法,其使用微流体芯片利用浮力捕获、分析和回收液滴。然而,labanieh等没有明确指出其中核酸被逆转录的单细胞核酸的分析,并且因此无法使用该方法获得单细胞的基因型。
14.专利申请us2013/0323732涉及用于测定单细胞和将单细胞cdna条形码化的方法和装置。us2013/0323732没有公开其中液滴在微流体芯片内融合的方法。
15.与此相反的是,本发明人成功开发了一种用于将单细胞核酸条形码化的在芯片上的微流体方法,其中将单细胞液滴捕获在个体的隔室中。再进一步将单细胞液滴与提供用于逆转录的反应混合物的液滴融合。
16.如上所述,本发明人开发的在芯片上的方法允许获得单细胞的表型。因此,本发明人进一步开发了一种独特的将表型信息(蛋白表达水平、细胞通路激活/活性、离子通道/gpcr活性)与基因型或表观遗传信息偶联的方法,从而允许确定具有感兴趣表型的单细胞的基因型。
17.在该方法各个步骤中对阵列成像的能力允许与常规方法相比获得每个单细胞更多的定量数据并且允许在表型筛选期间产生动力学数据,然后可以将其与特定单细胞的基因型联系起来。
18.该方法不同于到目前为止已知的现有技术,例如rotem等,因为例如在rotem等中基因组信息是通过对多个表型和基因型不相关细胞的聚集体进行测序而获得的。因此,他们的方法没有公开将每个单细胞的表型信息与基因型信息偶联在一起。
19.国际专利申请wo2016145409al公开了一种方法,其中感兴趣蛋白的表型和基因型可以是相关的。与本发明人的方法不同,在该方法中,将条形码与例如感兴趣的蛋白或其结合配偶体连接,并且在同时与编码所述感兴趣的蛋白的核酸连接。然后,将核酸逆转录以获得条形码化的cdna,之后再对条形码化的cdna测序。通过破坏乳液并进行表型测定,例如elisa或使用亲和柱的测定,平行地对感兴趣的蛋白进行表型分型。对于显示出所期望的表型的蛋白,然后可以通过测序对条形码序列进行分析。随后,通过将具有感兴趣表型的感兴趣蛋白的条形码与具有相同条形码的cdna匹配将表型与基因型联系起来。
20.然而,本领域技术人员将意识到的是,这样的方法不允许将单细胞的整个转录组与单细胞的表型相匹配,或者不能获得具有与存在的一种特定的感兴趣蛋白无关的表型的单细胞的基因型。
21.与此相反的是,本发明人的方法允许在一个步骤中对几种单细胞进行表型分型,然后通过混合其核酸平行地对那些单细胞进行基因分型。随后,将基因组信息与具有感兴趣表型的单细胞的表型联系起来。
22.此外,本发明人的方法允许确定任何表型,包括不一定与存在的感兴趣的单个蛋白相关的表型,但其可以与例如某些通路的活性改变相关,并且所述改变导致可以使用测定确定的任何表型,例如抗体分泌速率、离子通道活性、gpc活化、细胞的氧化还原电位改变。
技术实现要素:
23.本发明的第一个方面涉及一种用于对具有感兴趣表型的单细胞进行基因分型的方法,所述方法包括:
[0024]-提供多个储库,和
[0025]
a)对于多个储库,针对各个储库提供至少一种条形码序列和至少一种染料,其中所述至少一种条形码序列与所述至少一种染料的颜色和浓度相关,并获取阵列的图像,从而为各个储库映射(mapping)所述至少一种染料的所述颜色和所强度;和
[0026]
b)对于多个储库,针对各个储库提供至少一个单细胞并针对各个储库在所述至少一个单细胞上进行表型测定,并获取图像,从而为各个储库映射所述至少一个单细胞的所述表型;
[0027]
其中步骤a)在步骤b)之前进行或者步骤b)在步骤a)之前进行;然后
[0028]
c)对于多个储库,针对各个储库将在步骤b)中获得的所述单细胞的表型与在步骤a)中获得的所述至少一种染料的所述颜
[0029]
色和所述强度联系起来;和
[0030]-对于多个储库,针对各个储库将所述至少一个单细胞的核酸逆转录以获得用所述至少一种条形码序列条形码化的单细胞cdna,所述至少一种条形码序列与所述至少一种染料的所述颜色和浓度相关;和
[0031]-将所述基因型与所述至少一个单细胞的所述表型联系起来。
[0032]
本发明的第二个方面涉及一种用于条形码化单细胞核酸的微流体方法,所述方法包括:
[0033]-提供微流体装置,所述微流体装置包含芯片,所述芯片包含至少一个微流体通道和多个储库,
[0034]-向所述微流体通道的入口注入载体流体,所述载体流体包含分散在所述载体流体中的多个第一类型的液滴,其中所述第一类型的液滴是单细胞液滴或rt液滴,其中所述rt液滴的至少一些包含逆转录酶和至少一种寡核苷酸,和其中所述单细胞液滴的至少一些包含一个单细胞,其中所述单细胞包含单细胞核酸,
[0035]-对于多个储库,第一迁移步骤,其中通过浮力将在所述多个液滴中的所述第一类型的至少一个液滴移动到所述多个储库的一个储库中,
[0036]-向所述微流体通道的入口注入载体流体,所述载体流体包含分散在所述载体流体中的多个第二类型的液滴,其中所述第二类型的液滴是单细胞液滴或rt液滴,和其中当所述第一类型的液滴是单细胞液滴时所述第二类型的液滴是rt液滴,或者当所述第一类型的液滴是rt液滴时所述第二类型的液滴是单细胞液滴,
[0037]-对于多个储库,第二迁移步骤,其中,所述第二类型的至少一个液滴的至少一部分进入所述多个储库的一个储库中,
[0038]-对于多个储库,所述第一类型的所述至少一个液滴与所述第二类型的所述至少一个液滴在各个储库中或在其边缘处融合,从而产生融合的液滴,
[0039]-以及还包括以下步骤:
[0040]
a)针对每个融合的液滴,在所述融合的液滴中将所述单细胞核酸的至少一些与所述至少一种寡核苷酸杂交,
[0041]
b)在每个融合的液滴中,将在所述融合的液滴中存在的所述单细胞核酸的至少一些逆转录,从而产生单细胞cdna,和
[0042]
c)将至少一种条形码序列附接至在步骤b)中获得的所述单细胞cdna上,其中所述至少一种条形码序列编码所述单细胞的身份(identity),
[0043]
或者
[0044]-还包括以下步骤:
[0045]
a)针对每个融合的液滴,在所述融合的液滴中将来自至少一种细胞的单细胞核酸的至少一些与所述至少一种寡核苷酸杂交,其中所述至少一种寡核苷酸包含至少一种条形码序列,
[0046]
b)在每个融合的液滴中,将在所述融合的液滴中存在的所述单细胞核酸的至少一些逆转录,从而产生条形码化的单细胞cdna,其中所述至少一种条形码序列编码所述单细胞的身份。
附图说明
[0047]
图1显示了用于鉴定抗体依赖性细胞介导的细胞毒性(adcc)的基于单细胞液滴的表型测定。产生igg的细胞(2)分泌靶向表达膜蛋白的报告细胞(1)的抗体。在抗体(3)与被靶向的细胞结合后,通过细胞的fc受体募集杀伤细胞(4),其将诱导通过结合由(2)分泌的抗体介导的细胞毒活性(10)。在一些应用中,杀伤细胞是从pmbc中分离的或者是已知具有细胞毒性介导活性的细胞系。
[0048]
图2显示了用于鉴定补体依赖性细胞毒性(cdc)抗体的基于单细胞液滴的表型测定。产生igg的细胞(2)分泌靶向表达膜蛋白的报告细胞(1)的抗体。在抗体(3)与被靶向的细胞结合后,补体分子(6)与诱导细胞裂解的抗体结合(10)。
[0049]
图3显示了用于鉴定诱导细胞裂解、凋亡、内化、坏死的抗体药物缀合物(adc)(3)候选物的基于单细胞液滴的表型测定。将偶联药物的抗体(5)引入不同乳液中,每种乳液一种药物。在与抗体(3)结合后,并且在有效药物活性的情况下,在给定实施例中的靶细胞被裂解(10)。
[0050]
图4显示了用于鉴定激动性/拮抗性抗体(3)的基于单细胞液滴的表型测定。产生igg的细胞(2)分泌靶向表达膜蛋白的报告细胞(1)的抗体。在抗体与被靶向的细胞(1)结合
后,几种通路被激活或抑制,从而导致生理学修饰。根据细胞和受体的性质,可以将这些修饰用于在液滴中的单功能或多功能测定。不同的是,拮抗性抗体(3)将在同一液滴(7)中与配体竞争。然后,读取结果将是阻断激动剂的活性。
[0051]
图5显示了用于鉴定配体的激动活性的基于单细胞液滴的表型测定。使用基于落射荧光的显微镜以10x放大倍数进行图像采集。a.根据配体浓度加入不同浓度的荧光染料,以区分含有激动剂的乳液(荧光染料浓度较高)和不含激动剂的乳液(荧光染料浓度较低)。b.使用细胞标志物标记细胞。在与第二液滴群融合后,含有用于检测细胞内通路激活检测的其他底物以及用于rt(+/-pcr)的试剂,细胞被裂解导致细胞标志物在液滴内部扩散。将a与b结合给出测定条件信息。c.最后,以第3种颜色给出功能性读取结果,其显示了在这种情况下诱导细胞内信号传导通路激活的下游激动剂的募集。将在阈值以上的液滴认为是阳性的并且与由条件a+b所给出的预期相匹配。本实施例突出了将分泌抗体的复杂表型(下游信号传导细胞内级联激活)与其测序信息联系起来的可行性。
[0052]
图6显示了用于鉴定拮抗性/阻断抗体(3)的基于单细胞液滴的表型测定。产生igg的细胞(2)分泌靶向表达膜蛋白的报告细胞(1)的抗体(3)。在抗体结合与被靶向的细胞(1)结合后,配体或激动剂通过由核和壳构成的颗粒(8)逐渐释放。颗粒能够以与抗体产生类似的动力学释放配体,从而能够在所述液滴中进行竞争测定。颗粒可以由细胞生长凝胶构成,并且能够产生配体梯度,从而使得报告细胞能够在凝胶内部迁移,通常将其称为细胞移动(mobility)测定(9)。
[0053]
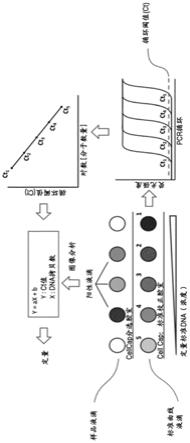
图7显示了用于组合表型和基因型信息恢复(recovery)的在微流体装置中进行的rt-pcr的实施例。在该实施例中,除了rt-pcr试剂以外,还将dna嵌入剂或taq-man探针加入混合物中。对于每个循环,由于嵌入剂或探针的耗尽,拷贝数呈指数增加直至达到平衡(plateau)。然后,以循环的函数绘制强度曲线,计算循环阈值(ct)的值。随后,以log[分子数量]为函数绘制ct值。根据标准曲线计算给定样品的分子数量。标准曲线由含有已知量的分子的液滴产生,也计算其ct。绘制来自标准样品的这些ct作为log[分子数量]函数的曲线,然后计算线性回归方程并将其用于对含有细胞的样品液滴的定量分析。
[0054]
图8显示了用于在液滴中筛选产生igg细胞的标准程序的实施例。步骤1,涉及制备b细胞和报告细胞。对b细胞群进行初步富集以增加igg分泌或产生细胞在其他类型无关群中的相对量。步骤2,引发单个b细胞与一个单报告细胞或多报告细胞的共同包封。步骤3,孵育含有细胞的乳液以使得igg产生细胞在液滴中分泌抗体。步骤4a,对发展igg特异性抗体的分离诱导的特定表型功能(结合
……
)的感兴趣的群进行分选。步骤4b,与步骤4a平行制备含有用于在液滴中进行逆转录(rt)的试剂的乳液。步骤5,将分选的液滴分散在含有多个储库的微流体装置内。通过微流体装置内的浮力捕获分选的液滴。步骤6,然后通过使用基于落射荧光的显微镜或用于荧光和/或发光采集的任何其他装置对含有细胞和呈现感兴趣表型的捕获的液滴成像。步骤7,在随后的步骤中,将在步骤4b中产生的乳液分散在微流体装置内并作为与一个单rt液滴融合的一个单分选液滴融合。步骤8,进行孵育步骤以允许进行最终与pcr反应偶联的逆转录。步骤9,孵育后,通过使用基于落射荧光的显微镜或用于荧光和/或发光采集的任何其他装置对微流体装置成像。步骤10,回收在微流体装置中捕获的乳液并最终通过pcr进行文库扩增。步骤11,扩增的文库被送去测序。完成整个过程后,进行两步数据分析。与步骤6和9相关的,按照3个一般步骤分析图像:校正图像、检测每个个体
孔/信号、和信号分析给出所述液滴的表型。与步骤11相关,按照下述3个一般步骤对测序数据进行分析:1)条形码提取、聚类和鉴定序列种类,2)抗体序列表征和vh/vl配对,3)抗体克隆分配和抗体候选物优先排序。步骤12,这两种分析的组合允许对所选择的抗体进行深度表征并将表型与基因型之间联系起来。
[0055]
图9显示了含有1060个基于浮力的捕获单元的所述微流体装置采集的图像。在该设计中,使用两个连续的腔室以增加捕获单元的总量。
[0056]
图10显示了在感兴趣细胞存在的情况下基于靶细胞的结合在分选过程中的一些采集的图像。a.含有负载有一个靶细胞和一个感兴趣细胞的两个分选液滴的两个捕获单元的亮视野采集。b.使用tritc滤光片采集的图像。在液滴内使用荧光分子允许在微流体装置中进行检测。c.使用cy5滤光片采集的图像,表明检测试剂定位于靶细胞上。
[0057]
图11显示了文库制备的实施例和对照。在两步pcr反应(pcr1和pcr2)之后,将cdna扩增至基于illumina的测序文库中。pcr2通常显示出针对vh和vl的~550bp的扩增产物。
[0058]
图12显示了在ngs测序分析过程中进行的几个步骤。其中之一由单细胞的igg产生细胞的vh序列与vl配对组成。该图显示了用于vh和vl配对的对数(读取结果的丰度)。
具体实施方式
[0059]
定义
[0060]
除非另有定义,否则与本公开内容相关的所使用的科学和技术术语应具有本领域普通技术人员通常理解的含义。
[0061]
此外,除非上下文另有要求,否则单数术语应包括复数,复数术语应包括单数。
[0062]
在通常情况下,与本文所述的细胞和组织培养、分子生物学以及蛋白和寡核苷酸或多核苷酸化学和杂交相关的术语和技术是本领域熟知和常用的那些。
[0063]“微流体”通常指流体在其中循环的通道的尺寸小于1毫米并且包括例如从1μm至1mm。
[0064]“微流体方法”通常指使用尺寸小于1毫米的微流体通道操纵少量流体(10-4
至10-18
升)的方法。那些微流体通道通常包含在微流体装置内,更特别地包含在微流体装置的微流体芯片内。在本技术下文的“微流体装置”章节中进一步描述用于本技术背景的微流体装置。
[0065]
本发明的“方法(process)”也可以称为方法(method)。
[0066]
使用标准技术进行重组dna、寡核苷酸合成以及组织培养和转化(例如,电穿孔、脂质转染)。根据生产厂商的说明书或者按照本领域的通常方法或本文所述进行酶促反应和纯化技术。除非特别相反地指出,否则本公开内容的实施将采用本领域技术范围内的病毒学、免疫学、微生物学、分子生物学和重组dna技术的常规方法,出于说明目的在下文中对其中的很多方法进行了描述。在文献中对这样的技术进行了充分说明。参见例如,sambrook,等molecular cloning:a laboratory manual(2nd edition,1989);maniatis等molecular cloning:a laboratory manual(1982);dna cloning:a practical approach,vol.i&ii(d.glover,ed.);oligonucleotide synthesis(n.gait,ed.,1984);nucleic acid hybridization(b.hames&s.higgins,eds.,1985);transcription and translation(b.hames&s.higgins,eds.,1984);animal cell culture(r.freshney,ed.,1986);
perbal,a practical guide to molecular cloning(1984)。
[0067]
与本文所述的分析化学、合成有机化学以及医学和药物化学相关术语以及实验室操作和技术是本领域技所熟知和常用的那些。使用标准技术进行化学合成、化学分析、药物制备、制剂和递送以及对患者进行治疗。
[0068]
如在本技术中所使用的,术语“核酸”通常指dna、rna、mirna或者其衍生物或模拟物的至少一个分子或链,其包含至少一个核碱基,例如在dna(例如,腺嘌呤“a”、鸟嘌呤“g”、胸腺嘧啶“t”和胞嘧啶“c”)或rna(例如,a、g、尿嘧啶“u”和“c”)中发现的天然存在的嘌呤或嘧啶碱基。术语“核酸”包括术语“寡核苷酸”。
[0069]
本技术中的“rna”指但不限于功能性rna,如mrna、trna、rrna、催化性rna、sirna、mirna和反义rna。在一个优选的实施方式中,rna指mrna。
[0070]
如本领域技术人员将理解的是,对单链的描述也定义了互补链的序列。因而,核酸还包括所描述的单链的互补链。因此,术语核酸包括互补dna。本领域技术人员还将意识到的是,可以将很多核酸的变体用于与给定核酸相同的目的。因而,核酸还包括基本上相同的核酸及其互补物。本领域技术人员还将理解的是,单链核酸(如引物)可以在杂交条件下(优选严格杂交条件下)与靶序列杂交。因而,核酸还包括在杂交条件下与靶序列杂交的引物。
[0071]
术语“寡核苷酸”指至少一个长度约3至约500个核碱基的分子。例如,寡核苷酸的长度可以是至少3个核碱基、至少10个核碱基、至少30个核碱基、至少50个核碱基、至少100个核碱基、至少300个核碱基或者至少400个核碱基。在一些情况下,寡核苷酸的长度可以是不超过500个核碱基、不超过300个核碱基、不超过100个核碱基、不超过50个核碱基等。任何这些的组合也是可能的,例如寡核苷酸的长度可以在3至300个核碱基之间,优选地在3至200个核碱基之间,更优选地在3至100个核碱基之间。
[0072]
这些定义指至少一个单链分子,但在一些实施方式中还包括至少一个另外的链,其部分地、基本上或完全与至少一个单链分子互补。因此,在一些实施方式中,所述定义指双链分子。
[0073]
因而,在一些实施方式中,核酸指至少一个双链分子,其包含一条或多条互补链,或者包含所述分子的链的特定序列的“互补物”。
[0074]
如在本技术中所使用的,“基因”可以是包含转录和/或翻译调控序列和/或编码区和/或非翻译序列(例如,内含子、5
’‑
和3
’‑
非翻译序列)的基因组基因。基因的编码区可以是编码氨基酸序列或者功能性rna(如trna、rrna、催化性rna、sirna、mirna和反义rna)的核苷酸序列。基因还可以是与编码区(例如,外显子和mirna)相对应的mrna或cdna,其任选地包含与其连接的5
’‑
或3
’‑
非翻译序列。基因还可以是在体外生产的扩增的核酸分子,其包含编码区的全部或一部分和/或与其连接的5
’‑
或3
’‑
非翻译序列。
[0075]
如在本文中所使用的,术语“严格条件”或“高度严格条件”对应于适于在具有确定的互补水平的核酸之间产生结合对,而不适于在显示出低于所述确定水平的互补性的核酸之间形成结合对的条件。严格条件是杂交和洗涤条件的组合并且具有序列依赖性。可以根据本领域技术人员公知的方法对这些条件进行改良(tijssen,1993,laboratory techniques in biochemistry and molecular biology—hybridization with nucleic acid probes,part i,chapter 2“overview of principles of hybridization and the strategy of nucleic acid probe assays”,elsevier,new york)。在通常情况下,将高度
严格条件选为比热熔点(tm)低约5℃,优选地在接近完全碱基配对双螺旋的tm的温度下(andersen,nucleic acid hybridization,springer,1999,p.54)。
[0076]
杂交程序是本领域所熟知的,并且描述于例如ausubel,f.m.,brent,r.,kingston,r.e.,moore,d.d.,seidman,j.g.,smith,j.a.,struhl,k.eds.(1998)current protocols in molecular biology.v.b.chanda,series ed.new york:john wiley&sons中。
[0077]
高度严格条件通常涉及在约50℃至约68℃下在5x ssc/5x denhardt溶液/1.0%sds中杂交,其中所述温度通常对应于与靶序列杂交的核酸的最高熔融温度tm,以及在约60℃至约68℃下在0.2xssc/0.1%sds中洗涤。例如,在本发明背景下,包含在至少一种寡核苷酸中的引物序列通常在约50℃至约68℃下一般在储库或者液滴或多个液滴中(如所谓的融合液滴或多个融合液滴)与互补核酸(例如互补rna序列)杂交。因此在一个实例中,所述融合液滴或所述储库还包含逆转录酶组合物,以及任选地裂解组合物,其中在本文下文的“逆转录”章节对逆转录酶组合物进行了定义以及在本文下文的“细胞裂解”章节对裂解组合物进行了定义。
[0078]
术语“抗体”指免疫球蛋白分子以及免疫球蛋白分子的免疫活性部分,即含有与抗原免疫特异性结合的抗原结合位点的分子。这样,术语抗体不仅包括完整的抗体分子,还包括抗体片段以及抗体变体,包括衍生物例如人源化抗体。在常规抗体中,两条重链通过二硫键彼此连接,并且每条重链通过二硫键与轻链连接。存在两种类型的轻链lambda(λ)和kappa(κ)。有五种主要的重链类别(或同种型),其决定了抗体分子的功能活性:igm、igd、igg、iga和ige。每条链含有不同的序列结构域。轻链包括两个结构域:可变结构域(vl)和恒定结构域(cl)。重链包括4个结构域:1个可变结构域(vh)和3个恒定结构域(ch1、ch2和ch3,统称为ch)。轻链(vl)和重链(vh)两者的可变区决定了对抗原的结合识别和特异性。轻链(cl)和重链(ch)的恒定区结构域赋予了重要的生物学性质,例如抗体链结合、分泌、转位(trans-placental)移动、补体结合和与fc受体(fcr)结合。fv片段是免疫球蛋白的fab片段的n末端部分,并且由一条轻链和一条重链的可变部分组成。抗体的特异性在于抗体结合位点与抗原决定簇之间的结构互补性。抗体结合位点由主要来自高变区或互补决定区(cdr)的残基组成。偶尔地,来自非高变区或框架区(fr)的残基影响整个结构域的结构并因此影响结合位点。互补决定区(cdr)指在一起限定天然免疫球蛋白结合位点的天然fv区域的结合亲和性和特异性的氨基酸序列。免疫球蛋白的轻链和重链各自具有3个cdr,分别称为l-cdr1、l-cdr2、l-cdr3以及h-cdr1、h-cdr2、h-cdr3。因此,抗原结合位点包括6个cdr,其包含来自每个重链和轻链v区的cdr组。框架区(fr)指介于cdr之间的氨基酸序列,即在单个物种的不同免疫球蛋白之间相对保守的免疫球蛋白轻链和重链可变区的那些部分,如kabat等所定义的(sequences of proteins of immunological interest,national institutes of health,bethesda,md.,1991)。
[0079]“抗体片段”包含完整抗体的一部分,优选完整抗体的抗原结合或可变区。抗体片段的实例包括fab、fab'、f(ab')2和fv片段;双体;线形抗体(参见美国专利号5,641,870;zapata等,protein eng.8(10):1057-1062[1995]);单链抗体分子;和由抗体片段形成的多特异性抗体。因此,术语抗体进一步表示单链抗体,例如骆驼抗体或纳米抗体或vhh。
[0080]
在本文中术语“t细胞受体”指在t细胞(,t淋巴细胞)表面上存在的抗原识别分子。
该定义明确地包括本领域公知的对该术语的理解,并且包括例如作为具有不变的cd3链的复合物的包含在细胞膜上表达的高变α或β链的二硫键连接的异二聚体或由其组成的受体,或者作为在t细胞子集上具有cd3的复合物的包含在细胞膜上表达的可变γ和δ链或由其组成的受体。
[0081]“抗体基因”和“t细胞受体基因”经历了一个称为v(d)j重组的独特基因重组机制,其仅在t细胞和b细胞成熟的早期阶段发育的淋巴细胞中发生。其涉及体细胞重组,并且导致分别在b细胞和t细胞上产生抗体/免疫球蛋白(ig)和t细胞受体(tcr)的高度多样性的库。
[0082]
在本技术中术语“多个”指超过1个相关对象的任何数字,例如超过500、超过1000、超过2000、超过5000、超过100000,例如1至100000,例如,1至10000、1至10000、10至1000、50至1000、100至1000、10至500个相关对象。
[0083]
微流体装置
[0084]
本发明的微流体方法在包含芯片的微流体装置上进行。
[0085]“微流体芯片”通常指通过对材料(玻璃、硅或聚合物,如pdms、pmma或coc)研磨、蚀刻、烧蚀或模塑制成的一组微通道。微流体芯片通常包括基材和支持物,其在一起限定了至少一条通道。
[0086]
在本发明的一些实施方式中,在本发明背景下使用的微流体装置包含含有多个储库的芯片。
[0087]
在本发明的一些实施方式中,在本发明背景下使用的微流体装置包含芯片,所述芯片包含至少一个微流体通道和多个储库。
[0088]
在相关的实施方式中,至少一个微流体通道在入口与出口之间沿着纵向方向(x)延伸。
[0089]
在相关的实施方式中,多个储库中的各个储库沿着高度方向(z)延伸,其与纵向方向(x)之间形成非零角度,并且各个储库在纵向方向(x)通向至少一个通道延伸。
[0090]
因此,在一些实施方式中,微流体装置含有芯片,所述芯片包含:
[0091]-至少一个微流体通道,其在入口与出口之间沿着纵向方向(x)延伸,
[0092]-多个储库,其中各个储库沿着高度方向(z)延伸,其与纵向方向(x)之间形成非零角度,并且各个储库通向至少一个通道。
[0093]
在一些实施方式中,在本文中“至少一个微流体通道”指至少1至100、1至80、1至50、1至40、1至30、1至20、1至10,例如1至6、1至4、1至3个通道。
[0094]
在一些实施方式中,在高度方向(z)与纵向方向(x)之间形成的非零角度是从85
°
至95
°
,优选90
°
。
[0095]
通道的入口通常用于注入至少一种流体和通道的出口通常用于收集至少一种流体。通道通常旨在允许至少一种流体沿着主方向从入口流向出口。
[0096]
通道的入口可以与至少一个储库连接,例如1至5个,优选1至4个,更优选1至3个,例如用于在通道中流动的液体的1、2或3个储库。
[0097]
通道的出口可以与至少一个储库(优选1或2个储库)连接,以收集来自通道的流体。
[0098]
在一些实施方式中,芯片是液滴阵列,更特别地是漂浮液滴阵列。
[0099]
在一些实施方式中,所述微流体装置还包含控制至少一种流体的流速的至少一个注射装置。
[0100]
在本文中“至少一种流体”可以指至少1种、至少2种、至少3种、至少4种、至少5种或多于5种流体。在入口注射的“至少一种流体”和在出口收集的“至少一种流体”可以是相同流体或不同流体。
[0101]
注射装置可以包含压力控制器或注射器驱动器。
[0102]
在一些实施方式中,在入口的至少一种流体指1种、2种、3种或4种流体,例如3种流体。
[0103]
因此在一个实例中,一种流体含有例如第一类型的液滴,一种第二流体含有例如第二类型的液滴,以及第三流体除去多个第一类型或第二类型的液滴并且将其从腔室中清除。第一类型和第二类型的液滴如本文下文在本发明方法的背景中所定义。根据所述实例,所述微流体装置还包含控制所述三种流体的流速的注射装置。
[0104]
在一些实施方式中,该装置包含适于在芯片的特定区域中感应电场的至少1个电气系统,优选1个电气系统。至少1个电气系统可以包括发电机、阳极和阴极。
[0105]
在一些实施方式中,将在本发明背景中的微流体装置用于装置组件中。
[0106]
所述装置组件还可以包含细胞分选器或用于产生液滴的单元,例如第一类型或第二类型的液滴,例如单细胞液滴或rt液滴,如在下文中进一步定义的。
[0107]
因此,在一个替代的实施方式中,芯片可以包含用于生产第一类型或第二类型的液滴(例如单细胞液滴或rt液滴,如在下文中进一步定义的)的单元。
[0108]
然后通过入口将这些液滴注入至少一个微流体通道中。
[0109]
本文中的“多个储库”指任何数量的储库。储库的数量以及因此多个储库优选地指从1至100000个储库,例如1至10000个储库,例如10至8000个、10至7000个、10至6000个、10至5000个、10至4000个、10至3000个、10至2000个、10至1000个,例如1000至10000个、1000至9000个、2000至8000个、3000至7000个、4000至6000个,例如4500至5500个。
[0110]
在本发明的背景下,可以将微流体装置的一个储库作为参照。然而,本领域技术人员将理解的是,可以将针对一个储库描述的方法平行地应用于在所使用的芯片中存在的多个储库。
[0111]
在一些实施方式中,芯片的储库是圆柱形的。在一些实施方式中,多个储库的储库尺寸是均匀的。
[0112]
本领域技术人员将理解的是,可以利用其几何参数对微流体装置(更特别地是微流体装置的芯片)进行表征,如多个储库中的一个储库的直径(d
储库
)、储库的深度(h
储库
)、注射通道的高度(h
通道
)、注射通道的宽度(w
通道
)以及多个储库中的个体储库之间的空间(x)。
[0113]
液滴
[0114]“液滴”通常指体积指标。在本发明的背景中,“液滴”指被第二流体包围的第一流体的分离的部分。值得注意的是,液滴不一定是球形的,也可以是假定的其他形状,其取决于例如外部环境。
[0115]
在本发明方法的背景下使用的术语“液滴”包括第一类型的液滴、第二类型的液滴(例如单细胞液滴或rt液滴)以及融合液滴,或者多个所述液滴。
[0116]
制备和注入液滴的方法是本领域所公知的,并且还将在本技术的下述章节“液滴
的制备”中对其进行进一步解释。对于液滴的制备而言,本领域技术人员将理解的是,液滴的尺寸遵循概率分布,例如高斯分布。还将进一步理解的是,可以对用于制备微流体液滴的参数进行选择,以获得具有特定体积的多个微流体液滴。
[0117]
在一些实施方式中,在本发明方法的背景下,液滴(特别是第一类型的液滴或第二类型的液滴)优选地基本上是单分散的。
[0118]
本文的“单分散的”指具有基本上相同的形状和/或尺寸的液滴。
[0119]
如本文如上所述,并且如本领域所公知的,液滴遵循形状和尺寸分布。因此,液滴可以具有横截面直径的均匀分布,即液滴可以具有直径或体积分布,以使得不超过约5%、不超过约2%或不超过约1%的液滴具有小于多个液滴的总体平均直径或体积的约90%(或小于约95%、或小于约99%)和/或大于其约110%(或大于约105%、或大于约101%)的直径或体积。在2004年4月9日由link等提交的名称为“formation and control of fluidic species”的国际专利申请号pct/us2004/010903(2004年10月28日以wo 2004/091763公开)中公开了用于生产横截面直径均匀分布的液滴的一些技术,其通过引用并入本文。本领域技术人员将理解的是,当在本技术中提及液滴的体积或尺寸时,该体积或尺寸指多个液滴的平均体积或尺寸。本领域的普通技术人员将能够确定液滴群的平均直径,例如使用激光散射或其他已知技术。在本发明的背景下形成的液滴可以是球形的,或者在某些情况下是非球形的。可以将与非球形液滴具有相同体积的完美数学球形的直径作为液滴(特别是非球形液滴)的直径。
[0120]“液滴”或“多个液滴”如“多个rt液滴”或“多个单细胞液滴”具有小于5nl,例如小于4nl、小于3nl,优选地小于3nl的平均体积。在一些实施方式中,所述多个微流体液滴具有小于3nl、小于2.5nl、小于2nl、小于1.5nl、小于1nl、小于0.5nl,例如0.1nl至3nl、0.5nl至3nl、1nl至3nl,通常是l0pl、20pl、30pl、50pl、0.1nl、0.5nl、1nl、1.2nl、1.4nl、1.6nl、1.8nl、2.0nl、2.2nl、2.4nl、2.6nl、2.8nl、3nl的平均体积。
[0121]
在一些实施方式中,多个微流体液滴的液滴具有1pl至5000pl、l0pl至5000pl或者l0pl至3000pl的平均体积。
[0122]
在一些实施方式中,多个微流体液滴的液滴具有等于或小于1nl的平均体积。
[0123]
因此,“融合液滴”或“多个融合液滴”具有小于10nl的平均体积。在一些实施方式中,所述多个融合液滴具有小于9nl、小于8nl、小于7nl、小于6nl、小于5nl、小于4nl、小于3nl、小于2nl、小于1nl、小于0.5nl,例如0.1nl至l0nl、0.1nl至8nl、0.1nl至6nl、0.1nl至5nl,如0.1nl至3nl、0.5nl至5nl、0.5nl至3nl、1nl至3nl,通常是0.1nl、0.5nl、1nl、1.2nl、1.4nl、1.6nl、1.8nl、2.0nl、2.2nl、2.4nl、2.6nl、2.8nl、3nl、4nl或5nl,例如11pl至8000pl的平均体积。
[0124]
在一些实施方式中,多个第一类型或第二类型的液滴(优选第一类型)具有小于注射通道高度(h
通道
)的平均直径。
[0125]
在一些实施方式中,多个第一类型或第二类型的液滴(优选第一类型)具有注射通道高度(h
通道
)30%至100%,例如注射通道高度(h
通道
)60%至100%、70%至100%、80%至100%、90%至100%、92%至98%、94%至98%,例如95%的平均直径。
[0126]
如本领域技术人员将理解的是,特别地,当在多个液滴中的至少一个第一类型的液滴通过浮力移入所述多个储库中的一个储库时,多个第一类型的液滴具有如上所述的注
射通道高度(h
通道
)30%至100%的平均直径。
[0127]
在一些实施方式中,多个第一类型或第二类型的液滴(优选第一类型)具有储库直径(d
储库
)60%至95%,例如70%至90%、75%至85%或75%至80%,优选75%至80%的平均直径。
[0128]
在一些实施方式中,多个第二类型的液滴具有大于注射通道高度(h
通道
)的平均直径,例如平均直径是100%至250%、120%至250%、150%至250%、200%至250%,优选200%至250%。
[0129]
如本领域技术人员将理解的是,当在迁移步骤中由于表面能的差异第二类型的一个液滴的至少一部分进入所述多个储库中的一个储库时,多个第二类型的液滴具有大于如本技术所述的注射通道高度(h
通道
)的平均直径。
[0130]
在一些实施方式中,多个第二类型的液滴具有小于或与第一类型的液滴一样大的平均直径。
[0131]
在一些优选的实施方式中,多个第一类型或第二类型的液滴(优选第一类型)具有1pl至5000pl,通常是1pl至4000pl、1pl至3000pl,例如1pl至500pl、1pl至400pl、1pl至300pl、1pl至200pl或1pl至100pl,优选1pl至100pl的平均体积。
[0132]
在某个实施方式中,多个第二类型的液滴具有等于或高于多个第一类型的液滴的平均体积的平均体积。
[0133]
在一些优选的实施方式中,多个第二类型的液滴具有10pl至5000pl、10pl至4000pl、10pl至3000pl,例如100pl至4000pl、100pl至3000pl、100pl至2000pl或100至l000pl,优选100pl至l000pl的平均体积。
[0134]
在一些实施方式中,多个第二类型的液滴具有储库深度(d
储库
)的100%至250%,例如150%至250%、170%至230%、180%至220%、190%至210%,例如具有储库深度(d
储库
)的200%的平均直径。
[0135]
在一些实施方式中,多个第二类型的液滴具有储库直径(d
储库
)的70%至130%,例如储库直径80%至120%、90%至120%、100%至120%、95%至115%、95%至110%,优选储库直径(d
储库
)的100%至120%的平均直径。
[0136]
在一些实施方式中,当第二类型的液滴部分进入储库时,多个第二类型的液滴具有大于储库直径(d
储库
)的平均直径。
[0137]
在本发明的背景下,微流体液滴或多个微流体液滴包含水性组合物。
[0138]
在本发明的背景下,“水性组合物”在单细胞液滴的情况下通常适于所使用的细胞并且通常包含如本文下文所定义的缓冲溶液。在rt液滴的情况下,水性组合物还可以包含例如逆转录酶、逆转录组合物和/或裂解组合物。
[0139]
液滴的制备
[0140]
在本发明方法的背景下,在一个步骤中,将包含多个第一类型的液滴的载体流体,以及在另一个步骤中,将包含多个第二类型的液滴的载体流体注入至少一个微流体通道的入口,优选一个微流体通道。
[0141]
第一类型的液滴是单细胞液滴或rt液滴,在本文下文的章节“用于条码化单细胞液滴的微流体方法”、“单细胞”和“逆转录”分别进一步定义了这些液滴的特征,其中当第一类型的液滴是单细胞液滴时第二类型的液滴是rt液滴,或者当第一类型的液滴是rt液滴
时,第二类型的液滴是单细胞液滴。
[0142]
本领域的普通技术人员将知晓用于制备微流体液滴的技术。例如在美国专利号7,708,949、8,337,778、8,765,485或者国际专利申请公开号wo 2004/091763和wo 2006/096571、pct/ep2016/080341中描述了用于在微流体液滴内包封细胞的技术,其各自通过引用并入本文。本领域技术人员可以从相同公开内容中(例如pct/ep2016/080341)容易地得出用于制备包含逆转录酶和至少一种寡核苷酸的rt液滴的技术。
[0143]
在一个实例中,在注入单独的微流体装置中之前制备单细胞液滴或rt液滴。在该实例中,通常在微流体装置中制备单细胞液滴或rt液滴,所述微流体装置具有用于液滴载体油(载体流体)的入口,和用于液滴水相组分的另外的入口。对于载体油而言,通常地,通常使用含有例如0.75%(w/w)表面活性剂(含有两个全氟聚醚嵌段(pfpe)和一个聚乙二醇(peg)嵌段的pfpe-peg-pfpe三嵌段共聚物)的氟化油(例如,hfe-7500)。表面活性剂通常用于防止液滴聚结,并且例如可以基于所使用的表面活性剂的理化性质调整其用量。用于乳化的载体油不限于氟化液体,以及可以成功使用替代流体,如基于烃的流体(例如,矿物油、己烷等)、硅油和其他类型的油。
[0144]
对于制备单细胞流体而言,一个入口用于液滴载体油,通常地还有一个另外的入口用于递送解离细胞的混悬液。
[0145]
对于制备rt液滴而言,在一个实例中,一个入口用于液滴载体油,通常地使用另外两个入口递送(1)逆转录酶和(2)至少一种寡核苷酸。
[0146]
在一些实施方式中,对于制备rt液滴,例如,在本发明方法的背景下,rt液滴可以与进一步含有成分的其他液滴融合,例如,至少一种条形码序列和至少一种染料。将流动液滴融合的方法是本领域技术人员公知的,并且例如在wo2010128157al中所描述的。
[0147]
如本领域技术人员将理解的是,例如,在单细胞液滴的情况下,在一个液滴中包封的细胞数量和液滴的尺寸遵循概率分布,例如泊松或高斯分布,并且取决于细胞浓度、主通道的几何形状,细胞悬液和载体流体的注射参数。
[0148]
因此,可以对参数进行调整以获得在其中具有1或0个细胞的液滴,从而避免了含有几个细胞的液滴。
[0149]
因此,在本发明的背景下,至少一些单细胞液滴包含一个单细胞。
[0150]
在本发明的背景下细胞包含核酸,因此本领域技术人员将理解的是,在本发明的背景下单细胞液滴含有单细胞,因此含有单细胞核酸。
[0151]
与制备单细胞液滴类似,本领域技术人员将理解的是,在rt液滴的情况下,逆转录酶和至少一种寡核苷酸的包封遵循概率分布,例如泊松或高斯分布,并且取决于逆转录酶的浓度、至少一种寡核苷酸的浓度、主通道的几何形状、逆转录酶、至少一种寡核苷酸和载体流体的注射参数。此外,在相同实施方式中,在rt液滴中含有的至少一种寡核苷酸与第一类型的至少一个颗粒结合。
[0152]
因此,在一个液滴中包封的第一类型的颗粒的数量也遵循概率分布,例如泊松分布,并且取决于颗粒浓度、主通道的几何形状、颗粒混悬液和载体流体的注射参数。
[0153]
因此,可以对参数进行调整以获得在其中具有0、1或2个颗粒的液滴。因此,在某个实施方式中,至少一些rt液滴优选地包含第一类型的一个颗粒。
[0154]“载体流体”与液滴的水性溶液不混溶。
[0155]
用于制备液滴的“载体流体”是本领域技术人员公知的并且通常是氟化油。
[0156]
因此,在一些实施方式中,载体流体是氟化油,如hfe-7500。
[0157]
此外,为了防止液滴聚结,载体流体还可以含有表面活性剂。
[0158]
因此,在一些实施方式中,载体流体还包含表面活性剂。
[0159]
表面活性剂通常以0.1%至10%,例如0.1%至1%或1%至10%、2%存在,其取决于表面活性剂的理化性质。在一个实例中,载体流体包含1.5%、1%或0.75%(v/v)的表面活性剂,例如含有两个全氟聚醚嵌段(pfpe)和一个聚乙二醇(peg)嵌段的pfpe-peg-pfpe三嵌段共聚物。
[0160]
表面活性剂优选在氟化流体中高度可溶并且在水相中几乎不溶。
[0161]
然而,由于rt液滴和单细胞液滴在后面的步骤中融合,因此用于制备液滴的表面活性剂的选择和浓度优选不会阻止所述液滴的融合。
[0162]
单细胞
[0163]
如在本文上文的章节“液滴的制备”中所述,包封条件(制备单细胞液滴的条件)优选以单细胞液滴含有0或1个细胞的方式选择。为了提高含有单细胞的液滴的百分比,在注入多个单细胞液滴的步骤之前,可以对多个单细胞液滴进行筛选和分选。
[0164]
此外,在一些实施方式中,可以在注入多个单细胞液滴之前,针对感兴趣的表型对所述多个单细胞液滴进行筛选。
[0165]
根据替代的实施方式,可以在注入多个单细胞液滴之后,针对感兴趣的第一表型和/或第二表型对所述多个单细胞液滴进行筛选。
[0166]
感兴趣的表型的实例是检测生物应答。其中,可以通过检测由抗原特异性抗体的分泌诱导的adcc(抗体依赖性细胞介导的细胞毒性)(3)来监测免疫应答的检测(见图1)。
[0167]
在生物学事件中,可以通过检测由抗原特异性抗体的分泌诱导的补体依赖性细胞毒性(cdc)(6)监测免疫应答的检测(见图2)。
[0168]
在生物学事件中,可以通过检测由抗原特异性抗体的分泌诱导的adc(抗体药物缀合物)监测药物作用的检测(见图3)。
[0169]
在生物学事件中,包括检测药物功能,像抗原特异性抗体的分泌诱导的激动性/拮抗性抗体(见图4、5)。
[0170]
在生物学事件中,包括检测药物功能,像进行竞争测定(见图6)。
[0171]
在生物学事件中,包括检测药物功能,像检测由抗体的分泌介导的报告细胞的细胞移动(见图6)。可以将这样的测定用于追踪在所述液滴内的报告细胞的行为改变。表达感兴趣的抗原并负载有未释放的可检测标记的靶细胞(1)将与igg产生细胞(2)和颗粒作为单细胞液滴共同包封。将在使得抗体分泌的条件下对液滴进行孵育。分泌的特异性抗体将重新定位到靶细胞上。同时,配体/激动剂以与igg产生相似的动力学从颗粒扩散并产生配体梯度。报告细胞将在配体浓度(9)的作用下迁移进入颗粒内。在阻断抗体(3)的情况下,报告细胞的进程被改变。然后,可以将迁移用于评估抗体的阻断/中和活性。
[0172]
因此,在一些实施方式中,在注入多个单细胞液滴之前,对单细胞液滴进行筛选和分选。
[0173]
微流体细胞分选技术是本领域技术人员公知的并且在例如wyatt schields,c.等(lab chip.2015 february 16;15(5):1230-1249)中进行了描述。
[0174]
微流体细胞分选技术的实例包括但不限于电泳、介电电泳(dep)、电渗流、声泳、光学操作、机械系统、磁泳、动电机制、光镊和被动细胞分选。一些方法也可以结合这些技术中的几种。
[0175]
在本文中被动细胞分选指依赖于固有差异并使用惯性力、流体动力学扩散、确定性横向置换、过滤、瞬时细胞粘附和细胞固化来分选细胞的方法。
[0176]
在一个优选的实施方式中,在注入多个单细胞液滴之前,使用声泳或通过介电电泳分选单细胞液滴。
[0177]
在一个实例中,优选地利用声泳(特别是表面声波)使所选择的液滴移动进入不同的分选箱,例如在us 20130213488 al中所描述的。
[0178]
在进一步优选的实施方式中,在注入之前,使用例如在wo2016059182中所述的方法,对单细胞液滴进行分选。
[0179]
如本领域技术人员所公知的,这些方法中的一些(如磁泳、声泳或动电机制)可能需要标记单细胞。然而,标记的类型以及是否需要标记可能取决于所要分析的细胞。举例来说,对于磁泳,例如,可以使用磁性颗粒对细胞进行标记,然而,例如红细胞可以基于其天然铁含量进行分选。或者,在一些实例中,可以使用铁磁流体或顺磁溶液对一些类型的细胞进行操纵。
[0180]
在大多数实施方式中,单细胞液滴还包含荧光染料。
[0181]
在本文中“荧光染料”指在光激发下能够重新发光的荧光物质。
[0182]
在一些实施方式中,例如,当在细胞分选背景下使用时,荧光染料与识别细胞上或其内部靶特征的抗体缀合;染料还可以附接在对细胞膜或其他细胞结构具有亲和性的化学实体上。在一些实施方式中,荧光染料识别细胞结构。
[0183]
在一些实施方式中,荧光染料包括但不限于反应性和缀合的染料、核酸染料、细胞功能染料以及荧光蛋白或荧光纳米颗粒。
[0184]“反应性和缀合的染料”包括但不限于氧杂蒽(例如荧光素)、罗丹明、香豆素和花青染料或其衍生物例如alexa fluor染料。
[0185]“核染料”包括但不限于sytox染料、draq7、碘化丙啶(pi)和7-氨基放线菌素d(7-aad)。
[0186]“胺染料”与细胞蛋白的氨基结合。那些染料与细胞表面的蛋白或死细胞细胞内的蛋白结合。
[0187]“细胞功能染料”是在细胞的特定代谢条件下变为荧光的染料,并且包括例如钙黄绿素。当与细胞内ca
2+
结合时,钙黄绿素变得发荧光。
[0188]“荧光蛋白”是本领域技术人员公知的,并且包括但不限于gfp或ebfp。
[0189]“荧光纳米颗粒”包括但不限于例如pan颗粒。
[0190]
如本领域技术人员将理解的是,上面提到的一些分选技术可能需要将颗粒引入单细胞液滴中。
[0191]
因此,在一些实施方式中,单细胞液滴还可以包含至少一个第二类型的颗粒。
[0192]
在一些实施方式中,在本文中至少一个第二类型的颗粒指至少1个、至少2个、至少3个,例如多于1个,例如1至10个、1至5个、1至3个颗粒。
[0193]
在一些实施方式中,第二类型的颗粒是荧光的。
[0194]
在一些实施方式中,所述第二类型的颗粒选自下组:弹性体颗粒、水凝胶颗粒、聚合物颗粒或磁性颗粒,优选水凝胶颗粒或磁性颗粒,其中在本技术的下述章节“寡核苷酸”中对磁性颗粒和水凝胶颗粒进行了定义。
[0195]
在一些实施方式中,磁性颗粒是顺磁性颗粒或超顺磁性颗粒。
[0196]
本技术中的“弹性体颗粒”指例如硅酮弹性体颗粒。
[0197]
在一些实施方式中,将第二类型的颗粒官能化,以使得其可以附着其他分子,例如蛋白、核酸或小分子。使颗粒官能化的方法是本领域技术人员公知的。
[0198]
在一些实施方式中,使用抗体将第二类型的颗粒官能化。可以使用抗体通过使用例如链霉亲和素-生物素连接将第二类型的颗粒官能化,如在本文下述第一类型的颗粒的背景下的“rt液滴”章节中所述的。
[0199]
在某个实施方式中,所述抗体针对单细胞的组分。
[0200]
在本发明的背景下,“细胞”具有其在生物学中使用的普通含义,例如细胞指可作为功能独立的生命单元(例如,单细胞生物体)或作为多细胞生物体的亚单元(例如,在植物和哺乳动物中)存在的自主自我复制单元,所述亚单元专门实施使得生物体作为一个整体的特定功能。然而,“细胞”还可以指休眠细胞,当应用有丝分裂刺激时,其通常仍能够进行细胞分裂。
[0201]
在一些实施方式中,细胞指原核细胞或真核细胞,优选真核细胞。
[0202]
将“真核细胞”与“原核细胞”加以区分的定义特征是真核细胞具有膜结合细胞器,尤其是包含遗传物质并被核膜包围的细胞核。
[0203]
在本发明背景下,“真核细胞”选自下组:哺乳动物细胞、植物细胞和真菌细胞,优选哺乳动物细胞。
[0204]
在本技术中的“哺乳动物”指任何哺乳动物,包括人、家畜和农场动物,以及动物园、运动或宠物动物,例如犬、猫、牛、马、绵羊、猪、山羊、家兔等。优选地,哺乳动物是人。
[0205]
因此,在一些实施方式中,细胞是哺乳动物细胞、经工程化的哺乳动物细胞或细胞系或哺乳动物免疫细胞。
[0206]
在一些实施方式中,哺乳动物细胞是免疫细胞。
[0207]
在一些实施方式中,免疫细胞可以是但不限于b细胞、t细胞或杂交瘤,优选b细胞。
[0208]
在一些实施方式中,本文中的一个细胞或多个细胞指不同类型的细胞或暴露于不同条件下的相同类型或来源的细胞。
[0209]
在一个特定的实施方式中,细胞是非哺乳动物细胞。
[0210]
在一个进一步特定的实施方式中,非哺乳动物细胞是酵母细胞、禽细胞或鲨鱼细胞。
[0211]
如上所述,单细胞液滴通常包含水性组合物,其中所述水性组合物通常适于所使用的细胞并且通常包含如本文下文中所定义的缓冲溶液。
[0212]
如本领域技术人员所公知的,细胞含有核酸,其中核酸的定义如本文上文所述。
[0213]
在本发明方法的背景下,细胞优选地是活细胞。将活细胞与死细胞相分离的方法是本领域技术人员公知的。
[0214]
细胞裂解
[0215]
如本领域技术人员所公知的,当所述细胞裂解时,存在于单细胞中的核酸被释放
出来。
[0216]
在本发明的背景下,“细胞裂解”可以通过酶促、物理和/或化学方法或其任何组合实现,特别是酶促、物理和/或化学方法。也可以使用其他细胞破碎方法。当在液滴(如单细胞液滴或融合液滴)中存在时,或者当在不含液滴的储库中存在时,可以将下文所述的细胞裂解方法用于裂解细胞。
[0217]
因此,在一些实施方式中,在本发明的方法的背景下的裂解步骤中使用酶促、物理和/或化学细胞裂解将单细胞或细胞裂解。
[0218]
用于除去细胞壁的“酶促方法”是本领域中公认的。酶通常是能够购买得到的,并且在大多数情况下,最初是从生物来源分离的。通常使用的酶包括溶菌酶、溶葡球菌酶、消解酶、变溶菌素、聚糖酶、蛋白酶和甘露糖(mannose)。
[0219]
如本领域技术人员所公知的,“化学细胞裂解”是通过化学物质例如去垢剂实现的,其通过破坏脂质-脂质、脂质-蛋白和蛋白-蛋白相互作用来破坏细胞周围的脂质屏障。用于细胞裂解的理想去垢剂取决于细胞类型和来源。非离子和两性离子去垢剂是较温和的去垢剂。triton x系列非离子去垢剂和两性离子去垢剂3-[(3-氯代丙基)二甲基氨基]-1-丙磺酸盐(chaps)通常用于这些目的。而相反的是,离子去垢剂是强溶解剂并且倾向于使蛋白变性,从而破坏蛋白的活性和功能。sds是一种结合并使蛋白质变性的离子去垢剂,在本领域中广泛用于破坏细胞。
[0220]“物理细胞裂解”指使用超声、热休克、冰休克或电穿孔。
[0221]
在一个实例中,使用冷休克将细胞裂解。在本发明方法的背景下,其可以通过冷却例如包含在多个储库中的单细胞的芯片实现。
[0222]
如本文的下文中所述,在一些实施方式中,rt液滴或多个rt液滴、融合液滴或多个融合液滴、或多个储库包含裂解组合物。
[0223]
在一些实施方式中,裂解组合物包含选自下组的酶:溶菌酶、溶葡球菌酶、消解酶、变溶菌素、聚糖酶、蛋白酶和甘露糖。
[0224]
在一个优选的实施方式中,在本发明的背景下,裂解组合物包含氯化镁、去垢剂、缓冲溶液和rnase抑制剂。
[0225]
在一些实施方式中,去垢剂选自下组:triton-x-100、np-40、nonidet p40、以及tween-20和igepal ca 630。
[0226]
缓冲溶液的非限制性实例可以包括tris-hci、hepes-koh、pipes-naoh、马来酸、磷酸、柠檬酸、苹果酸、甲酸、乳酸、琥珀酸、乙酸、新戊酸(三甲基乙酸)、吡啶、哌嗪,吡啶甲酸、l-组氨酸、mes、bis-tris、bis-tris丙烷、ada、aces、mopso、pipes、咪唑、mops、bes、tes、hepes、dipso、tapso、tea(三乙醇胺)、n-乙基吗啉、popso、epps、hepps、heppso、tris、三甲基甘氨酸、双甘氨肽、二甘氨酸、taps、吗啉、n-甲基二乙醇胺、ampd(2-氨基-2-甲基-1,3-丙二醇)、二乙醇胺、ampso、硼酸、ches、甘氨酸、capso、乙醇胺、amp(2-氨基-2-甲基-1-丙醇)、哌嗪、caps、1,3-二氨基丙烷、cabs或哌啶(亦参见www.reachdevices.com/protein/biologicalbuffers.html)。rnase抑制剂的非限制性实例可以包括rnase out、in、superin rnase和靶向广泛rnase(例如,a、b、c、1和t1)的那些抑制剂。
[0227]
如本文下述章节“用于条形码化单细胞核酸的微流体方法”中所述,当应用于液滴时,通常在将单细胞液滴与rt液滴融合后发生化学裂解。在一些实施方式中,细胞裂解优选
地发生在进行表型测定后,例如在用于对具有感兴趣表型的单细胞进行基因分型的方法的步骤b)之后。
[0228]
如本领域技术人员将理解的是,当加入其他组分时,例如逆转录酶和逆转录酶组合物以及裂解组合物的组分将被稀释,例如,在一个实例中,当rt液滴和单细胞液滴融合时,裂解组合物将被稀释。
[0229]
因此,针对裂解组合物的成分给出的浓度优选以最终浓度给出,例如在液滴融合之后。因此,本领域技术人员将理解以调整在储库或rt液滴中存在的初始浓度。
[0230]
在一些实施方式中,氯化镁的浓度是1mm至20mm。
[0231]
在一些实施方式中,去垢剂的浓度是0.1%至10%。
[0232]
在一个实例中,裂解组合物通常是0.2%triton、3mm mgcl2、50mm tris-hci ph 7.4。
[0233]
逆转录(rt)
[0234]
在本发明的方法的背景下的一个步骤中,注入多个rt液滴,其中至少一些rt液滴包含逆转录酶(rt)和至少一种寡核苷酸。
[0235]
在用于对具有感兴趣表型的单细胞进行基因分型的微流体方法的背景下,在多个储库的各个储库中提供了逆转录酶(rt)和至少一种寡核苷酸。
[0236]“逆转录酶(rt)”是在称为逆转录的方法中使用的从核酸模板(特别是rna模板)产生互补dna(cdna)的酶。
[0237]
在一些实施方式中,逆转录酶选自下组:superscriptase i、superscriptase ii、superscriptase iii、superscriptase iv、鼠类白血病rt、smartscribe rt或multiscribe rt。
[0238]
在一些实施方式中,逆转录酶具有模板转换活性。
[0239]
模板转换活性允许使用通用序列唯一地标记cdna。使用模板转换活性导致在其5’端用所述通用序列独特地标记cdna。在本技术中通用序列指通常用于cdna 5’端快速扩增(race)的序列。本领域技术人员通常知晓如何进行5’race以及可以使用哪种通用序列。
[0240]
在本发明方法的背景下,在第一类型的至少一个液滴与第二类型的至少一个液滴融合之后,或者任选地当在没有液滴的情况下进行该方法时,在对具有感兴趣表型的单细胞进行基因分型的方法的步骤c)之后,进行逆转录。
[0241]
因此,如在本文上文裂解组合物的背景下所述的,本领域技术人员将理解的是,当将不同成分(例如裂解组合物、逆转录酶或逆转录酶组合物)混合时,例如逆转录酶的成分将被稀释。因此,针对本文下文中的任何成分给出的浓度优选以例如液滴融合后存在的最终浓度给出。
[0242]
在一些实施方式中,逆转录酶的浓度是1至50u/μι,优选5至25u/μι,例如12.5u/μι。
[0243]“逆转录”或“rt反应”是一种方法,其中通过使用总细胞rna或poly(a)rna、逆转录酶、引物、dntp和rnase抑制剂将单链rna逆转录为单链互补dna(cdna)。本领域技术人员将理解的是,逆转录的产物是包含与其模板rna杂交的单链cdna的rna/dna双螺旋。将进一步理解的是,所述rna/dna双螺旋进一步与包含用于逆转录的引物序列的至少一种寡核苷酸连接。
[0244]
因此,本领域技术人员将理解的是,对核酸进行逆转录(例如在用于对单细胞核酸进行条码化的微流体方法的步骤b)中)导致产生单细胞cdna。
[0245]
因此,在一些实施方式中,至少一些融合液滴还包含由对来自单细胞裂解物的核酸进行逆转录产生的单细胞cdna。
[0246]
因此,在一些实施方式中,当不使用液滴时,储库还包含由对来自单细胞裂解物的核酸进行逆转录产生的单细胞cdna。
[0247]
在一些实施方式中,所述cdna指单链互补dna。
[0248]
在进一步的实施方式中,所述cdna包含在rna/dna双螺旋中。
[0249]
在一些实施方式中,rna/dna双螺旋指已被逆转录并且仍部分或全长地与合成cdna和/或至少一种多核苷酸的引物序列杂交的rna。
[0250]
如本领域技术人员将理解的是,在一些实施方式中,rna/dna双螺旋与至少一种寡核苷酸连接,所述寡核苷酸包含引物序列,在杂交步骤(例如,在步骤a)中)核酸(优选mrna)与之杂交,以及其在逆转录步骤(例如,在步骤b)中)用于逆转录。
[0251]
如本领域技术人员将理解的是,在一些实施方式中,至少一种寡核苷酸以及因此rna/dna双螺旋与第一类型的颗粒连接。
[0252]
在一些实施方式中,多个储库、rt液滴或多个rt液滴或者融合液滴或多个融合液滴包含逆转录酶组合物。
[0253]
在一些实施方式中,逆转录酶组合物包含蛋白酶抑制剂、dntp和/或dtt,优选蛋白酶抑制剂、dntp和dtt。
[0254]
在一些实施方式中,蛋白酶抑制剂包含多种蛋白酶抑制剂。
[0255]
在一些实施方式中,蛋白酶抑制剂选自下述列表:亮抑酶肽半硫酸盐、抑肽素(pepstatin)a、aebsf、抑肽酶、贝他定盐酸、e-64和pmsf。
[0256]
例如,蛋白酶抑制剂可以包含亮抑酶肽半硫酸盐、抑肽素a、aebsf、抑肽酶、贝他定盐酸、e-64和pmsf中的一种或多种。
[0257]
如在本技术中所使用的,术语“dntp”指脱氧核苷三磷酸,例如脱氧腺苷-5
’‑
三磷酸(datp,“a”)、脱氧胞苷-5
’‑
三磷酸(dctp,“c”)、脱氧鸟苷-5
’‑
三磷酸(dgtp,“g”)、脱氧胸苷-5
’‑
三磷酸(dttp,“t”)或者脱氧尿苷-5
’‑
三磷酸(dutp,“u”)。术语“dntp”还旨在指包含经修饰的碱基和碱基类似物的脱氧核苷三磷酸,所述碱基类似物能够模拟a、c、g、t或u的碱基配对,或者能够以简并模式进行碱基配对,例如与a或g、c或t、a或c、g或t、g或c或者a或t配对的碱基,称为核苷酸类似物。所述核苷酸类似物可以用于例如纯化,如在本文下文中对其进行进一步说明。
[0258]
本领域技术人员将理解的是,针对逆转录酶组合物的成分给出的浓度优选以例如在液滴融合后的融合液滴中存在的最终浓度给出。
[0259]
在一些实施方式中,dtt的浓度是1mm至l0mm,优选5mm。
[0260]
在一些实施方式中,dntp的浓度是0.01mm至l0m m,优选0.1至1mm,更优选0.5mm。
[0261]
在一些实施方式中,逆转录酶组合物还包含rnase抑制剂。在本文上文的章节“细胞裂解”中对rnase抑制剂进行了定义。
[0262]
寡核苷酸
[0263]
术语“寡核苷酸”如本文上文所定义的。
[0264]
在本发明的微流体方法的背景下,“至少一种寡核苷酸”包含引物序列。
[0265]“引物序列”通常是短的单链核酸,长度在10到50个核苷酸之间,设计为完全或几乎完全匹配感兴趣的核酸,以将其捕获,然后通过常规pcr对其进行扩增或通过常规rt对其进行逆转录。引物序列对其杂交的核酸是“特异性”的,即其优选地在严格杂交条件下杂交,更优选地在高度严格杂交条件下杂交,或者与其杂交的核酸(也称为靶序列)互补或几乎互补。
[0266]“严格条件”或“高度严格条件”如本文的上文所定义的。
[0267]
通常地,将引物序列作为核酸合成的起始点,允许聚合酶例如核酸聚合酶延伸引物序列并复制互补链。引物序列可以与靶核酸互补并与靶核酸杂交。在一些实施方式中,引物序列是合成的引物序列。
[0268]
在一些实施方式中,引物序列是非天然存在的引物序列。引物序列通常具有10至50个核苷酸的长度。例如,引物序列可以具有10至40、10至30、10至20、25至50、15至40、15至30、20至50、20至40或者20至30个核苷酸的长度。在一些实施方式中,引物序列具有18至24个核苷酸的长度。
[0269]
在一些实施方式中,引物序列选自下组:poly-t序列、随机dna序列和基因特异性序列。
[0270]
在本文中的“poly t序列”指含有10至50、10至40、10至30、10至20、25至50、15至40、15至30、20至50、20至40或者20至30个胸腺嘧啶“t”的序列。poly t序列与在mrna中存在的poly a尾杂交。
[0271]
在一些实施方式中,随机dna序列可以是任何适宜的长度如6至50、6至50、6至40、6至30、6至20、10至50、10至40、25至50、15至40、15至30、20至50、20至40或者20至30个核苷酸。
[0272]
在一个特定的实施方式中,引物是基因特异性序列并且基因选自下组:抗体重链可变基因、抗体重链恒定基因、抗体轻链可变基因、抗体轻链恒定基因、αt细胞受体基因(可变的或恒定的)、βt细胞受体基因(可变的或恒定的)、δt-细胞受体基因(可变的或恒定的)或者选择用于转录组分析的组的基因。
[0273]
措辞“抗体重链可变基因”、“抗体重链恒定基因”、“抗体轻链可变基因”和“抗体轻链恒定基因”中的术语“抗体”如本文的上文所定义的。
[0274]
在措辞“αt细胞受体基因”、“βt细胞受体基因”和“δt细胞受体基因”或“γt细胞受体基因”中的术语“t细胞受体”如本文的上文所定义。
[0275]
措辞“基因”如本文的上文所定义。
[0276]
本领域技术人员将理解的是,存在于多个储库的每个储库中或存在于一个rt液滴中的至少一种寡核苷酸的数量将适于将要从一个单细胞中转录或条形码化的不同核酸的数量(特别是rna的数量)。
[0277]
因此,在措辞“至少一种寡核苷酸”中的“至少一种”指在一个液滴或储库中存在的不同寡核苷酸的数量,其中至少一种寡核苷酸中的一种寡核苷酸的引物序列不同于其他寡核苷酸。
[0278]
在一些实施方式中,在措辞“至少一种寡核苷酸”中的“至少一种”指至少2种、至少3种、至少4种、至少5种、至少6种、至少7种、至少8种、至少9种、至少10种寡核苷酸。在一些实
施方式中,至少一种寡核苷酸指1至100种寡核苷酸,1至80种、1至60种、1至40种、1至30种、1至20种、1至10种,优选1、2、3、4、5、6、7、8、9种寡核苷酸。
[0279]
应当理解的是,因此“至少一种寡核苷酸”指以某种浓度存在于rt液滴或每个储库中的至少一种寡核苷酸,并且因此来自至少一种寡核苷酸的一种寡核苷酸指具有相同序列的多个寡核苷酸。
[0280]
本领域技术人员还将理解的是,例如当将细胞的转录组转录和条形码化时,将使用具有对所有mrna具有特异性的引物序列的寡核苷酸,如poly t引物序列,如将在本技术的下文中所进一步定义的,而当将基因特定转录组转录和条形码化时,使用包含基因特异性引物序列的寡核苷酸,如将在本文的下文中所进一步定义。
[0281]
因此,将理解的是,寡核苷酸的数量至少对应于其转录组将被转录和条形码化的特定基因的数量。
[0282]
在一个特定的实施方式中,至少一种寡核苷酸是至少两种寡核苷酸,其中至少两种寡核苷酸中的一种包含对一种基因(如抗体重链可变基因)具有特异性的引物序列,和其中另一种寡核苷酸包含对另一种基因(如抗体轻链可变基因)具有特异性的引物序列。
[0283]
在另一个特定的实施方式中,至少一种寡核苷酸是至少两种寡核苷酸,其中至少两种寡核苷酸中的一种包含对例如αt细胞受体基因或βt细胞受体基因或γt-细胞受体基因具有特异性的引物序列,和其中至少两种寡核苷酸的另一种包含对例如δt-细胞受体基因具有特异性的引物序列。
[0284]
在另一个特定的实施方式中,至少一种寡核苷酸是至少三种寡核苷酸,其中至少三种寡核苷酸的第一种包含对例如αt细胞受体基因具有特异性的引物序列和至少三种寡核苷酸的第二种包含对例如βt细胞受体基因具有特异性的引物序列,和其中至少三种寡核苷酸的第三种包含对例如poly a mrna具有特异性的引物序列。
[0285]“转录组”通常指在一个细胞或细胞群中所有信使rna分子的集合。因此,在本技术中“细胞的转录组”或“单细胞的转录组”指在一个细胞中的所有信使rna分子的集合。
[0286]
如本领域技术人员将理解的是,因此,基因特定转录组指来自一个基因的所有信使rna分子的集合。
[0287]
如本领域技术人员所知晓的,称为亚型(isoform)的不同基因产物可以由一个基因编码。因此,基因特定转录组还可以指一个特定基因的至少一个特定亚型的信使rna分子,例如一个特定基因的1、2、3、4个或更多个特定亚型的信使rna分子或一个特定基因的所有亚型的信使rna分子。
[0288]
因此,在一些实施方式中,在本发明背景下的单细胞核酸是rna,其中rna是如本文的上文所定义的。
[0289]
在其他的实施方式中,mrna包含poly a序列,也称为poly a尾。
[0290]
此外,在一些特定的实施方式中,在本发明的背景下,“至少一些核酸”指至少一种核酸,优选地,至少2种、至少3种、至少4种、至少5种或更多种核酸。在一个特定的实施方式中,步骤a)和步骤b)的核酸指1、2、3、4、5、6、7、8、9或10种核酸。
[0291]
可以将本发明的方法用于将单细胞的一种特定核酸至所有核酸逆转录。
[0292]
因此,在其他的实施方式中,在本发明的背景下,“至少一些核酸”指1至100000种核酸,例如1至80000种、1至60000种、1至40000种,如1、1000、2000、4000、6000、8000、10000、
12000、14000、16000、20000、25000、30000、45000、50000种核酸。因此,在一些实施方式中,本技术中的核酸指所有基因的rna。
[0293]
如上所述,本发明的方法还指逆转录基因定性转录组。
[0294]
因此,在一些实施方式中,本技术中的核酸指至少一种特定基因的rna。
[0295]
所述至少一种特定基因可以是至少1种、至少2种、至少3种、至少4种、至少5种,如1至10种、1至5种基因,例如1、2、3、4、5、6、7、8、9或10种基因。
[0296]
在一些实施方式中,所述至少一种特定基因选自下组:抗体重链可变基因、抗体重链恒定基因、抗体轻链可变基因、抗体轻链恒定基因、αt细胞受体基因、βt细胞受体基因、δt细胞受体基因和γt细胞受体基因。
[0297]
在一些实施方式中,还可以对特定基因进行选择以进一步获得细胞表型信息以及基于基因表达对细胞分类。
[0298]
在一些实施方式中,至少一种寡核苷酸还包含启动子和/或间隔子序列。
[0299]
启动子和/或间隔子序列优选地位于5’端或位于引物序列的5’端。启动子序列的实例包括但不限于:t7启动子、t3启动子或sp6启动子。
[0300]
在一些实施方式中,寡核苷酸还包含条形码序列。
[0301]
因此,在一些实施方式中,寡核苷酸包含从5’至3’的条形码序列和引物序列。
[0302]
在本技术中“条形码序列”或简称“条形码”指能够通过其序列与另一核酸序列相区分的独特的核酸序列,因此允许独特地标记核酸序列,以使得能够将其与携带另一条形码序列的另一核酸相区分。
[0303]
在一些实施方式中,条形码序列独特地从由其他细胞释放的核酸中识别由单细胞释放的核酸,例如,甚至在将核酸混合在一起之后。
[0304]
在一些实施方式中,将条形码序列用于区分例如来自不同细胞或其他来源的几十种、几百种或者甚至几千种核酸。
[0305]
在一些实施方式中,条形码序列是任何适宜的长度。足以将该条形码序列与其他条形码序列相区分的长度是条形码序列优选的长度。在一些实施方式中,条形码序列具有1至5、1至10、5至15或多于15个核苷酸的长度,如3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50、55、60、65、70、72、74、76、78、80、85、90或更多个核苷酸,如50至85个、60至80个、70至80个核苷酸。
[0306]
在一些实施方式中,条形码序列由一种以上条形码序列构成,因此可以将其称为“至少一种条形码序列”。
[0307]
在一个相关的实施方式中,不同的条形码序列可以来自潜在条形码序列的“库(pool)”,其本身通常由裂分合成法(split and poll synthesis)产生。如果条形码序列由一种以上条形码序列组成,则条形码序列可以来自潜在条形码序列的相同或不同的库。可以使用任何适宜的技术对序列的库进行选择,例如随机地,或者使得序列能够进行错误检测和/或校正,例如被一定距离(例如,hamming距离)所分隔,使得可以对在条形码序列读取中的错误进行检测,以及在一些情况下进行校正。库可以是任何数量的潜在条形码序列,例如至少100、至少300、至少500、至少1,000、至少3,000、至少5,000、至少10,000、至少30,000、至少50,000、至少100,000、至少300,000、至少500,000或至少1,000,000种条形码序列。
[0308]
将来自一个“库”或一个以上“库”的条形码序列连接在一起的方法是本领域技术人员公知的,并且包括但不限于使用连接酶和/或使用退火或引物延伸的方法。
[0309]
连接酶的非限制性实例包括dna连接酶,如dna连接酶i、dna连接酶ligase ii、dna连接酶iii、dna连接酶iv、t4 dna连接酶、t7 dna连接酶、t3 dna连接酶、大肠杆菌dna连接酶、taq dna连接酶等。很多这样的连接酶可以商业购买获得。
[0310]
在一些实施方式中,条形码序列是双链或单链核酸。
[0311]
在一些实施方式中,寡核苷酸还包含独特的分子标识符(umi)。umi位于条形码序列的3’端或5’端。
[0312]“独特的分子标识符”(umi)序列是本领域技术人员熟知的,并且例如在kivioja等人(nature method,2012,vol 9,n
°
l)中对其进行了描述。umi序列允许重复读取结果的生物信息去除。
[0313]
在一些实施方式中,通过最初将至少一种寡核苷酸与至少一个第一类型的颗粒结合,将至少一种寡核苷酸引入储库或液滴中,特别是引入rt液滴中。
[0314]
本领域技术人员将理解的是,将至少一种寡核苷酸暂时与颗粒结合允许提供具有大量寡核苷酸的颗粒。此外,最初将至少一种寡核苷酸与颗粒结合特别是当使用液滴时促进在每个液滴(如rt液滴)中引入至少一种寡核苷酸。
[0315]
因此,在一些实施方式中,储库或rt液滴还包含与至少一种寡核苷酸结合的至少一个第一类型的颗粒。
[0316]
本技术中的至少一个第一类型的颗粒指至少1个、2个、3个、4个、5个或更多个第一类型的颗粒,优选一个第一类型的颗粒。
[0317]
如本领域技术人员将理解的以及如文上文所解释的,在一个rt液滴中包封的第一类型的颗粒的数量和液滴的尺寸遵循概率分布,例如泊松分布,并且取决于第一类型的颗粒的浓度、水性组合物(如逆转录组合物或裂解组合物)的注射参数、主通道的几何形状、第一类型的颗粒和载体流体的注射参数。
[0318]
因此,在一些实施方式中,可以对参数进行调整以获得在其中具有2、1或0个第一类型颗粒的rt液滴,从而避免了液滴中含有2个以上第一类型的颗粒。
[0319]
在一个相关的实施方式中,可以对参数进行调整以获得在其中具有1或0个第一类型颗粒的rt液滴,从而避免了液滴中含有1个以上第一类型的颗粒。
[0320]
在一些实施方式中,至少一个第一类型的颗粒包封在rt液滴内,优选地,在每个液滴中含有不超过约2个第一类型的颗粒,在其他的实施方式中,至少一个第一类型的颗粒以不超过约1个颗粒/液滴包封在液滴内,或者至少一个第一类型的颗粒优选地以1个颗粒/液滴包封在液滴内,或者至少一个第一类型的颗粒以平均1个颗粒/液滴包封在液滴内。
[0321]
类似地,当不使用液滴时,在一些实施方式中,每个储库优选地包含不超过约2个第一类型的颗粒/储库,优选地不超过约1个颗粒/储库,或1个颗粒/储库,或平均1个颗粒/储库。
[0322]
在本发明的背景下,“颗粒”,例如第一类型的颗粒或第二类型的颗粒,指微粒。
[0323]
在一些实施方式中,颗粒是水凝胶颗粒、聚合物颗粒或磁性颗粒。
[0324]
颗粒可以具有不规则或规则的形状。例如,颗粒可以是球形的、椭圆形的或立方形的。
[0325]
在一些实施方式中,在本发明的背景下,颗粒是水凝胶颗粒。
[0326]
例如在名称为“assay and other reactions involving droplets”的国际专利申请号wo 2008/109176中描述了“水凝胶颗粒”。水凝胶的实例包括但不限于琼脂糖、聚(乙二醇)二丙烯酸酯或丙烯酰胺基凝胶,例如双丙烯酰胺、聚丙烯酰胺、链霉亲和素丙烯酰胺、聚-n-异丙基丙烯酰胺或聚n-异丙基聚丙烯酰胺或其混合物。在一个实例中,水凝胶颗粒包含丙烯酰胺、双丙烯酰胺和链霉亲和素丙烯酰胺。
[0327]
在另一组实施方式中,颗粒包含一种或多种聚合物,并且因此在本技术中将其称为“聚合物颗粒”。示例性的聚合物包括但不限于聚苯乙烯(ps)、聚己内酯(pcl)、聚异戊二烯(pip)、聚(乳酸)、聚乙烯、聚丙烯、聚丙烯腈、聚酰亚胺、聚酰胺和/或这些和/或其他聚合物的混合物和/或共聚物。
[0328]
此外,在一些实施方式中,颗粒是磁性的,并因此将其称为“磁性颗粒”,其能够允许对颗粒进行磁性操纵。
[0329]
例如,磁性颗粒可以包含铁或其他磁性物质。
[0330]
还可以对颗粒(特别是第一类型或第二类型的颗粒)进行官能化,以使得其可以附着其他分子,例如蛋白、核酸或小分子。因而,本发明的一些实施方式涉及一组颗粒,将其定义为例如核酸、蛋白、小分子或其他物质(如本技术中所述的那些)的文库。在一个实例中,使用抗体将所述颗粒官能化。在一些实施方式中,所述抗体是针对细胞的组分的。
[0331]
在一些实施方式中,颗粒(特别是第一类型的颗粒)是荧光的。
[0332]
在一些实施方式中,颗粒包含链霉亲和素。链霉亲和素可以与本文上文所定义的颗粒的表面偶联。
[0333]
在一些实施方式中,第1种或第2种颗粒的尺寸为0.1pl至100pl,如0.1pl至500pl、0.1pl至400pl、0.1pl至400pl、0.1pl至300pl,例如0.5pl至300pl、0.5pl至250pl、0.5pl至200pl、1pl至250pl、1pl至200pl,优选地1pl至200pl,通常100pl至200pl,如150pl。
[0334]
在一些实施方式中,至少一种寡核苷酸是与至少一个第一类型的颗粒共价连接的或非共价连接的,其中至少一个第一类型的颗粒是如本文的上文所定义的。
[0335]
在本文中“非共价连接”指例如链霉亲和素-生物素键。其他非共价键是本领域技术人员公知的,如抗生物素蛋白-生物素键或其his标签和镍键。
[0336]
在本技术中“共价连接”指例如氨基键或丙烯酸亚磷酰胺键。
[0337]“链霉亲和素”通常指从细菌streptomyces avidinii中纯化获得的52.8kda蛋白。链霉亲和素同源四聚体与生物素具有极高的亲和性,其解离常数(kd)的数量级为≈10-14
mol/l,生物素与链霉亲和素的结合是自然界中已知最强的非共价相互作用之一。
[0338]
在一个优选的实施方式中,非共价键是链霉亲和素-生物素连接。
[0339]
链霉亲和素-生物素键是本领域技术人员公知的。
[0340]
因此,在一些实施方式中,第一类型的颗粒例如包含链霉亲和素,和在同一实施方式中,至少一种寡核苷酸包含生物素。换言之,至少一种类型的寡核苷酸是生物素官能化的。
[0341]
不依赖于将至少一种类型的寡核苷酸与第一类型的颗粒连接所使用的键的类型,至少一种类型的寡核苷酸还可以包含至少一种接头序列。
[0342]
因此,在其他的实施方式中,“至少一种类型的寡核苷酸”或简称为“寡核苷酸”还
包含至少一种接头序列,所述接头序列优选包含在5’端附近。
[0343]
在一些情况下,除了上文所述的引物序列以外,寡核苷酸还可以含有用于测序的一种或多种引物。用于测序的这样的引物序列的实例包括但不限于p5引物、p7引物、pe1引物、pe2引物、a19引物或本文中讨论的其他引物。
[0344]
因此,在一些实施方式中,至少一种类型的寡核苷酸包含从5’至3’任选地接头序列、任选地启动子序列、任选地用于测序的引物序列、任选地条形码序列、任选地umi和引物序列。
[0345]
因此,本领域技术人员将理解的是,在一些实施方式中,至少一种寡核苷酸通过5’端与第一类型的颗粒结合。
[0346]
然而,在一些替代的实施方式中,至少一种寡核苷酸可以通过3’端与第一类型的颗粒结合。
[0347]
在一些实施方式中,“接头序列”是至少一种寡核苷酸通过其与第一类型的颗粒任选地连接的序列。
[0348]“本文中任选地连接”指一旦将与颗粒连接的至少一种类型的寡核苷酸加载入rt液滴或多个rt液滴或储库中,可以释放至少一种类型的寡核苷酸的可能性,以使得rt液滴或融合液滴或储库包含第一类型的颗粒和至少一种寡核苷酸,而至少一种类型的寡核苷酸不与所述第一类型的颗粒连接。
[0349]
优选地,接头序列是可裂解的接头序列,例如在应用适宜的刺激后能够被裂解,如酶促和/或光裂解。
[0350]“可裂解的接头”可以包括但不限于tev、胰蛋白酶、凝血酶、组织蛋白酶b、组织蛋白酶d、组织蛋白酶k、caspase lumatrix金属蛋白酶序列、磷酸二酯、磷脂、酯、-半乳糖、二烷基二烷氧基硅烷、氰乙基基团、砜、乙二醇二琥珀酸酯、2-n-酰基硝基苯磺酰胺、α-硫代苯酯、不饱和乙烯基硫醚、活化后的磺酰胺、丙二醛(mda)-吲哚衍生物、乙酰丙酰基酯、腙、酰腙、烷基巯基酯、二硫桥、偶氮化合物、2-硝基苄基衍生物、苯甲酰酯、8-喹啉基苯磺酸酯、香豆素、磷酸三酯,双芳基腙、bimane双硫代丙酸衍生物、对甲氧基苄基衍生物、叔丁基氨基甲酸酯类似物、二烷基或二芳基二烷氧基硅烷、原酸酯、缩醛、乌头酰基、腙、β-硫代丙酸酯、氨基磷酸酯、亚胺、三苯甲基、乙烯基醚、聚缩酮、2-(二苯基膦基)苯甲酸烷基酯衍生物、烯丙基酯、8-羟基喹啉酯、吡啶甲酸酯、邻二醇和硒化合物(参见例如,leriche g,chisholm l,wagner a)。
[0351]
可裂解的接头是本领域技术人员所熟知的,并且在化学生物学,例如leriche h.等(bioorg med chern.15;20(2):571-82.2012)中对其进行了进一步描述。裂解条件和试剂包括但不限于酶、亲核/碱性试剂、还原剂、光辐射、亲电/酸性试剂、有机金属和金属试剂以及氧化试剂。
[0352]
在一些实施方式中,本发明的方法还包括将与至少一个第一类型的颗粒结合的至少一种寡核苷酸从所述颗粒释放的步骤,例如在将其掺入rt液滴之后或者在储库中提供其之后。
[0353]
此外,在一些实施方式中,在单细胞核酸逆转录之前,将最初与至少一个第一类型的颗粒结合的至少一种寡核苷酸从所述至少一个第一类型的颗粒释放。
[0354]
在一些实施方式中,将至少一种寡核苷酸释放的步骤可以发生在将单细胞与rt液
滴融合之前或之后,将细胞裂解之后和/或将单细胞的核酸逆转录之前。
[0355]
本领域技术人员将理解的是,取决于选择用于释放至少一些寡核苷酸的时间点,术语“至少一些寡核苷酸”可以指例如与由细胞释放的核酸或dna/rna双螺旋杂交的至少一些寡核苷酸,如本文的上文中所定义的。
[0356]
在一些实施方式中,可以使用任何方法释放至少一些寡核苷酸,例如酶、亲核/碱性试剂、还原剂、光辐射、亲电/酸性试剂、有机金属和金属试剂以及氧化试剂。
[0357]
在一些实施方式中,可以使用酶促和/或光裂解释放至少一种寡核苷酸。例如,可以将核酸内切酶用于裂解接头序列或任何其他序列以从第一类型的颗粒中释放至少一些寡核苷酸。
[0358]
在其他的实施方式中,释放寡核苷酸指破坏键,例如链霉亲和素生物素键。破坏链霉亲和素生物素键的方法是本领域技术人员公知的,并且包括链霉亲和素的酶促消化和/或链霉亲和素的变性。
[0359]
在一些实施方式中,通过酶促消化链霉亲和素释放寡核苷酸。
[0360]
至少一种寡核苷酸的浓度是10nm,优选地至少100nm。
[0361]
在一些实施方式中,至少一种寡核苷酸的浓度是至少150nm、至少200nm、至少300nm、至少400nm、至少500nm、至少600nm、至少700nm、至少800nm、至少900nm和至少1μμ,例如100nm至5μμ、100nm至4μμ、100nm至3μμ、100nm至2μμ、100nm至1μμ,优选地100nm至500nm。
[0362]
在一个实例中,引物序列是poly t引物序列和至少一种寡核苷酸的浓度是100nm至3300nm(对应于3.3μμ)。
[0363]
在其他的实例中,引物序列是基因特异性引物序列和至少一种寡核苷酸的浓度是100nm或1000nm(对应于1μμ)。
[0364]
在一些实施方式中,在微流体液滴中的至少一种寡核苷酸中的每种寡核苷酸的浓度是至少10nm,优选至少100nm。
[0365]
在一些实施方式中,至少一种寡核苷酸中的每种寡核苷酸的浓度是至少150nm、至少200nm、至少300nm、至少400nm、至少500nm、至少600nm、至少700nm、至少800nm、至少900nm和至少1μμ,例如100nm至5μμ、100nm至4μμ、100nm至3μμ、100nm至2μμ、100nm至1μμ,优选100nm至500nm。
[0366]
根据上述,在一些实施方式中,储库、rt液滴和多个rt液滴还包含裂解组合物,其中所述裂解组合物是在本文上文的章节“细胞裂解”中所定义的。
[0367]
在一些实施方式中,至少一种寡核苷酸的浓度指在储库、在rt液滴或在融合液滴中的浓度。
[0368]
在一些实施方式中,可以在注入多个rt液滴之前对rt液滴进行筛选和分选。
[0369]
因此,在一些实施方式中,rt液滴还包含第二类型的颗粒,其中所述第二类型的颗粒是如在章节“单细胞”中所定义的。
[0370]
因此,在一些其他的实施方式中,rt液滴还包含如本文上文中所定义的染料。
[0371]
扩增和测序
[0372]
在一些实施方式中,本发明的方法还包括在回收所述条形码化的单细胞cdna后,扩增条形码化的单细胞cdna的步骤。在一些实施方式中,在除去未掺入的寡核苷酸之后,进
行所述扩增步骤。在一些实施方式中,在如本文的下文中定义的测序步骤之前,进行所述扩增步骤。
[0373]
在一些实施方式中,扩增步骤在多重反应、分离的聚合酶链反应(pcr)(见图11)、等温扩增或线性扩增中进行。
[0374]
在一些实施方式中,线性扩增是体外转录。
[0375]
在一些实施方式中,使用qpcr(例如单一和/或多重qpcr反应)对在本发明的方法中生产的条形码化的单细胞cdna进行定量。
[0376]
在其他的实施方式中,本发明的方法还包括对条形码化的单细胞cdna进行测序的步骤。
[0377]
在本发明的背景下,在一些实施方式中,本文所述的对条形码化的单细胞cdna测序的步骤指首先将条形码化的单细胞cdna与测序文库接触,并分别从对应于条形码化的单细胞cdna的测序文库扩增感兴趣的序列。
[0378]
在一些实施方式中,对条形码化的单细胞cdna的测序步骤可以包括对测序文库进行新一代测序(ngs)的方案(参见图12)
[0379]
在某些实施方式中,ngs方案包括每个试剂盒的流动池上样4pm至20pm之间的量的测序文库。
[0380]
在一些实施方式中,ngs测序方案还包括向一定量的测序文库或向试剂盒的流动池加入5-60%phix的步骤。
[0381]
用于条形码化单细胞核酸的微流体方法
[0382]
在本文中的“条形码化”指向核酸加入如本文上文的章节“寡核苷酸”所定义的称为条形码序列的基因序列,其能够将所述条形码化的核酸与具有另一添加的基因序列(即,另一独特的条形码序列)的核酸加以区分。
[0383]
本发明人开发了一种方法(见图8),其中,在包含芯片的微流体装置中,一个含有核酸的单细胞液滴与含有逆转录酶和具有引物序列的寡核苷酸的液滴特异性地融合。然后,在逆转录或此后的过程中,将核酸逆转录以及最终条码化。该方法的一个优点是仅浪费很少量的材料,因为一个单细胞液滴与一个rt液滴特异性地融合。另一个优点是将未使用的条形码除去,因此当进行cdna测序时,信噪比得到了改善。
[0384]
另一个优点是可以将条形码本身作为引物以继续进行单细胞rt-pcr(见图7)。
[0385]
因此,本发明涉及一种用于条形码化单细胞核酸的微流体方法,所述方法包括:
[0386]-提供微流体装置,所述微流体装置包含芯片,所述芯片包含至少一个微流体通道和多个储库,
[0387]-向所述微流体通道的入口注入载体流体,所述载体流体包含分散在所述载体流体中的多个第一类型的液滴,其中所述第一类型的液滴是单细胞液滴或rt液滴,其中所述rt液滴的至少一些包含逆转录酶和至少一种寡核苷酸,和其中所述单细胞液滴的至少一些包含一个单细胞,其中所述单细胞包含单细胞核酸,
[0388]-对于多个储库,第一迁移步骤,其中通过浮力将在所述多个液滴中的所述第一类型的至少一个液滴移动到所述多个储库的一个储库中,
[0389]-向所述微流体通道的入口注入载体流体,所述载体流体包含分散在所述载体流体中的多个第二类型的液滴,其中所述第二类型的液滴是单细胞液滴或rt液滴,和其中当
所述第一类型的液滴是单细胞液滴时所述第二类型的液滴是rt液滴,或者当所述第一类型的液滴是rt液滴时所述第二类型的液滴是单细胞液滴,
[0390]-对于多个储库,第二迁移步骤,其中,所述第二类型的至少一个液滴的至少一部分进入所述多个储库的一个储库中,
[0391]-对于多个储库,所述第一类型的所述至少一个液滴与所述第二类型的所述至少一个液滴在各个储库中或在其边缘处融合,从而产生融合的液滴,
[0392]-以及还包括以下步骤:
[0393]
a)针对每个融合的液滴,在所述融合的液滴中将所述单细胞核酸的至少一些与所述至少一种寡核苷酸杂交,
[0394]
b)在每个融合的液滴中,将在所述融合的液滴中存在的所述单细胞核酸的至少一些逆转录,从而产生单细胞cdna,和
[0395]
c)将至少一种条形码序列附接至在步骤b)中获得的所述单细胞cdna上,其中所述至少一种条形码序列编码所述单细胞的身份,
[0396]
或者
[0397]-还包括以下步骤:
[0398]
a)针对每个融合的液滴,在所述融合的液滴中将来自至少一种细胞的单细胞核酸的至少一些与所述至少一种寡核苷酸杂交,其中所述至少一种寡核苷酸包含至少一种条形码序列,
[0399]
b)在每个融合的液滴中,将在所述融合的液滴中存在的所述单细胞核酸的至少一些逆转录,从而产生条形码化的单细胞cdna,其中所述至少一种条形码序列编码所述单细胞的身份。
[0400]
制备和注入单细胞液滴或rt液滴的技术是本领域技术人员熟知的,并且还在章节“液滴的制备”中进行了进一步描述。
[0401]
在一些实施方式中,第一类型的液滴是单细胞液滴。在另一组实施方式中,第一类型的液滴是rt液滴。在本文上文的前述章节中对与单细胞液滴和rt液滴相关的特征进行了描述,特别是“液滴”、“单细胞”、“逆转录”和“寡核苷酸”章节。因此,在这些章节中提及的对“单细胞液滴”或“rt液滴”的描述完全适用于称为“用于条形码化单细胞核酸的微流体方法”的本章节。
[0402]
在微流体方法的背景下,“至少一种寡核苷酸”包含引物序列。在本文上文的章节“寡核苷酸”中对至少一种寡核苷酸和引物序列进行了定义。
[0403]
在一些实施方式中,在第一迁移步骤中,“至少一个第一类型的液滴”指1、2或3个,优选1或2个,更优选1个第一类型的液滴。
[0404]
因此,在优选的实施方式中,在第一迁移步骤中,对于多个储库而言,在每个储库中通过浮力接收一个第一类型的液滴。
[0405]“浮力”通常是指由与浸没物体的重量相反的流体施加的向上力。在本发明的背景下,浮力指由载体流体施加的向上力,其对抗在所述载体流体中浸没的液滴的重量。
[0406]
因此,在一些实施方式中,微流体装置是定向的,以使得多个储库位于通道上方,并且至少一个第一类型的液滴通过浮力进入上述定向的储库。在该实施方式中,载体流体具有高于水溶液密度的密度。
[0407]
在一些实施方式中,至少一个第一类型的液滴的第一迁移步骤导致占据多个储库的50%至100%,例如60%至100%、70%至100%、90%至100%,例如90%、91%、92%、93%、94%、95%、96%、97%、98%、99%和100%,优选地至少一个液滴的迁移步骤导致占据多个储库的90%至100%。
[0408]
在本文中“占据”指与储库的总数相比被至少一个液滴占据的储库的数量。例如,占据50%指50%的储库被至少一个液滴占据。
[0409]
在一些实施方式中,至少一个第一类型的液滴的第一迁移步骤导致所注入液滴的捕获效率为10%至100%,例如20%至100%、30%至100%、40%至100%、50%至100%、60%至100%、70%至100%、80%至100%、90%至100%,优选地80%至100%。
[0410]“捕获效率”指与注入入口的液滴总数相比在储库中捕获的液滴数量。例如,捕获效率50%指在储库中捕获的液滴占所提供的多个液滴总数的50%。
[0411]
在一些实施方式中,在第二迁移步骤中,至少一个第二类型的液滴指1、2或3个,优选1或2个,更优选1个第二类型的液滴。
[0412]
在第二迁移步骤中,至少一个第二类型的液滴可以完全迁移到储库中或者仅部分迁移,其取决于储库的尺寸、第二类型液滴的尺寸和第二类型液滴的尺寸。还在章节“液滴”和“微流体装置”中对那些尺寸进行了进一步定义。
[0413]
因此,在一些实施方式中,至少一个第二类型液滴的至少一部分指至少一个第二类型液滴的总体积的50%至100%,例如60%至100%、65%至100%、70%至100%、75%至100%、80%至100%、85%至100%、90%至100%、95%至100%,优选地90%至100%。
[0414]
因此,在替代的实施方式中,至少一个第二类型液滴的至少一部分指至少一个第二类型液滴的总体积的1至50%、1%至40%、1%至30%,例如2%至30%、5%至30%、10%至30%,优选地10%至30%。
[0415]
在一些实施方式中,对于多个储库,在第二迁移步骤中,至少一个第二类型液滴的至少一部分由于浮力或表面能的差异(优选表面能的差异)进入所述多个储库中的一个储库。
[0416]
在一些实施方式中,至少一个第二类型的液滴的第二迁移步骤导致占据多个储库的50至100%,例如60%至100%、70%至100%、90%至100%,例如90%、91%、92%、93%、94%、95%、96%、97%、98%、99%和100%,优选地至少一个第二类型液滴的迁移步骤导致占据多个储库的90%至100%。
[0417]
在一些实施方式中,至少一个第二类型的液滴的第二迁移步骤导致所注入液滴的捕获效率为10%至100%,例如20%至100%、30%至100%、40%至100%、50%至100%、60%至100%、70%至100%、80%至100%、90%至100%,优选地80%至100%。
[0418]“占据”和“捕获效率”如本文的上文中所定义的。
[0419]
在一些实施方式中,第一类型的液滴或第二类型的液滴还可以包含至少一种第二类型的颗粒,其中所述至少一个第二类型的颗粒如本文上文的章节“单细胞”中所定义的和颗粒如本文上文的章节“寡核苷酸”中所定义的。
[0420]
在一些实施方式中,针对多个储库,该方法还包括针对每个储库在所述至少一个单细胞上进行表型测定的步骤。
[0421]
如本领域技术人员将理解的是,在一些实施方式中,进行表型测定可能还需要将
细胞暴露于试剂。因此,在一些实施方式中,在参数测量之前、期间或之后,将单细胞暴露于一种或多种试剂。
[0422]
因此,在一些实施方式中,单细胞液滴还包含进行所述单细胞测定所需的一种或多种试剂。
[0423]
因此,在一些实施方式中,将一种或多种试剂整合至单细胞液滴中。
[0424]
在一些实施方式中,在融合液滴步骤之前进行表型测定。在一些实施方式中,在裂解细胞之前进行表型测定。表型测定还可以包括拍摄图像的步骤,从而针对每个储库映射所述至少一个单细胞的表型。“表型测定”和“拍摄图像”步骤如本文下文的章节“对具有感兴趣表型的单细胞进行基因分型的方法”中所定义的。
[0425]
在本发明方法的背景下,对多个储库进行融合步骤。如本领域技术人员将理解的是,可以在例如芯片选定的区域进行融合,特别是如果将电场用于融合液滴时。因此,在与融合步骤相关的一些实施方式中,多个储库可以指芯片的多个储库的一些储库。
[0426]
如本领域技术人员将理解的是,在一个实例中,根据表型测定的结果,本领域技术人员可以选择多个储库,其中rt液滴和单细胞液滴将是融合的。
[0427]
在一些实施方式中,在融合步骤中,对于每个储库,使用温度、电场、破乳剂或离子力,优选电场,将至少一个第一类型的液滴与至少一个第二类型的液滴融合。用于融合液滴的方法是本领域技术人员公知的,并且在例如wo 2010128157 a1中进行了描述。
[0428]
在一些实施方式中,使用电场将至少一个第一类型的液滴与至少一个第二类型的液滴融合,其中电场是10khz和500v,持续至少1秒,如至少2、3、4、5、6、7、8、9、10秒,通常8秒。
[0429]
在一些实施方式中,融合步骤导致第一类型的液滴与第二类型的液滴的融合效率在80%至100%之间,例如85%至100%、90%至100%、92%至100%、93%至100%、94%至100%、95%至100%、96%至100%、97%至100%、98%至100%,例如在第一类型的液滴与第二类型的液滴之间为98%、99%、100%,优选90%至100%。
[0430]
在本技术中“在第一类型的液滴与第二类型的液滴之间的融合效率”指其中与在一起提供的第一类型和第二类型一个液滴的事件总数相比提供的一个第一类型的液滴与一个第二类型的液滴产生的融合液滴的事件数量。
[0431]
在一些实施方式中,对于多个储库,所述方法还包括裂解例如至少一个单细胞液滴或融合液滴中的细胞以将核酸从单细胞释放进入单细胞液滴或融合液滴中的步骤。
[0432]
因此,在本发明方法的一些实施方式中,核酸指在杂交步骤(例如在杂交步骤a)中)和在逆转录步骤(例如在逆转录步骤b)中)释放的核酸。
[0433]
裂解细胞的步骤可以发生在将至少一个第一类型的液滴与所述至少一个第二类型的液滴融合的步骤之前,或者将所述液滴融合的步骤之后。在本文上文的章节“细胞裂解”中对可以用于裂解细胞的方法进行了定义。
[0434]
本领域技术人员将理解的是,所选择的裂解细胞的方法可能取决于所选择的裂解时间点,即在液滴融合之前或之后裂解。
[0435]
例如,酶促裂解或化学裂解通常用于融合步骤之后,因为酶促或化学裂解所需的组分通常包含在rt液滴中。
[0436]
在一个优选的实施方式中,细胞裂解不破坏在本发明的背景下使用的液滴。
[0437]
因此,在一些实施方式中,rt液滴或多个rt液滴包含裂解组合物,其中在本文上文的章节“细胞裂解”中对裂解组合物进行了定义。
[0438]
在一些实施方式中,本发明的方法还包括至少一个清除步骤。
[0439]
在本发明的背景下,“至少一个清除步骤”指至少1个、至少2个、至少3个、至少4个清除步骤。
[0440]
例如,通常可以在注入多个第一类型的液滴之前对装置进行清除以除去残留的空气。
[0441]
例如,通常可以在注入多个第一类型的液滴之后对装置进行清除以除去没有迁移进入多个储库的第一类型的液滴。
[0442]
例如,通常可以在注入多个第二类型的液滴之后对装置进行清除以除去至少部分地没有迁移进入多个储库的第二类型的液滴。
[0443]
针对每个融合液滴,本发明方法的步骤a)指在所述融合液滴中的至少一些单细胞核酸与至少一种寡核苷酸杂交。
[0444]
在本技术中“杂交”指引物序列(例如在至少一种寡核苷酸中的引物序列)与核酸中的互补核酸序列退火的现象,因此,如本领域技术人员所公知的,用于杂交的温度取决于所使用的引物序列和/或rt酶。
[0445]
在一个实例中,通过将液滴例如在55℃至60℃下孵育1h进行杂交步骤(例如,杂交步骤a)或b))
[0446]
在本文上文的章节“逆转录”中对在步骤b)中至少一些单细胞核酸的逆转录进行了进一步的定义。
[0447]
在一些实施方式中,至少一种寡核苷酸包含引物序列和至少一种条形码序列,其中“至少一种寡核苷酸”、“至少一种条形码序列”和“引物序列”如本文上文的章节“寡核苷酸”中所定义的。
[0448]
在相关的实施方式中,因此,例如步骤b)中的逆转录导致产生了条形码化的cdna。根据本文上文所述的不同实施方式,所述条形码化的cdna可以与第一类型的颗粒结合或者不与之结合。
[0449]
在一些实施方式中,本发明的方法还包括在逆转录步骤之后在通道的出口回收融合液滴的步骤。
[0450]
在本技术中“回收”指收集由逆转录产生的包含cdna或条形码化的cdna的微流体液滴。
[0451]
在一些实施方式中,回收融合液滴包括使装置绕x-轴旋转45
°
至135
°
(优选90
°
)和清除装置的步骤。然后,可以在出口收集融合液滴。
[0452]
在一些实施方式中,在逆转录步骤之后在通道出口回收融合液滴的步骤包括至少一个洗涤步骤。
[0453]
在洗涤融合液滴之后,包含条形码化cdna的液滴与包含未条形码化的cdna的液滴相比,融合液滴的下游处理可以是不同的。
[0454]
本领域技术人员将理解的是,对条形码化cdna的处理可以是不同的,因为从一个细胞获得的条形码化的单细胞cdna可以是与另一细胞的条形码化的单细胞cdna混合的,可以根据条形码序列对cdna加以区分。而与此相反的是,没有条形码化的cdna当与颗粒结合
时仅仅是混合的。
[0455]
因此,在一些实施方式中,cdna是未条形码化的,在相关的实施方式中,将通过步骤b)的逆转录产生的cdna回收,然后在步骤c)中附接至少一种条形码。在步骤c)中附接条形码之后,通常再将条形码化的cdna用于随后的扩增和测序文库的制备(见图11)。
[0456]
在一些实施方式中,cdna是条形码化的,在相关的实施方式中,将通过步骤b)的逆转录产生的条形码化的cdna回收,通常再将其用于随后的扩增和测序文库的制备。
[0457]
如本文上文的章节“扩增和测序”中对随后的扩增和测序文库的制备进行了定义(见图11)。
[0458]
因此,在一些实施方式中,本发明的方法还包括回收在至少一些融合液滴中通过逆转录产生的条形码化的单细胞cdna。
[0459]
更确切地说,在相关的实施方式中,回收指收集包含由逆转录产生的条形码化的cdna的微流体液滴,破坏微流体液滴并将包含在水性组合物中的条形码化的cdna与所述微流体液滴的油相分离。
[0460]
从液滴中分离核酸(特别是条形码化的cdna)的方法是本领域技术人员公知的,并且包括例如收集微流体液滴和通常使用全氟辛醇(v/v乳液)破坏微流体液滴。随后,孵育此前步骤中获得的乳液直至水相和油相分离。在一个实例中,通常将水相在例如4℃下以10,000g离心10min,并回收包含cdna的上清液。
[0461]
在一些实施方式中,该方法还包括除去未掺入的寡核苷酸的步骤。
[0462]“除去未掺入的寡核苷酸”包括将含有cdna和最终未掺入的寡核苷酸的水性组合物与纯化基质接触,其中纯化基质除去未掺入的寡核苷酸。如本领域技术人员将理解的是,进入除去未掺入寡核苷酸步骤的cdna优选地是条形码化的cdna。
[0463]
在一些实施方式中,纯化基质包括珠子或颗粒,其任选地形成柱子。在其他的实例中,使用例如丙烯酰胺凝胶通过尺寸选择除去未掺入的寡核苷酸。
[0464]
在一些实施方式中,“除去未掺入的寡核苷酸”的步骤包括将包含cdna的水性组合物与核酸外切酶接触,以降解至少一些液滴的水性组合物中的未掺入的寡核苷酸。
[0465]
在相关的实施方式中,核酸外切酶降解包含cdna的水性组合物中的单链核酸序列。
[0466]
本领域技术人员将理解的是,在例如步骤b)或c)中获得的cdna(如条形码化的cdna)通常以rna/dna复合物形式存在,因此免受所述核酸外切酶的影响。
[0467]
在一些实施方式中,cdna包含如本文的上文中所定义的一种或多种核苷酸类似物,其便于cdna序列或分子的纯化。
[0468]
如本领域技术人员将理解的是,在某些实施方式中,纯化的cdna不包含未掺入的寡核苷酸。
[0469]
在一些实施方式中,使用rnase a对cdna进行进一步处理。
[0470]“rnase a”是核糖核酸内切酶,其在c和u残基处特异性降解单链rna。
[0471]
在一些实施方式中,rnase a的浓度为10至1000μg/μl,优选50至200μg/μl,例如100μg/μl。
[0472]
在一些实施方式中,使用蛋白酶k对cdna进行进一步处理。
[0473]“蛋白酶k”是一种广谱的丝氨酸蛋白酶并且优选在疏水性氨基酸之后消化蛋白。
[0474]
在一些实施方式中,蛋白酶k的浓度为0.1至5mg/ml,优选0.1至1mg/ml,例如0.8mg/ml。
[0475]
然后通常再将回收的cdna用于随后的扩增和测序文库的制备,其如本文上文的章节“扩增和测序”中所定义的(亦参见图5)。
[0476]
如本文上文的章节“寡核苷酸”中所解释的,在其中至少一种寡核苷酸与至少一个第一类型的颗粒结合的实施方式中,对在融合液滴中存在的核酸逆转录导致单细胞cdna以rna/dna复合物形式与至少一个第一类型的颗粒结合。
[0477]
此外,在其中至少一种寡核苷酸不含条形码序列的实施方式中,由逆转录获得并且与所述至少一个第一类型的颗粒结合的cdna是未条形码化的。
[0478]
因此,在一个相关的实施方式中,在本技术中回收单细胞cdna指破坏微流体液滴并将包含在水性组合物中的与至少一个第一类型的颗粒结合的单细胞cdna与所述微流体液滴的油相分离。
[0479]
破坏微流体液滴的方法是本领域技术人员公知的,并且通常包括使用全氟辛醇(v/v乳液)。
[0480]
可以使用本领域技术人员公知的方法将与颗粒结合的cdna从油相中分离。例如,当颗粒是磁性颗粒时,可以使用磁铁分离cdna。在另一个实例中,当颗粒是水凝胶时,可以通过沉降分离cdna。
[0481]
将与至少一个第一类型的颗粒结合的cdna与油相分离导致产生包含多个第一类型的颗粒的库,其中每个颗粒与一个细胞的cdna结合。
[0482]
在相关的实施方式中,对于例如在步骤c)中将至少一种条形码序列附接到单细胞cdna上而言,本发明的方法还包括将与至少一个第一类型的颗粒结合的单细胞cdna分散到多个储库中的步骤,其中在每个储库中接受与单细胞的cdna结合的至少一个第一类型的颗粒(优选一个第一类型的颗粒)。这样的储库例如可以是通常是孔板,例如96孔板的孔。
[0483]
在一些相关的实施方式中,本发明的方法还包括步骤c)将条形码序列附接至在步骤b)中获得的单细胞cdna上,其中所述至少一种条形码序列编码所述单细胞的身份。
[0484]
至少一种条形码序列是如本文上文的章节“寡核苷酸”中所定义的。在一个优选的实施方式中,当在转录步骤之后将至少一种条形码附接时,所述至少一种条形码序列优选是单链核酸。本领域技术人员将理解的是,可以附接一种条形码序列,或一种以上条形码序列。当附接一种以上条形码序列时,彼此连接的单个条形码序列最终形成一个最终的条形码序列。那些单个条形码序列可以在随后的循环中附接。
[0485]
在一些实施方式中,附接条形码序列的步骤c)还包括附接umi序列,其中所述umi序列是如本文上文的章节“寡核苷酸”中所定义的。
[0486]
附接条形码序列或umi序列的方法是本领域技术人员公知的,并且包括例如使用连接酶和/或使用退火或引物延伸法。
[0487]
在一些实施方式中,附接条形码序列的步骤c)之后可以是洗涤步骤,以除去没有附接在单细胞cdna上的条形码。
[0488]
在一些实施方式中,该方法还包括除去未掺入的寡核苷酸的步骤。在本文的上文中进一步讨论了除去未掺入的寡核苷酸的步骤。
[0489]
在其中将cdna附接在至少一个第一类型的颗粒的实施方式中,该方法还包括从至
少一个第一类型的颗粒释放cdna或条形码化的cdna的步骤。在本文上文的章节“寡核苷酸”中描述了释放寡核苷酸的方法,并且其应用类似于cdna的释放,因为cdna是通过所述寡核苷酸与颗粒结合的。
[0490]
优选地,释放cdna的步骤发生在步骤c)中附接条形码序列之后。
[0491]
在一些实施方式中,附接条形码序列的步骤c)之后是回收条形码化的cdna的步骤。
[0492]
在本技术中回收条形码化的cdna指收集条形码化的cdna。
[0493]
然后,通常再将回收的条形码化的cdna用于随后的扩增和测序文库的制备,如在本文上文的章节“扩增和测序”中所定义的(见图11)。
[0494]
此外,在一些实施方式中,将至少一种寡核苷酸引入不含颗粒的rt液滴中,或者任选地,在逆转录之前使其从所述颗粒中释放。
[0495]
因此,本领域技术人员将理解的是,转录之后,本发明方法的这些实施方式将导致cdna不再附接在颗粒上。此外,在其中至少一种寡核苷酸不包含条形码序列的实施方式中,所述cdna未被条形码化。
[0496]
因此,在相关的实施方式中,rt液滴还包含聚合物。
[0497]
本领域技术人员将理解的是,因此在一些实施方式中,融合液滴包含所述聚合物。
[0498]
在一些实施方式中,所述聚合物在溶液形式中。
[0499]
在一些实施方式中,所述聚合物选自下组:海藻酸、琼脂糖、聚(乙二醇)二丙烯酸酯或丙烯酰胺基凝胶,如双丙烯酰胺、聚丙烯酰胺,链霉亲和素丙烯酰胺、聚-n-异丙基丙烯酰胺或聚n-异丙基聚丙烯酰胺或其混合物。
[0500]
在其他的实施方式中,将聚合物官能化以捕获核酸。
[0501]
将聚合物官能化以捕获核酸的方法是本领域技术人员公知的,并且包括但不限于链霉亲和素、组氨酸标签、生物素、钙调蛋白、snap-标签、生物素、acrydite。
[0502]
在相关的实施方式中,如本文的上文所述,回收融合液滴。
[0503]
在相关的实施方式中,如本文的上文所定义的回收融合液滴的步骤还包括将融合液滴聚合的步骤。
[0504]
例如,可以通过加入钙离子使水凝胶(如海藻酸)聚合。在其他情况下,可以将聚合引发剂,也称为交联剂(如过硫酸铵和用于丙烯酰胺的temed)加入液滴中。
[0505]
本领域技术人员将理解的是,当使融合液滴聚合时,在步骤b)中产生的单细胞cdna包含在所述聚合的液滴中。
[0506]
在一些实施方式中,通过交联获得聚合。
[0507]
在一些实施方式中,向融合液滴中加入交联剂,例如通过扩散。
[0508]
在替代的实施方式中,rt液滴包含交联剂。本领域技术人员将理解的是,因此在同一实施方式中,融合液滴也包含所述交联剂。
[0509]
在一些实施方式中,用于聚合的交联剂被活化。
[0510]
特别地,当rt液滴包含交联剂时,所述交联剂需要活化以进行聚合。
[0511]
在某个实施方式中,通过加热或uv使交联剂活化。
[0512]
在相关的实施方式中,对于在步骤c)中将条形码附接至cdna上而言,本发明的方法还包括将包含单细胞cdna的聚合的液滴分散到多个储库的步骤,其中优选地在每个储库
中接受一个聚合的液滴。储库可以是通常是96孔板的孔。
[0513]
本领域技术人员公知的是,小核酸(例如条形码序列)以及酶(例如连接酶)可以迁移进入如本文的上文中定义的聚合物。
[0514]
因此,将附接条形码序列的步骤c)以如本文上文所述相同的方法应用于在所述聚合物中包含的cdna中,以用于将cdna附接在颗粒上。因此,如在本文上文涉及将cdna附接在颗粒上的实施方式中所定义的那些应用将条形码附接在cdna上的步骤。
[0515]
因此,可以将条形码附接在3’或5’端。
[0516]
在一些实施方式中,附接条形码序列的步骤c)还包含附接如本文的上文中定义的umi序列。
[0517]
在一些实施方式中,附接条形码序列的步骤c)之后是洗涤步骤,以除去没有附接在cdna上的条形码。
[0518]
在一些实施方式中,该方法还包括除去未掺入的寡核苷酸的步骤。除去未掺入的寡核苷酸是如本文的上文中所定义的。
[0519]
在一些实施方式中,该方法还包括从聚合的液滴释放条形码化的cdna的步骤。可以通过简单扩散、光裂解或电泳从聚合的液滴中释放cdna。
[0520]
优选地,释放cdna的步骤发生在步骤c)中附接条形码序列之后。
[0521]
在一些实施方式中,附接条形码序列的步骤c)之后是回收条形码化的cdna的步骤。然后,通常再将回收的条形码化的cdna用于随后的扩增和测序文库的制备,如在本文上文的章节“扩增和测序”中所定义的(见图11)。
[0522]
用于对具有感兴趣表型的单细胞进行基因分型的方法
[0523]“基因分型”通常指使用生物化学的方法确定个体的核酸序列的方法。在本发明的背景下,基因分型指确定单细胞的核酸序列,特别是感兴趣的单细胞的。
[0524]“表型”通常指生物体可观察到的特征或性状的组合,如其形态、发育、生物化学或生理学特性。表型是生物体遗传密码(其基因型)的表达以及环境因素的影响和这两者之间的相互作用产生的。在本发明的背景下,单细胞的表型指存在或不存在特定的特征,如存在或不存在特定抗体,或存在或不存在特定抗原,或存在或不存在特定活性,其可以观察到或通常使用表型测定进行鉴定。
[0525]
感兴趣的表型的实例是对生物应答的检测。其中,可以通过检测由抗原特异性抗体的分泌诱导的adcc(抗体依赖性细胞介导的细胞毒性)(3)监测免疫应答的检测(见图1)。
[0526]
在生物学事件中,可以通过检测由抗原特异性抗体的分泌诱导的补体依赖性细胞毒性(cdc)(6)监测免疫应答的检测(见图2)。
[0527]
在生物学事件中,可以通过检测由抗原特异性抗体的分泌诱导的adc(抗体药物缀合物)监测药物作用的检测(见图3)。
[0528]
在生物学事件中,包括检测药物功能,像抗原特异性抗体的分泌诱导的激动性/拮抗性抗体(见图4、5)。
[0529]
在生物学事件中,包括检测药物功能,像进行竞争测定(见图6)。
[0530]
在生物学事件中,包括检测药物功能,像检测由抗体的分泌介导的报告细胞的细胞移动(见图6)。可以将这样的测定用于追踪在所述液滴内的报告细胞的行为改变。表达感兴趣的抗原并负载有未释放的可检测标记的靶细胞(1)将与igg产生细胞(2)和颗粒作为单
细胞液滴共同包封。将在使得抗体分泌的条件下对液滴进行孵育。分泌的特异性抗体将重新定位到靶细胞上。同时,配体/激动剂以与igg产生相似的动力学从颗粒扩散并产生配体梯度。报告细胞将在配体浓度(9)的作用下迁移进入颗粒内。在阻断抗体(3)的情况下,报告细胞的进程被改变。然后,可以将迁移用于评估抗体的阻断/中和活性。
[0531]
因此,在用于对单细胞进行基因分型的方法的背景下,首先对在多个储库(例如,通常在96孔板的储库中,或者在微流体装置的储库中)中存在的单细胞进行表型分型,然后对其进行基因分型。本发明人开发了一种方法,其中基于特定条形码与染料组合的使用,使得在测序后,将条形码化的单细胞cdna的基因序列与所述单细胞所观察到的表型联系起来成为可能。
[0532]
因此,本发明涉及一种用于对具有感兴趣表型的单细胞进行基因分型的方法,所述方法包括:
[0533]-提供多个储库,和
[0534]
a)对于多个储库,针对各个储库提供至少一种条形码序列和至少一种染料,其中所述至少一种条形码序列与所述至少一种染料的颜色和浓度相关,并获取阵列的图像,从而为各个储库映射所述至少一种染料的所述颜色和强度;和
[0535]
b)对于多个储库,针对各个储库提供至少一个单细胞并针对各个储库在所述至少一个单细胞上进行表型测定,并获取图像,从而为各个储库映射所述至少一个单细胞的所述表型;
[0536]
其中步骤a)在步骤b)之前进行或者步骤b)在步骤a)之前进行;然后
[0537]
c)对于多个储库,针对各个储库将在步骤b)中获得的所述单细胞的表型与在步骤a)中获得的所述至少一种染料的所述颜
[0538]
色和所述强度联系起来;和
[0539]-对于多个储库,针对各个储库将所述至少一个单细胞的核酸逆转录以获得用所述至少一种条形码序列条形码化的单细胞cdna,所述至少一种条形码序列与所述至少一种染料的所述颜色和浓度相关;和
[0540]-将所述基因型与所述至少一个单细胞的所述表型联系起来。
[0541]
在一个优选的实施方式中,所述方法是微流体方法。
[0542]
在一些优选的实施方式中,多个储库包含在含有至少一个微流体通道的微流体装置中。因此,在一个实施方式中,该方法是微流体方法,所述微粒体方法包括提供微流体装置的步骤,所述微流体装置包含含有至少一个微流体通道的芯片和多个储库。
[0543]
因此,本发明还涉及一种用于对具有感兴趣表型的单细胞进行基因分型的微流体方法,所述方法包括:
[0544]-提供微流体装置,所述微流体装置包含含有多个储库的芯片,和
[0545]
a)对于多个储库,针对各个储库提供至少一种条形码序列和至少一种染料,其中所述至少一种条形码序列与所述至少一种染料的颜色和浓度相关,并获取阵列的图像,从而为各个储库映射所述至少一种染料的所述颜色和强度;和
[0546]
b)对于多个储库,针对各个储库提供至少一个单细胞并针对各个储库在所述至少一个单细胞上进行表型测定,并获取图像,从而为各个储库映射所述至少一个单细胞的所述表型;
[0547]
其中步骤a)在步骤b)之前进行或者步骤b)在步骤a)之前进行;然后
[0548]
c)对于多个储库,针对各个储库将在步骤b)中获得的所述单细胞的表型与在步骤a)中获得的所述至少一种染料的所述颜
[0549]
色和所述强度联系起来;和
[0550]-对于多个储库,针对各个储库将所述至少一个单细胞的核酸逆转录以获得用所述至少一种条形码序列条形码化的单细胞cdna,所述至少一种条形码序列与所述至少一种染料的所述颜色和浓度相关;和
[0551]-将所述基因型与所述至少一个单细胞的所述表型联系起来。
[0552]
在用于对具有感兴趣表型的单细胞进行基因分型的微流体方法的背景下,“微流体方法”和“微流体装置”如本文上文的章节“定义”中所定义的。
[0553]“条形码序列”如本文上文的章节“寡核苷酸”中所定义的。
[0554]“多个储库”如本文上文的章节“微流体装置”中所定义的。
[0555]
在一些实施方式中,在“至少一种条形码序列”中的“至少一种”和在“至少一种染料”中的“至少一种”指多于1种、多于2种、多于3种,如1、2、3、4、5、6、7、8、9、10种条形码序列和/或染料,优选2、3、4或5种条形码序列和/或染料,更优选2、3或4种条形码序列和/或染料,甚至更优选2或3种条形码序列和/或染料,例如2种条形码序列和/或染料。
[0556]
在一些实施方式中,染料指荧光染料。荧光染料是如本文上文的章节“单细胞”中所定义的。
[0557]
在一些优选的实施方式中,在一种溶液中提供了至少一种条形码和至少一种染料。
[0558]
在一些实施方式中,至少一种条形码和至少一种染料彼此之间不连接在一起。
[0559]
在一些实施方式中,至少一种条形码和至少一种染料彼此之间不是共价连接的。
[0560]
在一些实施方式中,至少一种条形码和至少一种染料不是使用非共价连接故意连接在一起。
[0561]
本技术中“故意的”指这样的事实,即在一些实施方式中,至少一种条形码和至少一种染料不暴露于诱导非共价连接的特定条件,即未使用例如链霉亲和素和生物素对其进行修饰以使用非共价连接使其彼此之间连接在一起。然而,本领域技术人员将理解的是,由于至少一种染料的性质和至少一种条形码序列的核酸的性质,在一些情况下,至少一种染料和至少一种条形码序列可以通过非共价相互作彼此之间结合在一起。这些“非共价相互作用”包括静电作用、π-作用、范德华力和疏水性作用。
[0562]
在一些实施方式中,至少一种条形码与至少一种染料一起提供,其中所述至少一种染料以已知浓度提供。
[0563]
在一些实施方式中,至少一种染料的浓度是0.1nm至100μμ,如1nm至50μμ、1nm至30μμ、1μμ至50μμ、1μμ至30μμ,优选地1nm至30μμ。本领域技术人员将理解的是,所使用的浓度取决于至少一种染料的性质。
[0564]
在一些优选的实施方式中,当提供两种条形码序列时,提供两种染料,如提供三种条形码序列,则提供三种染料。
[0565]
本领域技术人员将理解的是,当至少一种条形码序列指一种条形码序列和至少一种染料指一种染料时,在第一储库中提供的条形码序列不同于在另一储库中提供的条形码
序列,并且在第一储库中与条形码序列一起提供的染料不同于在另一储库中与条形码序列一起提供的染料和/或这些染料的浓度是不同的。
[0566]
本领域技术人员将理解的是,当至少一种条形码序列指两种条形码序列,和优选地至少一种染料指两种染料时,则在第一储库中提供的两种条形码序列的至少一种不同于在另一储库中提供的两种条形码序列的至少一种,并且在第一储库中与两种条形码序列一起提供的两种染料的至少一种不同于在另一储库中与两种条形码序列一起提供的两种染料的至少一种和/或在第一储库中与两种条形码序列一起提供的两种染料的至少一种的浓度不同于在另一储库中与两种条形码序列一起提供的两种染料的至少一种染料的浓度。
[0567]
本技术步骤a)中的“获取图像”指通过本领域技术人员公知的任何方法获取图像,例如荧光显微镜、共聚焦显微镜或荧光成像技术。
[0568]
为了进一步理解,在本文的下文中对步骤a)进行举例说明,针对两个储库(a和b),在每个储库中使用两种条形码和两种染料,对于该实例不限于步骤a)。例如,条形码1通常在溶液中与alexa fluor 405(紫色)一起提供,其浓度通常为10μμ。条形码2通常在溶液中与alexa fluor 532(绿色)一起提供,其浓度通常为15μμ。条形码1与浓度为10μμ的alexa fluor 405结合和条形码2与浓度为15μμ的alexa fluor 532结合。当这两种条形码条形码1和条形码2在一个储库(储库a)中一起提供时,伴随条形码的这两种染料的颜色和浓度是混合在一起的。当通常获取荧光显微镜图像时,将针对每个储库(包括储库a)记录荧光信号的强度和颜色。然后,基于参照比例,可以得出结论,针对在储库a中存在的这两种染料的混合物记录的颜色和强度是与条形码1和2的组合相关联的。
[0569]
当现在在另一储库(称为储库b)中,条形码1与浓度为10μμ的alexa fluor 405一起提供和条形码3与例如浓度为20μμ的alexa546一起提供,储库b将具有不同于储库a的另一种颜色和强度。因此,基于步骤a)中获取的图像,使用参照比例,可以得出结论,针对储库b中存在的染料混合物记录的颜色和强度是与条形码1和3的组合相关联的。
[0570]
因此,在步骤a)中获取的阵列的图像能够针对多个储库的每一个储库绘制在每个储库中存在的至少一种染料的颜色和强度。此外,针对每个储库绘制的颜色和强度与在那些储库中存在的至少一种条形码序列相关。因此,针对多个储库的每一个储库,本领域技术人员能够从步骤a)中获得的图像得出结论,其中在所述储库中提供了至少一种条形码。
[0571]
可以通过本领域技术人员公知的任何方法提供步骤a)中的至少一种条形码序列和至少一种染料。
[0572]
在一些实施方式中,对于多个储库,至少一种条形码序列与多个储库的每一个储库的表面连接在一起。
[0573]
在相关的实施方式中,将至少一种条形码序列与储库的表面连接在一起不影响溶液中的至少一种染料。短语“不影响溶液中的至少一种染料”指染料仍在溶液中。
[0574]
将核酸(如至少一种条形码序列)与表面连接的方法是本领域技术人员公知的,并且例如在us5412087中对其进行了描述。在将至少一种寡核苷酸与至少一个第一类型的颗粒连接在一起的背景下,还在本文上文的章节“寡核苷酸”中对那些方法进行了进一步描述。
[0575]
因此,在一些实施方式中,对于多个储库,至少一种条形码序列与储库的表面共价连接或非共价连接。“非共价连接”、“共价连接”、“链霉亲和素”如本文上文的章节“寡核苷
酸”中所定义的。
[0576]
在一个优选的实施方式中,非共价键是链霉亲和素-生物素连接。
[0577]
非共价键是链霉亲和素-生物素键是本领域技术人员公知的。因此在一个实例中,使用例如水凝胶包覆储库的表面,如本文上文的章节“寡核苷酸”中所定义的,可以使用链霉亲和素将所述水凝胶官能化,并且使用生物素将至少一种条形码序列官能化。
[0578]
在一些实施方式中,其中至少一种条形码序列指一种以上条形码序列,本领域技术人员将理解的是,在一些实施方式中,条形码序列与储库的表面顺序连接。因此,第一条形码序列连接到如本文上文所述的储库表面上,然后第二条形码序列附接在第一条形码序列上,并且最后第三条形码序列附接在第二条形码序列上,以此类推,其取决于条形码序列的数量。
[0579]
在替代的实施方式中,在将所述(至少一种)条形码序列连接到储库的表面之前,条形码序列彼此之间附接在一起导致产生了一条条形码序列。
[0580]
在其他的实施方式中,至少一种条形码序列进一步附接在umi序列上,其中所述umi序列是如本文上文所述的章节“寡核苷酸”中所定义的。
[0581]
将核酸彼此之间附接在一起,或者将两条条形码序列或umi序列与条形码序列附接在一起的方法是本领域技术人员公知的,并且包括但不限于使用连接酶和/或使用退火或引物延伸法。
[0582]
因此,在一些实施方式中,其中提供了至少一种条形码序列和至少一种染料的溶液还包含连接酶。在本文上文的章节“寡核苷酸”中给出了连接酶的实例。
[0583]
不依赖于将至少一种条形码与储库的表面连接在一起所使用的键的类型,条形码序列还可以包含至少一种接头序列。
[0584]
在一些实施方式中,条形码序列优选地使用5’端或3’端与表面连接,优选地使用5’端。
[0585]
本领域技术人员将理解的是,在一些实施方式中,其中至少一种条形码序列指一种以上条形码序列,与孔的表面连接的第一条形码序列(即,位于5’端或3’端的条形码序列,优选5’端)在其5’端或3’端(优选5’端)包含至少一个接头序列。
[0586]
在一些实施方式中,“接头序列”是利用其至少一种条形码序列与储库表面任选地连接的序列。
[0587]
本技术中“任选地连接”指可以将至少一种条形码序列释放,以使得至少一种条形码序列优选地附接在至少一种引物序列上的可能性,如本技术的下文中所进一步描述的。
[0588]
优选地,接头序列是可裂解的接头序列,如本文上文的章节“寡核苷酸”中所定义的。
[0589]
因此,在一些实施方式中,本发明的方法还包括释放与储库的表面结合的至少一种条形码序列的步骤。
[0590]
在一些实施方式中,如本文的下文中所进一步描述的,当在液滴中进行该方法时,至少一种条形码序列被释放,特别是释放进入至少一个rt液滴中。
[0591]
在一些实施方式中,通过将rt液滴与储库的表面接触,使至少一种条形码序列释放进入至少一个rt液滴中。
[0592]
在一些实施方式中,通过润湿使rt液滴与表面接触。
[0593]
因此,在一些实施方式中,通过润湿使至少一种条形码序列释放进入至少一个rt液滴中。
[0594]
在本技术中“润湿”指改变半固相或固相上的液相的表面能。
[0595]
此外,在一些实施方式中,在逆转录单细胞中的核酸之前,从所述表面释放与储库的表面连接的至少一种条形码序列。
[0596]
此外,在一些实施方式中,在裂解至少一个单细胞之前,从所述表面释放与储库的表面连接的至少一种条形码序列。
[0597]
当在液滴中进行时,在一些实施方式中,在至少一个单细胞液滴与rt液滴融合之前,从所述表面释放与储库的表面连接的至少一种条形码序列。
[0598]
在一些实施方式中,可以使用任何方法释放至少一种条形码,例如酶、亲核/碱性试剂、还原剂、光辐射、亲电/酸性试剂、有机金属和金属试剂以及氧化试剂。
[0599]
在一些实施方式中,可以使用酶促和/或光裂解释放至少一种条形码。例如,可以将核酸内切酶用于裂解接头序列或任何其他序列以从储库的表面释放至少一种条形码序列。
[0600]
在其他的实施方式中,释放至少一种条形码序列指破坏键,如链霉亲和素生物素键,如在本文上文所述的章节“寡核苷酸”中所定义的。
[0601]
在一些实施方式中,通过酶促消化链霉亲和素释放至少一种条形码。
[0602]
本领域技术人员将理解的是,释放条形码序列所需的组分可以通过本领域技术人员公知的任何方法提供,可以在多个储库的每一个中,或者当在液滴中进行时,例如可以在rt液滴中,以使得当将rt液滴与表面接触时通常释放至少一种条形码序列。
[0603]
在该方法的步骤b)中,对于多个储库,在每个储库中提供至少一个单细胞。
[0604]
在本文的上述章节“单细胞”中对“至少一个单细胞”进行了定义,并且优选地指一个单细胞。
[0605]
在本文中“表型测定”指允许鉴定细胞的表型(更具体地单细胞的表型)的方法。“表型”如本文的上文中所定义的。
[0606]
在一些实施方式中,表型测定选自检测dna序列;检测rna序列;检测选自下组的分子:蛋白、碳水化合物、脂质及其任何组合;检测小分子;检测活性;检测离子浓度;检测离子电位;和检测氧化还原电位。
[0607]
根据表型测定,可以使用任何适宜的测定方法针对所选择的参数对至少一个单细胞进行测定,所述测定方法可以是定性的和/或定量的。适宜的检测方法可以包括光谱方法、电学方法、流体力学方法、成像方法和/或生物学方法等,特别是适合或适用于分析单细胞的那些。这些方法可以涉及检测单个或多个值,依赖于时间或不依赖于时间(例如,稳态或终点)的值和/或平均值或(时间和/或空间)分布值等等。这些方法可以测量和/或输出模拟和/或数字值。
[0608]“光谱方法”通常可以包括检测光(或波状粒子)的任何性质,特别是通过与样品相互作用而改变的性质。适宜的光谱方法可以包括吸收、发光(包括光致发光、化学发光和电化学发光)、磁共振(包括核和电子自旋共振)、散射(包括光散射、电子散射和中子散射)、衍射、圆二色性和旋光等等。
[0609]
适宜的“光致发光方法”可包括生物发光共振能量转移(bret)、荧光强度(flint)、
荧光偏振(fp)、荧光共振能量转移(fret)、荧光寿命(flt)、全内反射荧光(tirf)、荧光相关光谱(fcs)、光漂白后的荧光恢复(frap)、荧光活化细胞分选(facs)以及其磷光和其他类似物等等。
[0610]
如本领域技术人员将理解的是,在一些实施方式中,进行表型测定可能还需要将细胞暴露于试剂。
[0611]
因此,在一些实施方式中,在参数测量之前、期间或之后将单细胞暴露于一种或多种试剂。
[0612]
在一些实施方式中,在步骤b)中提供其之前,将单细胞暴露于一种或多种试剂。
[0613]
在一些实施方式中,试剂包括但不限于化学/生物细胞调节剂、检测/测定试剂、溶剂、缓冲液、培养基、洗涤溶液。
[0614]“化学调节剂或生物调节剂”可以包括用于检测与细胞相互作用的任何试剂。相互作用通常包括与颗粒的特异性结合和/或对颗粒(或调节剂)的任何可检测的基因型或表型效应。化学/生物调节剂可以包括与受体相互作用的配体(例如,拮抗剂、激动剂、激素等)、离子、气体、碳水化合物、脂质、有机物、聚合物、蛋白、小分子或核酸(特别是sirna)。
[0615]“检测/测定试剂”可以包括染色、染料、标记、酶、底物、辅因子和/或特异性结合配偶体(sbp)等。
[0616]
在一些实施方式中,在步骤b)中的获取图像指使用本领域技术人员公知的适合于所使用的表型测定的任何方法获取图像,通常是光谱方法。特别地,获取图像指使用具有阵列或线性照相机的亮视野显微镜或荧光显微镜获取图像。
[0617]
本领域技术人员知晓如何调整使用所使用的试剂进行的表型测定以及获取图像的技术。
[0618]
在步骤b)中获取的图像为每个储库映射了在每个储库中所含的单细胞的表型。
[0619]
因此,在步骤c)中,基于在步骤a)中获得的图像和在步骤b)中获得的图像,对于多个储库,本领域技术人员能够将在一个储库中在步骤b)中获得的表型与对于同一储库在步骤a)中获得的至少一种染料的颜色和强度联系起来,其中在步骤a)中获得的至少一种染料的颜色和强度与在所述同一储库中提供的至少一种条形码序列相关联。
[0620]
因此,对于多个储库,在步骤c)中本领域技术人员因此能够将在一个储库中观察到的至少一个单细胞的表型与在所述同一储库中提供的至少一种条形码序列联系起来。
[0621]
在一些实施方式中,该方法还包括选自下述步骤的至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少11个步骤,如1、2、3、4、5、6、7、8、9、10、11个步骤:
[0622]-至少一个清除步骤,
[0623]-对于多个储库,针对各个储库提供至少一种寡核苷酸,其中所述至少一种寡核苷酸包含引物序列,
[0624]-对于多个储库,针对各个储库将所述至少一种条形码序列附接至所述至少一种寡核苷酸,
[0625]-对于多个储库,针对各个储库提供裂解组合物,
[0626]-对于多个储库,针对各个储库裂解所述至少一个单细胞,
[0627]-对于多个储库,针对各个储库提供逆转录酶和逆转录酶组合物,
[0628]-对于多个储库,针对各个储库将单细胞核酸的至少一些与所述至少一种条形码化的寡核苷酸杂交,
[0629]-回收所述条形码化的单细胞cdna,
[0630]-从所述条形码化的cdna中除去未掺入的寡核苷酸,
[0631]-扩增所述条形码化的单细胞cdna,
[0632]-对所述条形码化的单细胞cdna进行测序。
[0633]
在本文上文“用于条形码化单细胞核酸的微流体方法”的背景下对这些另外的步骤进行了描述。因此,本领域技术人员将理解的是,与上述步骤相关的在整个说明书中的实施方式和特征可完整地应用于这些步骤。
[0634]
例如,在“液滴的制备”、“寡核苷酸”、“逆转录”和“用于条形码化单细胞核酸的微流体方法”章节中涉及“至少一种寡核苷酸”的描述完全适用于称为“用于对具有感兴趣的表型的单细胞进行基因分型的方法”的章节。在“定义”、“逆转录”、“寡核苷酸”和“用于条形码化单细胞核酸的微流体方法”章节中涉及“引物”或“引物序列”的描述完全适用于称为“用于对具有感兴趣表型的单细胞进行基因分型的方法”的章节。
[0635]
本领域技术人员将理解的是,用于“在每个储库中将至少一种条形码序列附接至至少一种寡核苷酸”的方法等同于如在用于条形码化单细胞核酸的方法的步骤c)的背景下所述的“用于将条形码化的序列附接至单细胞cdna”的方法或者如本文的上文中所述的“将至少一种条形码序列附接至umi序列”或“将条形码序列彼此之间相附接”的方法。因此,用于将至少一种条形码序列附接至至少一种寡核苷酸的方法是本领域技术人员公知的,并且通常包括但不限于使用连接酶和/或使用退火或引物延伸法。在本文上文的章节“寡核苷酸”中给出了连接酶的实例。在一些实施方式中,条形码序列优选地在至少一种寡核苷酸的5’端附接在至少一种寡核苷酸上导致寡核苷酸从5’到3’包含条形码序列和引物序列。因此,如将至少一种寡核苷酸与至少一种颗粒连接,则优选地在附接至少一种条形码序列之前释放至少一种寡核苷酸。
[0636]
此外,在“定义”、“细胞裂解”、“逆转录”、“寡核苷酸”和“用于条形码化单细胞核酸的微流体方法”章节中涉及“裂解组合物”的描述完全适用于称为“用于对具有感兴趣表型的单细胞进行基因分型的方法”的章节。类似地,在“细胞裂解”、“逆转录”、“寡核苷酸”和“用于条形码化单细胞核酸的微流体方法”章节中涉及“裂解至少一个单细胞”的步骤完全适用于称为“用于对具有感兴趣表型的单细胞进行基因分型的方法”的章节。
[0637]
在“定义”、“rt液滴的制备”、“逆转录”、“寡核苷酸”和“用于条形码化单细胞核酸的微流体方法”章节中涉及“逆转录酶”和“逆转录酶组合物”或“逆转录步骤”的描述完全适用于称为“用于对具有感兴趣表型的单细胞进行基因分型的方法”的章节。
[0638]
在“定义”和“用于条形码化单细胞核酸的微流体方法”章节中涉及“杂交步骤”的描述完全适用于称为“用于对具有感兴趣表型的单细胞进行基因分型的方法”的章节。
[0639]
在一些实施方式中,在本技术中回收条形码化的单细胞cdna指将由逆转录产生的条形码化的cdna与储库分离。
[0640]
在“用于条形码化单细胞核酸的微流体方法”章节中涉及“除去未掺入的寡核苷酸”的步骤的描述完全适用于称为“用于对具有感兴趣表型的单细胞进行基因分型的方法”的章节。
[0641]
在“扩增和测序”章节中涉及“扩增条形码化的单细胞cdna”和“对条形码化的单细胞cdna进行测序”的步骤的描述完全适用于称为“用于对具有感兴趣表型的单细胞进行基因分型的方法”的章节。
[0642]
本领域技术人员将理解的是,在步骤b)中的单细胞包含核酸。
[0643]
如本文的上文中所述,本领域技术人员将理解的是,在一个储库中裂解至少一个单细胞的步骤导致核酸从单细胞进入所述储库。
[0644]
在一些实施方式中,裂解细胞的步骤发生在转录步骤之前。在一些优选的实施方式中,裂解细胞的步骤发生在进行表型测定的步骤b)之后。
[0645]
根据上述,在一些实施方式中,用于对具有感兴趣表型的单细胞进行基因分型的微流体方法包括:
[0646]-提供微流体装置,所述微流体装置包含芯片,所述芯片包含多个储库,和
[0647]
1.对于多个储库,针对各个储库提供至少一种条形码序列和至少一种染料,其中所述至少一种条形码序列与所述至少一种染料的颜色和浓度相关,并获取阵列的图像,从而为各个储库映射(mapping)所述至少一种染料的所述颜色和强度;和
[0648]
2.对于多个储库,针对各个储库提供至少一个单细胞并针对各个储库在所述至少一个单细胞上进行表型测定,并获取图像,从而为各个储库映射所述至少一个单细胞的所述表型;
[0649]
其中步骤a)在步骤b)之前进行或者步骤b)在步骤a)之前进行;然后
[0650]
3.对于多个储库,针对各个储库将在步骤b)中获得的所述单细胞的表型与在步骤a)中获得的所述至少一种染料的所述颜
[0651]
色和所述强度联系起来;和
[0652]-任选地,对于多个储库,针对各个储库提供至少一种寡核苷酸,其中所述至少一种寡核苷酸包含引物序列,
[0653]-任选地,对于多个储库,针对各个储库将所述至少一种条形码序列附接至所述至少一种寡核苷酸,
[0654]-任选地,对于多个储库,针对各个储库提供裂解组合物,
[0655]-任选地,对于多个储库,针对各个储库裂解所述至少一个单细胞,
[0656]-任选地,对于多个储库,针对各个储库提供逆转录酶和逆转录酶组合物,
[0657]-任选地,对于多个储库,针对各个储库将所述单细胞核酸的至少一些与所述至少一种条形码化的寡核苷酸杂交,
[0658]-任选地,对于多个储库,对于所述至少一个单细胞的各个储库的核酸进行逆转录,以获得使用所述至少一种条形码序列条形码化的单细胞cdna,所述条形码序列与至少一种染料的颜色和浓度相关联;
[0659]-任选地,回收所述条形码化的单细胞cdna,
[0660]-任选地,从所述条形码化的cdna中除去未掺入的寡核苷酸,
[0661]-任选地,扩增所述条形码化的单细胞cdna,
[0662]-任选地,对所述条形码化的单细胞cdna进行测序,和
[0663]-将基因型与所述至少一个单细胞的表型联系在一起。
[0664]
在一些实施方式中,在液滴中进行用于对具有感兴趣表型的单细胞进行基因分型
的方法。液滴如在本文上文的章节“液滴”中所定义的。
[0665]
因此,将在液滴中提供的至少一个单细胞称为单细胞液滴。在此前的章节如“液滴”、“单细胞”和“用于条形码化单细胞核酸的微流体方法”中涉及对“单细胞液滴”的描述完全适用于称为“用于对具有感兴趣表型的单细胞进行基因分型的方法”的章节。
[0666]
在相关的实施方式中,在液滴中提供的至少一种寡核苷酸和逆转录酶,在本技术中称为rt液滴。因此,在此前的章节如“定义”、“液滴”、“液滴的制备”、“单细胞”、“细胞裂解”、“逆转录”、“寡核苷酸”和“用于条形码化单细胞核酸的微流体方法”中涉及对“rt液滴”的描述完全适用于称为“用于对具有感兴趣表型的单细胞进行基因分型的方法”的章节。
[0667]
如本领域技术人员将理解的是,在某些实施方式中,可以先提供rt液滴或单细胞液滴,如本文上文在“用于条形码化单细胞核酸的微流体方法”背景中所述的。因此,在一些实施方式中,该方法包括步骤:
[0668]-向所述微流体通道的入口注入载体流体,所述载体流体包含分散在所述载体流体中的多个第一类型的液滴,其中所述第一类型的液滴是单细胞液滴或rt液滴,其中所述rt液滴的至少一些包含逆转录酶和至少一种寡核苷酸,和其中所述单细胞液滴的至少一些包含一个单细胞,其中所述单细胞包含单细胞核酸,
[0669]-对于多个储库,第一迁移步骤,其中使在多个液滴中的所述第一类型的至少一个液滴进入所述多个储库的一个储库中,
[0670]-向所述微流体通道的入口注入载体流体,所述载体流体包含分散在所述载体流体中的多个第二类型的液滴,其中所述第二类型的液滴是单细胞液滴或rt液滴,和其中当所述第一类型的液滴是单细胞液滴时所述第二类型的液滴是rt液滴,或者当所述第一类型的液滴是rt液滴时所述第二类型的液滴是单细胞液滴,
[0671]-对于多个储库,第二迁移步骤,其中,所述第二类型的至少一个液滴的至少一部分进入所述多个储库的一个储库中。
[0672]
在“用于条形码化单细胞核酸的微流体方法”章节中涉及对这些步骤的描述完全适用于称为“用于对具有感兴趣表型的单细胞进行基因分型的微流体方法”的章节。
[0673]
在一些实施方式中,那些步骤可以在所述至少一个单细胞上对每个储库进行表型测定的步骤b)之前进行。本领域技术人员将理解的是,当在液滴中存在时,如本文上文所述的步骤b)的表型测定可以在单细胞上进行。
[0674]
如本领域技术人员将进一步理解的是,可以在当在多个储库中提供单细胞液滴时,或者当在多个储库中提供单细胞液滴和rt液滴这两者时,进行表型测定。
[0675]
在一些实施方式中,在第一迁移步骤中,在多个液滴中的至少一个第一类型的液滴通过浮力、水动力或通过物理场,优选浮力进入所述多个储库中的一个储库。
[0676]
如本领域技术人员将进一步理解的是,当该方法在液滴中进行时,该方法还包括下述步骤:
[0677]-对于多个储库,所述至少一个第一类型的液滴与所述至少一个第二类型的液滴在各个储库中或在其边缘处融合,从而导致产生融合液滴。
[0678]
在一个优选的实施方式中,融合步骤优选地在进行表型测定的步骤b)之后进行。
[0679]
在此前的章节如“用于条形码化单细胞核酸的微流体方法”中涉及对融合步骤的描述完全适用于称为“用于对具有感兴趣表型的单细胞进行基因分型的微流体方法”的章
节。
[0680]
在一些实施方式中,当在液滴中进行该方法时,在如本文上文所定义的每个储库中提供了至少一种条形码序列和至少一种染料。因此,在一些实施方式中,在步骤a)中获取至少一种染料的图像之后,通过例如如本文上文所述的润湿将至少一种条形码序列掺入rt液滴中。
[0681]
或者,在一些实施方式中,将至少一种条形码序列和至少一种染料与在多个rt液滴的rt液滴中的逆转录酶和至少一种寡核苷酸一起提供。
[0682]
在相关的实施方式中,将至少一种条形码序列附接在rt液滴中的至少一种寡核苷酸上,导致产生至少一种条形码化的寡核苷酸。将条形码序列附接在寡核苷酸上的方法如本文上文所述。在一些相关的实施方式中,rt液滴还包含连接酶。
[0683]
当在液滴中进行“用于对具有感兴趣表型的单细胞进行基因分型的方法”时,该方法在步骤c)之后还包括下述步骤:
[0684]-对于每个融合液滴,将来自至少一个细胞的至少一些单细胞核酸与至少一种条形码化的寡核苷酸杂交,
[0685]-在每个融合液滴中,将在所述融合液滴中存在的至少一些单细胞核酸逆转录,从而产生条形码化的单细胞cdna,其中所述条形码序列编码所述单细胞的身份。
[0686]
在此前的章节如“用于条形码化单细胞核酸的微流体方法”中涉及杂交和逆转录步骤的描述完全适用于称为“用于对具有感兴趣表型的单细胞进行基因分型的微流体方法”的章节。
[0687]
当在液滴中进行时,本发明的方法还包括在逆转录步骤之后在通道的出口回收融合液滴的步骤。在本技术中“回收融合液滴”指收集包含条形码化的cdna的微流体液滴,如本文上文的章节“用于条形码化单细胞核酸的微流体方法”中所述的。
[0688]
关于“至少一种寡核苷酸”,在一些事实方式中,至少一种寡核苷酸与至少一个第一类型的颗粒连接在一起。在一些实施方式中,通过最初将至少一种寡核苷酸与至少一个第一类型的颗粒连接在一起,将至少一种寡核苷酸引入储库或液滴中,特别是引入rt液滴中。
[0689]
因此,在此前的章节如“寡核苷酸”和“用于条形码化单细胞核酸的微流体方法”的章节中涉及与至少一个第一类型的颗粒连接的至少一种寡核苷酸的描述完全适用于称为“用于对具有感兴趣表型的单细胞进行基因分型的微流体方法”的章节。
[0690]
因此,在一些实施方式中,至少一种寡核苷酸与所述至少一个第一类型的颗粒共价连接或非共价连接,其中“共价连接”或“非共价连接”和“至少一个第一类型的颗粒”如本文上文的章节“寡核苷酸”中所定义的。
[0691]
不依赖于将至少一种类型的寡核苷酸与第一类型的颗粒连接所使用的键的类型,至少一种类型的寡核苷酸还可以包含至少一种接头序列,其中所述接头序列如本文上文的章节“寡核苷酸”中所定义的。
[0692]
因此,在其他的实施方式中,“至少一种类型的寡核苷酸”或简称为“寡核苷酸”还包含至少一种接头序列,所述接头序列优选地包含在5’端或3’端,更优选地在5’端。
[0693]
本领域技术人员将理解的是,在一些实施方式中,至少一种寡核苷酸通过3’端或5’端(优选地5’端)与第一类型的颗粒结合。
[0694]
在一些实施方式中,本发明的方法还包括在将其掺入储库或rt液滴后,从所述颗粒中释放与至少一个第一类型的颗粒结合的至少一种寡核苷酸的步骤。
[0695]
此外,在一些实施方式中,在逆转录单细胞核酸之前,将最初与至少一个第一类型的颗粒结合的至少一种寡核苷酸从所述至少一个第一类型的颗粒中释放。
[0696]
此外,在一些实施方式中,在附接至少一种条形码之前或之后,将最初与至少一个第一类型的颗粒结合的至少一种寡核苷酸从所述至少一个第一类型的颗粒中释放。
[0697]
释放至少一种寡核苷酸的步骤可以发生在单细胞液滴与rt液滴融合之前或之后;优选地在融合液滴之前。
[0698]
释放至少一种寡核苷酸的步骤可以发生在裂解单细胞之后,但在逆转录单细胞核酸之前。
[0699]
本领域技术人员将理解的是,在一个储库或液滴中存在的寡核苷酸的数量将适于不同核酸的数量,特别是rna的数量,其在单细胞中被转录和条形码化。将以与在章节“寡核苷酸”中描述的对rt液滴中寡核苷酸进行调整相同的方式对储库或液滴中寡核苷酸的数量进行调整。因此,在措辞“至少一种寡核苷酸”中的“至少一种”指在一个储库或液滴中存在的不同寡核苷酸的数量,其中至少一种寡核苷酸中的一种寡核苷酸其引物序列不同于另一种寡核苷酸。在措辞“至少一种寡核苷酸”中的“至少一种”如在章节“寡核苷酸”中所定义的。
[0700]
至少一种寡核苷酸的浓度如本文上文的章节“寡核苷酸”中所定义的。
[0701]
至少一种寡核苷酸的浓度是至少10nm,优选至少100nm。
[0702]
在整个本技术中,术语“和/或”是语法连接,将其解释为可能发生包含其所连接的一种或多种情况。例如,在短语“可以对序列进行误差检测和/或校正”中的措辞“误差检测和/或校正”表示可以对序列进行误差检测和可以对序列进行误差校正或者可以对序列进行误差检测或者可以对序列进行误差校正。
[0703]
如在本说明书和所附权利要求中所使用的,除非上下文另有明确规定,否则单数形式的“一个/一种(a/an)”和“所述/该(the)”包括复数引用,如所指的多个对象。
[0704]
在整个本技术中,应将术语“包含/包括”解释为包括所有具体提及的特征以及可选的、另外的和未指明的特征。如在本技术中所使用的,使用术语“包含/包括”还公开了其中除了具体提及的特征以外不存在其他特征的实施方式(即,“由
……
组成”)。
[0705]
在整个说明书中,在一个章节中描述的特征完全适用于本说明书的其他章节。因此,本发明还包含在本说明书不同章节中所描述的实施方式的组合。
