一种基于复合水凝胶的干细胞与胰岛
β
细胞共培养方法
技术领域
1.本发明属于干细胞及组织工程技术领域,涉及一种基于复合水凝胶的干细胞与胰岛β细胞共培养方法,具体是涉及一种基于复合水凝胶材料细胞培养体系的脐带血间充质干细胞与胰岛β细胞共培养的方法。
背景技术:
2.糖尿病是严重危害人类健康的慢性疾病之一。与传统治疗方法相比,胰岛移植技术可以更好地模拟生理性的胰岛素分泌,并且为患者提供了一种风险较小且疗效更好的替代疗法。然而,胰岛供体来源短缺、移植后的免疫排斥反应、胰岛的提取及移植过程中胰岛数量及质量的损失等问题严重限制了胰岛移植在临床上的广泛应用。而在胰岛中,胰岛β细胞是已知的产生胰岛素的唯一内分泌细胞,胰岛β细胞功能障碍甚至被认为是糖尿病发生的根本原因。因此,近年来通过体外培养胰岛β细胞构建功能性类胰岛组织之后进行移植成为新的热点。虽然体外培养技术在不断改进,但是培养时细胞的存活率下降和移植后细胞的活力及功能损失,从而导致移植细胞的效能下降,仍然是胰岛素分泌细胞移植治疗糖尿病的一大阻碍。究其原因,是由于胰岛细胞在生长过程中具有功能性成团的特点,最适宜其生长的细胞微环境是三维的。而目前最普遍的二维平面细胞培养方法未能给胰岛细胞的生长及成团提供完备且适宜的三维细胞微环境。
3.通过组织工程策略,就是利用生物材料与胰岛共移植,包括筛选理想的细胞外基质替代物即支架材料,并进行活性修饰(例如药物、活性分子的固定等),构建适宜胰岛生长的细胞外微环境,同时降低炎症反应和免疫排斥反应,改善胰岛的存活和功能。研究表明,胰岛细胞具有力学敏感性,采用必要的细胞外基质,可以引导类似胰岛结构的形成;也可以通过细胞外基质与细胞表面的黏附分子作用、转导细胞信号、促进细胞存活和β细胞分化。例如,使用藻酸盐胶囊包裹胰岛细胞,进行体外培养,发现胰岛体外培养细胞的存活率增加而且移植后疗效更佳。然而,目前支架材料仍然存在力学强度较差易坍塌、可调节的物理性能单一、难以保证胰岛生存所需要的营养物质和氧气运输等关键问题,无法为维持胰岛细胞的存活和功能提供最佳的三维细胞微环境以及有效解决胰岛移植存在的免疫排斥问题。因此,筛选理想的细胞外基质替代物,也就是三维支架材料非常重要。
4.胰岛长期维持形态和发挥功能依赖于胰岛组织的重构,这需要通过体外微环境构建促进细胞迁移、增殖、分泌和血管新生等,寻找一种方法可促进胰岛细胞更成熟,纯度更高的方法是亟待解决的问题。有研究表明,生理条件下,细胞与细胞,组织与组织之间是紧密联系的,细胞分泌因子可促进临近细胞的功能,间充质干细胞分泌的vegf等多种因子、细胞间基质可以促进胰岛活性与功能,因此,本发明研发一种基于3d水凝胶模拟最优的三维胰岛细胞微环境,将干细胞与胰岛β细胞共培养,在体外构建具有更好功能性的胰岛β细胞球微组织。
技术实现要素:
5.发明目的:本发明的目的是提供了一种基于新型复合水凝胶材料建立的三维培养体系,在本体系中,将胰岛β细胞和干细胞共培养,从而更有利于体外构建的胰岛β细胞球微组织活性和分泌功能。
6.技术方案:本发明所述的一种基于复合水凝胶的干细胞与胰岛β细胞共培养方法;具体操作步骤如下:
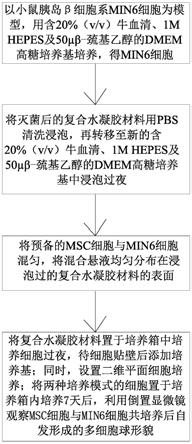
7.(1)、以小鼠胰岛β细胞系min6细胞为模型,用含20%(v/v)牛血清(gibco,南美)、1m hepes及50μβ-巯基乙醇的dmem高糖培养基(sigma)进行培养,得min6细胞;待到70-80%融合后以1:2的方式进行传代;
8.(2)、将灭菌后的复合水凝胶材料用pbs清洗浸泡,再转移至新的含20%(v/v)牛血清、1m hepes及50μβ-巯基乙醇的dmem高糖培养基中,后在培养箱中浸泡过夜;
9.(3)、将预备的msc细胞与min6细胞以不同比例混匀,后以直接接触的共培养方式将含有msc细胞与min6细胞的混合悬液均匀分布在浸泡过的复合水凝胶材料的表面;具体的是:逐滴的滴入复合水凝胶材料的表面,使细胞悬液尽可能均匀分布在复合水凝胶材料的表面;
10.(4)、将步骤(3)中表面分布有混合悬液的复合水凝胶材料置于培养箱中,培养细胞过夜,待细胞贴壁后及时添加新鲜完整培养基,进行后续培养、观察。培养时间为1-7天;同时,设置二维平面细胞培养,即培养皿平板培养条件为对照组;
11.将两种培养模式的细胞置于培养箱内正常培养7天后,利用倒置显微镜观察msc细胞与min6细胞共培养后自发形成的多细胞球形貌;期间活细胞工作站连续观测细胞生长过程情况。
12.进一步的,在步骤(1)中,所述min6细胞的培养条件是:在温度37℃、5%co2的环境下进行常规培养。
13.进一步的,在步骤(2)中,所述复合水凝胶材料的制备制备步骤具体如下(新型复合水凝胶材料的制备及结构和力学、生物界面特性);
14.(2.1)、将一定质量比的成分a、成分b及交联/引发体系溶解于pbs中,50℃震荡或搅拌使其溶解,得到溶液一;
15.(2.2)、将溶液一注入透明模具中,室温(通常是25℃)、405nm波长的可见光照射下实施聚合反应(控制温度引发材料物理交联,随后通过热或紫外光照引发交联),得到具有互穿网络的凝胶一;
16.(2.3)、将(目标细胞以一定单位体积数量种植于凝胶一表面):min6细胞以1-3
×
105个细胞/100μl的浓度同时添加不同比例的msc细胞共同接种于凝胶一的表面进行培养,培养一定时间后从而获得多细胞三维模型。
17.进一步的,所述成分a是抗细胞粘附组分等,优选的是聚乙二醇二丙烯酸酯等;
18.成分b是促细胞粘附组分等,优选的是是明胶甲基丙烯酰基等;
19.所述成分a与成分b的质量比是1:2-1:10;
20.通过调控成分a与成分b之间的比例对细胞粘附密度进行定标;针对每种细胞不同的粘附特性调整a/b之间的比例,达到最优的成球效果。
21.材料的表征:
22.利用显微ct和激光共聚焦显微镜原位表征复合材料的三维空间结构,原子力显微镜可以用来检测材料的力学性能及界面特性;材料表面粘附性能则可以通过表面粘附能检测仪来进行表征。
23.进一步的,在步骤(3)中,所述msc细胞与min6细胞的浓度比是:1:5-1:50。
24.进一步的,在步骤(3)中,所述min6细胞的浓度是1-3
×
105个细胞/100ul。
25.本发明中,复合水凝胶材料构建了适宜胰岛β细胞三维培养微环境,通过调控复合水凝胶材料的多种力学性能,包括细胞黏附能力、弹性模量和应力松弛,发现非常适宜并且可以调控胰岛β细胞生长,并能够控制细胞自发形成三维多细胞β球结构;
26.另一方面,基于此复合水凝胶材料构建的体外三维培养环境,将脐带血来源的间充质干细胞(msc)与胰岛β细胞共培养,观察该条件下msc对胰岛β细胞形态、存活率的影响及机制,发现相较单独培养的胰岛β细胞球,共培养方法可以大大提高胰岛细胞的存活率,改善胰岛细胞的功能。本培养体系可以更好的提供胰岛细胞所需营养、进行物质交换,更接近胰岛细胞的最优生长条件,因而可促进胰岛素合成与分泌功能。
27.有益效果:本发明与现有技术相比,本发明的特点:1、本发明设计的基于新型复合水凝胶材料的三维共培养体系,所应用的细胞种类广泛,可以为各类肿瘤细胞或健康上皮、内皮细胞的一种或几种,是一种极具应用前景且操作简单的三维培养平台;2、可以通过调控复合水凝胶材料的力学和生物界面性能(包括材料硬度、弹性模量、界面粘附特性等),针对某一种细胞探索模拟最优的三维细胞微环境;由于提供了于体内更加接近的微环境,细胞间紧密连接形成,而非传统粘附剥夺法形成的松散的聚集体;3、形成的多细胞球与粘附剥夺法相比具有更高的化疗药物抗性,有作为药物筛选平台的潜力;4、本发明在体外构建类胰岛器官并结合干细胞共培养技术,有望解决胰岛移植中工体短缺的瓶颈问题,对临床上推动胰岛移植的发展和糖尿病的防治具有非同寻常的意义。
附图说明
28.图1是本发明的操作流程图;
29.图2是本发明中通过调控复合水凝胶材料的结构从而改变材料的力学性能(a-b),对细胞生长的影响的比较(c)研究示意图;
30.图3是本发明普通二维平面培养(control:a,e)与复合水凝胶上三维培养(mlc-,mcs-culturing hydrogel:b&f,c&g)7天后,光镜下min-6细胞形态观测示意图;10
×
(a-d)及20
×
(e-h),scale bar:200μm(a-d)及100μm(e-h);
31.图4是本发明在水凝胶构建的不同微环境下(a和b),单独培养min-6及msc与min-6共培养7天后,光镜下细胞形态观测。
具体实施方式
32.下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
33.如图1所示,本发明所述的一种基于复合水凝胶的干细胞与胰岛β细胞共培养方法;具体操作步骤如下:
34.(1)、以小鼠胰岛β细胞系min6细胞为模型,用含20%(v/v)牛血清(gibco,南美)、1m hepes及50μβ-巯基乙醇的dmem高糖培养基(sigma)进行培养,得min6细胞;待到70-80%融合后以1:2的方式进行传代;
35.(2)、将灭菌后的复合水凝胶材料用pbs清洗浸泡,再转移至新的含20%(v/v)牛血清、1m hepes及50μβ-巯基乙醇的dmem高糖培养基中,后在培养箱中浸泡过夜;
36.(3)、将预备的msc细胞与min6细胞(将min6细胞以1-3
×
105个细胞/100μl的浓度接种)以不同比例混匀,后以直接接触的共培养方式将含有msc细胞与min6细胞的混合悬液均匀分布在浸泡过的复合水凝胶材料的表面;具体的是:将预备的脐带间充质干细胞(mscs)与min6细胞以不同比例混匀,置于浸泡过的复合水凝胶材料中进行接种;逐滴的滴入复合水凝胶材料的表面,使细胞悬液尽可能均匀分布在复合水凝胶材料的表面;
37.(4)、将步骤(3)中表面分布有混合悬液的复合水凝胶材料置于培养箱中,培养细胞过夜,待细胞贴壁后及时添加新鲜完整培养基,进行后续培养、观察。培养时间为1-7天;同时,设置二维平面细胞培养,即培养皿平板培养条件为对照组;
38.将两种培养模式的细胞置于培养箱内正常培养7天后,利用倒置显微镜观察msc细胞与min6细胞共培养后自发形成的多细胞球形貌;期间活细胞工作站连续观测细胞生长过程情况。
39.进一步的,在步骤(1)中,所述min6细胞的培养条件是:在温度37℃、5%co2的环境下进行常规培养。
40.进一步的,在步骤(2)中,所述复合水凝胶材料的制备制备步骤具体如下(新型复合水凝胶材料的制备及结构和力学、生物界面特性);
41.(2.1)、将一定质量比的成分a、成分b及交联/引发体系(交联/引发剂:如lap)溶解于pbs中,50℃震荡或搅拌使其溶解,得到溶液一;
42.(2.2)、将溶液一注入透明模具中,室温(通常是25℃)、405nm波长的可见光照射下实施聚合反应(控制温度引发材料物理交联,随后通过热或紫外光照引发交联),得到具有互穿网络的凝胶一;
43.(2.3)、将(目标细胞以一定单位体积数量种植于凝胶一表面):min6细胞以1-3
×
105个细胞/100μl的浓度同时添加不同比例的msc细胞共同接种于凝胶一的表面进行培养,培养一定时间后从而获得多细胞三维模型。
44.进一步的,所述成分a是抗细胞粘附组分等,优选的是聚乙二醇二丙烯酸酯(pegda)等;
45.成分b是促细胞粘附组分等,优选的是是明胶甲基丙烯酰基(gelma)等;
46.所述成分a与成分b的质量比是1:2-1:10;
47.通过调控成分a与成分b之间的比例对细胞粘附密度进行定标;针对每种细胞不同的粘附特性调整a/b之间的比例,达到最优的成球效果。
48.材料的表征:
49.利用显微ct和激光共聚焦显微镜原位表征复合材料的三维空间结构,原子力显微镜可以用来检测材料的力学性能及界面特性;材料表面粘附性能则可以通过表面粘附能检测仪来进行表征。
50.进一步的,在步骤(3)中,所述msc细胞与min6细胞的浓度比是:1:5-1:50。
51.进一步的,在步骤(3)中,所述min6细胞的浓度是1-3
×
105个细胞/100ul。
52.实施例:
53.pegda/gelma粘附位点可调水凝胶的制备以及脐带血间充质干细胞(msc)与小鼠胰岛β细胞系min-6共培养;
54.步骤1、如图2所示,将一定质量比的pegda和gelma,以及bis加入pbs中,在55℃水浴条件下充分搅拌使各组分溶解,充分溶解后加入引发剂lap,得到溶液一;
55.步骤2、将溶液一注入透明模具中,25℃下引发材料物理交联,使用波长405nm的光照射水凝胶使其彻底固化,得到具有互穿网络的凝胶一;将凝胶一浸泡于pbs中,随后置于6孔板中环氧乙烷对其进行灭菌,以备用于细胞培养;
56.步骤3、单独培养min-6细胞时,将min-6细胞以0.2x106的密度接种在经过灭菌处理的凝胶一表面,37℃、5%二氧化碳的环境下培养,每两天更换一次培养液;如图3所示,7天后,多细胞结构形成并观测其形态,通过调控水凝胶的物理及表面性质,可以相应调控不同的多细胞球形态(图3b和3c),并且相较于市售常用的超低粘附培养皿中生长形成的多细胞球的松散无规则结构(图3d),在本培养体系中形成的多细胞球更紧密;
57.步骤4、将msc与min-6细胞共培养时,控制min-6细胞以0.2x106的密度不变,不同比例的msc与min-6细胞悬液混匀接种在共培养系统中,37℃、5%二氧化碳的环境下培养,每两天更换一次培养液;如图4所示,在调控水凝胶构建的两种不同微环境a和b下,分别用dii(细胞膜红色荧光探针)对min-6、dio(细胞膜绿色荧光探针)对msc细胞膜染色,7天后,观测两种条件下,多细胞球的形态;发现无论在哪种条件下,与msc共培养都可以改善min-6细胞状态且显著提升min-6细胞的活性,并且当培养时间至14天时效果更为显著,单独培养的min-6细胞几乎全部凋亡,而共培养形成的多细胞球形态依然得以保持,min-6活性仍然能够维持。
58.以上仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,应视为本发明的保护范围。
