一株枯草芽孢杆菌hks018及其在生产
β-甘露聚糖酶中的应用
技术领域
1.本发明涉及微生物,特别是一株枯草芽孢杆菌hks018及其在生产β-甘露聚糖酶中的应用。
背景技术:
2.枯草芽孢杆菌(bacillus subtilis)生长、繁殖速度较快,可利用蛋白质、多种糖及淀粉,分解色氨酸形成吲哚。在遗传学研究中应用广泛,对此菌的嘌呤核苷酸的合成途径与其调节机制研究较清楚。广泛分布在土壤及腐败的有机物中,易在枯草浸汁中繁殖,故名。有的菌株是α-淀粉酶和中性蛋白酶的重要生产菌;有的菌株具有强烈降解核苷酸的酶系,故常作选育核苷生产菌的亲株或制取5'-核苷酸酶的菌种。枯草芽孢杆菌菌体生长过程中产生的枯草菌素、多粘菌素、制霉菌素、短杆菌肽等活性物质,这些活性物质对致病菌或内源性感染的条件致病菌有明显的抑制作用。
3.β-甘露聚糖酶(β-mannanase,ec.3.2.l.78)能够攻击甘露聚糖骨架的内部β-1,4糖苷键,释放甘露寡糖。β-甘露聚糖酶广泛存在于细菌、真菌、放线菌、植物和动物中。水解产物甘露寡糖(mannan-oligosaccharide,mos)不仅能够刺激肠道正常菌群的增殖,抑制病原微生物的生长,对乳杆菌(lactobacilli)和双歧杆菌(bifidobacteria)生长有益,还具有多种生物学活性,如增强动物免疫、调节糖脂代谢、促生长和抗氧化等作用,mos还通过调控肠道微生物增强了二甲双胍的降糖效果。
4.β-甘露聚糖酶在自然界中普遍存在,微生物是其最主要的生产来源。目前,应用于工业生产β-甘露聚糖酶的菌种多为曲霉、芽抱杆菌、酵母等,在食品、医药、饲料等领域有广泛的应用。β-甘露聚糖酶在饲料工业中作为一种饲料添加剂,能有效地降解饲料中的甘露聚糖,提高动物对饲料的消化能力。目前依据文献报道的细菌来源的β-甘露聚糖酶比真菌来源的温度稳定性更好,尤其是芽孢杆菌来源的甘露聚糖酶。虽然目前有大量不同种类不同来源的β-甘露聚糖酶被发现,但野生型β-甘露聚糖酶尚不能完全满足工业化生产的需求,酶学性质上都存在一定的缺陷,如野生型β-甘露聚糖酶活性较低,耐高温能力差,无法承受饲料添加剂制粒阶段的高温。通过异源表达提高β-甘露聚糖酶的酶活和适用范围,获取活性较高的、耐高温、生产成本较低的β-甘露聚糖酶,无疑是β-甘露聚糖酶进一步扩大应用市场的重要方式。目前已经实现了β-甘露聚糖酶基因在大肠杆菌、枯草芽孢杆菌、毕赤酵母、黑曲霉和里氏木霉中的成功表达。为了满足β-甘露聚糖酶在食品加工、功能性食品开发、养殖业、医药、造纸等领域的应用,开发耐高温、高稳定性的β-甘露聚糖酶具有重要意义。但如何应用新筛选的枯草芽孢杆菌来生产β-甘露聚糖酶,以满足工业生产中对β-甘露聚糖酶的需要,至今未见有公开报导。
技术实现要素:
5.针对上述情况,为克服现有技术之缺陷,本发明之目的就是提供一株枯草芽孢杆菌 hks018及其在生产β-甘露聚糖酶中的应用,可有效解决β-甘露聚糖酶的制备,满足工业
生产中对β-甘露聚糖酶的需要问题。
6.本发明解决的技术方案是,一株枯草芽孢杆菌hks018,分类命名为枯草芽孢杆菌 (bacillus subtilis),于2021年5月20日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号:cgmcc no:22574,保藏地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所;
7.所述的枯草芽孢杆菌hks018可有效用于生产β-甘露聚糖酶,实现枯草芽孢杆菌hks018 在生产β-甘露聚糖酶中的应用,所生产的β-甘露聚糖酶最适ph8.5,最适反应温度70℃,mg
2+
和cu
2+
具有明显的促进β-甘露聚糖酶活性的作用。
8.本发明枯草芽孢杆菌hks018是新筛选的一株枯草芽孢杆菌,可有效用于生产β-甘露聚糖酶,该β-甘露聚糖酶最适ph8.5,最适反应温度70℃;在ph5.0~9.0和60~80℃,酶的稳定性良好,在食品、养殖、医药、造纸、纺织等行业方面具广泛应用价值,实现了枯草芽孢杆菌hks018来源的β-甘露聚糖酶基因的异源表达,为其在生物催化制备低聚甘露糖的工业应用奠定了基础和提供了技术保障,有巨大的经济和社会效益。
附图说明
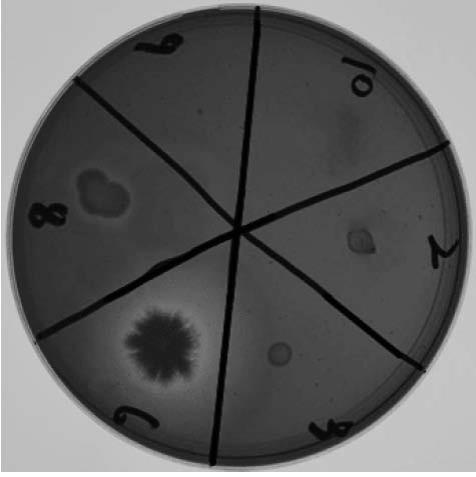
9.图1为本发明枯草芽孢杆菌hks018菌株的水解透明圈筛选图。
10.图2为本发明枯草芽孢杆菌hks018重组质粒构建图谱图。
11.图3为本发明枯草芽孢杆菌hks018质粒提取产物电泳图。
12.图4为本发明枯草芽孢杆菌hks018 sds-page凝胶电泳图。
13.图5为本发明温度对β-甘露聚糖酶活性的影响图。
14.图6为本发明不同温度下β-甘露聚糖酶的稳定性曲线图。
15.图7为本发明ph对β-甘露聚糖酶活性的影响曲线图。
16.图8为本发明金属离子和edta对β-甘露聚糖酶活性的影响图。
具体实施方式
17.以下结合具体情况对本发明的具体实施方式作详细说明。
18.在具体实施中,一株枯草芽孢杆菌hks018,分类命名为枯草芽孢杆菌(bacillus subtilis),于2021年5月20日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号:cgmcc no:22574,保藏地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所;
19.该枯草芽孢杆菌hks018在制备β-甘露聚糖酶中的应用,其应用方法包括以下步骤:
20.(1)克隆枯草芽孢杆菌hks018:
21.以枯草芽孢杆菌hks018菌株的基因组dna为模板,对其β-甘露聚糖酶基因克隆,pcr 反应体系为:1μl基因组dna模板,1μl上游引物(10μmol/l),1μl下游引物(10μmol/l),25μl taq pcr mastermix(2
×
),22μl ddh2o。pcr扩增反应条件为:95℃预变性10min,94℃变性30s,55℃退火30s,72℃延伸2min,30个循环,72℃延伸10min;扩增完成后,使用 0.8%的琼脂糖凝胶检测合格,得质粒pet-20b(+);
22.所述的上游引物-f:5
′‑
aagcttatgggggagttgcatt-3
′
,下游引物-r: 5
′‑
ctcgagttcaacgattggcgtt-3
′
;
23.(2)将质粒pet-20b(+)经hindⅲ和xhoⅰ酶切后,胶回收线状质粒条带,检测合格后,使用t4连接酶与目的基因片段16℃过夜连接,转化至e.coil bl21(de3)感受态细胞,涂布在含有50μg/ml氨苄青霉素的lb固体培养基上,37℃,倒置过夜培养;挑取阳性转化子经菌落pcr扩增检测正确后,得扩增的重组质粒pet-20b(+)-β-mannanase;
24.(3)将含有重组质粒pet-20b(+)-β-mannanase的阳性转化子按lb液体培养基重量体积 1%接种至lb液体培养基中,37℃,200r/min,过夜培养8-12h,其中氨苄青霉素终浓度为 100μg/ml;取培养好的菌液按照体积1%的接种量转接至含有100μg/ml氨苄青霉素的lb液体培养基中,培养至od
600
为0.6时,加入已过滤除菌的诱导剂iptg异丙基-β-d-硫代半乳糖苷母液使其在lb培养基中终浓度为1mmol/l,25℃,180r/min培养8h后,离心收集菌体;用ph7.4的磷酸缓冲液重悬洗涤3次,使用平衡缓冲液(equilibration buffer)重悬菌体,超声破碎后4℃离心收集上清液,0.2μm滤膜过滤后,用于后续蛋白纯化;
25.所述的平衡缓冲液(equilibration buffer)是由300mm nacl、10mm咪唑和20mm ph7.4 磷酸缓冲液混匀制成;
26.(4)蛋白纯化:重组质粒pet-20b(+)-β-mannanase中载体带有his-tag标签,采用 ni-nta树脂纯化β-甘露聚糖酶,将破碎后的上清液与结合缓冲液(equilibration buffer) 平衡过的镍柱树脂混合,在4℃环境中结合30min后,装入小型层析柱,放掉上清,加入2 倍柱体积的漂洗缓冲液(wash buffer)洗脱3次,去除非特异结合的蛋白;再使用亲和层析缓冲液(elute buffer)洗脱3次,并收集洗脱液;洗脱液使用merck millipore离心式过滤器和20mm ph7.4磷酸缓冲液对洗脱液进行置换,去除咪唑,得蛋白纯化的β-甘露聚糖酶;
27.所述的结合缓冲液(equilibration buffer)是由300mm nacl、10mm咪唑和20mm ph7.4 磷酸缓冲液混匀制成;
28.所述的漂洗缓冲液(wash buffer)是由300mm nacl、20mm咪唑和20mm ph7.4磷酸缓冲液混匀制成;
29.所述的亲和层析缓冲液(elute buffer)是由300mm nacl、300mm咪唑和20mm ph7.4 磷酸缓冲液混匀制成。
30.本发明菌株是新筛选的一株枯草芽孢杆菌hks018,可有效用于生产β-甘露聚糖酶,经实验取得了非常好的有益技术效果,有关资料如下:
31.一、菌株的筛选与鉴定
32.1、筛选
33.称5g土样于无菌生理盐水中,土壤采自南阳市西峡县后沟塘村多年种植魔芋的土壤,在 37℃,180r/min摇床上培养2h;取2ml土壤悬液加入到富集培养基(魔芋胶5g/l,蛋白胨 5g/l,kh2po
4 1g/l,mgso
4 0.1g/l,自然ph)中,37℃、180r/min摇床上培养12h。富集培养的菌液进行梯度稀释,取适量菌液涂布于初筛平板培养基(魔芋胶5g/l,蛋白胨5g/l, kh2po
4 1g/l,mgso
4 0.1g/l,琼脂20g/l,自然ph)中,37℃倒置24h,每个稀释梯度设置 3个平行。培养24小时后,向平板中加入0.1%刚果红染液,静置30min,观察水解圈大小。挑取水解圈直径最大的单菌落(如图1所示),进行划线纯化。
34.2、分子生物学鉴定
35.对其16s rdna基因和gyrb基因进行扩增测序,送至测序公司华大基因进行测序。
对测序结果在ncbi网站上进行在线blast比对,该菌株与bacillus subtilis bcrc10255t(dq309293) 同源性为100%,确定hks018菌株为枯草芽孢杆菌。经软件mega 6.0构建系统发育树:
[0036][0037][0038]
该菌株与bacillus subtilis bcrc10255t(dq309293)在同一个进化分支上,表明二者亲缘关系最近。结合api生理生化鉴定系统比对结果,见表1:
[0039]
表1生理生化特性鉴定
[0040][0041]
注:+:阳性,-:阴性,+w,弱阳性
[0042]
鉴定菌株为枯草芽孢杆菌,分类命名为枯草芽孢杆菌(bacillus subtilis),于2021年5 月20日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号:cgmcc no: 22574,保藏地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所。
[0043]
二、枯草芽孢杆菌hks018在生产β-甘露聚糖酶中的应用(试验)
[0044]
1、β-甘露聚糖酶基因的克隆及表达载体的构建
[0045]
依据枯草芽孢杆菌hks018鉴定结果,在美国国家生物技术信息中心(national center of
ꢀꢀ
biotechnology information,ncbi)数据库中寻找关系较近菌株的β-甘露聚糖酶基因序列,利用软件snapgene4.2.4设计引物。以hindⅲ和xhoⅰ分别为上、下游多克隆位点,设计引物序列为:上游引物-f:5
′‑
aagcttatgggggagttgcatt-3
′
,下游引物-r: 5
′‑
ctcgagttcaacgattggcgtt-3
′
。以枯草芽孢杆菌hks018菌株的基因组dna为模板,对其β-甘露聚糖酶基因克隆,pcr反应体系为:1μl基因组dna模板,1μl上游引物 (10μmol/l),1μl下游引物(10μmol/l),25μl taq pcr mastermix(2
×
),22μl ddh2o。pcr 扩增反应条件为:95℃预变性10min,94℃变性30s,55℃退火30s,72℃延伸2min,30个循环,72℃延伸10min。扩增完成后,使用0.8%的琼脂糖凝胶检测,合格后,使用通用引物27f、 1492r和up-1、up-2r分别对其16s rdna基因和gyrb基因进行扩增测序,送至测序公司华大基因进行测序。测序结果如下:
[0046]
16s rdna序列
[0047][0048][0049]
gyrb扩增序列如下:
buffer(300mm nacl,300mm咪唑,20mm ph7.4磷酸缓冲液)洗脱3次,并收集洗脱液。洗脱液使用merck millipore离心式过滤器和20mm ph7.4磷酸缓冲液对洗脱液进行置换,以去除咪唑。蛋白浓度采用bca法测定。上述纯化过程每一步洗脱液均使用十二烷基硫酸钠
‑ꢀ
聚丙烯酰胺凝胶电泳(sds-page)检测,结果如图4所示,m:prestained protein ladder;泳道1,2:β-甘露聚糖酶粗酶液,β-甘露聚糖酶。
[0055]
5、β-甘露聚糖酶酶学性质研究
[0056]
5.1、β-甘露聚糖酶活性测定
[0057]
β-甘露聚糖酶的活性采用dns法测定。以灭活的酶液为对照,分别取0.1ml适当稀释的酶液与0.9ml浓度为0.5%的甘露聚糖溶液混匀,于50℃水浴10min,加入200μl dns,煮沸5min。吸取200μl反应液在540nm处测定吸光度。每个样品设定3个重复。酶活力单位定义为:在上述反应条件下,以每分钟生成1μmol甘露糖所需要的酶量为1个酶活力单位 (u/ml)。
[0058]
5.2最适温度和温度稳定性
[0059]
取纯化后的β-甘露聚糖酶适当稀释后,分别于25~100℃的温度下水浴10min,测定酶活,研究温度对β-甘露聚糖酶活性的影响。试验以测得的最高酶活为100%计算相对酶活。结果如图5所示,β-甘露聚糖酶的最适反应温度为70℃,且在100℃水浴10min,还具有80%的活性,属于耐高温酶。
[0060]
将酶液置于60~100℃的温度下保温120min,每10min取样在最适温度下测定β-甘露聚糖酶活性,研究该酶在不同温度下的稳定性。试验以测得的最高酶活为100%计算相对酶活。结果如图6所示,60~70℃保温2h,剩余酶活力在60%以上;80℃保温60min,剩余酶活力在50%以上;90~100℃保温30min,剩余酶活力在50%以上,表明该酶的热稳定性很好。
[0061]
5.3最适ph
[0062]
取纯化后的酶液,用不同ph的缓冲液稀释,在50℃、ph3.0~9.5的条件下测定β-甘露聚糖酶活性,探究不同ph对酶活力的影响,确定其最适反应ph及ph耐受范围。试验以测得的最高酶活为100%计算相对酶活。结果如图7所示,纯化后的β-甘露聚糖酶在ph8.5条件下活性最高,在ph3.0~8.5范围内,随ph的升高,酶活性升高,ph超过8.5后,酶活性随 ph的升高而迅速降低。β-甘露聚糖酶在ph5.5~9.0范围内,保持较高酶活性(大于70%),说明该酶具有较广的ph耐受范围。
[0063]
5.4金属例子和edta对酶活力的影响
[0064]
粗酶液进行适当稀释后,分别与10mmol/l k
+
、mn
2+
、zn
2+
、mn
2+
、ca
2+
、edta、cu
2+
、 mg
2+
等不同金属离子溶液等体积混合。在50℃条件下保温1小时,以未加金属离子的粗酶液作为对照,其β-甘露聚糖酶酶活性为100%,分别计算不同金属离子的相对酶活性。结果如图8所示,mg
2+
和cu
2+
具有促进β-甘露聚糖酶活性的作用,分别使酶活性提高了48%和26%; k
+
、zn
2+
、mn
2+
、ca
2+
和edta均对酶活性有不同程度的抑制作用,其中edta对酶活性抑制程度最大,降低了85%的酶活性,ca2+和mn
2+
仅有微弱的抑制作用。
[0065]
本发明枯草芽孢杆菌hks018是新筛选的一株枯草芽孢杆菌,可有效用于生产β-甘露聚糖酶,该β-甘露聚糖酶最适ph8.5,最适反应温度70℃;在ph5.0~9.0和60~80℃,酶的稳定性良好,在食品、养殖、医药、造纸、纺织等行业方面具广泛应用价值,实现了枯草芽孢杆菌hks018来源的β-甘露聚糖酶基因的异源表达,为其在生物催化制备低聚甘露糖的工业
应用奠定了基础和提供了技术保障,有巨大的经济和社会效益。
